アロニア・メラノカルパの抽出物、アントシアニン、プロシアニジンはラジカルスカベンジャーおよび酵素阻害剤として作用する
Marie Bräunlich et al., |
要約 |
| アロニア・メラノカルパ(Aronia melanocarpa)の果実および樹皮から抽出した抽出物、サブフラクション、単離アントシアニン、および単離プロシアニジンB2、B5、C1について、抗酸化活性および酵素阻害活性を調べた。4つの異なるバイオアッセイ、すなわちジフェニルピクリルヒドラジル(DPPH)ラジカル消去活性、15-リポキシゲナーゼ(15-LO)阻害活性、キサンチンオキシダーゼ(XO)阻害活性、およびα-グルコシダーゼ阻害活性を用いた。アントシアニンの中では、シアニジン-3-アラビノシドが最も強いラジカル消去活性および酵素阻害活性を示し、シアニジン-3-キシロシドが最も弱い活性を示した。これらの効果は、アントシアニジンに結合した糖ユニットの影響を受けているとみられる。プロシアニジンを多く含むサブフラクションは、強力なα-グルコシダーゼ阻害剤であることが明らかになった。これらは高いラジカル消去能、15-リポキシゲナーゼ(15-LO)に対する強い阻害活性、およびキサンチンオキシダーゼ(XO)に対する中程度の阻害活性を有していました。三量体プロシアニジンC1は、二量体プロシアニジンB2およびB5と比較して、生物学的アッセイにおいて高い活性を示しました。本研究は、アロニア・メラノカルパの様々なポリフェノール化合物が、α-グルコシダーゼ阻害により血糖値を低下させる有益な効果を有し、酸化ストレスを軽減する可能性があることを示唆しています。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 実験セクション |
| 2.1. 植物材料 |
| 2.2. 試薬 |
| 2.3. 抽出および分画 |
| 2.4. アントシアニンの単離 |
| 2.5. プロシアニジンの単離 |
| 2.6. 分析 |
| 2.6.1. 薄層クロマトグラフィー(TLC) |
| 2.6.2. 高速液体クロマトグラフィー(HPLC) |
| 2.6.3. UV測定 |
| 2.6.4. チオリシス |
| 2.6.5. 質量分析 |
| 2.6.6. 核磁気共鳴(NMR) |
| 2.7. DPPHラジカル消去活性 |
| 2.8. 15-リポキシゲナーゼ阻害(15-LO) |
| 2.9. キサンチンオキシダーゼ(XO)阻害 |
| 2.10. α-グルコシダーゼ阻害活性 |
| 2.11. 統計 |
| 3. 結果と考察 |
| 3.1. 抽出と化学的特性評価 |
| 3.2. 生化学的活性 |
| 4. 結論 |
| 本文 |
| 1.はじめに |
| アロニア(学名:Aronia melanocarpa (Michx.) Elliott、学名:Photinia melanocarpa (Michx.) K. R. Robertson、学名:J. B. Phipps)は、ブラックチョークベリーとも呼ばれ、バラ科に属し、観賞用低木、ジュース、ワイン、ジャムの原料となる果実、そして天然食品着色料の豊富な供給源として栽培されています[1,2]。近年、ブラックチョークベリーは抗酸化作用を持つポリフェノールの含有量が多いことから人気が高まっています[3]。実際、酸素ラジカル消去能(ORAC)アッセイで測定されたブラックチョークベリーは、これまでに調査されたベリー類やその他の果物の中で最も高い抗酸化作用を有しています[2,4]。アロニアの果実には、主にアントシアニンとプロアントシアニジンを中心とするフラボノイドが高濃度に含まれています。フリーラジカルの形成は脂質過酸化と強く関連しており、細胞の老化、変異誘発、炎症、発がん、冠動脈疾患、糖尿病など、様々な疾患の発症にも関与していることが示唆されている[5]。蓄積されたエビデンスは、糖尿病患者が酸化ストレス下にあり、フリーラジカル生成能とラジカル消去能のバランスが崩れていることを示唆している[6,7,8,9,10,11]。15-リポキシゲナーゼ(15-LO)とキサンチンオキシダーゼ(XO)は、それぞれ過酸化酵素と酸化促進酵素であり、血管細胞における活性酸素種(ROS)の発生源である[12,13]。ROSの過剰産生は、内皮機能不全に関与している可能性がある。したがって、活性酸素種産生を阻害する物質は、心血管機能にプラスの効果をもたらす可能性がある。アロニア・メラノカルパの果汁とそのアントシアニンは、2 型糖尿病および糖尿病に伴う合併症の予防と管理に有効である可能性が示唆されている [14,15]。α-グルコシダーゼは小腸上皮に存在する膜結合酵素で、二糖類やオリゴ糖からグルコースを分解する触媒作用をするため、炭水化物の消化に重要な役割を果たしている。α-グルコシダーゼと α-アミラーゼの活性を阻害し、炭水化物の吸収可能な単糖への消化を遅らせることで、食後高血糖を抑制し、糖尿病の発症を予防できる可能性がある [16]。研究により、アントシアニンが腸の α-グルコシダーゼを阻害する可能性があることが明らかになっており、Adisakwattana ら [16] はシアニジン 3-ルチノシドがその作用機序で炭水化物の吸収を遅らせることを報告している。私たちの知る限り、ラジカルスカベンジャー、リポキシゲナーゼ阻害剤、キサンチンオキシダーゼ阻害剤、および α-グルコシダーゼ阻害剤としてのチョークベリーのアントシアニンとプロシアニジンに関する体系的な調査はこれまで報告されていません。 |
| 本論文では、アロニア・メラノカルパから単離された抽出物、亜分画、アントシアニン、プロシアニジンのin vitro抗酸化活性を、1,1-ジフェニル-2-ピクリルヒドラジル(DPPH)ラジカル消去能および酵素15-リポキシゲナーゼおよびキサンチンオキシダーゼ阻害能を用いて測定した。さらに、ポリフェノールを豊富に含む抽出物のα-グルコシダーゼ阻害能についても試験した。 |
| 2. 実験セクション |
| 2.1. 植物材料 |
| アロニア(A. melanocarpa (Michx.) Elliott var. Moscow)の果実は、2010年8月にノルウェー、クレップのサーハイム(Særheim、58°47′N、5°41′E)で収穫されました。果実は抽出まで-20℃で保存されました。証拠標本(MB201201)は、ノルウェー、オスロ大学薬学部薬学部門に保管されています。プロシアニジンの供給源として、同じ植物から樹皮を採取しました。直径1~2cmの枝を選び、樹皮を丁寧に除去しました。合計1500gの生重量(FW)を採取し、凍結乾燥すると乾燥重量(DW)は732gになりました。植物材料は小片に切断され、抽出まで-20℃で保存されました。 |
| 2.2. 試薬 |
| ジフェニルピクリルヒドラジル(DPPH)ラジカル、リノール酸、大豆由来の15-リポキシゲナーゼ15-LO、ヒポキサンチン、牛乳由来のキサンチンオキシダーゼ、パン酵母由来のα-グルコシダーゼ、4-ニトロフェニルα-D-グルコピラノシド(PNP-G)、ケルセチン、アカルボース、リン酸ナトリウムカリウム、ベンジルメルカプタン、トリフルオロ酢酸(TFA)、ジメチルスルホキシド(DMSO)、酢酸エチル(EtOAc)、ジクロロメタン(DCM)、アセトン、エタノール(EtOH)、メタノール(MeOH)は、Sigma-Aldrich(St. Louis, MO, USA)から購入した。プロシアニジンB2およびB5参照化合物は、Plant Polyphenols LLC(Boyce, LA, USA)から入手した。その他の試薬はすべて入手可能な最高純度のものを使用した。 |
| 2.3. 抽出および分画 |
| アロニア果実(5.5 kg FW)を凍結乾燥し、粉砕した後、ソックスレー抽出器を用いてDCM(5 L)およびEtOH(4.5 L)で抽出した。植物残渣は、50% EtOH 3 Lを3回加え、70℃で2時間撹拌してさらに抽出した。全ての抽出物を真空濃縮し、それぞれ26 g、250 g、80 gを得た。50% EtOH抽出物(2.5 g)をAmberlite XAD-7HP(3 × 30 cm、Sigma-Aldrich、St. Louis, MO, USA)カラムで分画した。溶出液は、水400 mL、メタノール300 mL、メタノール中0.1% TFA 200 mL、アセトン-水(70:30)200 mLの順であった。この手順を、カラムに全量10 gをアプライするまで繰り返した。MeOH画分(Amb-MeOH)を真空濃縮乾固し、2 gを得た。このうち920 mgをSephadex LH-20(3 × 30 cm、GE Healthcare、Uppsala, Sweden)に溶解し、MeOH-水(20:80~100:0)を溶出液としてさらに分画した。これにより、Seph I(418 mg、20% MeOHで溶出)、Seph II(44 mg、40% MeOH)、およびSeph III(278 mg、100% MeOH)の3つのサブフラクションが得られた。 |
| 2.4. アントシアニンの単離 |
| 2.3節で述べた研究と並行して、アロニア果実(2 kg FW)を2 × 6 L MeOH(0.5% TFA v/v)で24時間常温浸漬し、溶媒の大部分を真空蒸発させた。濃縮された水分濃縮抽出物(0.5 L)を4 × 0.5 L の EtOAc で分配した。有機相は除去し、水相はAmberlite XAD-7HP(5 × 50 cmカラム)を用いて水でpH 6になるまで濃縮・精製し、その後1 L MeOH(0.5% TFA)で溶出した。アントシアニン濃縮抽出物は、Sephadex LH-20カラム(5 × 100 cm)を用いて、15%(3 L)および30%(4 L)MeOH(0.1% TFA v/v)のステップグラジエントで溶出されました。200 mLの画分を回収し、HPLCで分析しました。純度の許容範囲は、520 nmおよび280 nmで検出された分析対象物のピーク面積が総面積の96%を超える場合と定義されました。重複する画分は一緒にして同じカラムに再適用し、5回のカラム分析で約200 mgのシアニジン 3-ガラクトシド(1)、200 mgのシアニジン 3-アラビノシド(3)、および20 mgのシアニジン 3-キシロシド(4)が得られました。純粋なシアニジン 3-グルコシド(2)はごく微量しか得られませんでした。 |
| 2.5. プロシアニジンの単離 |
| オリゴマープロシアニジンの供給源として、ベリー類ではなく樹皮を選択しました。樹皮はより豊富な供給源であり、より単純なポリフェノール組成(例えば、アントシアニンを含まない)を与えるためです。樹皮サンプル(466 g DW)を70%アセトン 2 × 10 Lで室温で24時間抽出しました。真空濃縮後、抽出液0.5 LをDCM 2 × 0.5 Lで脱脂しました。乾燥物6.4 gを含む有機相は除去しました。サンプルをさらに0.5 L EtOAc 3回で分配し、有機相を真空濃縮した後、凍結乾燥しました。EtOAc部分から7.8 g DWが得られました。このうち2gを5×100cmのSephadex LH-20カラムに通し、50%(2L)、80%(3L)、100%(10L)のメタノールの段階勾配を用いて分離した。1Lずつ分取し、薄層クロマトグラフィー(TLC)およびHPLCで分析した。プロシアニジンB2(5)約200mg、B5(6)約20mg、C1(7)約50mgが得られた。純度の許容範囲は、280nmおよび蛍光検出における分析対象物のピーク面積が、全クロマトグラフィー面積の96%以上を占めることと定義した(2.6節参照)。 |
| 2.6. 分析 |
| 2.6.1. 薄層クロマトグラフィー(TLC) |
| プロシアニジンの薄層クロマトグラフィー分析は、ポリエチレンテレフタレート(PET)箔(Sigma-Aldrich、St. Louis, MO, USA)上のシリカゲルを用いて、移動相系(上層:EtOAc-HCOOH-HOAc-H2O(75:2:3:20 v/v))を用いて実施した。移動相間距離は10 cmであった。スポット検出には、バニリン酸-HCl-MeOH(1:4:100, w/v/v)をスプレーした後、ヘアドライヤーで加熱した。 |
| 2.6.2. 高速液体クロマトグラフィー(HPLC) |
| 個々のアントシアニンの純度確認には、Agilent Technologies(Santa Clara, CA, USA)のAgilent 1100システムを使用し、社内標準化合物[17]との比較により同定した。分離はEclipse XDB-C8(4.6×150 mm、5 µm)カラム(Agilent Technologies、Santa Clara, CA, USA)を用いて、(A) HCOOH-H2O(1:9 v/v)および(B) HCOOH-MeOH-H2O(10:50:40, v/v)からなる二成分溶媒系を用いて行った。グラジエント(AのB)はアイソクラティックで、0% Bを2分間、18分間で0%から70%まで直線的に増加し、次の2分間で70%から100%まで直線的に増加し、さらに2分間で100%から0%まで直線的に増加し、その後2分間カラムをリコンディショニングしました。すべてのHPLCサンプルは、注入前に13 mmシリンジフィルター(ナイロン0.45 µm、VWR International、Radnor, PA, USA)でろ過しました。流量は0.8 mL/分で、10 µLのサンプルをカラムに注入し、30 °Cで分離を行いました。クロマトグラムは280 nmと520 nmで取得しました。 |
| プロシアニジンの高速液体クロマトグラフィー分析は、同じ機器とカラムを用いて、溶媒系(A)0.05% TFAおよび(B)MeCN中の0.05% TFAで実施した。グラジエント(AのB)は、5%(10分)、5%から15%(10分)、15%から20%(10分)、20%から100%(6分)、100%から5%(4分)とし、最後に2分間カラムをリコンディショニングした。流速は0.5 mL/分、カラム温度は30℃とし、10 μLずつ注入した。蛍光検出は、励起276 nm、発光316 nm(HP 1046A検出器、Hewlett-Packard、Palo Alto, CA, USA)で行い、UV吸光は280 nmで検出した。 |
| 2.6.3. UV測定 |
| バイオアッセイで使用したUV測定には、Biochrom Libra S32 PC(Biochrom Ltd、Cambridge, UK)を使用した。 |
| 2.6.4. チオリシス |
| (訳者注:チオリシス(Thiolysis)とは、チオール(R-SH)と反応して化合物を2つに分解する化学反応のことで、水による加水分解(Hydrolysis)に似ていますが、チオールが使われるのが特徴です。脂肪酸のβ酸化(β-oxidation of fatty acids)や、縮合タンニンの解重合(depolymerisation of condensed tannins)などで見られ、アセチルCoA生成など生化学的プロセスでも重要です)粗抽出物約10 mgを、1.1% HCl (v/v)を含む5%ベンジルメルカプタンを含むメタノール溶液に溶解し、50℃で30分間加熱した。標準物質として、それぞれ末端にカテキンとエピカテキンを有するプロシアニジンB1とB2を用いた。チオリシス反応後の生成物は、プロシアニジンと同様の高速液体クロマトグラフィー法で分析した。 |
| 2.6.5. 質量分析 |
| ベリー類(メタノール抽出物)および樹皮(70%アセトン)の粗抽出物、ならびに単離されたプロシアニジンについて、nanoAcquity超高速液体クロマトグラフィー(UPLC)(Waters、Milford, MA, USA)とnanoLockspray質量較正装置を備えた四重極飛行時間型(QTOF)マイクロハイブリッド質量分析計(Waters社)を組み合わせ、液体クロマトグラフィーと質量分析を組み合わせたLC-MS法によってさらに特性評価を行った。逆相分離は、長さ600 mm、内径0.05 mmの自社製多孔質ポリマーモノリスカラムを用いて行った。移動相は、(A)0.1%ギ酸および0.05%水酸化アンモニウム水溶液と、(B)0.1%ギ酸アセトニトリル水溶液を混合したものを用いた。分析カラムと同様のタイプの短いトラップカラム (50 mm) に、移動相組成 1% B を使用して、水で希釈した 2 µL のサンプルを高流量 (3 µL/分) で 5 分間注入しました。大きなデュエルボリュームを補うために、400 nL/分の高流量で B を 2% から 10% に変化させることにより、0 分から 10 分の直線グラジエントを実行しました。次に、流量を 200 nL/分に下げ、化合物は 30 分で B が 30%、40 分で B が 80% に達するグラジエントで溶出しました。ポジティブモードのエレクトロスプレーイオン化 (ESI+) を使用し、キャピラリー電圧を 3 kV、コーン電圧を 35 V に設定しました。質量スペクトルは、1 秒のスキャン時間で m/z 範囲 200~2000 で収集されました。機器の制御、データ取得、およびデータ処理は、MassLynx 4.1 ソフトウェア (Waters、Milford, MA, USA) を使用して行われました |
| 2.6.6. 核磁気共鳴(NMR) |
| 抽出物および画分の1Hおよび13C核磁気共鳴(NMR)分光法は、Varian Gemini 200(Varian、Palo Alto, CA, USA)、Bruker DPX 300またはBruker AVII 400(Bruker、Rheinstetten, Germany)装置を用いて、テトラメチルシラン(TMS)を内部標準としてCDCl3またはCD3OD中で実施した。 |
| 2.7. DPPHラジカル消去活性 |
| DPPHラジカルに対する消去活性は、既報[18]の方法で測定した。簡単に説明すると、DPPHメタノール溶液(A517 1.0)2.95 mLに、試験化合物(DMSOまたはMeOHに溶解)50 µLを加えた。混合物を撹拌し、5分間の517 nmにおけるUV吸光度の減少を測定した。ラジカル消去率は100 × (Astart − Aend)/(Astart)として算出した。ここで、Astartは試験化合物添加前の吸光度、Aendは反応時間5分後の吸光度である。値は試験物質の吸光度で補正した。陽性対照としてケルセチンを用いた。 |
| 2.8. 15-リポキシゲナーゼ阻害(15-LO) |
| 大豆リポキシゲナーゼを用いて15-リポキシゲナーゼ阻害を測定した。リノール酸(134 µM)を含むホウ酸緩衝液(0.2 M、pH 9.00、2.90 mL)溶液に、DMSOまたはMeOHに溶解した被験物質50 µL、あるいは(ブランクとして)DMSOまたはMeOHのみを添加した。15-リポキシゲナーゼを含むホウ酸緩衝液50 µL溶液(10,000 U/mL)を加え、添加後30秒から90秒までの234 nmにおける吸光度の増加を測定した。酵素阻害率は100 × [(∆A1 − ∆A2)/∆A1]として計算された。ここで、∆A1および∆A2は、それぞれ試験物質を含まないサンプルおよび試験物質を含むサンプルにおけるA234の増加値である[18]。陽性対照としてケルセチンを用いた。 |
| 2.9. キサンチンオキシダーゼ(XO)阻害 |
| ヒポキサンチンを基質とするキサンチンオキシダーゼ阻害活性は、Noroら[19]の手順に若干の改変を加えて分光光度計で測定した。試験化合物50 µL(DMSOまたはMeOHに溶解)、あるいは(ブランクとして)DMSOまたはMeOH単独、1.85 mLの50 mMリン酸ナトリウム-カリウム緩衝液(pH = 7.5)、および酵素溶液100 µL(50 mMリン酸ナトリウム-カリウム緩衝液、pH = 7.5で1.8 U/mL)からなる混合液を、使用直前に調製した。基質溶液(蒸留水中ヒポキサンチン20 µg/mL)1.0 mLを添加した。混合液を撹拌し、5分間にわたって290 nmにおける吸光度の増加を測定した。酵素阻害率は100 × [(∆A1 − ∆A2)/∆A1]として算出した。ここで、∆A1および∆A2は、それぞれ試験物質を含まないサンプルおよび試験物質を含むサンプルにおけるA290の増加値である。陽性対照としてケルセチンを用いた。 |
| 2.10. α-グルコシダーゼ阻害活性 |
| α-グルコシダーゼ阻害活性は、Matsui et al. [20] が報告した手順を若干改変して測定した。酵素溶液は、100 mM塩化ナトリウムを含む50 mMリン酸緩衝液(pH = 7.0)で、α-グルコシダーゼ濃度800 mU/mLに調製した。各アッセイでは、DMSOまたはMeOHに溶解した試験溶液20 µLと酵素溶液80 µLを37 °Cで5分間プレインキュベートした。反応は、基質溶液(緩衝液中に0.7 mM PNP-Gを含む)1.9 mLを加えることで開始し、溶液を37 °Cで15分間インキュベートした。 0.5 Mトリス溶液2.0 mLを添加して反応を停止させた後、PNP-Gから遊離したPNPの400 nmにおける吸光度を測定した。酵素阻害率は100 × (AB − AS)/(AB)で算出した。ここで、ABとASはそれぞれブランクとサンプルの吸光度を表す。陽性対照としてアカルボースを用いた。 |
| 2.11. 統計 |
| DPPH、15-リポキシゲナーゼ、キサンチンオキシダーゼ、およびα-グルコシダーゼアッセイのサンプルは3回測定し、結果は平均値±標準偏差として示した。統計学的評価にはスチューデントt検定を用い、p < 0.05を統計的に有意と判定した。 |
| 3. 結果と考察 |
| 3.1. 抽出と化学的特性評価 |
| チョークベリー果実において、アントシアニンはフェノール化合物群の中で2番目に多いグループを構成している[1]。アロニア・メラノカルパのアントシアニンは、主に4種類のシアニジン配糖体(3-ガラクトシド、3-グルコシド、3-アラビノシド、3-キシロシド)の混合物であり、そのうちシアニジン3-ガラクトシドが主要成分である(図1)[17]。アロニア果実から主要アントシアニンを単離するために、メタノール抽出とトリフルオロ酢酸(TFA)添加抽出を実施した。これは、直接アルコール抽出では収率が非常に低く、アントシアニンを安定したフラビウムカチオン型で保持できないためである。アントシアニン(1~4)は純粋化合物として単離され、その構造を図2に示す。クロマトグラフィーおよびスペクトル特性は、これまでの観察結果と一致した[17]。図3に示すように、アロニアベリーも抽出されました。 |
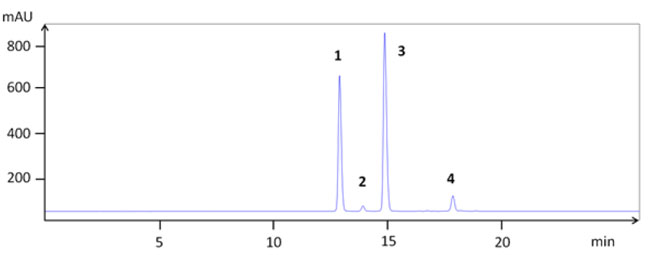 |
| 図1. 単離されたアントシアニンの高速液体クロマトグラフィー(HPLC)クロマトグラム:シアニジン 3-ガラクトシド(1)、シアニジン 3-グルコシド(2)、シアニジン 3-アラビノシド(3)、シアニジン 3-キシロシド(4)。 |
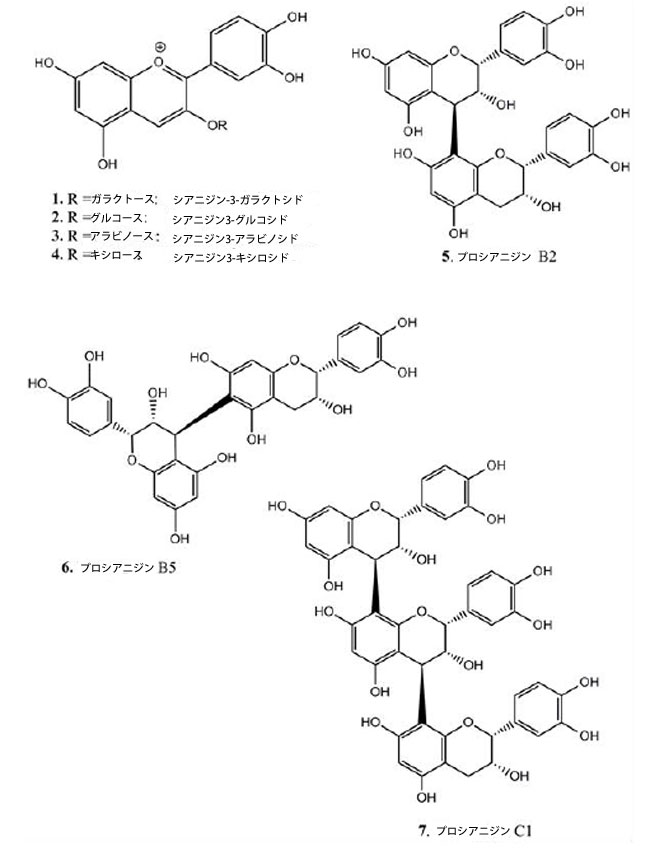 |
| 図2. アロニアの果実と樹皮から単離された化合物の化学構造。 |
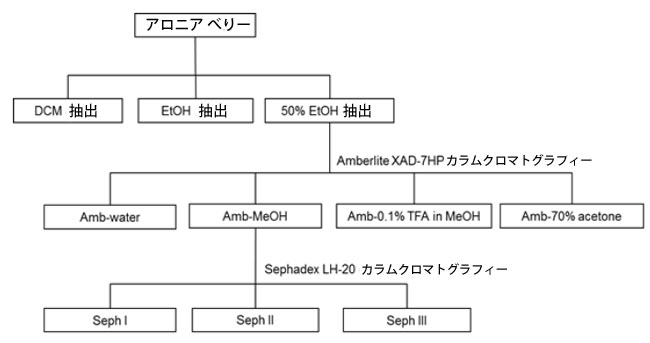 |
| 図3. アロニアの果実からの抽出および分画手順。アントシアニン(セクション2.4)とプロシアニジン(セクション2.5)は異なる手順で抽出されました。 |
| 1H NMRおよび13C NMR分析の結果、50%エタノール抽出物(70℃)中にプロアントシアニジンが存在することが明らかになった。抽出物のサブフラクションは、主にエピカテキンの立体化学を持つプロアントシアニジンで構成されていることが示された(1H NMR:B環プロトン:約6.8 ppm、A環プロトン:約6.0 ppm [21];13C NMR:約77 ppmにC-2、80~82 ppmにシグナルなし [22])。しかし、40%メタノールで溶出したSeph II画分にはプロアントシアニジンは含まれていなかった。 |
| この手順と並行して、二量体 (5 と 6) および三量体 (7) のプロシアニジン (図 2) をアロニアの樹皮から単離した。樹皮は、総フェノール構造に関する複雑さが低い (アントシアニンがないなど) ため、果実に比べてプロシアニジンを単離するためのより簡単なソースであることが判明した。プロシアニジンの濃度もアロニアの樹皮の方が高かった。プロシアニジン B2、B5、および C1 は、アロニア植物の樹皮と果実の両方に存在することが以前に示されている [2]。単離された化合物は、標準物質 (B2 および B5) に対する共クロマトグラフィーおよび質量分析によって同定された (図 4、表 1)。粗抽出物のチオリシスにより、エピカテキンがプロシアニジンの主要なモノマー単位であり、スターターおよびエクステンダー単位の両方であることが明らかになった。カテキンはごく少量しか検出されなかった。これは、エピカテキンのエピマー化によるものと考えられる。 |
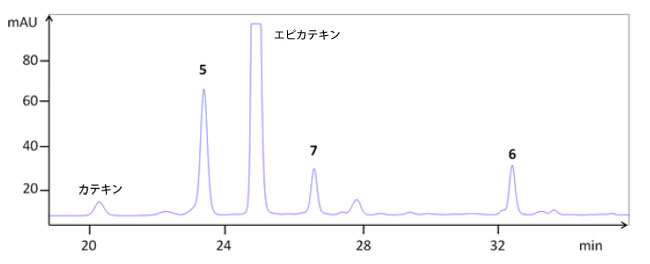 |
| 図4. アロニア・メラノカルパの樹皮抽出物のHPLCクロマトグラム。プロシアニジンB2(5)、B5(6)、C1(7)を示している。 |
| 表1. アロニア・メラノカルパ由来のアントシアニンとプロシアニジンのクロマトグラフィーおよびスペクトルによる特性評価。 |
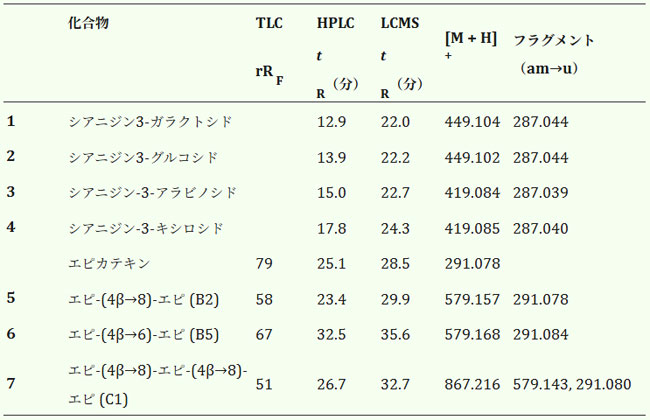 |
| これまでに、主に(−)-エピカテキン単位からなる重合プロシアニジンが、チョークベリーに含まれるポリフェノール化合物の主要クラスであることが報告されている[1,3]。プロシアニジンの重合度は、果実中で2~23単位まで変化し、デカマー以上の部分が明らかに優勢であり、フラバン-3-オールサブユニットは主にC4-C6およびC4-C8結合(B型結合)で結合している[1]。遊離エピカテキンはブラックチョークベリーにも存在するが、その濃度は重合プロシアニジンと比較すると大幅に低い。以前の調査では、アロニアベリーのアントシアニン濃度は0.6%~2%(DW)、プロシアニジン濃度は4%~5%(DW)と報告されている[2]。 |
| 3.2. 生化学的活性 |
| 粗抽出物、細分画分、単離化合物のDPPH消去剤、15-リポキシゲナーゼ、およびα-グルコシダーゼ阻害剤としての活性を表2に示す。50%エタノール粗抽出物は高いラジカル消去活性を示し、プロシアニジンを多く含む細分画分(Amb-MeOH、Seph I、およびSeph III画分)でその効果がさらに強まった。三量体プロシアニジン(化合物7)は、二量体プロシアニジン(化合物5および6)よりも高いラジカル消去活性を示した。化合物5および7のラジカル消去能は文献[23,24]とよく一致している。しかし、化合物6はこれまでDPPH消去剤として報告されていなかったようである。アントシアニンもまた高いラジカル消去能を示した。化合物1~4については、サンプル濃度の上昇により、紫外線吸収に影響を与える強い色の混合物が生じたため、IC50値を確立できなかった。このため、サンプル濃度10.4 µg/mLにおける消去率を測定した。化合物1~3は、アントシアニンの中で最も強いDPPH消去能を有することがわかった。化合物4の活性は他のアントシアニンの活性とは異なり、DPPHラジカル消去能が最も弱い。したがって、アントシアニジンに結合した糖単位が生物学的効果に影響を与える可能性がある。アントシアニンのラジカル消去活性は、以前の研究とほぼ一致しているが、化合物3は化合物2よりもわずかに活性が低いことが報告されている[25]。 |
| 表2.アロニア抽出物、画分、化合物のジフェニルピクリルヒドラジル(DPPH)ラジカル消去活性、15-リポキシゲナーゼ活性、およびα-グルコシダーゼ阻害活性。 |
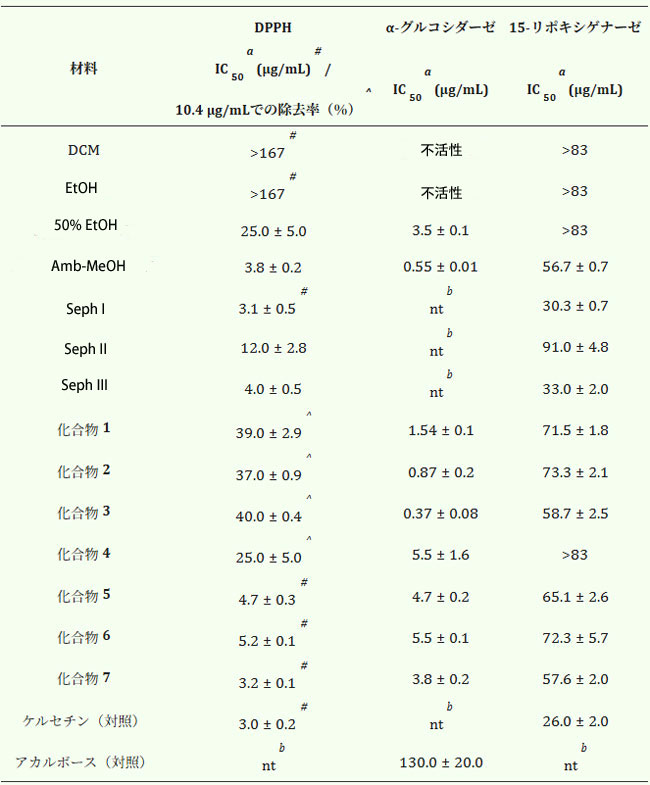 |
| a IC 50 : 50% の消去または阻害をもたらす濃度。b nt : 未テスト。DCM: ジクロロメタン。 |
| 50% EtOH 粗抽出物、Amb-MeOH 画分および化合物 1~7 は、陽性対照である抗糖尿病薬のアカルボースと比較して、α-グルコシダーゼアッセイで高い活性を示した。さらに、精製されたアントシアニンは、単離された二量体および三量体プロシアニジン(化合物 5~7)よりも活性が高かった。植物からの一部のアントシアニン抽出物は、強力な in vitro α-グルコシダーゼ阻害効果を発揮することが知られている [26]。また、McDougall ら [27] は、α-グルコシダーゼの阻害の程度は、さまざまなソフトフルーツのアントシアニン含有量に関係することを発見した。アントシアニンの中で、化合物 2 と 3 が最も高い活性を示し、化合物 4 が最も低い活性を示した。物質 1 の活性は、文献 [28] と一致している。 [29]は、フラバン-3-オールモノマーおよびオリゴマーのα-グルコシダーゼ阻害活性は分子量の増加とともに増加し、最も強いもの(ペンタマー)と最も弱いもの(モノマー)の間で効力に有意な差があることを示した。Amb-MeOH画分にはポリマープロシアニジンが含まれているようで、これがα-グルコシダーゼに対するその強い効果を説明できるかもしれない。三量体プロシアニジン(化合物7)は、二量体プロシアニジン(化合物5および6)と比較して、より強いα-グルコシダーゼ阻害活性を有していた。この活性は分子量の増加とともに増加するようであり、これは以前に報告された結果[29]とよく一致している。アントシアニンについては、α-グルコシダーゼ阻害とDPPHラジカル消去活性との間に非常に有意な相関関係があることを確認した(p < 0.005、R2 = 0.997)。これは文献[6]とよく一致している。粗抽出物、Amb-MeOH画分、およびプロシアニジンについては、有意な相関は認められなかった。Sephadex LH-20画分(Seph I~III)については、材料不足のためα-グルコシダーゼ阻害活性の試験は実施できなかった。 |
| Amb-MeOH画分は15-リポキシゲナーゼに対して高い阻害活性を示し、その効果はプロシアニジンが豊富なサブ画分(Seph IおよびSeph III画分)でさらに強まった。単離されたアントシアニンとプロシアニジン間の活性差は比較的小さかった。両化合物群とも高い15-リポキシゲナーゼ阻害活性を有し、化合物3と7が最も活性が高かった。化合物1、2、3、および7の15-リポキシゲナーゼ阻害活性は、これまでの研究結果と一致している[23,30]。しかし、物質4、5、および6は、これまで15-リポキシゲナーゼ阻害剤として報告されていないようである。 |
| 粗抽出物、サブフラクションおよび単離化合物の キサンチンオキシダーゼ阻害剤としての活性を表 3 に示す。 |
| 表3.アロニアベリー抽出物、画分、化合物のキサンチンオキシダーゼ阻害活性。 |
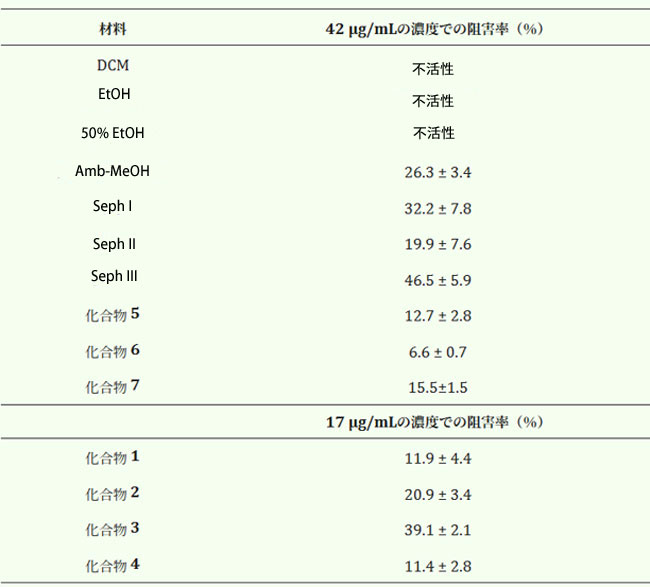 |
| Amb-MeOH 画分は キサンチンオキシダーゼアッセイで中程度の活性を示し、プロシアニジンに富むサブ画分 (Seph I および Seph III 画分) ではその効果がさらに強化されました。吸光度が分光計の検出上限を超えたため (粗抽出物、サブ画分、プロシアニジンのサンプル濃度 > 42 µg/mL、アントシアニンのサンプル濃度 > 17 µg/mL)、抽出物および化合物の濃度を高くすることはできませんでした。化合物 7 は単離されたプロシアニジンの中で最も強力な阻害剤であり、化合物 3 はアントシアニンの中で最も強力でした。ただし、いずれも陽性対照のケルセチン (IC50 0.6 ± 0.1 µg/mL) よりも効果は低かったです。当社が知る限り、アロニアベリー抽出物および物質 1、3、4、6 によるキサンチンオキシダーゼの阻害はこれまで報告されていません。 |
| DCM および EtOH 粗抽出物はともに DPPH ラジカル消去剤、15-リポキシゲナーゼ、キサンチンオキシダーゼおよび α-グルコシダーゼ阻害剤としては不活性であった。単離されたアントシアニンのうち、化合物 3 はラジカル消去活性および酵素阻害活性が最も強く、化合物 4 は最も弱かった。これらの効果は、アントシアニジンに結合した糖単位に影響されているようである。三量体プロシアニジン(化合物 7)は、二量体プロシアニジン(化合物 5 および 6)と比較して生物学的アッセイで高い活性を示し、分子量が増加するにつれて活性が増加するようであった。さらに、2 つの二量体プロシアニジン間には活性差があり、化合物 5 が最も活性が高かった。血管細胞では、酸化促進酵素サンチンオキシダーゼおよび過酸化酵素 15-リポキシゲナーゼによって活性酸素種が生成される可能性がある [31]。アロニアベリーから単離された成分は、15-リポキシゲナーゼおよびサンチンオキシダーゼに対する阻害活性を示し、酸化ストレスを軽減する可能性がある。最近まで、アントシアニンはバイオアベイラビリティが非常に低いと考えられていたが、アントシアニンのバイオアベイラビリティは過小評価されていたことが実証されている[32,33]。さらに、アントシアニンは、血漿中で代謝されていない状態(例えば、配糖体として)で検出できる数少ないポリフェノールの1つである[32]。フラバノールのバイオアベイラビリティは重合度によって異なることを考慮に入れる必要がある。低分子量オリゴマープロシアニジン(DP ≤ 3)は消化管でそのまま吸収されるが、重合は腸管吸収を大きく阻害する[32,33,34]。生体内で15-リポキシゲナーゼおよびサンチンオキシダーゼ阻害剤として作用するには、成分が消化管から吸収される必要がある。試験化合物の既知の生物学的利用能を考慮すると、アントシアニンおよびオリゴマープロシアニジン(DP ≤ 3)を含むアロニア製品および抽出物は、生物学的に関連する15-リポキシゲナーゼおよびサンチンオキシダーゼ効果を有する可能性がある。α-グルコシダーゼ阻害は、炭水化物の消化と腸管からの単糖類の吸収を遅らせる[16]。プロシアニジンを豊富に含む画分、アロニア・メラノカルパの果実から精製されたプロシアニジンおよびアントシアニンは、強力なα-グルコシダーゼ阻害剤であり、血糖値を下げる有益な効果がある可能性を示唆している。 α-グルコシダーゼは小腸上皮に存在する膜結合型酵素であるため、生体内でα-グルコシダーゼ阻害剤として作用するためには、化合物が消化管から吸収される必要はない[20]。したがって、高重合度のアントシアニンやプロシアニジンであっても、消化管においてα-グルコシダーゼ阻害剤として局所的な作用を発揮する可能性がある。 |
| 4. 結論 |
| アロニア・メラノカルパの抽出物、画分、および成分の一部は、in vitro において、ラジカルスカベンジャー、15-リポキシゲナーゼ阻害剤、サンチンオキシダーゼ阻害剤、および α-グルコシダーゼ阻害剤として潜在的な健康効果を有することを明らかにした。三量体プロシアニジン C1 と二量体プロシアニジン B2 および B5 の活性の違いは、我々の知る限り、これまで報告されていない。また、この活性はアントシアニジンに結合した糖ユニットの影響を受ける可能性が高いことも明らかになった。アロニア・メラノカルパ の抽出物および画分が、ラジカルスカベンジャー、15-リポキシゲナーゼ阻害剤、サンチンオキシダーゼ阻害剤、および α-グルコシダーゼ阻害剤としてどのような作用を示すかについて、体系的な研究はこれまで報告されていない。これらの抽出物、画分、および化合物の in vivo における活性は、今後の研究の重要な課題であると考えられる。アロニアベリーに含まれる生理活性化合物は、ラジカルスカベンジャー、過酸化酵素および酸化促進酵素(15-リポキシゲナーゼ、サンチンオキシダーゼ)の阻害剤、そして糖尿病に関与する可能性のあるα-グルコシダーゼの阻害剤を豊富に含むことから、この植物の栄養価を高めています。これは食品業界にとって興味深い点であると考えられます。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Nutrients. 2013 Mar 4;5(3):663–678.に掲載されたExtracts, Anthocyanins and Procyanidins from Aronia melanocarpa as Radical Scavengers and Enzyme Inhibitors.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |