
Amin Gasmi et al., |
概要 |
| 世界中で、科学者はCOVID-19の特定の治療法を探しています。 抗ウイルスアプローチとは別に、ウイルスに対する健康的な免疫応答をサポートするための介入は、食事療法、栄養、ライフスタイルのアプローチを通じて実現可能です。 この物語のレビューは、ウイルス感染に対する微生物叢を介した免疫調節効果に影響を与える食事、栄養、およびライフスタイルの介入に関する最近の研究を探求しています。 累積的な研究では、気道微生物叢とSARS-CoV-2が互いに影響し、病原菌微生物叢-宿主の反応を決定することが報告されています。 タバコの喫煙は、微生物叢の豊富さを混乱させる可能性があります。 腸内細菌叢の組成と多様化は、気道微生物叢と自然免疫および獲得免疫に影響を及ぼします。これには、食事からの主要栄養素と微量栄養素のバランスからのサポートが必要です。 カラフルな野菜は、発酵性のプレバイオティクスと抗炎症性、抗酸化性の植物栄養素を供給しました。 発酵食品や飲料は腸内細菌叢をサポートします。 敏感な人では、高い免疫反応性の食物抗原の回避が抗ウイルス免疫に貢献します。 このレビューは、気道と腸内細菌叢、抗ウイルス性宿主免疫、および重度のCOVID-19に向けた臨床経過を防ぐための食事、栄養、およびライフスタイルの介入の影響との関連を示唆しています。 |
1.はじめに |
2019年12月の開始以来、コロナウイルス病2019(COVID-19)の発生は、原因となるウイルスである重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)の高い感染力と感染により、わずか3か月で世界的大流行となりました[1–3]。 コロナウイルス病に関するWHO-中国合同ミッション2019によると、感染者の78%は無症候性でした[4,5]。 COVID-19症例の81%、14%、および5%は、それぞれ軽度、中等度、および重度の臨床症状を示しました[6]。 食事、栄養、ライフスタイル、環境要因など、個々の宿主の代謝状態は、SARC-CoV-2感染のこれらのさまざまな臨床症状を決定的に決定します[7–10]。 |
| COVID-19の臨床イベントには、乾いた咳、発熱、呼吸困難、肺炎、呼吸不全などがあります[1]。ヒト気道上皮はSARS-CoV-2の侵入部位です[11]。 上気道から下気道までの呼吸粘膜に生息する微生物叢は、健康と病気に重要な役割を果たします[12–17]。いくつかの研究は、宿主免疫、呼吸器の健康、ウイルス感染、およびウイルスワクチンに対する免疫応答に対する微生物相の間の相互関係を示唆しました[18–20]。 腸、口腔、肺の微生物叢のバランスは、ウイルスに対する宿主の免疫寛容と、ウイルス感染の臨床的重症度と期間に影響を与えます[20,21]。 腸内微生物叢の種と代謝産物の変化は、呼吸器ウイルス感染中に強調されており、腸-肺軸に沿った微生物叢を介したクロストークを介して肺に影響を与える可能性があります[19]。 |
| 腸内毒素症および関連する肺合併症は、COVID-19疾患の進行中にも観察されています[22–25]。多くの潜在的な分子標的薬と新しく到着したワクチンの中で、食事と栄養が微生物叢の組成と多様性を決定し、したがって宿主の免疫に影響を与えます。ただし、部屋の中の象であるかのように、これらの単純なオプションの説明はまだ限られています[26–31]。 ここでは、COVID-19に対する宿主の免疫を潜在的に調節する健康な微生物叢のバランスを維持するための食事と栄養の介入を確認します。 |
| 2.微生物叢と宿主免疫 |
人間は無菌の泡の中に住んでいないので、宿主は食物、環境毒素、細菌、寄生虫、真菌、ウイルスなどの細菌を含む外部環境と動的に相互作用します[32–34]。 微生物叢は、皮膚、腸、肺、角膜、膣など、すべての表面の裏地全体でこれらの相互作用の健康的なバランスを仲介します[19,35–37]。 消化管、特に結腸には、人体で最も人口の多い微生物が生息しています。微生物細胞の数とそのゲノムの数は、それぞれ宿主の数の10倍と100倍です[15]。 |
| バリアライニングの統合された機能、保護粘液、および抗菌ペプチドは、最初に微生物の移動から内部の宿主環境を保護します[38]。しかし、樹状細胞やマクロファージなどの組織に存在する抗原提示細胞は、外部の微生物抗原を継続的にサンプリングして処理し、メッセージを宿主の免疫細胞に中継します[38]。 これらの処理された分子パターンは、自己、非自己、損傷、または病原体および危険に関連する分子パターン[39]のような危険な信号のさまざまな信号を含みます。 。これらの外部信号の組み合わせた処理は、炎症誘発性および抗炎症性応答の動的な内部バランス、病原体に対する宿主の耐性、および微生物叢の組成と多様化を決定します[38]。 これらの相互作用は、さまざまな免疫細胞の増殖、分化、成熟を調節します[40–42]。 |
| それらとは別に、いくつかの微生物代謝物、特に短鎖脂肪酸(SCFA)は、結腸細胞、メッセンジャー、および微生物と宿主の免疫同期のメディエーターの代謝燃料として機能します[13,40–42]。発酵性食物繊維と結果として生じる結腸微生物叢の組成は、腸の健康、バリア機能、および内腔の恒常性を維持するSCFA合成を決定します。したがって、炎症性腸疾患などのいくつかの障害から宿主を保護します[43–45]。興味深いことに、インフルエンザA感染は、これらのSCFA産生を妨害し、臨床症状に寄与する微生物叢の不均衡を生み出します[46]。 |
| 3.肺と気道の微生物叢 |
肺の無菌環境の歴史的概念からはほど遠い、肺微生物叢は気道耐性と呼吸器感染に対する免疫応答に大きく貢献しています[15,47]。ただし、肺の微生物数は結腸の微生物数に比べて少なくなっています[15]。上気道と下気道における微生物の存在量と多様化の変化は、喘息や肺感染症などの気道の病状と相関しています[48]。たとえば、免疫調節性のPrevotella種は、肺の恒常性を促進します。肺の炎症誘発性環境は、粘液産生と血管系の強化、および内皮透過性の増加などの栄養素濃縮プロセスを通じて、ガンマプロテオバクテリアなどのいくつかのグラム陰性菌の増殖を増加させます[49]。 |
| タバコの喫煙などの気道関連のライフスタイル要因は、抗炎症性のOceanospirillales、Desulfuromonadales、Nesterenkonia、およびLactobacillaceae乳酸桿菌を減少させながら、炎症誘発性のProteobacteriaおよびFirmicutesの数の増加に向けて肺微生物組成を大幅に変化させます[50]。 興味深いことに、最近の系統的レビューは、喫煙とCOVID-19の否定的な臨床転帰との関連を示唆しました[51]。 |
| しかし、最近の研究では、喫煙は進行および重度のウイルス感染のリスクを大幅に高めることに同意しています[8]。この発見は、ライフスタイル、微生物叢、および抗ウイルス免疫の間の密接な関係を示唆しています。 |
| 4.肺と腸内細菌叢の接続 |
| 動物実験では、生後2週間の間に肺微生物叢の数が増加し、徐々に変化することが報告されています[52]。これらの変化は、制御性T細胞の数の増加によって特定のアレルゲンに対する肺の免疫寛容に影響を及ぼしました[14]。いくつかの研究により、肺と腸内細菌叢との関連が明らかになりました[53,54]。ネオマイシン誘発性の微生物叢の不均衡、別名腸内毒素症は、インフラマソーム、樹状細胞、およびT細胞応答の不活化を通じて、動物モデルのインフルエンザウイルスによる肺感染を増加させました[55]。S. pneumoniaeによって誘発された肺感染の間、微生物叢が枯渇したマウスは、対照よりも炎症が大きく、臓器の損傷が多く、肺胞マクロファージの食作用活性が少なかった[56]。微生物叢が枯渇したマウスへの健康な糞便微生物叢の移行は、呼吸器症状の重症度を改善し、炎症性サイトカインのレベルを低下させました[56]。腸の腸内毒素症は、肺炎や慢性閉塞性肺疾患、嚢胞性線維症、肺がんなどの他の呼吸器疾患を含む気道感染症にかかりやすくする可能性があります[57,58]。それらの異なる場所にもかかわらず、これらの2つの微生物群集は、互いに密接に影響を及ぼし、相互作用しています。 |
| 5.微生物叢とSARS-CoV-2感染に対する保護 |
累積的な研究は、微生物が宿主細胞へのウイルス付着の促進またはインターフェロンや自然免疫活性化などの抗ウイルス免疫のサポートのいずれかを通じて、多くのウイルス感染に対する宿主応答に有意に関与していることを示唆しました[59–61]。微生物叢と感染の特定の証拠は、SARS-CoV-2でも利用可能になり始めています[62–66]。 |
| マウスの肺では、共生細菌がI型インターフェロンの抗ウイルス活性を増強しましたが、これは抗生物質によって鈍化されました[67]。無菌マウスはインフルエンザ感染で死亡する傾向がありましたが、腸内細菌叢の再コロニー化はマクロファージの抗炎症極性化を促進しました[68]。Kanmaniらは、マウスの鼻腔にグラム陽性菌であるCorynebacterium pseudodiphtheriticumが定着すると、呼吸器合胞体ウイルス感染症の症状が軽減され、続発性肺炎球菌性肺炎が予防されたと報告しました[69]。これらの抗ウイルス反応のメカニズムは、肺胞マクロファージにおけるトール様受容体3シグナル伝達の自然免疫活性化の増加、インターフェロンシグナル伝達、およびT細胞活性化でした[69]。Wuらは、呼吸器インフルエンザウイルス感染に応答した、腸の微生物叢を介したトール様受容体7シグナル伝達の活性化も報告しました[70]。 |
| これらのメカニズムとは別に、微生物叢は代謝物、特に酪酸(重要なSCFA)を介して抗ウイルス効果を発揮することができます。Trompetee et alは、SCFAがエフェクターT細胞のエネルギー代謝と活性を増強し、インフルエンザ感染症状を改善することを実証しました[71]。酪酸を含むSCFAの7日間の前処理は、CD8 + T細胞機能を回復させ、抗体反応を増加させ、マウスのインフルエンザ感染を予防しました[36,72]。 喘息のマウスモデルにおける酪酸およびプロピオン酸治療は、炎症性サイトカイン、インターロイキン9、肥満細胞の活性化、および好酸球とTh9 T-ヘルパー細胞[73]による肺浸潤を抑制しながら、抗炎症性制御性T細胞のマスター転写因子であるFOXP3の産生を増加させました。 同種造血幹細胞移植中に免疫抑制治療を受けた360人の患者を対象とした研究では、酪酸産生腸細菌の存在量と下気道感染の可能性の低下との間に5倍の関連性があることが報告されました[74]。 |
| 腸および肺の微生物相は、いくつかの免疫調節メカニズムによって宿主の抗ウイルス免疫に影響を及ぼします。したがって、微生物叢の組成と多様化のバランスをとる介入は、COVID-19で潜在的に役割を果たす可能性があります。 |
| 6.マイクロバイオータ関連の食事および栄養介入の可能性 |
| 6.1 一般的な側面 |
| 健康的な免疫には、個々の食事パターンに由来するさまざまな主要栄養素と微量栄養素からのサポートを統合する必要があります。 ビタミンD、亜鉛、セレンなどの特定の栄養素の欠乏は、特定の栄養素の補給が有益である可能性がある場合、宿主の抗ウイルス反応を損ないます[7,10,75–82]。 一般に、バランスの取れた食事、適切な栄養状態、および色とりどりの野菜からの抗炎症および抗酸化植物栄養素の定期的な摂取は、SARS-CoV-2に対する宿主の反応をサポートし、COVID-19に関連する重症度、期間、および死亡率を減らすことができます [83,84]。 |
| 6.2 プレバイオティクス |
| 食物プレバイオティクスは、腸内細菌に栄養を与え、短鎖脂肪酸の生成に寄与する発酵性および非消化性繊維化合物です[85]。ガラクトオリゴ糖、トランスガラクトオリゴ糖、およびフラクトオリゴ糖を含むこれらのプレバイオティクスは、有益な微生物叢株の数を維持し、有益な短鎖脂肪酸の産生を維持するため、健康な宿主の抗ウイルス免疫を調節する可能性があります。繊維が豊富な食事は、インフルエンザウイルス感染の重度の病理学的症状と気道の炎症からマウスを保護します[86]。高繊維食と酪酸補給を行ったマウスは、ケモカイン発現の減少、循環単球数の増加、好中球浸潤の低下、T細胞の生体エネルギーの促進、肺の炎症の減少、インフルエンザウイルスのクリアランスの増強を示しました[86]。 |
| Luoto et alは、プレバイオティクスとプロバイオティクスであるLactobacillus rhamnosus GGを組み合わせて使用することで、ライノウイルスによって誘発された気道感染症による乳児の発生率の低下を報告しました[87]。発酵性オリゴ糖、ビタミン、およびその他の抗酸化剤を含む実験食を補給した高齢者は、インフルエンザワクチンに対する症状の持続期間が短く、抗体価が高く、リンパ球の増殖が対照よりも高かった[88]。 |
| 最近の研究では、COVID-19患者が腸内毒素症を示し、乳酸桿菌とビフィズス菌が減少したことが報告されています[89]。いくつかの裏付けとなる証拠にもかかわらず、プレバイオティクスはCOVID-19の潜在的な免疫調節戦略です。 しかし、色とりどりの野菜を定期的に摂取することで、プレバイオティクス機能のための非消化性繊維と、抗炎症および抗酸化効果をもたらす植物栄養素も提供されます。この食事パターンは、微生物叢を介した抗ウイルス免疫をサポートすることができます[89]。 |
| 6.3 プロバイオティクス |
| プロバイオティクスは、腸内微生物叢のバランスと多様化を媒介する可能性のある有益な微生物叢の事前に決定された特定の菌株であり、したがって、ウイルス感染を含む病原体に対する宿主の免疫を増強します[90]。 マルチビタミンとミネラルをラクトバチルス菌とビフィズス菌のプロバイオティクス菌株と組み合わせて使用すると、インフルエンザ誘発性の風邪の期間と重症度が軽減され、Tヘルパー細胞の数が増加します[85,91]。 プロバイオティクスであるラクトバチルスプランタルムDK119またはラクトバチルスカゼイDN-114001の投与は、インフルエンザ感染から宿主を保護し、一般的な感染症の期間を短縮します。 これらの関連するメカニズムは、インターロイキン12とインターフェロンγの産生の増加、マクロファージと樹状細胞の活動の調節、および宿主の炎症反応の低下です[92-94]。 |
| したがって、プロバイオティクスはCOVID-19の賢明な免疫調節オプションです。 しかし、蓄積された証拠は、治療管理における特定のプロバイオティクス株の役割を結論付けるには時期尚早です[89,95,96]。 |
| 6.4 発酵食品および飲料 |
| 利用可能な公開された研究の数は限られていますが、オミクスベースの研究では、発酵食品の消費量と有益な微生物叢の違いとの関連が報告されています[97]。 発酵プロセスは、細菌や酵母によって食品中の糖分を分解します。 発酵食品や発酵飲料には、生きた細菌とプレバイオティクス繊維が含まれています。 乳製品の発酵により、ケフィア、ヨーグルト、カッテージチーズが得られます。 その他の発酵食品および飲料には、発酵野菜、テンペ、味噌、漬物、ザウアークラウト、キムチ、コンブチャ、およびビートクワスやアップルサイダーなどの他の飲料が含まれます。これらの発酵食品の摂取は、微生物叢と宿主の代謝の健康に潜在的に有益です[97-99]。 |
| ケフィアは、宿主の免疫力を調節し、ウイルスや細菌の感染の可能性を減らし、多くの宿主の代謝状態に利益をもたらす、安価な自家製の発酵ミルク飲料です[100,101]。 ケフィアの発酵プロセスには、乳酸菌と酵母の共生作用が含まれます[100,102]。 細胞株研究は、T細胞増殖の減少に対するケフィアの効果とジカウイルス曝露の細胞変性効果を報告しました[103]。 乳酸桿菌を含む新しいケフィアは、樹状細胞の天然アジュバントとして作用し、いくつかのサイトカインの分泌を促進し、細胞傷害性T細胞の活性を増強し、ウイルス感染に対して作用します[84,104]。 |
| 6.5 制限食 |
| いくつかの研究は、腸内細菌叢が、食物抗原分解、腸バリアの完全性、および抗炎症性制御性T細胞の促進のメカニズムを通じて食物感受性に影響を与える他の宿主素因の中にあることを報告しました[105]。ウイルスと宿主の相互作用はこれらの恒常性を破壊し、食物抗原に対する病原性応答を誘発します[105,106]。この懸念は、SARS-CoV-2パンデミックの際に食物過敏症またはアレルギーの既往歴のある個人にとって特に重要です。 |
| 健康的な微生物叢のバランスのためのこれらの介入とは別に、高い免疫反応性抗原を含む食品の食事の回避は、宿主の抗ウイルスの可能性に貢献します。グルテン感受性は、自己免疫性セリアック病の発症の根底にあります[107]。ウイルス誘発性のインターフェロンγ応答は、アデノウイルス、エンテロウイルス、ロタウイルス、C型肝炎ウイルスなどのいくつかのウイルス感染時にセリアック病の進行を悪化させます[108–111]。興味深いことに、非毒性種であるレオウイルスはグルテンと相互作用し、セリアック病の進行につながる免疫応答を開始します[106]。 |
| これらの証拠により、既知の食物過敏症、アレルギー、または自己免疫状態のリスクを持つ個人は、COVID-19の発生時に宿主の耐性を促進するために制限された食事を検討する可能性があります。 |
| 結論 |
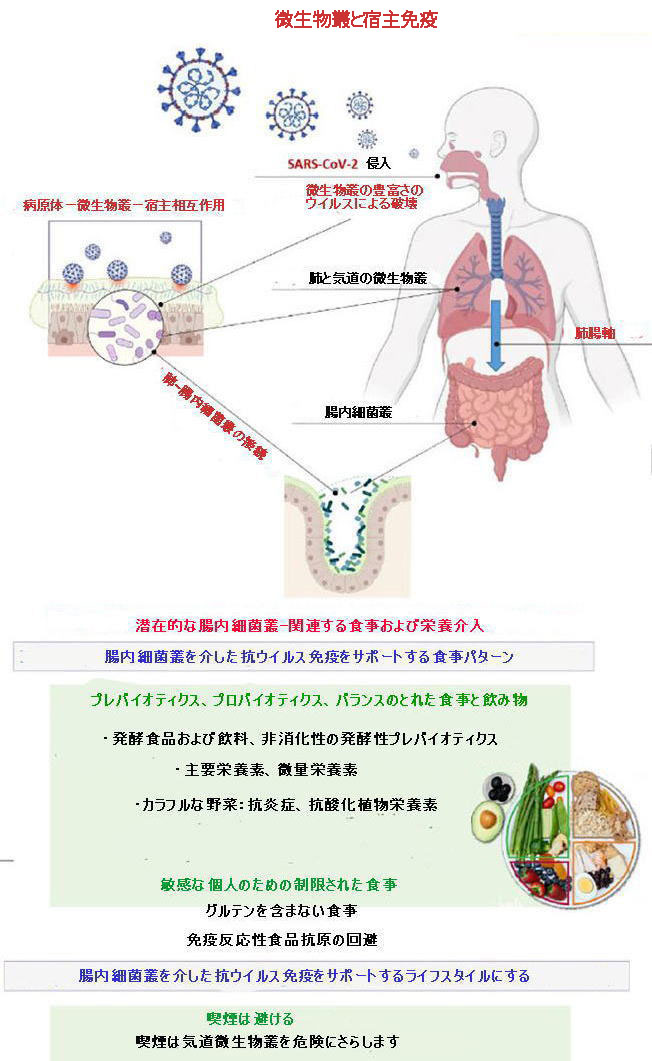
科学者たちはこれまでにCOVID-19の特定の治療法を探しています。抗ウイルスアプローチとは別に、ウイルスに対する健康的な免疫応答をサポートするための介入は、食事療法、栄養、ライフスタイルのアプローチを通じて実現可能です。 図1に示すように、気道微生物叢とSARS-CoV-2は互いに影響を及ぼし、宿主の免疫応答を決定します。 ウイルス感染は、微生物叢の豊富さを破壊する可能性があります。 ただし、腸内細菌叢の組成と多様化は、気道微生物叢とその免疫に影響を与えます。 喫煙は気道微生物叢を危険にさらします。 健康的な免疫には、食事からの主要栄養素と微量栄養素のバランスが必要です。カラフルな野菜は、発酵性のプレバイオティクスと抗炎症性、抗酸化性の植物栄養素を供給しました。 |
| 発酵食品や発酵飲料は腸内細菌叢をサポートします。 敏感な人では、免疫反応性の高い食物抗原を避けることは、抗ウイルス免疫に貢献します。 これらの食事と栄養の介入は、重度のCOVID-19に向けた臨床経過を妨げる可能性があります。 |
 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
| この文献は、Clinical Immunology 226 (2021) 108725に掲載されたThe microbiota-mediated dietary and nutritional interventions for COVID-19を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |