
Julio Villena et al., |
概要 |
| 粘膜感染と急性呼吸器症候群コロナウイルス2(SARS-CoV-2)に対する免疫応答、および開発中または使用中のコロナウイルス病2019(COVID-19)に対する現在のワクチンに関する最も重要な特性は、乳酸菌ベースのワクチンがこの病気との闘いにおいて有効な代替手段を提供するために機会を強調するために改訂されています。さらに、この記事では、(a)有益なラクトバチルスプランタルム株による粘膜抗ウイルス防御の改善に関与する細胞および分子メカニズム、(b)L.プランタルムにおける異種タンパク質の発現システム、および(c )経口投与後に腸および気道に防御免疫応答を誘導することができたL.プランタルムにおけるウイルス抗原の発現の成功。 L. plantarumがウイルス抗原を発現する能力(SARS-CoV-2のスパイクタンパク質を含む)と、経口投与後の腸粘膜と呼吸粘膜の両方で先天性および適応免疫応答を特異的に調節する能力は、この乳酸菌が粘膜COVID-19ワクチンの開発に使用される可能性を示しています。 |
1.はじめに |
コロナウイルスは、幅広い宿主を持つプラス鎖一本鎖RNA(ssRNA)ウイルスです。 現在までに、次の7つのヒトコロナウイルス(HCoV)がヒト病原体として同定されました。 HCoV-229E、HCoV-OC43、HCoV-NL63およびHCoV-HKU1(非重症の一般的な寒さの原因)、2003年に中国で分離された重症急性呼吸器症候群コロナウイルス(SARS-CoV)および中東呼吸器症候群コロナウイルス(MERS -CoV)2012年に中東諸国で出現した[1]。 SARS-CoVとMERS-CoVはどちらも高病原性ウイルスであり、致死率の高い院内感染を引き起こしました。 7番目で最近同定されたヒトコロナウイルスはSARS-CoV-2であり、コロナウイルス病2019(COVID-19)の原因です。 |
| COVID-19は、2019年12月に中国の武漢で出現し、その高い伝染性と病原性により、数か月で世界中に急速に広がりました。 SARS-CoV-2はSARS-CoVやMERS-CoVよりも穏やかな臨床的関与を引き起こしますが、2021年2月1日のWHOの状況報告によると、COVID-19は世界中で1億人以上に影響を及ぼし、2,217,005人が死亡しています( WHO、2021年)[2]。 |
| 社会的距離の拡大や封鎖など、ほとんどの国でいくつかの通行抑止政策が実施されています。 また、これまでにないワクチン開発競争が始まりました。 現在、中国のBBIBP-CorV(Sinopharm)とCoronaVac(Sinovac)、Pfizer-BioNTech COVID-19ワクチン(Pfizer)、mRNA-など、いくつかのCOVID-19ワクチンが第III相臨床試験を終了しているか、緊急使用許可を与えられています。 米国では1273ワクチン(Moderna)、ロシアではSputnik-Vワクチンであり、SARS-CoV-2感染を抑制し、近い将来にパンデミックを阻止する希望を提供します[3,4,5]。 |
| SARS-CoV-2に対する防御免疫応答は十分に理解されていないため、どのワクチン戦略が最も成功するかは不明です。 COVID-19ワクチンの大部分は、ウイルスが標的細胞に侵入するのを防ぐために、抗SARS-CoV-2中和抗体を誘導するように設計されています。場合によっては、ワクチンは体液性免疫と細胞性免疫の両方を誘導するように設計されており、感染した宿主でのウイルス複製を制限するのに役立ちます[5]。注目すべきことに、ほとんどのワクチンは非経口使用のために設計されているため、SARS-CoV-2が粘膜組織に感染し、ヒトからヒトへの感染が呼吸器飛沫によって媒介されるという事実にもかかわらず、主に全身性免疫を誘導することができます。糞口感染は除外されていません[6,7]。 SARS-CoV-2に対する体液性免疫だけでなく細胞性免疫も生成し、このウイルスが複製を開始する粘膜表面に防御免疫を誘導する必要があるため、この第1世代のCOVID-19ワクチンは前述の制限を克服することを可能にする新世代のワクチンと後で置き換える必要があると推測できます。 |
| 保護粘膜免疫応答は、経口または経鼻経路による粘膜免疫によって最も効果的に誘導されますが、注射されたワクチンは一般に粘膜免疫の誘導が不十分です。しかし、粘膜表面の物理化学的障壁と耐性を誘発する傾向があるため、粘膜免疫応答の誘発は困難です[8]。したがって、粘膜ワクチン送達システムは、高用量の抗原および効率的な粘膜アジュバントを必要とする。乳酸菌は、デリバリーベクターと粘膜アジュバントの両方として提案されています[9,10]。過去数十年間、組換え乳酸菌は、胃腸の状態に対する自然な耐性と、腸の自然免疫応答と適応免疫応答の両方を調節する能力により、新世代の経口ワクチンベクターとしてテストされてきました。この意味で、ラクトバチルス プランタルム(Basonym Lactobacillus plantarum)は、腸管に一時的にコロニーを形成する胃腸の状態に耐え、局所(腸粘膜)だけでなく、離れた粘膜部位の粘膜免疫応答を有益に調節するため、経口ワクチンの開発に適しています。よく(呼吸粘膜)そしてそのゲノムの操作のために利用できる分子技術があります。 |
| ここでは、粘膜部位でのSARS-CoV-2感染、ウイルスに対する免疫応答、および開発中の現在のCOVID-19ワクチンに関する関連情報を改訂します。 そして、この病気との闘いにおいて代替手段を提供するための乳酸菌ベースのワクチンの可能性を分析します。 さらに、(a)L.plantarum菌株による粘膜抗ウイルス防御の改善に関与する細胞および分子メカニズム、(b)L.plantarumの異種タンパク質発現システム、および(c)組換えL. plantarumの経口投与後の腸内および気道の防御免疫応答をレビューします。 |
| 2. SARS-CoV-2粘膜感染症 |
| SARS-CoV-2のウイルス29.9kbゲノムは、それぞれスパイク(S)、エンベロープ(E)、膜(M)、ヌクレオカプシド(N)タンパク質と呼ばれる4つの構造タンパク質をコードしています。 ゲノムはまた、非構造タンパク質とアクセサリー因子をコードしています(図1)。 |
| 図1 SARS-CoV-2ビリオン(A)およびゲノム(B)の構造。 |
| ビリオンには、ゲノムRNAとNタンパク質で構成されるヌクレオカプシドが含まれており、S、E、Mタンパク質で構成されるウイルスエンベロープ内に封入されています。 RNAゲノムの約3分の2は大きなポリタンパク質(ORF1a / b)をコードし、3 '末端に近い最後の3分の1はスパイク(S)、エンベロープ(E)、膜(M)、ヌクレオカプシド(N)の4つの構造タンパク質をコードします。 S1およびS2ドメインと受容体結合ドメイン(RBD)を示すSタンパク質の構造が強調表示されています。 |
| SARS-CoVとSARS-CoV-2を比較する機能的およびゲノム研究は、SARS-CoV-2のスパイクタンパク質(またはSタンパク質)がこのウイルスの侵入受容体として機能することを示しました。 SARS-CoV-2受容体の認識と付着は、Sタンパク質の受容体結合ドメイン(RBD)と、多数の細胞で発現するヒトアンジオテンシン変換酵素2(ACE2)との相互作用によって開始されます(図2)。さらに、SARS-CoV-2エントリーには、TMPRSS2酵素などのセリンプロテアーゼによるSタンパク質の効率的なプライミングが必要です[11,12]。したがって、鼻および気管支の上皮や肺胞など、ACE2およびTMPRSS2の発現が高いヒト組織および臓器の細胞集団は、SARS-CoV-2感染に対してより脆弱です。これらの細胞には、気道の上皮細胞、肺実質、小腸(図2)、血管内皮細胞、腎臓、肝臓、心臓血管組織が含まれます[12,13]。 これは、COVID-19患者が発症する症状の多様性を説明しています。 これらの症状は患者ごとに異なります。ただし、ほとんどの症候性の患者は、気道と胃腸管の愛情の兆候があります。粘膜組織においてSARS-CoV-2がACE2に結合する効率は、SARS-CoVよりもACE2へのSARS-CoV-2の結合親和性が高いことからわかるように、伝染性の重要な決定要因として提案されました[12]。 |
| 2.1 SARS-CoV-2呼吸器感染症 |
| COVID-19の臨床症状は、軽度の呼吸器症状から重度の急性呼吸窮迫症候群(ARDS)までさまざまです。 最も一般的な症状は、乾いた咳、鼻炎、喉の痛み、息切れ、胸痛、筋肉痛、倦怠感、肺炎です[14、15、16、17]。 入院が必要な重症例では、ARDS、二次感染、心臓の変化などの合併症が現れます[14]。 |
| 鼻上皮細胞は、呼吸器系でACE2の発現が最も高い細胞集団に属します[18,19]。 ACE2は、初代気液界面鼻細胞培養でのin vitro scRNA-seq研究によって裏付けられているように、鼻上皮の杯細胞および繊毛細胞で発現しています。 ウイルス複製は細胞変性効果を引き起こし、繊毛の動きを止めます[20,21]。 鼻上皮には、嗅覚ニューロンと副細胞(繊毛細胞、ゴブレット細胞、分泌細胞、およびACE2を発現する予備の基底幹細胞[22])も含まれており、匂いの検出に関与します。 嗅覚上皮の支持細胞のSARS-CoV-2感染は、局所的な炎症とともに、COVID-19患者によく見られる無嗅覚症を引き起こします[22,23]。 |
| 先に述べたように、ACE2とTMPRSS2はII型肺細胞でも高度に発現しており(図2)、下気道でのSARS-CoV-2複製を可能にします[20]。 II型肺細胞のウイルス溶解は、肺胞構造を維持する機能を損ない、それが次に肺のガス交換機能を低下させます[21]。肺損傷は、II型肺細胞のびまん性反応性過形成、びまん性肺胞損傷、浮腫、およびタンパク性またはフィブリン性肺胞滲出液の存在を特徴とします[14]。下気道感染症のより重症の症例では、間質性線維芽細胞が増殖して肺胞中隔を肥厚させ、硝子膜が形成されます。さらに、炎症のために、単核細胞の顕著な間質性浸潤が観察され得る。これらの浸潤は、特に二次細菌感染が存在する場合、肺胞内空間への好中球の沈着を伴う可能性があります[14]。注目すべきことに、肺血管系で高いACE2レベルを発現する内皮細胞も、SARS-CoV-2感染の影響を受けやすく、それらの損傷により、肺胞-毛細血管関門が変化します[14、19、20]。 |
| 図2 SARS-CoV-2感染症にかかりやすい粘膜組織 |
| ウイルスは表面受容体ACE2およびTMPRSS2を発現する粘膜細胞に感染し(A)、活発な複製は細胞の死を引き起こし、呼吸および腸の変化を引き起こします(B)。 |
| 2.2 SARS-CoV-2腸感染症 |
| さまざまなレベルのACE2およびTMPRSS2が、消化管の上皮サブタイプ細胞を含むさまざまな細胞型[24,25,26,27,28,29,30,31,32]で検出されています(図2)[26,29、 31,32]。 ACE2の発現が最も高かったのは、小腸の吸収性腸上皮細胞、特に回腸と空腸でした[20,33,34]。 腸粘膜におけるSARS-CoV-2複製のさらなる証拠は、十二指腸上皮細胞におけるヌクレオカプシドタンパク質の検出、COVID-19患者の糞便[33,36,37]および直腸[7,38]サンプル中のSARS-CoV-2RNA [7,38]の検出でした[35]。 COVID-19成人患者で観察された主な胃腸症状は、悪心または嘔吐(1〜10%)、下痢(2〜10%)[39,40]および腹痛(2〜6%)[41,42]でした。 COVID-19小児患者を追跡した研究では、下痢が主な兆候であり、感染した10人の子供のうち3人で報告されました[7]。 |
| 臨床的および実験的証拠は、SARS-CoV-2が腸粘膜に効果的に感染および複製できることを示しており、これは疾患管理、患者ケア、および感染管理に重要な意味を持っています[40]。 たとえば、糞便のウイルス排出は、トイレのプルームから生成される感染性エアロゾルの発生源となり、媒介生物の伝播につながる可能性があります[43]。 この感染経路は、患者の約50%が腸サンプルでSARS-CoV-2 RNAが陽性であり、呼吸器サンプルで陰性を示した後も腸のSARS-CoV-2排出が陽性であったことを考えると特に関連性があります。 次に、腸粘膜からのウイルス排出が豊富であり、呼吸器症状の解消後も長く続く可能性があることが示唆されています[7,38]。 |
| 3. SARS-CoV-2免疫応答とワクチン |
| 3.1 SARS-CoV-2免疫応答 |
| COVID-19の病態生理は、SARS-CoV感染症の病態生理に似ており、感染した組織に損傷を与える攻撃的な炎症反応を特徴としています。 したがって、COVID-19の重症度は、SARS-CoV-2によって誘発される細胞傷害だけでなく、宿主の反応にも依存します。 急速なウイルス複製は、上皮細胞の広範な破壊、炎症誘発性サイトカイン/ケモカインの放出、および感染組織への炎症性細胞の動員を誘発します[44]。 したがって、SARS-CoV-2複製を制御する宿主の能力と炎症反応を調節する能力の両方がCOVID-19の結果を決定します[44,45,46]。 ウイルスに対する宿主の反応を理解するために考慮すべき主な側面は次のとおりです。 |
| (i)I型インターフェロン依存性免疫。 |
| 複製中に、病原体関連分子パターン(PAMP)が露出します。これは、免疫細胞と非免疫細胞の両方で発現するパターン認識受容体(PRR)によって認識されます [47,48]。 PAMPとパターン認識受容体の相互作用は、I型およびII型インターフェロン(IFN)と炎症性サイトカインを誘導するシグナル伝達経路を活性化します。 IFN、特にIFN-βは、隣接する免疫細胞および非免疫細胞上の数百のインターフェロン刺激遺伝子(ISG)のアップレギュレーションを通じて、抗ウイルス状態を促進します。したがって、粘膜組織におけるI型IFNの適切かつタイムリーな産生は、ウイルスの複製と播種を早期に抑制するために重要です。 SARS-CoV-2などのコロナウイルスは、免疫検出を回避し、この初期のI型IFNを介した抗ウイルス反応を弱めることができます[44、45、46]。 I型IFNの早期生産の失敗は、より重症のCOVID-19症例の発症と関連しています[16、45、49]。興味深いことに、生命を脅かすSARS-CoV-2呼吸器感染症の患者を評価する臨床およびゲノム配列決定研究では、I型IFNの抗ウイルス効果につながるシグナル伝達経路に関与する主要遺伝子Toll様受容体-3、IRF7、およびIFNAR1に変異が存在することが報告されました[50 ]。さらに、重症または重症のCOVID-19患者の血液サンプル中のI型IFNのレベルとSARS-CoV-2力価を評価する臨床試験では、I型IFNの産生の低下が血液中のウイルス量の増加と相関することが報告されました[ 51]。さらに、同じ研究は、I型IFNの非効率的な早期産生が炎症反応の悪化と関連していることを説明しました。これらの発見と一致して、COVID-19患者におけるI型およびIII型IFNの産生低下は、炎症性ケモカインおよびサイトカインの分泌の上昇を伴い、COVID-19の病状を悪化させることが報告されています[49、52]。 COVID-19の重症例では、血液中の炎症性単球と好中球の数の増加、および気道内のCD14 + CD16 +単球由来マクロファージが検出されました[3]。 |
| (ii)樹状細胞アクティベーション。 |
| 自然免疫機構の適切な活性化と調節は、初期段階で感染を制御するだけでなく、適切な適応応答を誘発するためにも必要です。 SARS-CoVおよびMERS-CoVと同様に、SARS-CoV-2は、IFNシグナルを減衰させることによって樹状細胞の活性化を抑制します[53]。 さらに、トランスクリプトミクス研究[54]によると、HLA-DMA、HLA-DMB、HLA-DRB1、およびCD74の発現は、COVID-19の重症例では大幅に減少しています。 その結果、SARS-CoV-2は、抗原提示に影響を与えることにより、適応免疫応答を損ないます。 |
| (iii)T細胞性免疫。 |
| 多くの研究が、COVID-19の最も重症な症例における適応免疫の顕著な変化を示しています。一般に、COVID-19疾患の重症度とは関係なく、CD8 + T細胞はCD4 + T細胞よりも活性化されているようです[55]。血液サンプル中のCD4 +およびCD8 + T細胞の数の減少は、COVID-19に苦しむ患者、特により重症の場合に一貫して観察されます[7,25,56,57]。さらに、T細胞受容体シーケンシングは、重度の症例と比較して、軽度の疾患を患っているCOVID-19患者の血液[58]および気道T細胞[59]のTCRクローン性が高いことを示しました。さらに、集中治療室の患者における血中CD8 + T細胞の減少の程度は、COVID-19関連疾患の死亡率と相関しています[55]。 CD8 + T細胞集団のいくつかの質的変化は、重度のCOVID-19症例でも説明されており、消耗マーカーの発現の増強[60,61]やCD107aおよびグランザイムBの発現の減少[61,62]が含まれます。一方、CD4 + T細胞の機能は、重症のCOVID-19患者でも損なわれます。IFN-γを産生するCD4 + T細胞が大幅に減少します[56,63,64]。対照的に、SARS-CoV-2タンパク質N、M、およびSに特異的なロバストなT細胞応答は、軽度のCOVID-19から回復している患者のIFN-γELISPOTによって検出されました[65,66]。 |
| (iv)B細胞性免疫。 |
| SARS-CoV-2感染後の数日間におけるIgM、IgG、およびIgAタイプのウイルス特異的抗体の迅速な検出は、COVID-19患者における強力なB細胞応答の生成を示しています[55]。 NおよびSタンパク質は最も免疫原性の高い分子であるため、ほとんどの抗体はこれらの抗原に向けられています[67,68]。さらに、Sタンパク質の受容体結合ドメインに向けられた中和抗体は、ウイルスと侵入受容体ACE2との相互作用をブロックし、感染を防ぎます[68]。 高いSARS-CoV-2特異的抗体価は、COVID-19患者のウイルス量と逆相関し、invitroウイルス中和の増強と直接相関することが示されました[69,70]。さらに、B細胞集団は重症型のCOVID-19に苦しむ患者で減少します[7,25,56,57]。小児では、ウイルス特異的IgMが1週間以内にIgGに切り替わり、この効率的な体液性免疫応答が小児で観察される軽度の症状の原因であることを示唆しています[71]。 |
| 全体として、これらのデータは、免疫記憶の発達とともに効率的な特異的適応免疫応答の生成が、SARS-CoV-2感染を予防またはその重症度を軽減するための重要なツールになり得ることを示しています。 したがって、COVID-19ワクチンは、他のどの病気でもこれまでに見られなかったような世界のレースで開発されています。 |
| 3.2 SARS-CoV-2ワクチン |
| COVID-19のパンデミックに対抗するための安全で効果的なワクチンの緊急の必要性は、多くのワクチン候補の研究、特性評価、および開発を加速させました。ワクチン製造業者と学術科学機関は、新規で確立されたプラットフォームを使用して、SARS-CoV-2に対するワクチンを開発するために世界的に協力しました[72,73]。これらの実験的ワクチンのいくつかは、すでに第III相臨床試験に進んでいるか終了しています[4]。 大まかに言えば、効率的なワクチンを開発するには、次の2つの要素が必要です。 標的病原体の抗原を、免疫応答が最初に生成される身体部位に送達することができる抗原送達システム、および宿主免疫系を活性化するためのシグナルを提供するアジュバント[74]です。 COVID-19に対するワクチンの開発に使用されるさまざまなワクチンプラットフォームは、抗原送達ベクターおよびアジュバントとしてさまざまな戦略を利用しています。これらのプラットフォーム技術には、生のSARS-CoV-2、組換え抗原または合成ペプチド、核酸ベース(DNAおよびRNA)ワクチン、非複製および複製ウイルスベクターの不活化または弱毒化が含まれます[4,5]。 |
| 従来の不活化ワクチンには、高力価の感染性ウイルスが必要です。次に、この戦略では、バイオセーフティーレベル3の施設でSARS-CoV-2を大量に培養する必要があります。これには、安全性とロジスティックの大きな懸念があります。注目すべきことに、SARS-CoV-2の不完全な不活化は、ワクチン製造労働者やワクチン接種を受けた人々、特に高齢者や併存疾患のある患者などのリスクの高い集団の人々にリスクをもたらします[4,5]。さらに、ウイルスの不活化のプロセスは、抗原性エピトープの修飾を誘発し、それらを生存可能なウイルスのものとは異なるものにする可能性があります。これらの不利な点を回避するために、弱毒生ワクチンを使用することができます。これは、病原体のさまざまな抗原(実際のエピトープ)に対する免疫応答を誘導できるためです。この種のワクチンの欠点は、弱毒化生ウイルスと野生型コロナウイルスとの組換えのリスクです[4,5]。前臨床試験または使用中のCOVID-19ワクチン候補のいくつかは、高い有効性を示した非複製アデノウイルスベクターのプラットフォームに基づいています[4]。それにもかかわらず、この種のワクチンは、同じウイルスの追加免疫または将来の適用を制限するウイルスベクターに対する免疫応答の発達など、いくつかの制限を提示します。さらに、ウイルスベクターに対する既存の免疫はワクチンを無効にする可能性があります[5]。 |
| これらの懸念はすべて、サブユニットワクチンを使用することで回避できます。このアプローチでは、ワクチンは定義された組換えタンパク質または合成ペプチドで処方されます。サブユニットワクチンには特定のウイルス抗原フラグメントが含まれており、他の病原性成分は含まれていないため、一般的に安全性が高いと考えられています[4,5,75]。サブユニットワクチンの免疫原性が低いため、強力なアジュバントの使用が義務付けられています。さらに、この種のワクチンで生成される免疫応答は使用するアジュバントに大きく依存するため、ワクチン製剤に組み込まれるアジュバントは慎重に選択する必要があります。前述のように、SARS-CoV-2のSタンパク質の受容体結合ドメインは、標的細胞の感染に重要な役割を果たします。したがって、Sタンパク質または受容体結合ドメインに向けられた抗体は、感染から効率的に保護することができます[75]。これと一致して、SARS-CoVのSタンパク質に向けられた抗体がウイルスを中和し、感染を防ぐことができることが以前に報告されました[76]。一方、SARS-CoV-2に感染した人のほとんどは、最初の症状から1〜2週間後に、Sタンパク質に対するIgM、IgG、およびIgA抗体を産生します[5]。 SARS-CoV-2感染によって誘導される中和抗体、特にSタンパク質に存在するエピトープに向けられた中和抗体は、ウイルス感染の制御と再感染の防止に重要な役割を果たし[77]、防御の原理であることが示唆されました。回復期の血漿治療[78]。したがって、Sタンパク質はSARS-CoV-2サブユニットワクチン候補の主要な標的抗原を構成します[5,75]。 |
| Sタンパク質はS1ドメインとS2ドメインで構成されています(図1)。 S1ドメインは膜遠位にあり、宿主受容体ACE2に結合する受容体結合ドメインを含んでいます[3]。 全長Sタンパク質、S1-受容体結合ドメインまたは受容体結合ドメインを含むさまざまな形態のSタンパク質は、動物モデルおよび非ヒト霊長類で抗体応答を生成し、SARS-CoV-2感染に対する防御を与えることが示されました[75]。 S1-受容体結合ドメインまたは受容体結合ドメインに向けられた抗体は、ウイルスとACE2の相互作用をブロックしますが、S1またはS2ドメインの他の領域をターゲットとする抗体は、Sタンパク質のコンフォメーション変化を阻害し、膜融合をブロックします[75]。 |
| 抗Sタンパク質IgG抗体価の評価は、COVID-19の症例間で大きく異なり、検出できないものから100,000を超える値までさまざまです[5]。適切な抗体反応の発生を制限する可能性のある感染の病理学的結果は、COVID-19患者に見られる抗体価の幅広い変動の原因として示唆されました。さらに、強い抗体反応は必ずしも軽度の病気と相関しているわけではありません。いくつかの臨床研究は、入院を必要とするCOVID-19の最も重症な症例を後に発症した患者で最も高い抗体価を報告しました[5]。対照的に、軽度の症候性感染症の人は一般的に抗体反応が弱かった。高レベルの中和抗体が回復期の個人で観察されており[65]、これはCD4 + T細胞応答と相関しています[79]。 COVID-19から回復した患者のうち、100%がSタンパク質特異的CD4 + T細胞を有し、70%が血液サンプル中にSタンパク質特異的CD8 + T細胞を有していました[79]。さらに、いくつかの研究では、COVID-19から回復した人は中和抗体とT細胞の両方のレベルが高いようであり、重症の場合と比較して、COVID-19の軽度の症例では気道に記憶CD8 + T細胞の数が多いことが報告されています。 [59,65,79]。この証拠は、SARS-CoV-2に対する効果的な防御には抗体媒介免疫とT細胞媒介免疫の両方が必要であることを示唆しています[3]。 |
| DNAおよびRNAワクチンには、SARS-CoV-2の選択された遺伝子が含まれており、細胞質送達後、これらの遺伝子はウイルスタンパク質に翻訳され、防御免疫応答を誘導します。 核酸ベースのワクチンには、生産性、安定性、および貯蔵に関して関連する利点があります。 これらのタイプのワクチンは体液性免疫と細胞性免疫の両方を誘発することが証明されていますが、SARS-CoV-2の一般的な経験と組み合わされた新たなデータは、他のワクチンプラットフォームと比較して、高力価の抗体を誘発する能力が最も低い可能性があることを示しています[5]。 さらに、DNAまたはRNAワクチンが粘膜保護免疫を誘発できるかどうかの明確な証拠はまだありません[4,5]。 |
| 前述のすべてのワクチンは、COVID-19と戦うための貴重なツールです。 それでも、粘膜免疫の発生に関する報告はありません。 したがって、ウイルスの粘膜複製とその拡散を回避するために、粘膜免疫系に影響を与える能力を備えた新世代のワクチンへの道はまだ開かれています。 |
| 4.粘膜組織における抗ウイルス免疫応答のモジュレーターとしてのL. plantarum |
| 腸の微生物叢は、局所粘膜組織(腸粘膜)と遠位粘膜部位(呼吸器粘膜)の両方で粘膜抗ウイルス免疫を維持する上で重要な役割を果たします[80,81,82,83]。注目すべきことに、ほとんどの科学的研究は、上皮および抗原提示細胞と相互作用することにより、腸および気道免疫の自然免疫防御メカニズムを調節する腸内細菌叢の能力を強調しています。さらに、粘膜の自然免疫応答のこの調節は、粘膜の抗ウイルス性の細胞性および体液性の適応免疫応答にも影響を及ぼします[82,84,85]。驚くべきことに、腸内細菌叢のすべてのメンバーが粘膜の抗ウイルス免疫の有益な調節に等しく寄与するわけではありません。これにより、粘膜組織の抗ウイルス防御を高めるために、免疫生物学と呼ばれる免疫調節能力を持つ有益な細菌の特定の菌株を探索する可能性が開かれました[82,84,85]。免疫調節能力を備えたこれらの有益な微生物の中で、いくつかのL. plantarum菌株は、経口投与された場合に局所および遠位の抗ウイルス免疫応答を改善するための興味深い代替手段です[86,87,88]。 |
| 4.1 L. plantarumによる腸の抗ウイルス免疫応答の調節 |
| 上皮細胞と腸粘膜に到達する微生物との相互作用は、それらの微生物が引き起こす免疫応答のタイプを決定する上で中心的な役割を果たします[89,90]。ウイルスの場合、初期の腸の先天性反応は、I型IFNの分泌と、抗ウイルス活性を発揮するいくつかのインターフェロン刺激遺伝子の産生です。腸の有益な微生物はこれらの生来の抗ウイルスメカニズムを改善することが示され[82]、したがって、微生物-腸上皮細胞の相互作用は、腸のウイルス感染と戦うのを助ける免疫生物を選択するための効果的なツールとして使用されてきました。この点に関して、我々は、最初に確立されたブタ腸上皮細胞株(PIE細胞)が、Toll様受容体-3およびRIG-I受容体のリガンドならびにロタウイルス感染に応答できることを実証した[91,92]。さらに、in vitro ブタ腸上皮細胞株細胞システムは、ポリ(I:C)刺激またはロタウイルスチャレンジ時にIFN-β産生およびインターフェロン刺激遺伝子発現を特異的に調節する能力を備えた免疫生物乳酸菌株のスクリーニングに役立ちます[82]。 ブタ腸上皮細胞株細胞での我々の研究は、L. plantarum株CRL1506およびMPL16がIFN-γおよびIFN-βレベルを増加させ、同時にインターフェロン刺激遺伝子のアップレギュレーションを伴うことを示しましたが、CRL681などの他のL. plantarum株はできませんでした[87,88、 93]。 L. plantarum CRL1506およびMPL16によってアップレギュレーションされたインターフェロン刺激遺伝子ISGの中で、ウイルスから腸粘膜を保護するために重要なMx2およびRNAseLで顕著な効果が観察されました[94]。これらおよびおそらくIFN-α/β経路を介してCRL1506およびMPL16株によって誘導される他のいくつかのインターフェロン刺激遺伝子は、乳酸桿菌で処理されたブタ腸上皮細胞株細胞で見られるロタウイルス複製の低下に関連していると考えられます。マウスモデルを使用して、L.plantarumCRL1506およびMPL16の抗ウイルス免疫調節特性をinvivoで確認しました[87,95,96]。両方の系統は、Toll様受容体-3アゴニストポリ(I:C)でチャレンジした後、マウスの腸I型IFNおよびIFN-γの産生を有意に増加させました。これと一致して、他の研究では、腸上皮の抗ウイルス免疫を強化するL. plantarum株の能力が報告されています(図3)。 L. plantarum Lp-1の抗ウイルス免疫調節特性は、コロナウイルス伝染性胃腸炎ウイルス(TGEV)に感染したブタ空腸細胞(IPEC-J2細胞)で研究されました。 これは、子豚に下痢、嘔吐、および高い死亡率を引き起こす最も重要な胃腸病原体の1つです[97]。 実験データは、L. plantarum Lp-1で処理されたIPEC-J2細胞のTGEV力価が対照よりも有意に低いことを示した。この効果は、TGEV感染後のIPEC-J2細胞におけるIFN-β、ZAP、MX2、MX1、PKR、OASLおよびインターフェロン刺激遺伝子15の発現を増強するLp-1株の能力に関連していました[97]。 |
| 図3 腸粘膜のウイルスに対する耐性と免疫応答に対する経口投与された免疫生物Lactiplantibacillus plantarum株の有益な効果 |
| 腸上皮細胞におけるパターン認識受容体を介したシグナル伝達経路の活性化は、I型IFNおよびインターフェロン刺激遺伝子の産生を刺激するだけでなく、炎症性サイトカインおよびケモカインの発現も刺激します。 NF-κBシグナル伝達経路の活性化は、ウイルス感染後の腸上皮におけるIL-1β、IL-8、GM-CSF、CCL-3およびCXCL-10を含む炎症性サイトカインの産生を刺激します[98,99]。この炎症反応は、ウイルスに対する宿主防御の第一線です。免疫細胞を動員して活性化します。しかし、規制緩和されたり、時間の経過とともに過度に延長したりすると、組織の損傷や上皮バリアの機能不全につながる可能性があります[98,99]。次に、ウイルスによって誘発される腸の炎症反応の効率的な調節は、感染に対する完全な保護を達成するために不可欠です。免疫生物は、腸の炎症反応の調節にも役立ちます。 L. plantarum株CRL1506およびMPL16は、Toll様受容体-3の活性化時にブタ腸上皮細胞株細胞における炎症誘発性メディエーターの産生を特異的に調節することを実証しました[87,88,93]。さらに、CRL1506株とMPL16株はどちらも、炎症性サイトカインの産生と腸上皮細胞と上皮内リンパ球の相互作用を調節することにより、マウスのToll様受容体-3誘発性小腸損傷を軽減しました[87,95]。 異常なToll様受容体-3シグナル伝達が腸上皮でIL-15の発現を誘導し、CD3 + NK1.1 +CD8αα+上皮内リンパ球の活性化を引き起こし、パーフォリン経路によって誘導される腸上皮細胞のアポトーシスを増加させることが示されました[ 100]。マウスでは、ポリ(I:C)の投与により、腸粘膜のToll様受容体-3が活性化され、絨毛萎縮と粘膜びらんが誘発されます[101]。これらの発見と一致して、IL-15受容体の遮断がマウスをポリ(I:C)誘発性の小腸損傷から部分的に保護することが実証された[101]。 Toll様受容体-3の活性化は、腸上皮細胞を刺激してレチノイン酸初期誘導性1(RAE1)を発現させ、CD3 + NK1.1 +CD8αα+細胞を誘導してIL-15を介してNKG2Dを発現させます[102]。次に、RAE1-NKG2Dの相互作用は、腸の損傷において顕著な役割を果たします。興味深いことに、Toll様受容体-3活性化の前にL. plantarum CRL1506で前処理したマウスは、腸上皮細胞でのIL-15およびRAE1のレベルの低下と、CD3 + NK1.1 +CD8αα+上皮内リンパ球でのNKG2Dの発現低下に反応することを示しました[95]。さらに、poly(I:C)チャレンジの前にCRL1506またはMPL16系統で治療されたマウスは、腸のTNF-α、IL-1β、およびIL-8のレベルを有意に低下させました[87,95]。腸の炎症性損傷におけるL.プランタルム菌株の有益な効果は、ポリ(I:C)チャレンジ後の体重減少と腸の組織学的損傷の有意な減少に変換されました。 |
| L. plantarum LRCC5310、特にその細胞外多糖類(EPS)は、ヒトロタウイルスに対する拮抗作用を誘発します。 LRCC5310株またはそのEPSで処理されたMA104細胞は、未処理のコントロールと比較した場合、細胞変性の変化が有意に低く、ウイルス複製が減少していました[103]。さらに、経口投与されたL. plantarum LRCC5310は、ロタウイルス感染に対する若いマウスの保護を強化し、下痢とウイルス排出の期間を短縮し、腸上皮の完全性の破壊を防ぎました[103]。補完的なinvitro研究は、L.plantarumLRCC5310 EPSが腸上皮細胞とマクロファージの両方でIL-10を増加させ、IL-1βとTNF-αを減少させることを示しました[103]。 L. plantarum LRCC5310がロタウイルス腸炎の乳児に投与された臨床試験では、臨床症状と実験室の炎症マーカーに関して、試験開始時に対照群とLRCC5310治療群の間に有意差は示されませんでした。しかし、試験の終わりに、対照と比較した場合、LRCC5310で治療された子供における下痢の重症度と期間、およびロタウイルス力価が有意に減少しました[104]。 |
| また、L.plantarumCRL1506が炎症性サイトカインの発現を調節し、腸の抗原提示細胞の活性化と成熟に影響を与えることも実証しました[93]。 樹状脂肪はIFN-α/βを産生し、I型IFNに応答して成熟することが報告されています。さらに、IFN-α/βはインビボで樹状脂肪の活性化を強力に増強することが示されており、ウイルス感染の状況における自然免疫と適応免疫の間の重要なリンクとして機能します[105]。実際、I型IFNによる樹状細胞のin vitro処理は、これらの細胞を活性化し、T細胞応答を開始する能力を高めます。 I型IFNで刺激された樹状脂肪は、MHC-IIと、共刺激分子CD40およびCD86の発現を改善しました。さらに、IFNで処理された樹状細胞は、IFN-γを産生するCD4 +およびCD8 + T細胞を刺激する能力が高かった[106,107]。 これらの報告に沿って、私たちのinvitroおよびinvivoの結果は、腸内でのMHC-II、IL-1β、IL-6およびIFN-γの発現の増加によって証明されるように、免疫生物学的L.plantarum株CRL1506およびMPL16が腸の樹状細胞で Th1応答を改善できることを示しました [87,88,93]。 したがって、L.plantarumは、I型IFN依存的に樹状細部の抗原提示を調節する能力を通じて、腸の適応免疫を刺激することができます。さらに、この仮説は、経口投与されたL. plantarum CRL1506またはその生存不能な細菌様粒子(BLP)が経口ワクチンに対する免疫応答を改変できるかどうかを評価することを促しました[108]。 私たちの手では、L。plantarumCRL1506またはその細菌様粒子は、ロタウイルスワクチンと併用した場合にアジュバント能力を示しました。 L. plantarum CRL1506またはその細菌様粒子によるマウスの免疫化は、ロタウイルス抗原に対して生成される特定のTh1粘膜および全身性免疫応答を大幅に改善しました。さらに、私たちの免疫プロトコルは、細胞性免疫を刺激するだけでなく、腸のIgAおよび血清IgG特異的抗体のレベルの上昇も、ロタウイルスワクチンおよびCRL1506株で免疫された動物で見られました[108]。これらの結果は、I型IFNがin vivoで抗体反応を促進することが実証されたため、免疫生物学的L.plantarum治療によって誘発される適応反応の効率的な生成においてI型IFNに重要な役割を果たすという仮説の追加の証拠を提供します[109]。実際、I型IFNは、IgGのすべてのサブクラスの抗原特異的抗体の合成を増加させ、広く使用されているアジュバントよりもはるかに効果的にIgG2aおよびIgG3抗体を誘導することが示されました[109]。私たちの結果と一致して、L.plantarum06CC2の経口投与は、単純ヘルペスウイルス1型(HSV-1)に感染したマウス[110]だけでなく、パイエル板の未攻撃のパッチ[110]でもIFN-γとIL-12p40の発現を有意に増加させました「111]。さらに、乳酸桿菌処理は脾臓NK細胞活性とIFN-γ産生細胞を改善しました。 06CC2株によって誘発されたこの免疫調節効果は、皮膚病変における単純ヘルペスウイルス1型力価の低下と相関していた。 |
| 注目すべきことに、私たちと他のグループは、L.plantarum株がウイルス感染またはワクチン接種によって引き起こされる腸の細胞性および体液性免疫応答を改善する能力に関して異なるアジュバント能力を持っていることを証明しました。ロタウイルスワクチンとL.plantarum CRL1506で免疫したマウスでは、体液性と細胞性の両方の腸特異的免疫応答が大幅に向上しましたが、L.plantarum CRL1905またはその細菌様粒子で処理した動物ではそうではなく、異なる菌株が粘膜アジュバントとして異なって機能することを示しています[108]。有益な免疫調節性乳酸桿菌に対する細胞応答の最終的な結果は、さまざまなパターン認識受容体と相互作用してさまざまなシグナル伝達経路を誘発できるさまざまな微生物関連分子パターン(MAMP)の組み合わせに依存します[112]。特定の乳酸桿菌株と非免疫細胞および免疫細胞との間に確立された細胞および分子の相互作用のユニークな組み合わせは、乳酸菌、特にL.plantarumの免疫調節特性が株に依存する特性である理由を説明しています。次に、機能性食品の開発や粘膜ワクチンのアジュバントとして使用するために、腸の免疫を有益に調節する能力を備えた最も効果的なL.plantarum菌株の効率的な選択が必要です。以下に概説するように、この効果は少数の株によってのみ達成されるため、目的の機能性食品またはワクチン製剤が腸粘膜だけでなく気道などの離れた粘膜部位にも免疫を与えることを目的とする場合、これはより適切になります。 |
| 4.2 L.plantarumによる呼吸器抗ウイルス免疫応答の調節 |
| 動物モデルでの実験と人間の臨床試験は、経口投与された場合、特定の乳酸菌株が呼吸器免疫を調節し、細菌およびウイルス感染に対する耐性を高めるのに効果的であることを示しました。 このグループの免疫生物学的乳酸菌は、肺炎球菌性肺炎、一般的な風邪やインフルエンザのような症状などの呼吸器感染症に対する子供、大人、高齢者の耐性を改善します[85]。 この独特の免疫調節特性を有する乳酸菌株の中には、L.plantarum種に属する菌株のグループがあります(図4)。 |
| 図4 呼吸器粘膜のウイルスに対する耐性と免疫応答に対する経口投与された免疫生物Lactiplantibacillus plantarum株の有益な効果 |
| 腸粘膜に免疫調節能力を有するすべての乳酸桿菌株が、経口投与されたときに呼吸器免疫を刺激できるわけではありません[110,111,112,113,114,115,116]。 経口投与されたL.plantarum MPL16は、呼吸器免疫を調節することができたが、L.plantarum CRL1506は調節できなかった。 MPL16株は、気道内のIFN-γおよびI型IFNのレベルを改善することができ、CD4 +IFN-γ+ T細胞およびCD11c + SiglecF +肺胞マクロファージの機能を調節する能力を示しています。 さらに、L.plantarumMPL16で治療したマウスに見られる呼吸器IFN-γおよびIFN-βのレベルの上昇は、RSウイルス感染に対するマウスの耐性の改善と相関していました[87]。 |
| 呼吸器免疫を調節する経口投与された乳酸菌の菌株依存性能力は、他の研究グループによっても確認されました。経口投与されたときに呼吸器免疫を調節するいくつかのL.plantarum株の能力は、IFV肺炎の致死モデルで評価されました[110]。評価された菌株の中で、L.plantarum 06CC2は、IFVに感染したマウスの生存を改善する能力で際立っていましたが、L.plantarum菌株05 AM23、06TCa8、06TCa40、06CC9は保護効果を誘発しませんでした。経口投与された06CC2株は、肺のIFV力価を低下させ、気道のTh1応答と、肺と脾臓の両方のNK細胞活性を改善しました。さらに、免疫調節乳酸菌の大規模なスクリーニングでは、いくつかのLactiplantibacillus株が、TNF-α活性化HT-29細胞と末梢血単核細胞の両方で免疫を調節する能力について評価されました[116]。評価された菌株の中で、L.plantarum CNRZ1997は、上皮細胞と免疫細胞の両方で炎症性サイトカインの産生を有意に増加させることができましたが、他のL.plantarum菌株は効果を示さなかったか、抗炎症能力があることが示されました。興味深いことに、この研究は、経口投与されたCNRZ1997系統が、マウスの気道におけるIFVの複製を減少させることができることを示しました。 L. plantarum CNRZ1997による経口治療は、L。rhamnosusGGまたはL.casei DN114-001(前臨床およびヒト試験における抗IFV特性を持つ2つの市販のプロバイオティクス株)による経口治療と同じくらい効果的で、IFV感染からマウスを保護しました[ 84]。 |
| 健康な被験者のTh1免疫を改善した熱殺菌L.plantarum L-137で見られたように、生存能力は抗ウイルス呼吸免疫の有益な調節に必要ではないようです[117]。この株は、コンカナバリンAが誘導する血中リンパ球の増殖を増加させ、CD4 +IFN-γ+ T細胞の割合を高めることができました。経口投与された熱殺菌L.plantarum L-137は、マウス[118]およびブタ[119]で抗ウイルス免疫を有益に調節し、IFV感染後のマウスでIFN-βの産生を刺激しました[118]。ブタでのさらなる研究は、L-137株が血球におけるIFN-βの発現を有意に改善することを示しました[119]。 L. plantarum L-137による治療は、対照と比較した場合、ブタの体重増加が高くなることを意味し、健康状態の改善を示しています。上気道感染症に対するL-137株の影響は、精神的ストレスレベルが高いヒト被験者で評価されました[120]。 L. plantarum L-137は、呼吸器感染症の発生率、期間、重症度、および投薬期間を短縮しました。同様に、L。plantarumnF1強化ヨーグルトの摂取は、高齢者のIL-12およびIFN-γ産生とNK細胞活性を改善し、抗ウイルス免疫を刺激する可能性を示しています[121]。実際、熱処理されたL. plantarum nF1によるマウスの経口治療は、脾臓、NK細胞膜マーカーKlrb1、およびNK細胞とT細胞の活性化マーカーにおけるIFN-γ、IL-2、IL-12の発現を有意に増加させました。 IFVによるチャレンジ後のCD69 [122]。これらの発見と一致して、より高い脾臓NK活性がnF1治療マウスで観察されました。 L. plantarum nF1によって誘発されたこれらの免疫学的変化は、IFV力価の低下およびマウスの生存率の改善と相関していました[122,123]。 |
| 肺胞マクロファージは、腸内微生物によって誘発される呼吸器免疫の有益な調節における重要な細胞です。腸内細菌叢は、肺胞マクロファージの最適な抗ウイルス機能を維持するのに役立つことが示されました。有益な腸内微生物は、肺胞マクロファージがI型IFNと、呼吸器ウイルス感染に対する耐性を改善するIRF7、IFNGR1、STAT1、STAT2、IFIT3、MX1、OAS1などの抗ウイルス因子を産生する効率的な能力に関与しています[81]。我々は最近、呼吸器免疫を調節する能力を備えた免疫生物が、ウイルスチャレンジに対する肺胞マクロファージの応答を機能的に調節できることを実証した。実際、我々の結果は、肺胞マクロファージが、L. rhamnosus CRL1505 [115]またはL.plantarumMPL16(出版のために提出)で経口治療されたマウスの気道におけるIFN-γおよびIFN-βの増強に大きく寄与することを示しています。さらに、L. rhamnosus CRL1505またはL.plantarumMPL16による経口治療後の肺胞マクロファージにおける、IFNAR1、Mx2、OAS1、OAS2、RNAseL、およびIFITM3の発現の改善が実験で検出されました。私たちの結果と一致して、L.plantarumDK119で経口投与されたマウスは、BAL IL-2およびIFN-γレベルが高く、IFV感染時の炎症の程度が低いことが報告されました[124]。乳酸菌治療は、肺のウイルス量を減らし、感染したマウスの生存率を改善しました。対照的に、DK119処置マウスの気道におけるIL-6およびTNF-αのレベルは、IFV感染後の対照マウスからのものと比較して低かった。このサイトカインのパターンと一致して、L.plantarumDK119を投与されたマウスで炎症の程度の有意な低下が観察されました。 CD3-CD11b-CD11c + F4 / 80 +肺胞マクロファージの枯渇を誘発するためにクロドロネートリポソームで治療されたマウスでは、DK119株の投与は、IFV感染によって誘発される重度の体重減少と死亡率の変化を誘発できず、肺胞マクロファージがL. plantarum DK119を介した保護において重要な役割を果たします[124]。 |
| 呼吸器の抗ウイルス免疫を調節するために経口投与された免疫生物によって使用される細胞および分子シグナルの正確な性質は、まだ決定されていない。 CD4 + T細胞とIFN-γをブロックする最近の実験により、経口投与された免疫生物によって誘発される遠隔効果を説明できる潜在的なメカニズムの推測が可能になります[115]。いわゆる一般的な粘膜免疫系の存在は、1つの粘膜組織で活性化された免疫細胞が動員されて離れた粘膜部位に到達し、そこで免疫応答に影響を与える可能性があることを意味します。次に、腸粘膜から気道へのB細胞とT細胞の動員は、経口投与された免疫生物によって発揮される有益な効果に関与している可能性があります[85,115]。 L. plantarum MPL16などの菌株は、腸から肺へのCD4 +IFN-γ+ T細胞の動員を誘導し、IFN-γの局所産生は気道の自然免疫微小環境を調節し、肺胞マクロファージなどの細胞局所免疫の活性化をもたらします。 前のセクションで述べたように、L.plantarum06CC2は、06CC2株が腸の免疫を介して気道でその保護効果を誘発したという仮説を支持する気道と同様に[110]パイエル板でのIFN-γとIL-12の発現を増強します。 一方、L.plantarumYUは、マウスのパイエル板、腸間膜リンパ節、脾臓からの抗原提示細胞によって、TLR2刺激に関連するIL-12のinvitro産生を強力に誘導することが示されました[125]。経口投与されたL.plantarum YUは、IFVでチャレンジした後、体重減少と肺ウイルス複製を減らし、腸のIgA濃度と脾臓のナチュラルキラー細胞活性を高めることができました。注目すべきことに、BALサンプル中のIFV特異的分泌型IgAのレベルは、L.plantarumYUによる経口治療によっても増加しました[125]。 いくつかの乳酸菌株は、マウスのパイエル板から分離された免疫細胞の初代培養でIgAの産生を刺激する能力に従って評価されました[126]。評価された菌株の中で、L.plantarumAYAとN63はinvitroでIgAレベルを有意に増加させる能力を持っていました。ただし、2つの系統をin vivoで評価した場合、L.plantarumAYAのみが経口投与マウスの腸IgAレベルを上昇させました。注目すべきことに、免疫調節効果は、生菌と熱殺菌したL. plantarumAYAの両方で得られました。 AYA系統の経口投与は、IL-6の発現を調節することによって樹状細胞を刺激し、マウスパイエル板のIgA + B220 +細胞の数を大幅に増加させました。 AYA系統で治療され、その後IFVで攻撃されたマウスは、ウイルス感染に対する耐性が改善されました。この保護効果は、気道における高レベルのIgAの誘導に関連していました[126]。この研究は、L.plantarumAYAが腸のDCでIL-6産生を刺激し、それがIgA + B細胞の形質細胞への分化を促進して腸のIgA産生を改善することを示唆しました(図3)。さらに、L.plantarumAYAは、腸粘膜から気道へのIgA + B細胞の動員も誘発し、ウイルス性呼吸器感染症の状況でIgA産生を増強します(図4)。 |
| 全体として、これらのデータは、適切な免疫生物L. plantarum菌株を使用して、腸粘膜と呼吸粘膜の両方で同時に抗ウイルス免疫を改善できることを示しています。したがって、これらは粘膜ワクチン開発のための興味深い生物工学的リソースです。 |
| 5. 粘膜ワクチン開発のためのプラットフォームとしてのL.plantarum |
| 現在、承認されている粘膜ワクチンはほとんどありません。それらのほとんどは、コールドチェーンを必要とし、病原性に戻るリスクを伴う弱毒化病原体を構成します。重要なことに、これらの粘膜ワクチンは、粘膜の健康状態が悪い個人では効果が限られています[127]。 これらの制限のために、それらの天然の酸および胆汁耐性、室温での安定性、および粘膜の自然免疫応答および適応免疫応答を有益に調節するそれらの能力のために、次世代の粘膜ワクチンベクターとしての組換えLABなどの新しいタイプの粘膜ワクチンベクターが必要です。 さらに、乳酸菌遺伝子発現の操作を可能にする分子生物学技術の進歩により、科学者は病原体抗原を含む医学への応用の可能性がある多種多様な分子をそれらの中で発現することが可能になりました。ワクチンベクターとして、乳酸菌は、単純で非侵襲的な粘膜投与、低コスト、高い安全性レベルなど、いくつかの利点を提供します。 乳酸菌は、それ自体に対して最小限の免疫応答を誘発する傾向があり、代わりに、粘膜免疫系を介した取り込みに続いて、発現した外来抗原に対する高レベルの全身および粘膜抗体を誘導します[128]。さらに、前のセクションで強調したように、経口投与された乳酸菌の一部は、腸粘膜だけでなく気道でも特異的免疫を誘導するために使用できます。 |
| ワクチンベクターとして使用するための乳酸菌には、一般にStreptococcus gordonii、Lactococcus lactis、および複数のLactobacillus種が含まれます。 それらのほとんどはL.lactisベースのワクチンですが、L.plantarumベースのワクチンの免疫原性はL.lactisよりも有意に高いことが報告されています[129]。 異種抗原を発現する組換えL.プランタルムは、粘膜組織の病原体および毒素に対する特異的な体液性および細胞性免疫応答の両方を誘発する可能性があり[129,130,131,132,133,134,135,136]、L.plantarumの経口投与は過去数十年間に抗ウイルス免疫応答を効果的に刺激することができる[87,88]。L.plantarumは、組換えウイルス抗原を送達するための媒体として評価されています[131,137,138]。 |
| 現在までに、ウイルス抗原の細胞表面発現のために、L.plantarumに基づくいくつかの送達システムが確立されました(表1)[137,138,139]。ヒトパピローマウイルス(HPV)タイプ16のE7変異タンパク質(E7mm)の細胞壁固定システムは、ウイルスタンパク質のN末端にあるLactococcus Usp45タンパク質の最初の15アミノ酸、 C末端にあるL.plantarumlp_2940タンパク質の細胞壁アンカー[139]とシグナルペプチドを融合することによって構築されました。 E7mmタンパク質は、アンカーモチーフLPQTXEを介してL.plantarumの細胞壁に効率的に固定および表示できます[139]。ただし、細胞表面での異種タンパク質の表示効率は、シグナルペプチド、表面アンカー、および宿主細胞の表面構造によって影響を受ける可能性があります[137,139,140]。 L. plantarumの場合、異種抗原はC末端またはN末端アンカーを介して細菌の表面に表示されます。 C末端アンカーには、LPXTGまたはLPQTXEドメインを含むソルターゼを介した共有結合細胞壁アンカーが含まれます。これらはソルターゼによって触媒され、細胞壁のペプチドグリカンに共有結合します[140]。 N末端アンカーには、L.plantarumに由来するリポボックスベースの共有細胞膜アンカー、L.plantarumに由来するライシンモチーフ(LysM)ベースの非共有細胞壁アンカー、L .plantarumに由来するN末端シグナルペプチドベースの膜貫通アンカー、枯草菌由来のポリ-γ-グルタミン酸シンターゼA(pgsA)を固定[140,141,142]が含まれます。 |
| 表1 Lactiplantibacillus plantarumで正常に発現したウイルス抗原の要約 |
| ヒトパピローマウイルス16型(HPV-16)、Jサブグループ鳥白血病ウイルス(ALV-J)、ブタ流行性下痢ウイルス(PEDV)、伝染性胃腸炎ウイルス(TGEV)およびニューカッスル病ウイルス(NDV)。 |
| ブタIFN-λ3は、それぞれC末端細胞壁アンカーおよびN末端膜貫通アンカーpgsAと結合していました。 そして、両方の戦略がブタIFN-λ3を細菌表面に固定し、IPEC-J2細胞におけるブタ流行性下痢ウイルス(PEDV)およびTGEVに対する強力な抗ウイルス効果を刺激することが見出されました。 しかし、C末端細胞壁アンカーを備えた組換えL. plantarumは、pgsAを備えた組換えL. plantarumよりも強力な抗ウイルス効果を示しました[143]。 |
| 8つの異なるLactobacillusにおける3つの表面アンカーの細胞表面表示効率を評価し、L.plantarumのLPXTGおよびLysMベースのアンカーがリポタンパク質アンカーよりも高い効率を示すことがわかりました[137]。 特に、異質性は抗原ディスプレイ細胞と細胞集団で観察されました。 さらに、8つのLactobacillus種の表面ディスプレイの比較分析により、L.plantarumとL. brevisが最も有望な媒体であり、重要な抗原特異的粘膜IgA、IFN-γ、IL-17を誘発する可能性があることがわかりました[131]。 さらに、発現カセットのコドン最適化がL.plantarumの異種タンパク質の発現を促進できることを以前に発見しました[144]。 これらの結果は、表面ディスプレイをさまざまな抗原とホストに最適化する必要があることを示しており、ホストからの相同アンカーは、異種タンパク質を表示するための有望な候補であるようです。 |
| 樹状細胞およびM細胞を標的とする戦略は、粘膜および適応免疫応答を増強するのに効果的であることが示されています。 L.plantarumで発現した異種抗原の樹状細胞およびM細胞への特異的送達が最近調査されました[132,133,135,144,145,146,147]。 Wangらは、ニューカッスル病ウイルス(NDV)[132]、TGEV [133]、PEDV [135]、および鳥インフルエンザウイルスH9N2 [134]に対して、ウイルス抗原を融合させることにより、特定の抗原を送達するための一連の組換えL.plantarumを構築しました。それぞれ樹状細胞標的ペプチド(DCpep)を使用します。結果は、樹状細胞標的ペプチド融合抗原が腸のIgAの産生を有意に増加させ、抗原を樹状細胞に直接標的化することによってB細胞とT細胞の増殖と分化を刺激することを示しました。さらに、この戦略は、細胞性および体液性免疫応答の有意な増強につながります[132,133,134,135,144]。さらに、M細胞標的ペプチド(Mpep)と融合し、L.plantarumで発現したブタ繁殖・呼吸障害症候群ウイルス(PRRSV)GP5タンパク質は、樹状細胞標的ペプチド融合GP5タンパク質よりもわずかに高い抗原性を示すこともわかりました[144]。 |
| 特に、実験的なL. plantarumベースのワクチンは、経口投与した場合に局所および遠位の特異的免疫を誘導することが示されています(図5)。ガチョウパルボウイルス(GPV)VP2抗原を発現する組換えL. plantarumの免疫原性は、BALB / cマウスで評価されました[148]。組換え乳酸桿菌で経口免疫されたマウスは、腸粘膜で特異的IgAの顕著な産生を示した。さらに、この研究では、対照と比較した場合の組換えVP2-GPVタンパク質による脾細胞のin vitro刺激によるTNF-αおよびIFN-γのレベルの上昇によって示されるように、特定の細胞性免疫の誘導についても説明しました。 ニューカッスル病ウイルスのHN-樹状細胞標的ペプチドを発現する組換えL.plantarumで経口免疫したニワトリは、血清抗HI抗体と特異的腸IgAの両方を産生し、対照動物と比較した場合、HIチャレンジ時に脾臓T細胞の増殖率が有意に高かった[132]。注目すべきことに、ニューカッスル病ウイルス感染に対するニワトリの耐性は免疫化プロトコルによって改善されました。同様に、Jトリ白血病ウイルス(ALV-J)のgp85タンパク質を発現する組換えL.プランタルム株によるニワトリの胃内免疫は、特定の血清IgGおよび腸のIgA抗体の産生を誘導しました[141]。さらに、この免疫化治療は、対照群と比較した場合、Jサブグループ鳥白血病ウイルス-Jウイルス血症を有意に減少させた。豚コレラウイルス(CSFV)のE2タンパク質は、L.plantarumで発現し、組換え細菌を使用して、経口経路でブタを免疫しました[149]。動物の免疫化は、特定の血清IgGおよび腸のIgAの産生、ならびに豚コレラウイルスに対する特定の細胞毒性反応を誘発しました。さらに、ウイルスチャレンジ実験は、L。plantarumE2-豚コレラウイルスがウイルス感染に対する防御ブタを改善する能力を示しました。これは、生存率が高く、症状の重症度が低いことからもわかります。 |
| 図5 腸および呼吸器組織におけるウイルスに対する耐性および免疫応答に対する経口投与された組換えラクトバチルス プランタルム株の有益な効果 |
| 遠位粘膜部位の免疫応答を改善する経口投与された組換えL.プランタルムの能力は、主にウイルス性病原体IFVで研究されました(図5)。 IFVの血球凝集素(HA)を発現するL.プランタルム株を構築し、特定の免疫を誘導し、ウイルス感染から保護する組換え株の能力をBALB / cマウスで評価しました[150]。マウスの経口免疫は、腸粘膜と気道の両方で特定の血清IgGおよび抗HAIgA抗体の産生を誘導しました。粘膜および全身の有効なB細胞応答の誘導は、パイエル板、腸間膜リンパ節、および脾臓におけるFAS + PNA + B220 + B細胞のレベルの上昇によってさらに実証されました。組換え乳酸菌による経口免疫は、HA抗原による再刺激時にリンパ節および脾臓のT細胞による細胞増殖速度およびIFN-γ産生の増強によって示されるように、特定の細胞性免疫応答を生成した。興味深いことに、経口投与されたL. plantarum HA-IFVは、IFVによる鼻腔内チャレンジに対するマウスの保護を大幅に改善しました。免疫化されたマウスは、対照と比較した場合、体重減少、死亡率、呼吸器ウイルス力価、および肺の病理が低かった。これらの有益な効果は、後にL.plantarumでHA-DCpepを発現させることによって改善されました[151]。同様に、IFVのNP-M1-DCpepを発現する組換えL. plantarumは、特定の全身および粘膜免疫を誘導し、経口投与後のウイルス攻撃からマウスを保護することができました[152]。 IFVの異なるサブタイプに対する防御を改善するために、2つのウイルス抗原の融合を発現する組換え乳酸桿菌が開発されました。 IFVからの融合M2eおよびHA2抗原を発現する組換えL.プランタルムで経口免疫されたニワトリは、感染チャレンジ後の肺ウイルス力価の低下および肺および喉の病理学的損傷の減少によって示されるように、病原体から保護されました[153]。 IFVから融合抗原HA2と3M2eを発現するL.plantarumによるマウスの経口免疫は、粘膜および全身の特異的免疫を刺激し、ウイルス性病原体による呼吸チャレンジに対するマウスの耐性を高めました[154]。 |
| これらの研究は、組換えL. plantarum株の経口投与が、特定の免疫を強化することにより、胃腸および呼吸器ウイルスによる感染に対する保護を提供できることを示しました。 この戦略は、SARS-CoV-2などの粘膜組織(腸と呼吸器)の両方を効率的に複製して感染させることができるウイルスに対する耐性を改善するために非常に興味深いものです。 |
| L.plantarumにおけるSARS-CoV-2抗原の発現の成功 |
| 前述のように、不活化ワクチン、生ウイルスワクチン、組換えタンパク質ワクチン、DNAまたはmRNAワクチン、ベクターベースのワクチンなど、180を超えるワクチンがさまざまな段階で開発されています[155]。 SARS-CoV-2のSタンパク質は、ウイルス感染を開始する宿主ACE2と相互作用する能力を持つ主要な抗原であるため、Sタンパク質はウイルスに対するワクチンの主要な抗原標的でした[155,156]。 前述のように、SARS-CoV-2感染は、粘膜および全身の両方の抗体反応を誘発する可能性があり、重症および軽度のCOVID-19患者の上気道および腸管で高い特異的IgAを示し[155,157]、粘膜免疫応答がウイルス感染に対して重要な役割を果たすことを示唆している。 したがって、上気道および腸管におけるウイルスSタンパク質の表示および提示は、SARS-CoV-2に対する効果的な粘膜免疫応答を誘発する可能性があり、これにより、疾患の重症度を軽減し、ウイルスの播種を回避することができます。 |
| L. plantarum LP18(CGMCC 1.557とも呼ばれる)は、腸細胞への接着性が高く、免疫調節機能が優れているため、有望な免疫生物株であることを以前に示しました[138,158,159,160]。 次に、SARS-CoV-2のSタンパク質を細菌表面に表示できる組換えL. plantarum LP18を、5 '末端の内因性シグナルペプチドと最適化されたS遺伝子の3'末端の標的ペプチドDCpepの配列を融合することによって構築しました(図6)[161]。 この実験的ワクチンのinvivo評価は、L.plantarumによって示される抗原が、SARS-CoV-2感染に対する粘膜免疫応答を有意に刺激できることを示しています(未発表のデータ)。 組換えL.plantarumに基づく粘膜標的ワクチンがCOVID-19の有望な候補ワクチンであることをさらに強調します。組換えL.プランタルムの有効性と安全性の評価はまだ進行中です。 |
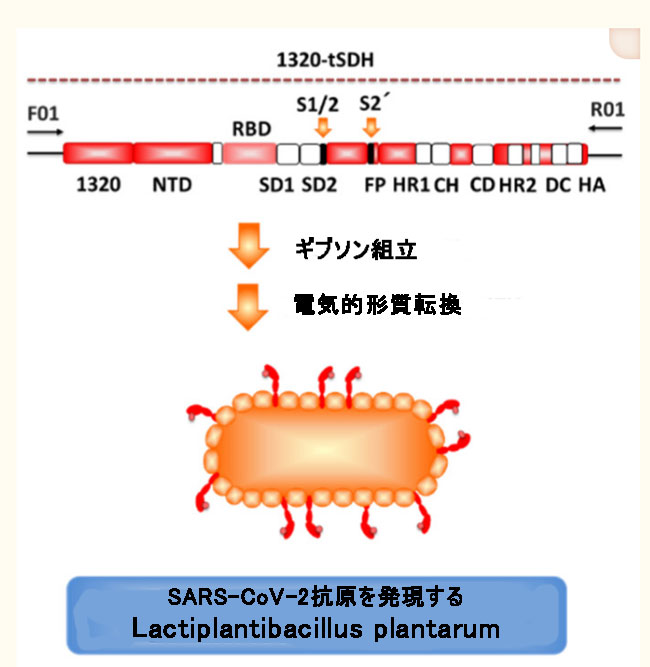 |
| 図6 SARS-CoV-2スパイクタンパク質を発現する組換えラクトバチルス プランタルム株の構築の概略図。 Wang et alから変更 [161]。 |
| 6.結論 |
| 一般に、皮下、筋肉内、または腹腔内経路を介した全身ワクチン接種は、特定の粘膜免疫を誘導することができません。 次に、宿主の適応免疫システムは、病原性微生物が体のより深い組織に侵入した後にのみ、病原性微生物と戦うことができます。 したがって、特定の全身性免疫応答を誘導するだけでなく、粘膜免疫系と全身性免疫系の両方を刺激するワクチンの開発は、病原体が侵入した時点で病原体を制御するのに非常に有利です。 この戦略により、粘膜組織の感染に関連する症状を回避するだけでなく、病原体の拡散を回避することも可能になります。 全身ワクチンに関するこれらの一般的な考慮事項は、COVID-19と戦うことを目的とした開発中または使用中のほとんどすべてのワクチンに当てはまるようです。 |
| 粘膜免疫の誘導は、樹状細胞などの局所的な抗原提示細胞によって取り込まれる抗原によって開始されます。腸内では、抗原は腸の樹状細胞によって処理され、腸間膜のリンパ節に移動して、抗原特異的なTリンパ球とBリンパ球の誘導を刺激します。活性化されると、抗原特異的リンパ球は増殖と分化を経て、遠心性リンパを介して腸間膜リンパ節を出て、胸腔を介して血液循環に入ることができます。このようにして、活性化された抗原特異的TおよびBリンパ球の大部分が腸粘膜に戻ります。興味深いことに、これらの活性化された免疫細胞の一部は、気道などの局所腸粘膜から離れた粘膜組織に到達することができます。経口免疫化による腸管および気道におけるエフェクターおよび/またはメモリーTおよびB細胞の誘導は、両方の粘膜組織で複製することができる病原体に対する保護のために非常に価値があります。 SARS-CoV-2は主に気道粘膜を複製して影響を及ぼしますが、臨床的および実験的研究により、このウイルスが消化管に感染する能力が実証されています。報告によると、COVID-19の患者のかなりの割合が胃腸症状を発症し、COVID-19が確認された患者のほぼ半数が糞便サンプルで検出可能なSARS-CoV-2RNAを示しています[162]。さらに、複数のinvitroおよびinvivo動物研究により、SARS-CoV-2による腸感染の直接的な証拠が提供されています[162]。したがって、腸粘膜へのウイルスの影響の調査が進行している間、腸管と気道の両方で防御免疫を誘導することができる免疫調節乳酸菌に基づく粘膜ワクチンの設計は、SARS-CoV-2に対して戦いを進めるために非常に重要です。 |
| 胃の極端なpHや腸のプロテアーゼが豊富な環境を含む胃腸管の敵対的な環境は、摂取した抗原の免疫原性に深刻な影響を与える可能性があります。 さらに、胃腸の免疫系は、エフェクター免疫応答を誘発するのではなく、経口抗原に対して耐性を持って応答する傾向があります。 これらの特徴は、粘膜免疫を効率的に刺激する適切な抗原送達システムおよびアジュバントを見つけることが困難であるため、効率的な経口ワクチンの生成を非常に困難にしている。 |
| ここでレビューしたように、過去数十年のバイオテクノロジーおよび免疫学的研究は、粘膜ワクチンの生成に使用されるL.plantarumの可能性を示しています。現在、乳酸菌では、L.plantarumのSARS-CoV-2スパイクタンパク質などの異種タンパク質を発現させることができます。他の組換えL.plantarum菌株は、経口免疫に使用すると腸内で防御免疫応答を誘導することが証明されており、敵対的な胃腸環境から発現抗原を保護する細菌の能力を強調しています。さらに、有益なL. plantarum株による粘膜抗ウイルス防御の改善に関与する細胞および分子メカニズムの理解に大きな進歩が見られました。これにより、近い将来、組換え乳酸桿菌ベースのワクチン設計の改善が可能になります。それらの効率を高めます。さらに、研究により、免疫生物および組換えL. plantarum菌株が一般的な粘膜免疫系を刺激し、経口投与後の腸だけでなく気道にも防御免疫を誘導できることが示されています。これらの科学的進歩は、粘膜COVID-19ワクチンの開発に使用されるL.plantarumの可能性を明確に示しています。 これは、現在の全身ワクチンを補完するものとして使用でき、粘膜感染に関連する症状を改善し、SARS-CoV-2の蔓延を減らすために協力することができます。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Microorganisms. 2021 Apr; 9(4): 683.に掲載されたLactiplantibacillus plantarum as a Potential Adjuvant and Delivery System for the Development of SARS-CoV-2 Oral Vaccines.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |