
John P. Haran & Beth A. McCormick |
人間の腸内細菌叢は、私たちの体に共存し、人間の健康の保護、代謝、および生理学的機能に不可欠な細菌、原生動物、真菌、およびウイルスの群集です。 腸内毒素症(Dysbiosis)は伝統的に感染のリスクの増加に関連していますが、腸内細菌群集構造内の不均衡は、有害な炎症反応と相関しており、体内の多くの臓器系に影響を与える病気のプロセスに関与しているとますます認識されています。 さらに、腸内毒素症と加齢性疾患との関係は、腸内細菌叢が腸粘膜と全身性免疫系の両方とどのように通信するかにある可能性があることが明らかになりつつあります。 したがって、腸内細菌叢が加齢に果たす重要な役割の理解における最近の進歩と、この知識が加齢性疾患を予防または治療するための腸内菌共生バランス失調(dysbiotic)のない腸内細菌叢の形成を目的とした潜在的な新規治療法への扉を開く方法について説明します。 |
加齢に伴う腸内細菌叢の変化 |
米国の医療制度は、人口の高齢化により、持続不可能な負担が増大しています。 多くの国で65歳以上の人々の割合が増加しているため、高齢者の健康を改善することが不可欠です。 実際、現在の増加率では、2030年までにアメリカ人の5人に1人が65歳以上になると予測されています(1)。 腸内細菌叢は外部環境と宿主の間のインターフェースを占め、腸内細菌と人間の間の相互作用は人生の各段階で起こります。主に出生直後から始まり、老年期まで続きます(図1)。 この洗練された腸内細菌叢生態系は、人間の発達に不可欠で健康をサポートする一連の生理学的活動において極めて重要な役割を果たしています。 この生態系も微調整されています。なぜなら、私たち自身の細胞と腸内細菌叢との協力が弱まると、腸内の微生物群集が感染源になり、時には生命を脅かす病気につながる可能性があるからです。 |
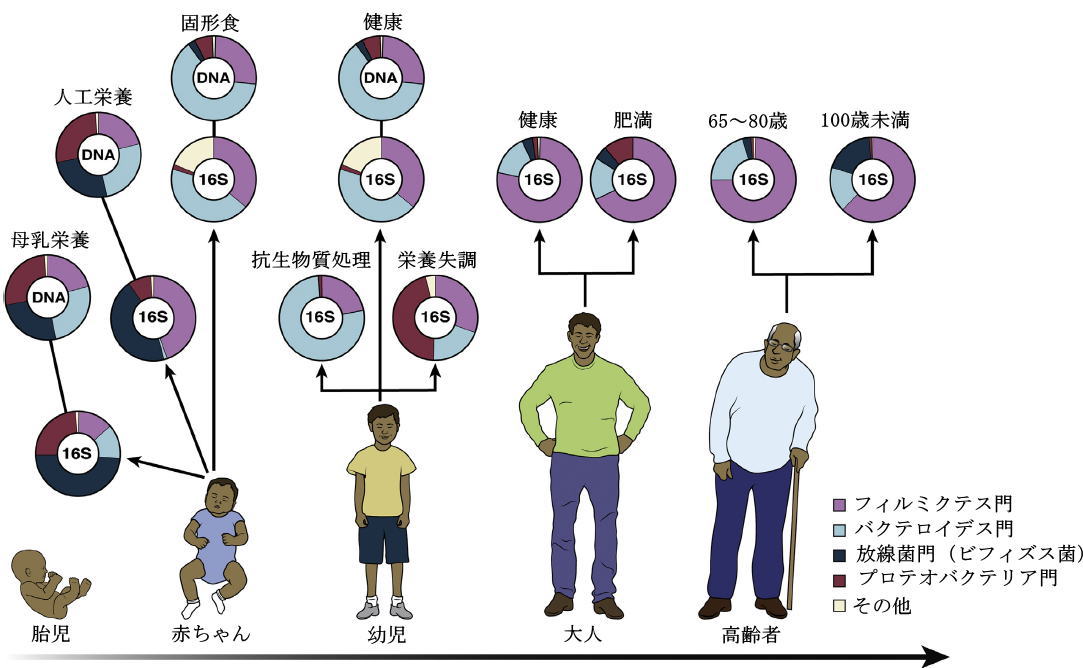 |
ライフステージを通しての発症と形成 |
| グラフは、人生のさまざまな段階におけるヒト細菌叢組成の主要な門の相対的な存在量の全体的な概要を提供します。 16S RNAまたはメタゲノムアプローチ(DNA)のいずれかによって測定されます。 乳児および人工乳で育てられた乳児(Schwartz et al、163)、乳児固形食品(Koenig et al、164)、幼児の抗生物質治療(Koenig et al、164)、健康または栄養失調の幼児(Monira et al、165)、成人、高齢者、および百歳以上の健康(Biagi et al、32)、および 成人の肥満(Zhang et al、166)から届くデータ。 |
| 健康な人はさまざまな種類の細菌叢を持っていますが、健康状態が悪い人や高齢者(高齢者)は、多くの場合、多様性が低く、病気の原因となる細菌叢の割合が高くなります。 したがって、私たちが老化するにつれて、私たちの「老化細菌叢」は、消化器の健康と吸収、および免疫機能に悪影響を与える可能性のある多くの組成変化を受ける可能性があります(5)。 腸内毒素症は、体内または体内の細菌叢の不均衡または不適応を説明する用語であり、健康または病気を促進する細菌の喪失または獲得のいずれかとして定義することができます。 健康な非異生物細菌叢は、その宿主と共生的に働き、重要な保護機能(すなわち、病原体の置換、栄養素の競争、抗菌剤の産生)構造機能(すなわち、バリア強化、免疫グロブリンAの誘導、免疫系の発達)、および代謝機能(すなわち、ビオチンおよび葉酸の合成、非消化性食品の発酵、エネルギー節約、イオン吸着、および腸上皮細胞の分化および増殖の制御)を与えることによって健康を促進します。 逆に、異生物性または不適応性の腸内細菌叢は、腸内だけでなく他のいくつかの臓器系にも関連しており、心血管系(11,12)、免疫系(13,14)、神経系(15,16)、および呼吸器系(17,18)を含むがこれらに限定されないいくつかの例があります。 |
| 腸内細菌叢がさまざまな動的疾患プロセスに影響を与える可能性があることを考えると、高齢者の腸内細菌叢の組成を決定し、その変動を健康の可能な決定要因として特徴付けることには大きな関心があります(19–23)。 加齢は、生活の質と量に影響を与える加齢に伴う罹患率(心臓病、脳卒中、高血圧、認知障害、癌など)と一致するため、これは特に老齢者や高齢者にとって密接な関係があります。 しかし、加齢とともに腸内細菌叢内で発生する変化は完全には理解されていません。 |
| 動物モデルシステムは、特定の腸に関連する細菌の存在が細胞の老化に影響を与えることを明確に示しています。 優れたモデルはキイロショウジョウバエです(24 )。ミバエの細菌叢組成の変化は、加齢に伴う腸内バリア機能障害に関連しており、これも全身性免疫活性化、そして最終的には死につながることがわかっています(25)。 さらに、有害な副作用を引き起こすことなく特定の細菌を排除することで、ハエの寿命を延ばすことが示されています(26)
。 最近では、Smith らは(27)、寿命の研究で腸内細菌叢を操作するための別のモデルとして、短命のアフリカのターコイズキルフィッシュを使用しました。 |
| 非常に驚くべきことに、このグループは、中年の魚が若い魚から移された細菌でコロニーを形成したとき、彼らは彼らの対照の対応物よりも長生きし、人生の後半で著しく活発であったことを発見しました。 若い魚の細菌が生着した中年の魚は、成魚になるまでより多様な細菌叢群集を保持し、重要な細菌を若い魚と共有していることも観察され、健康状態の改善にも関連していると推測されるました。 |
| したがって、この研究の結果は、腸内細菌叢の組成を制御する能力が健康を改善し、寿命を延ばすことができることを示唆しています。 さらに、このモデルは、細菌叢が老化にどのように影響するかについての新しい洞察を提供し、加齢性疾患(ARD)の発症を遅らせる上で重要なリソースになる可能性があります。 これらの発見と一致して、カエノラブディティス・エレガンス(線虫の1種)(28)やマウス(29,30)などの他の動物モデルやモデル生物で行われた老化研究は、腸内細菌叢の調節が老化のタイムラインの変化につながる可能性があるという考えをさらに支持し、そのような変更は寿命を延ばすことができます。 まとめると、これらの研究はすべて、腸内細菌叢が宿主の老化において中心的な役割を果たしていることを示しています。 |
| 腸内細菌叢の加齢に伴う変化の証拠は、さまざまな人間の加齢集団で説明され始めています。 しかし、そのような研究は、研究グループとしての認知症の高齢者や老人ホームの環境に住む高齢者が関与する課題に加えて、研究グループとしての高齢者の不足によって制限されてきました。 それにもかかわらず、細菌の多様性の低下、優占種の変化、有益な細菌と代謝経路の変化を示す、加齢に伴う細菌叢の変化が明らかになっています(31–33)。 これらの変化は、バクテロイデス門とフィルミクテス門の主要な門が優勢に切り替わる、より高い分類法のアプローチからよりよく解決されます。 ただし、これらの観察された組成の変化は門レベルで止まりません。 高齢者でその存在量が最も顕著に減少する種は嫌気性菌であり(31,35)、特にクロストリジウムクラスターXIVa、フィーカリバクテリウム・ プラウスニッツィイ、および放線菌(主にビフィズス菌属)のレベルが低い(32,34–39)。 加齢とともに減少することが示されている他の主要な代謝種には、アッカーマンシア・ムシニフィラ(40)
、ムチン分解細菌、ルミノコッカス・ブロミ(41)、デンプン分解のキーストーン種、および一般的な腸内共生菌、ルミノコッカス・グナビスが含まれます(32,33)。 これらの変化は加齢に伴う異生物細菌叢を物語っていますが、年齢とともに報告される種の存在量の変動は、食事、環境、ライフスタイルなどの国籍に関連する外的要因による可能性があります(42)。 |
| 国籍に基づく影響の違いは別として、異なる条件下で生活する高齢者も、腸内細菌叢の構造が異なることが観察されています。 たとえば、地域社会に住む高齢者と老人ホーム環境に住む高齢者の間には、微生物叢の特徴が明確に区別されています(43,44)。 実際、高齢者が新しい老人ホームの環境に移動した後、腸内細菌叢が変化する明確な時間依存の方法があり、腸内細菌叢の構造変化が発生するのに約1年かかります(34)。 米国の老人ホームは、自然界での管理または熟練した看護を行うことができる高齢者向けのサービスを提供していますが、これらのケア環境は、抗菌薬、食事の質の低下、病原体の蔓延の増加など、微生物叢に悪影響を与える頻繁な薬物曝露の環境も示しています( 36,45–48 )。老人ホームと地域在住の高齢者の間の腸内細菌叢の違いには、一般に、バクテロイデス門の割合が高く、科および属レベルで他のさまざまな細菌の割合が低いことが含まれます(36)。 老人ホームの高齢者の間での細菌集団のこのような変化は、健康なまたは「若々しい」腸内細菌叢のいずれかに関連する種の喪失も表しています。 不思議なことに、そして最初の印象とは反対に、長老の腸内細菌叢は、投薬の変更、抗菌薬への曝露、または健康状態の大きな変化の外で、一時的な安定性を示します。 個々の老人ホームの環境(住居の床/翼など)も腸内細菌叢の形成に重要な役割を果たします(49)。これは、虚弱な高齢者をグループ化して生活する際に、意思決定に情報を提供し、重要な考慮事項を与えるのに役立ちます。 |
| 分類学の違いと歩調を合わせて、腸内細菌叢の代謝の可能性も年齢とともに変化します。 高齢者の間では(栄養と虚弱を考慮した後)、加齢に伴う代謝異常には、ムチンとデンプンの分解の減少、必須アミノ酸の合成、窒素塩基とビタミンの合成の減少が含まれます(41)。 同様に、老化は筋肉量の進行性の喪失(サルコペニア)と関連しており、これは必須アミノ酸の利用可能性の低下に関連しています(50,51)。 さらに、高齢者グループの間では、腸内細菌叢の変化が短鎖脂肪酸産生の遺伝子の喪失を明らかにするだけでなく、日和見病原体の存在と相関する糖分解能の全体的な減少を示すこともさらに観察されています。 |
| 薬は腸内細菌叢の組成に影響を与えます |
| 老化する腸内細菌叢構造の重要な影響力は薬物療法です。 高齢者に一般的に処方されている多くの薬(老人ホームと地域社会の両方の設定を包括している)は、腸内細菌叢の組成に特定の影響を与えることがよく知られています。 これの最も良い例は、多様性の深刻な喪失と微生物分類学の存在量の変化がある抗生物質曝露の場合です(48,53 抗生物質への曝露は、多剤耐性菌の発生にもつながります。 これは、高齢者、特に老人ホームの環境に住む人々の間で増大している重大なヘルスケアの問題です。 現在までに、老人ホームで年間160万から380万の感染があり(54,55)、40万人もの感染者が死亡しています(56)。 残念ながら、多剤耐性菌による感染は老人ホームで増加し続けており56,57)、高齢者が多剤耐性菌の感染で入院した場合の死亡率は40%にもなる可能性があります(58)。 |
| さらに、米国の老人ホームは、植民地化の有病率が非常に高いため、他の医療環境に多剤耐性菌を導入するための主要な貯水池になっています( 59–61)。 腸内細菌叢は人間の健康の中心となる極めて重要な役割を果たしているため(62)、健康な腸内細菌叢は次に宿主の免疫系に関与し、病原体耐性に寄与します(63)。 抗生物質療法は、腸内細菌叢の多様性と豊かさを著しく低下させます。 これは、抗生物質耐性の病原性細菌と日和見細菌の両方が悪用できる脆弱な免疫不全環境を作り出します。これらの細菌は、病院や老人ホームの環境で頻繁に遭遇します。 |
| 最も臨床的に重要な抗生物質耐性腸内病原菌には、腸内細菌科に属するグラム陰性桿菌に加えて、グラム陽性Cディフィシルおよびバンコマイシン耐性エンテロコッカスフェシウムが含まれます(64,65)。 したがって、病原体によるコロニー形成および感染に抵抗するための共生細菌による深遠な貢献は、宿主の健康にとって基本的であり、長い間観察されてきた。 それにもかかわらず、私たちは、高齢者の間で発生する腸内細菌叢の腸内毒素症の根底にある分子の詳細と、これが病原性疾患にどのように関連しているのかを明らかにし始めたばかりです(9,41)。 したがって、私たちがどのように老人ホームの虚弱な高齢者に食事を与え、治療し、グループ化するかによって、多剤耐性菌の蔓延を防ぐための新しいアプローチが提供される可能性があります。 |
| 非抗生物質の投薬も微生物叢の組成の変化に関連しており、食品医薬品局によって承認されたマークされた薬物の約24%が、少なくとも1つの一般的な腸内細菌叢の細菌株を阻害することが示されています(66)。 多くの腸内細菌叢メンバーの相対的な存在量と、病気の過程で認められた変化は広範囲に及びます(表1)。 |
|
表1 属または種ごとの腸内細菌叢メンバーの リストおよびそれぞれが関連していることが示されている公表された病状 |
| ノート。 このリストは、これらの微生物叢メンバーの文献レビューに基づいており、高齢者の健康に影響を与える一般的なカテゴリに分類されています。 これは、各メンバーで公開されているすべての文献を収集することを目的としたものではありませんが、利用可能な関連文献のいくつかへの参照を提供します。 HIV、ヒト免疫不全ウイルス; IBD、炎症性腸疾患。 |
| さらに、プロトンポンプ阻害剤(47,67,68)、スタチン(69-71)、非ステロイド性抗炎症薬72および非定型抗精神病薬(73-76)などの一部の非抗生物質薬の腸内細菌叢への影響は、健康な若年成人でのみ報告されています。 高齢者によく見られるのは、これらのクラスに属する薬の使用と、個人におけるこれらの薬の混合です。 |
| 多剤併用として知られる、特に過剰な薬剤の組み合わせは、高齢者に広く行き渡っており、腸内細菌叢と高齢者の健康に独自の悪影響を及ぼします(77,78)。 確かに、多剤併用は、居住者の半数以上が毎日5回以上の薬を服用している老人ホームで特に普及しています。 |
| 寿命を改善するための腸内細菌叢の調節の役割 |
| 分類法は、腸内細菌叢の代謝能力に情報を与え、影響を与えます。 したがって、腸内細菌叢の成分が年齢とともに変化することを考えると、それはそのような年齢に関連した変化に介入し、遅らせるか、あるいは逆転させる機会を提供するかもしれません。 人間では、百歳以上の人が慢性疾患を遅らせる、あるいは回避する能力があるため、健康な老化研究のモデルとして使用されてきました(80,81)。さらに、遺伝学も広く研究されています(82)。 しかし、今日まで、この切望された集団の腸内細菌叢を調査した研究はほんのわずかです。 どの腸内細菌叢の特徴が長寿に関連しているかについての洞察を得るために、Kong らは83、最近中国の5つの「長寿の郡」のうちの1つ都江堰地域からの長寿(90歳以上)のグループの腸内細菌叢を特徴づけました。 この長寿コホートの腸内細菌叢を若年成人グループの腸内細菌叢と比較すると、Kongらは83、長寿グループの腸内細菌叢の多様性が若年成人グループよりも大きいことを発見しました。 |
| これらの結果は、長寿の個人のグループも含む独立したイタリアのコホートからのデータを使用して検証されただけでなく(32,84)、2つの追加の最近の研究によっても裏付けられました(37,85)。 Kong ら(86)による長寿コホートの腸内細菌叢のより深い特性評価は、短鎖脂肪酸生産菌として知られているいくつかの潜在的に有益な細菌分類群の濃縮を示しました。 不思議なことに、この結果は、フィーカリバクテリウムなどの有益な細菌に一般的に関連する特定の操作分類単位の減少、および潜在的な細菌病原体(大腸菌や赤痢菌など)に関連するいくつかの操作分類単位の増加と相まっていた。 |
| 腸内細菌叢と健康な老化との因果関係を描くのは時期尚早ですが、この観察研究は、多様でバランスの取れた腸内細菌叢を維持することが健康な老化の重要な要因である可能性を示唆する重要な手がかりを提供します。 それでも、健康な老化を特異的に標的にして促進するために腸内細菌叢を調節できるかどうかは、注意深く取り組む必要のある重要な問題です。 より具体的には、加齢はまた、生活の質と量に影響を与える加齢に伴う病的状態(例えば、心臓病、脳卒中、高血圧、認知障害、および癌)を引き起こすため、 老化した腸内細菌叢がこれらの病気のプロセスにどのように影響するかを理解することは、日和見病原体の予防だけでなく、腸内細菌叢を介して人間の健康を改善するために重要です。 |
| 微生物と健康な老化との最初の関連は、現代の微生物学と免疫学の創設者の一人であるエリー・メチニコフによってなされました。 1908年に、彼はノーベル医学賞をパウル・エールリヒと共有しただけでなく、その時代の最も影響力のある本の1つである"寿命の延長"(メチニコフ、1908)を出版しました。 この本では、メチニコフは、高等動物が存在のために奮闘するためにますます複雑な腸を必要とするという概念を発展させ、腸内細菌の2種類の代謝を区別しました。 (1)廃棄物として有害な代謝物をもたらす腐敗、および(2)乳酸のような有益な代謝最終産物をもたらす発酵。 腸内の細胞分解のプロセスと戦うために、彼は食事の改善を推奨し、乳酸菌の発酵代謝が有害な腸内細菌による細胞分解とそれらの組織への毒性効果を相殺するという考えを支持しました。 彼は、伝統的に高いヨーグルト消費を示している集団も寿命の延長を示しているという観察によって、これらの概念を支持しました。 100年以上後、食事療法またはプロバイオティクス介入のいずれかによる腸内細菌叢の調節は、腸内細菌叢の構成を変化させることによって宿主の寿命を延ばすことができるという興味をそそる仮説を支持する動物モデルで証明されています(87)。 人間の間のこの可能性はまだ比較的未踏であり、個々の異質性によって複雑になる可能性がありますが、それは老化プロセスに影響を与えるユニークで潜在的に有望な戦略を提供します。 |
| 炎症と加齢性疾患 |
| 加齢性疾患と老年症候群で共有される基本的なメカニズムの1つは、炎症老化と呼ばれる慢性の軽度の炎症です。 加齢性疾患は、年齢とともに発生率が指数関数的に増加する疾患であり、アテローム性動脈硬化症、糖尿病、高血圧、癌、アルツハイマー病(AD)などの障害が含まれます(89,90)。 炎症性メディエーター(例えば、腫瘍壊死因子-a、インターロイキン(IL-6)の慢性的なアップレギュレーションは、老化プロセス中に誘発されることが示されています。 これらの炎症性メディエーターは、免疫機能に劇的な影響を与える多くのシグナル伝達経路91を活性化し、免疫老化と呼ばれる免疫系の段階的な悪化をもたらします(14,92)。 現在、炎症老化と免疫老化の両方がほとんどの加齢性疾患の原因であると考えられており(細菌感染のリスクの増加だけでなく)、健康的な老化を促進するための新しい介入の肥沃な基盤となっています(93)。 腸内細菌叢の腸内毒素症は、炎症老化を促進するための触媒として機能する可能性があります(図2)。 |
| 腸内細菌叢は、脳、心臓、内分泌、筋骨格、および免疫系の障害に関連しています。 これは炎症老化から加齢性疾患への経路に沿ったセクションの概要です。 |
| しかし、特に加齢性疾患に関連する高齢者の全身性免疫機能またはこの機能の低下への影響に関する腸内細菌叢相互作用の文脈における腸内毒素症の寄与は、厳密には研究されていません。 |
| それにもかかわらず、腸内細菌叢の加齢に伴う腸内毒素症が高齢者の全体的な炎症状態に寄与することを示唆する文献が増えています(94、95)。 たとえば、免疫老化の結果の1つである神経炎症は、アルツハイマー病やパーキンソン病を含むいくつかの神経障害の進行を促進すると長い間考えられてきました(96,97)。 急性および慢性の両方の全身性炎症は、アルツハイマー病.の認知機能の低下に関連しています(98)。 これを概観すると、世界中で4,600万人以上が認知症で生活しており、この数は今後20年間で2倍になると予測されており、米国の人口の3.3%がアルツハイマー病.の影響を受けるという驚くべき予測があります(99、100)。 炎症老化と免疫老化の両方がアルツハイマー病.の患者でよく説明されています(101–104 )。アルツハイマー病の病状に伴う炎症反応は、サイトカインIL-6、腫瘍壊死因子-a、IL-1b、トランスフォーミング成長因子-b、IL-12、およびIL-18.の末梢濃度が高いことによって特徴づけられます(101)。 さらに、アルツハイマー病では、自然免疫系と後天性免疫系の両方が変化していることが示されています(105–107)。 たとえば、アルツハイマーの患者は、ナイーブT細胞のレベルが低下し、メモリーT細胞集団が増加し(108)、活性化CD4+、CD25+、T細胞の割合が高くなります(103)。 AD患者によく見られるT細胞集団のこのような変動は、分化したT細胞の状態が高まっていることを示しています。 これは、持続的な抗原曝露とナイーブ/メモリーT細胞バランスの調節不全を受けている適応免疫システムと一致しています(108)。 |
| この炎症誘発性状態の潜在的な推進力として注目されている1つの領域は、腸内細菌叢です。 異生物性腸内細菌叢は、認知障害につながる神経炎症を引き起こす全身性炎症を誘発することが示されています(109)。 グリア細胞の表現型は、腸内細菌叢の腸内毒素症によるものを含む、末梢の炎症性刺激によって大きく調節されることが知られています(110,111)。 炎症性炎症の量の増加、抗炎症剤の量の減少、腸内の細菌も、認知障害と脳アミロイドーシスの患者の全身性炎症状態に関連していることが示されています(112)。 アルツハイマー病-腸内細菌叢の相互作用に関して、アルツハイマーの病因は、考えられる病因として慢性細菌感染症に関連していると長い間考えられてきました(113)。 より最近の16Sベースの研究では、健康な対照と比較して、患者の特定の分類群の存在量に有意な変化が見られました(114,115)。 また、これらの研究の1つは、腸内細菌叢の組成をアルツハイマー病脳脊髄液のバイオマーカーレベルに関連付けました(114)。 したがって、1つの一般的な理論は、アルツハイマーの病因は腸内細菌叢の不均衡と密接に関連しており、実際には腸に起因する可能性があるというものです。 |
| アルツハイマー病の炎症性原因経路の促進における細菌の役割はますます認識されるようになっていますが(113、116、117)、それはまだ確立されていません。 この目標に取り組むための一歩を踏み出すにあたり、Harach らが実施した研究は、腸内細菌がアルツハイマー患者の脳Aβアミロイドーシスの発症に役割を果たすことを最初に報告したものの1つです(118)。 この研究の重要な発見は、非トランスジェニック野生型マウスと比較して、Aβ前駆体タンパク質トランスジェニックマウスの腸内細菌叢の劇的な変化でした。 さらに、彼らはまた、Aβ前駆体タンパク質トランスジェニックマウスを腸内微生物叢を有する対照マウスと比較して無菌環境で飼育した場合、脳のAβアミロイド病理の大幅な減少を観察しました。 この観察は、無菌Aβ前駆体タンパク質トランスジェニックマウスの従来の方法で飼育されたAβ前駆体タンパク質トランスジェニックマウスからの微生物によるコロニー形成が脳のAβ病理を増加させたのに対し、野生型マウスからの微生物によるコロニー形成ははるかに効果が低かったことを実証することによってさらに裏付けられた。 要約すると、これらの発見は、Aβアミロイド病理の発症における細菌の関与の可能性を明らかにし、より一般的には、腸内細菌叢が神経変性疾患の発症に寄与する可能性があることを示唆している。 |
| 最近、私たちのグループは、アルツハイマー病の高齢者と認知症のない高齢者を比較すると、異生物パターンが見られることを示す老人ホームの高齢者のコホートの調査結果を報告しました( 16 )。このような腸内毒素症は、抗炎症特性を持つヒト結腸の必須代謝物である酪酸を合成する可能性のある細菌の割合と有病率の低下、および炎症誘発性状態を引き起こすことが知られている分類群の獲得を特徴とします。 これらの変化と一致して、「アルツハイマー腸内細菌叢」がP糖タンパク質の調節不全を介して腸上皮の恒常性にどのように悪影響を与える可能性があるかも示しました。 P糖タンパク質は腸の恒常性の重要なメディエーターであり(119)、ダウンレギュレーションされると炎症性状態を引き起こす可能性があります(図3)。 アルツハイマー病の腸内細菌叢を認知症のない高齢者と区別する細菌種も、アルツハイマー患者のP糖タンパク質発現レベルの低下を予測することがわかった。 これらの種は主要な酪酸生産者であり、ユーバクテリウム属、クロストリジウム属、ブチリビブリオ属のメンバー120や、バクテロイデス ドレイやアッケルマンシア グリカニフィラなどの腸内の炎症誘発性状態に関連することが知られている細菌が含まれます(121)。 したがって、アルツハイマー患者で観察されたより低いP糖タンパク質発現を最もよく予測することが見出された細菌メンバーはすべて、他の病的状態の結腸炎症に影響を与えることが知られています。 |
| 図3 MRP2(多剤耐性タンパク質2) / HXA3(ヘポキシリンA3)軸は、通常の共生コロニー形成の状況で好中球反応を抑制し、病原体または異常なシグナルへの応答を活性化する炎症性経路が抗炎症性P-gp(P糖タンパク質)/eCB(エンドカンナビノイド)経路に対してバランスが取れている動的に調節されるシステムの炎症誘発性アームを形成します 2セットの脂質ベースのシグナル伝達分子(eCBおよびHXA3)は、耐性または炎症のいずれかの期間中に頂端表面から放出され、腸管腔への好中球の動員を制御します。 この重要なバランスの調節不全は、腸の炎症性疾患に直接寄与する可能性があります。 |
| 私たちは、脳-腸軸に関係する複雑な相互作用を解き始めたばかりです。 したがって、分類群と、これらの微生物群集がアルツハイマー病(および他の神経変性疾患)の進行に寄与する役割をより深く理解することは、腸内毒素症と認知機能低下との因果関係について病気の予防または停止の知識を深めるのに役立つ必要があります。 |
| 腸内細菌叢は、パーキンソン病のマウスモデルにおける神経炎症の運動障害を調節することもわかっています(122)。 パーキンソン病患者の運動機能障害は、タンパク質α-シヌクレイン(aSyn)の凝集を特徴とすることがよくあります。 Sampson らは(22)、タンパク質α-シヌクレインを過剰発現するマウスモデルを使用して、腸内細菌叢が運動障害、ミクログリアの活性化、およびタンパク質α-シヌクレインの病理に必要であることを示しました。 この同じ研究では、パーキンソン病に冒された患者からの微生物叢によるタンパク質α-シヌクレイン過剰発現マウスのコロニー形成も、健康なヒトドナーから移植された微生物叢と比較して、身体的悪化を増強することが見出されました。 腸内微生物がパーキンソン病の進行に影響を与えるメカニズムはよく理解されていませんが、タンパク質α-シヌクレインが脳に現れる前に腸内分泌細胞に見られるという最近の発見は、パーキンソン病の病状が最初に腸で始まり、次に細胞間プリオンのような増殖に類似した方法で中枢神経系に広がる可能性があるという主張を支持します(123)。 |
| 他の加齢性疾患は、腸の炎症性腸内毒素症に起因する可能性のある同様の炎症老化/免疫老化プロファイルを共有しています。 たとえば、Fransen ら(29)は、老化した腸内細菌叢を若い無菌マウスに移すと、炎症老化を促進する老化した腸内細菌叢内の特定の細菌種を特定しました。 この効果は主に、移植後の老化した腸内細菌叢におけるアッケルマンシアのレベルの低下と、ヒト経口細菌中の咲くチャイバクテリア(TM7細菌)およびプロテオバクテリアのレベルの上昇に関連していました。 腸内細菌叢組成のこのような変化は、主に小腸での腸の炎症、炎症性細菌成分の循環への漏出、および全身コンパートメントでのT細胞活性化の増加と相関していました。 他の例では、関節リウマチ患者の糞便サンプルをマウスに接種すると、ヘルパーT細胞(Th17)依存的に関節炎を起こしやすいマウスの関節リウマチの発症が促進されました124。 同様に、腸内毒素症は、全身性ホメオスタシスの破壊と、それに続く肥満、B細胞低下、2型糖尿病につながる炎症性経路に寄与することが示されています(125)。 リポ多糖およびその他の微生物因子は、老化した筋肉の表現型の特徴でもある炎症性シグナル伝達および骨格筋の変化を促進します126。 最後に、複数の異なる種類の癌の原因と発症におけるヒト腸内細菌祖の新たな、しかし証明されていない貢献的な役割さえあります127。 したがって、局所的に始まり、その後全身的に効果を発揮する、さまざまな形態の異生物誘発性炎症が、健康な人間の老化に重大な負担をもたらす多くの加齢性疾患の開始および/または推進力として役立つ可能性があります。 |
| 腸内細菌叢のフレイル接続は他の加齢性疾患への要ですか? |
| フレイルは、高齢者へのストレスの多い出来事の後、脆弱性が高まり、恒常性の解決が不十分な状態です(128,129)。 フレイルは地域在住の高齢者に非常に蔓延しているが(130)、老人ホームの人口では特に高く、高齢者の50%がフレイルであり、さらに40%がフレイル前の定義を満たしている(131)。 Fried らは、握力の低下、エネルギーの低下、覚醒速度の低下、身体活動の低下、および/または意図しない体重減少など、エネルギーの低下を示す5つの表現型基準のうち3つを満たすものとして、フレイルの最初の操作上の定義の1つを提供しました(28)。 それ以来、臨床的に適用するのがより簡単な他の多くのスコアリングシステムが出現しました(132,133)。 しかし、これらの確立されたパラメータのすべてをもってしても、高齢者をフレイルと定義する際のゴールドスタンダードの欠如が残っています(134–136)。 それにもかかわらず、フレイルを測定するために使用される計測ツールに関係なく、フレイルと定義された高齢者は、病院に入院した(137)または地域社会に住んでいる139,140または老人ホーム(141,142)の設定で、救急科の高齢者の死亡リスクが明らかに増加しています。 |
| 老化と密接に関連しているこの複雑なプロセスは、生理学的システムのコンステレーションの低下を伴い、わずかなストレッサーイベントの後でも脆弱性の増加と健康状態の不均衡な変化につながります(143)。 比較的少数の医学的原因(例えば、投薬、栄養、または運動不足)を除いて、フレイルの原因は十分に理解されていないままです(136,143,144)。 しかし、フレイルの原因に関する新たな理論は、炎症と免疫老化の発達に関係しています。 他の加齢性疾患と同様に、フレイルも免疫機能障害や炎症と関連があり、炎症性サイトカインの産生が複雑に変化します(145,146)。 この理論の中には、腸内細菌叢との関連があります。しかし、腸内毒素症をフレイルに関連付ける研究は比較的調査されていません(147)。 知られていることは、フレイルは、腸内細菌叢の多様性の喪失と、ユーバクテリウム・ドリカムとエガセラ・レンタの存在量の増加、フィーカリバクテリウム・ プラウスニッツィイの減少など、特定の分類学的関連性によって特徴付けられることです。 老人ホームの高齢者では、これは、特に異生物パターンを含む、 酪酸産生生物の喪失と、炎症関連生物の存在量の増加、およびリポ多糖生合成とペプチドグリカン生合成の代謝経路の増加が見られる(41)。地域社会に住む関連する腸内細菌叢(36)の喪失に関連しています。 高齢者の臨床転帰と健康関連の生活の質との重要な関係を考えると、新たな理論とフレイルを治療するメカニズムの欠如と相まって、腸内細菌叢は健康な老化を改善するための重要な鍵を握る可能性があります。 |
| 高齢者の腸内細菌叢を改善するための課題と機会 |
| 腸内細菌叢と高齢者の病気との関連を特定することで、病気を改善または予防するための介入への扉が開かれます。 これらの腸内細菌叢に基づく介入は、若年人口の研究に遅れをとっていますが、高齢化人口の増加と高齢者の病気の負担を考えると、人間の健康を改善する絶好の機会を提供します。 腸内細菌叢ベースの介入は、伝統的にプロバイオティクス、通常は乳酸桿菌とビフィズス菌、または非消化性オリゴ糖を含むプレバイオティクスに焦点を当ててきました(148)。 高齢者を対象とした臨床試験では、腸内細菌叢を操作する能力だけでなく、その際のこの集団の安全性も実証されています(149)。 ただし、この点での臨床効果はまだ十分に実証されていません。 |
| 腸内細菌叢の操作に焦点を当てた臨床試験作業を進めることは、幅広い疾患プロセスに対処する可能性のある新しい機会を利用するでしょう。 乳酸桿菌は、歴史的に、研究された最も慢性的なプロバイオティクスの1つです。 1987年に正常な健康な人の糞便から最初に分離されて以来、ラクトバチルスはさまざまな臨床適応症に使用されてきました。 健康な人では、それは一時的に遠位消化管にコロニーを形成し、常在する腸内細菌叢にプラスの影響を及ぼします(150,151)。 さらに、ラクトバチルス菌は、抗生物質の使用による下痢(152,153)から旅行者の下痢154および自己免疫性の原因による下痢に対処する臨床試験で使用されています(155)。 胃腸障害以外では、ラクトバチルスは尿路感染症の予防に使用されており(156)、関節リウマチの治療に使用されており(157)、ワクチン投与の免疫調節剤として使用されており(158)、集中治療室の患者の予防治療として使用されています(159)。 乳酸桿菌以外にも、他のプロバイオティクス細菌との組み合わせが、加齢に関連する多くの人間の病気を治療する治療法としてテストされています。 明らかに、プロバイオティクスには、高齢者集団でしっかりとテストする必要がある複数の病気のプロセスを治療するための実績と可能性があります。 |
| しかし、ほとんどのプロバイオティクスは食品として製造されているため、これらの製品の品質と安全性を新しい治療薬として確保することは困難です。 これらの薬剤の投与量、安全性、および作用機序の基本的な問題は、どの細菌株がさまざまな病状の下で利益をもたらすかがまだ不明であるため、まだ解決する必要があります。 市場への多系統プロバイオティクスの出現とデザイナープロバイオティクスのための操作された細菌の前提により、食品とプロバイオティクスが腸内細菌叢に対する正確な機械的作用にどのように影響するかについての理解を進めることはさらに重要であり、健康と病気における高齢者の腸内細菌叢についてのより良い理解も必要です。 |
| 高齢者の間では、食事療法は、アルツハイマー病などの最も破壊的な加齢性疾患のいくつかに対処する上で有望であることが示されています。 大規模な疫学研究では、健康的な食事が認知症や認知機能低下を予防することが示されています。これは、アルツハイマー病のマインドダイエット(神経変性遅延ダイエット)などの食事療法で証明されています(160)。 フィンランドのFINGER(老年医学的介入研究9試験などの大規模な介入が進行中であり、アルツハイマー病の予防に有望な結果を示しています(161)。 これらの食事介入の正確なメカニズムはよく知られていませんが、食事療法中に発生する腸内細菌叢の変化が、アルツハイマー病の改善された結果の背後にある原動力である可能性があるという証拠が増えています(95,162)。 この点で、食事療法が腸内細菌叢をどのように変化させるか、そしてこれらの変化がアルツハイマー病の症状を改善する主な要因であるかどうかをよりよく理解することが重要です。 食事療法の介入中に、腸内細菌叢が因果経路のメディエーターまたは主要な薬剤として機能するかどうかはまだ不明です。しかし、この謎を解明することは、腸-脳軸を介した認知機能低下の病態生理学と治療を理解するのに大いに役立ちます。 |
| 腸内細菌叢研究の未来は刺激的な可能性に満ちています。 腸内細菌叢を健康な人間の発達に結びつけ、腸内細菌叢の腸内毒素症がどのように病気につながるかを示す証拠は豊富にあります。 現在、病気の進行を促進するのは個々の細菌集団の豊富さではない可能性があることがますます認識されています。 しかし、集合的な細菌叢(すなわち、機能的な遺伝子と経路の細菌コンソーシアム)とその代謝物は「機能的なコア細菌叢」と呼ばれ、病状に対する感受性の増加を理解するための鍵を握る可能性があります。 臨床的には、病気の予防や治療において「機能的なコア細菌叢」をどのように変えることができるかは、それが実行されるまでにはまだ長い道のりがあります。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
| この文献は、Gastroenterology 2021;160:507–523に掲載されたAging, Frailty, and the Microbiome —How Dysbiosis Influences Human Aging and Disease を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |