
Maira Jimenez-Sanchez et al., |
要約 |
| 本レビューでは、恒常性および病態の両方において皮膚と消化管の間で生じる双方向シグナル伝達を記述する、新たに登場した用語「腸-皮膚軸(GSA)」について考察する。腸-皮膚軸間のコミュニケーションの中心となるのは、腸内細菌叢と皮膚細菌叢、すなわちこれらのバリア表面に定着する微生物群である。バランスの取れた微生物叢は、自然免疫、ビタミンD受容体、アリール炭化水素受容体シグナル伝達など、多様な宿主経路に影響を及ぼすことで、組織の恒常性と宿主防御の両方に貢献する。一方、ある部位における微生物叢の不均衡、すなわちディスバイオシス(dysbiosis)は、局所的なバリア機能不全につながり、他の部位における組織恒常性を阻害するシグナル伝達経路の活性化を引き起こし、アトピー性皮膚炎や乾癬などの炎症性皮膚疾患、あるいは炎症性腸疾患などの腸疾患につながる可能性がある。これまで、腸-皮膚軸に関する研究のほとんどは、腸内細菌叢と食事が皮膚の健康に及ぼす影響について検討してきましたが、最近の研究では、皮膚を紫外線B波に曝露することで、腸内細菌叢と腸の健康の両方に有益な調節効果をもたらすことが示されています。このように、臨床医や研究者はこれまでこれらの器官系を別々に研究してきましたが、腸-皮膚軸は皮膚疾患と消化器疾患の病因をより深く理解し、両器官の健康を促進するための新たな機会を提供します。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.腸と皮膚のバリア機能 |
| 3.腸管と皮膚における自然免疫と獲得免疫 |
| 4.腸内細菌叢と皮膚の健康 |
| 5.腸内細菌叢と皮膚疾患 |
| 6.腸-皮膚軸におけるコミュニケーション経路 |
| 6.1.腸管と皮膚のコミュニケーション |
| 6.2.皮膚と腸管とのコミュニケーション |
| 6.3.ビタミンDシグナル伝達 |
| 6.4.トリプトファン代謝物と芳香族炭化水素受容体シグナル伝達 |
| 6.5.皮膚損傷 |
| 7.紫外線放射 – 局所的および全身的影響 |
| 7.1皮膚治療としての紫外線照射 |
| 7.2.紫外線は全身に影響を及ぼす |
| 8.腸内細菌叢と皮膚細菌叢のコミュニケーション:紫外線による調節 |
| 9. 腸-皮膚軸関連疾患に対する紫外線療法の可能性 |
| 10.結論 |
| 本文 |
| 1.はじめに |
| 人体は、主に皮膚と消化管という二つのインターフェースを通して、外部環境と常に接触しながら発達し成長します。 これらの部位は、様々な環境シグナルを受け取り、それが深部組織に伝達され、通常は有益な反応や恒常性維持反応を引き起こします。 残念ながら、これらの部位は生物的および非生物的脅威の両方に対して脆弱な標的部位でもあります。皮膚は外胚葉から、腸は内胚葉と中胚葉の複雑な相互作用から形成されるなど、胚発生の起源は異なりますが、これらの器官は多くの基本的な構造的・機能的類似点を共有しています1,2。 どちらも上皮細胞で覆われており、上皮細胞は保護バリアとして機能し、その下にある間質細胞と免疫細胞からのシグナルによって支えられ、強化されています3。 さらに、どちらも血管と神経が広範囲に分布しているため、免疫系や中枢神経系との迅速なコミュニケーションが可能になり、環境からの脅威への迅速な対応を促進しています4。 注目すべきことに、どちらの表面にも、マイクロバイオームと呼ばれる多様な常在微生物群が生息しています。 |
| 多くの研究において、消化管や肺といった異なる粘膜関連リンパ組織(MALT)5 間での免疫細胞の輸送とコミュニケーションが顕著であることが実証されており、粘膜免疫と防御を広範に促進する手段となる可能性があります。近年では、一見無関係の器官系である皮膚と腸の間でも、重要なシグナル伝達/細胞間クロストークが存在することが明らかにされる研究が増えています6。腸-皮膚軸(GSA)と呼ばれる、これら2つの器官を結ぶコミュニケーション経路は、多様なサイトカイン7–10、微生物代謝物11,12、ホルモン13,14、神経伝達物質15,16 によって媒介されています。これらの分子は、組織の恒常性を維持し、様々な刺激に対する全身反応を調整する上で重要な役割を果たしていることが明らかになっています。これらの分子の中でも、ビタミンDなどのホルモンや、アリール炭化水素受容体(AhR)リガンドを含む主要な微生物代謝物は、免疫応答や代謝プロセスの調節に関与し、全身の健康状態に影響を及ぼすことが知られています。さらに、皮膚への紫外線B波(UVB)などの環境因子の影響は、直接影響を受ける組織を超えて、腸管を含む遠隔臓器の機能にも影響を与えます17。 |
| 本レビューでは、皮膚と腸管の双方向コミュニケーションの概念を裏付ける最近の知見、そして微生物代謝物、シグナル伝達分子、環境因子などを含む様々な分子が果たす役割を概説する。これらの経路を解明することで、多様な環境シグナルが組織の恒常性維持を促進する仕組みについての理解を深めるとともに、UVB光が腸-皮膚軸を介してヒト消化管に新たな治療アプローチを提供する可能性を示唆する。 |
| 2.腸と皮膚のバリア機能 |
| 皮膚は、皮下組織(最深層)、真皮、表皮の3層で構成されています18。表皮は、その付属構造(毛包、皮脂腺、汗腺など)とともに、外部環境と最初に接触するバリアであり、細菌、真菌、ウイルス、寄生虫など、皮膚に生息する様々な微生物が定着し、常に刺激を受けています6。同様に、腸は上皮バリアによって保護されており、病原性細菌、ウイルス、食物抗原などの潜在的に有害な因子を腸管腔内に隔離することで宿主を保護しています19。このバリアを構成する細胞のうち、杯細胞(腸管上皮細胞(IEC)のサブセット)は、上皮を覆い支える保護的な生理化学的ゲルを形成する粘液を合成します。一方、他の分泌型腸管上皮細胞は、免疫反応を制御し、抗菌作用を発揮し、免疫系を活性化させる分子を放出します。腸管上皮バリアは、ゾヌラオクルデン、クローディン、オクルディンなどのタイトジャンクションタンパク質によって維持されており、これらは細胞間空間を密閉し、腸管透過性を調節する上で重要な役割を果たしています21。これらのタンパク質が分解されると、腸管透過性が増加し、「リーキーガット」としても知られる状態になり、細菌や食事成分などの管腔因子が腸粘膜や全身循環に入り込み、炎症を引き起こします21。 |
| 3.腸管と皮膚における自然免疫と獲得免疫 |
| 皮膚と腸管は、環境からの脅威に頻繁にさらされるため、防御免疫反応と抗菌反応を引き起こすことができる多様な細胞を保有しています。特に皮膚の真皮には、樹状細胞、マクロファージ、γδ Tリンパ球、自然リンパ球(ILC)など、複数の自然免疫細胞が存在します22。体内最大の免疫器官である消化管には、同様の自然免疫細胞が高密度に存在します23。さらに、腸管上皮細胞は、Toll様受容体(TLR)やヌクレオチド結合オリゴマー化ドメイン(NOD)様受容体などのパターン認識受容体を発現し、自然腸管防御の重要な構成要素として機能しています。これにより、脅威に迅速に対応することが可能となります。例えば、「センチネル杯細胞」と呼ばれる分泌型腸管上皮細胞のサブセットは、TLRを介して病原性刺激を認識し、インフラマソーム依存的に粘液を急速に放出することで反応することが最近示されました24。さらに、腸管上皮細胞は抗菌ペプチド(AMP)の産生を通じて病原体のコロニー形成を積極的に防ぎますが、感染した腸管上皮細胞はインフラマソーム誘導性のピロプトーシスを起こし、侵入した病原体を腸管腔内に排出することができます25。同様に、皮膚のケラチノサイトはさまざまなTLRを発現し、細菌感染を感知して抗菌作用を発揮する抗菌ペプチドや免疫細胞の動員を促進するケモカインを産生することができます26,27。 |
| 皮膚と腸には、周囲から抗原を採取し、免疫反応を制御する樹状細胞の特殊なサブセットが存在します。同様に、これらの組織には、制御性T細胞(Treg)、エフェクターT細胞、メモリーT細胞など、多様なT細胞サブセットが存在し、免疫調節、監視、そして病原体に対する免疫反応の発現に極めて重要な役割を果たしています28。さらに、免疫監視、炎症、そして組織バランスに不可欠な組織マクロファージは、両臓器に豊富に存在し、宿主防御とアレルギー反応における役割で最もよく知られているマスト細胞も存在します29,30。 |
| 4.腸内細菌叢と皮膚の健康 |
| ヒトの腸内と皮膚には、多様な微生物が生息しており、総称してマイクロバイオータと呼ばれています。皮膚には1cm2あたり104~106個の微生物細胞が存在し31、腸内の微生物密度は糞便1gあたり10の11乗に達することもあります32。健康な状態では、宿主とマイクロバイオータは共生関係にあり、宿主の皮膚と腸は微生物に生息場所と栄養源を提供します。腸内細菌叢と皮膚のマイクロバイオータの具体的な構成とそれぞれの機能については、以下で概説します。 |
| 人間の皮膚には、出生時に細菌、古細菌、ウイルス、真菌などのさまざまな微生物が定着しており、出産方法が乳児の初期の皮膚微生物叢プロファイルに大きな影響を与えています33~35。膣から生まれた新生児は、主にラクトバチルス属の細菌を特徴とする、母親の膣細菌に非常によく似た皮膚微生物叢の特徴を持っています。対照的に、帝王切開で生まれた乳児は、皮膚微生物の多様性が低い傾向があり36~38、主に環境微生物と母親の皮膚由来の微生物(ブドウ球菌、コリネバクテリウム、プロピオニバクテリウム属など)が定着しています36。 この常在細菌による初期の定着は、免疫寛容の確立に重要な役割を果たしているようです34。皮膚細菌の存在は、Treg細胞にFOXP3転写因子の発現を引き起こし、免疫調節機能の発達に重要なステップとなるからです39。 生後4~6週間以内に、乳児の皮膚マイクロバイオームの多様性は増加し、母親の皮膚マイクロバイオームとより密接に整合します38。これらの微生物が乳児の皮膚を外部からの脅威から守る能力は、特に、子どもの免疫系が未発達で皮膚バリアが脆弱なため重要です。表皮ブドウ球菌(Staphylococcus epidermidis)やコーニイブドウ球菌(Staphylococcus cohnii)などの特定の細菌は、乳児をアトピー性皮膚炎(AD)や湿疹(乾燥して鱗屑状の皮膚を特徴とする炎症性疾患)などの皮膚疾患から守ることが知られています40。 表皮ブドウ球菌は一般的に有益な常在菌と考えられていますが、その保護効果は菌株特異的であるように思われます。最近の研究では、表皮ブドウ球菌の特定の菌株がサイトカインIL-1βなどの炎症誘発性メディエーターの発現を誘導することが示されており41、これは、成人42,43と乳児44,45の両方において、表皮ブドウ球菌の多量存在とアトピー性皮膚炎の最重症例との間に観察される相関関係を説明できます。 |
| 乳児の発達過程を通じて、常在細菌は様々なサイトカインや抗菌ペプチドの産生に影響を与え続け、病原体に対する皮膚の防御力を強化します。例えば、表皮ブドウ球菌(S. epidermidis)のような細菌は、インターロイキン(IL)-17産生CD8+ T細胞を介してケラチノサイトからのカルプロテクチンS100A8/9の産生を刺激し、炎症性サイトカインである腫瘍壊死因子(TNF)-αおよびIL-6の産生を阻害することで不適切な免疫活性化を抑制するリポテイコ酸を産生します46,47。思春期には、皮膚マイクロバイオームに大きな変化が起こり、フィルミクテス門、バクテロイデス門、プロテオバクテリア(β-およびγ-)は、より脂溶性の放線菌に取って代わられます。この変化は、皮膚微生物叢の不均衡(ディスバイオシス)を引き起こし、尋常性ざ瘡などの皮膚疾患の一因となる可能性があります48。民族性や地理的差異も皮膚の特性に影響を与え、集団間で異なる皮膚微生物叢の構成をもたらすことが報告されています49,50。皮膚細菌プロファイルの最も顕著な差異は、湿度、温度、pH、脂質および皮脂含有量、抗菌ペプチド発現などの異なる生理学的特性に反映されるように、体の部位に関連しています33,51–54。興味深いことに、前腕、手のひら、人差し指、膝の裏、足の裏など、いくつかの皮膚部位には、腸内微生物叢と比較して、より系統的多様性の高い微生物叢が生息しています54。衛生習慣、着用する衣服の種類、食事、薬、日光への曝露などの環境条件も、時間の経過とともに皮膚細菌群集を変化させ、微生物叢の構成の進化につながります54,55。 |
| 人間の腸内には出生直後から微生物が定着し、乳児の出産方法やその後の食事(母乳か粉ミルクかなど)の影響を受けます。消化管、特に結腸には、人体で最も多くの細菌が生息しています。腸内細菌叢を構成する1,000~1,500種の細菌種は500万種以上の異なる遺伝子を有し、バクテロイデス属、フィルミクテス属、放線菌属、プロテオバクテリア属、フソバクテリア属、シアノバクテリア属、およびヴェルコミクロビア属に属しています56。腸内細菌叢は、食物の消化を助ける、免疫系の発達と病原体に対する防御を促進する、ビタミンの生合成、脂肪の蓄積と血管新生を促進するなど、多様な機能を発揮する一方で、短鎖脂肪酸(SCFA)の酢酸、プロピオン酸、酪酸などの重要な代謝産物も生成します57。驚くべきことに、腸内細菌叢は気分や行動にも影響を与え、動物モデルにおいていくつかの神経精神疾患や異常行動の病因と関連付けられています58,59。 |
| 腸内微生物群は、最初の定着後、宿主が老化し成長するにつれて、徐々に多様な生態系へと発達していきます。微生物と宿主の免疫系は協力関係を通じて共に成熟します。宿主は食物を提供し、常在細菌叢は腸内病原体やその他の有害な刺激から宿主を保護します60,61。皮膚と同様に、バクテロイデス・フラギリスや特定のクロストリジウム属などの腸内細菌は、Foxp3+ Treg細胞の局所集団の増加を引き起こし、それによって常在細菌に対する免疫寛容に寄与します62。さらに、腸粘膜固有層のマクロファージは病原体の貪食に特化しており、他の組織部位のマクロファージと比較して、炎症誘発反応が顕著ではありません63。この適応は、宿主が不必要なまたは過剰な炎症反応を引き起こすリスクを最小限に抑えることで、多数の常在細菌叢の存在に適応していることを示唆しています64。 |
| 5.腸内細菌叢と皮膚疾患 |
| 前述のように、微生物叢の乱れは、細菌叢のバランスが崩れた状態を指し、多くの場合、細菌の多様性と安定性の低下を特徴とします。腸内細菌叢の乱れは、アトピー性喘息、精神疾患(うつ病、統合失調症、依存症)、肥満、2型糖尿病、心血管疾患、関節リウマチや多発性硬化症(MS)などの自己免疫疾患など、様々な疾患の発症と進行に関与していることが示唆されています65–67。さらに、炎症性腸疾患(IBD)や過敏性腸症候群(IBS)などの消化器疾患は、健常者と比較して腸内細菌叢のプロファイルが変化していることと関連しており、微生物叢の乱れは腸内生理、栄養吸収、そして宿主の免疫系に影響を及ぼす可能性があります。 |
| 多くの場合、炎症は腸で発生したか皮膚で発生したかに関係なく、腸内細菌叢のディスバイオシスによって最初に引き起こされ、腸-皮膚軸が皮膚に悪影響を及ぼす出発点となるのではないかと私たちは考えています68。特に、腸内細菌叢のディスバイオシスは、微生物の代謝能力(栄養代謝、脂質代謝、ビタミンBおよびKの合成、解毒、ホルモン代謝など)の変化と関連して全身性炎症を引き起こすことが多く、皮膚を含む他の臓器系に影響を及ぼし、皮膚の恒常性を乱す可能性があります69–74。さらに、腸内細菌叢のディスバイオシスは、T細胞の活性化、免疫抑制性サイトカインおよびTreg細胞の産生低下と関連しており、これらは共に微生物叢に対する宿主の寛容性を維持するために不可欠です69。 皮膚の微生物叢のディスバイオシスが消化管などの末端部位で同様の有害な影響を引き起こすかどうかは、あまり注目されていませんが、将来の研究の優先事項となる。 |
| 微生物のディスバイオシスから疾患の促進への移行は複雑で、複数の相互に関連したメカニズムが関与しています。腸内細菌叢の乱れは腸管バリアを損ない、透過性(「リーキーガット」)を高め、全身性炎症を誘発する可能性があります75。この不均衡は免疫調節異常も促進し、炎症誘発性経路(Th1、Th17)の過剰活性化を引き起こし、免疫寛容の低下を引き起こします76。さらに、短鎖脂肪酸の減少や有害な副産物の増加など、微生物代謝物のレベルの変化は、炎症や組織損傷を悪化させる可能性があります77–79。遺伝的素因と、食事、ストレス、抗生物質の使用などの環境要因は、疾患の進行にさらに寄与する可能性があります80,81。微生物バランスを回復し、その後の症状や病理を緩和するための標的治療法を開発するための前提条件として、これらの関係を理解するためのさらなる研究が必要であることに留意する必要があります。 |
| 腸内細菌叢の異常は、腸の完全性と機能、さらには腸と皮膚の軸を維持するために重要な腸幹細胞(ISC)にも大きな影響を及ぼす可能性があります。健康な微生物叢は腸幹細胞の増殖と分化をサポートしますが、ディスバイオシスはこれらの機能を阻害し、腸管バリアの完全性を損ない、透過性を高めます82。この混乱により、微生物の転座とそれに続く全身性炎症が促進され、皮膚疾患が悪化する可能性があります83。微生物とその代謝産物は、直接的および/または間接的に腸幹細胞と相互作用し、幹細胞ニッチに影響を及ぼし、上皮機能、再生、修復を調整します84。ディスバイオシスと皮膚炎症の関連性は、慢性皮膚疾患患者の血流中の腸内細菌 DNA の増加が認められるという調査結果によって強調されています85。すでに述べたように、ディスバイオシスは 短鎖脂肪酸の産生を減少させます。短鎖脂肪酸は通常、腸幹細胞の機能、上皮バリアの完全性のサポート、および炎症の緩和に重要な役割を果たします11,68。これらの経路に関与する主要な微生物群には、フソバクテリア、プロテオバクテリア、フィルミクテス綱、ラクノスピラ科、コリバクテリア、ヘリコバクター・ピロリ、コレラ菌などが挙げられます。セラチア・マルセセンス、エルウィニア・カロトヴォラ・カロトヴォラ-15、シュードモナス・エントモフィラといった特定の細菌は、これらのメカニズムを通じて腸管恒常性維持、損傷修復、そして腸管壁機能維持に寄与することが知られています82。 |
| 消化管と皮膚疾患の関連性は、図1に示すように、過去の研究4によって十分に裏付けられています。特に、炎症性腸疾患(IBD)やセリアック病などの消化管疾患の患者の10%~25%は、乾癬(鱗状のプラークと肥厚性皮膚病変を特徴とする)や皮膚潰瘍などの皮膚病変も経験します4,86。腸管吸収不良を特徴とするセリアック病は、皮膚症状として皮膚炎や乾癬を併発することがよくあります。一方、酒さ(皮膚の発赤や発疹を引き起こす慢性の炎症性皮膚疾患)の患者は、小腸細菌過剰増殖症(SIBO)を頻繁に発症します87。消化管ポリープと悪性腫瘍を特徴とするポイツ・イェガース症候群は、一般的な皮膚症状として口囲の色素沈着を特徴とすることがよくあります86。さらに、炎症性腸疾患(IBD)患者は、皮膚潰瘍、血管炎、脱毛、紅斑毛包炎、乾癬などがあり4,86、これらの症状のいくつかは患者の消化管炎症の重症度と関連している88。特に注目すべきは、皮膚微生物叢によく存在する常在菌であるマラセチア・レストリクタの腸内コロニー形成が、一部の患者においてクローン病(炎症性腸疾患の一種)の発症に寄与している可能性があり、その存在は疾患の重症度の増加と相関している89。これらの知見は、皮膚微生物叢のメンバーが炎症性腸疾患の発症に関与していることを示唆しているが、その根底にあるメカニズムはまだ完全には解明されていない。しかし、免疫系と内分泌系の両方がこの相互作用に重要な役割を果たしていると示唆する研究もある69。 |
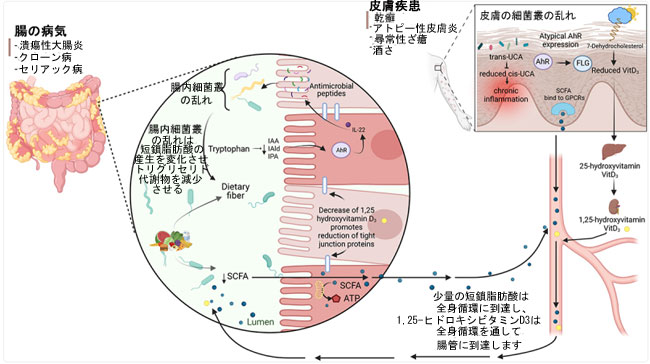 |
| 図1 消化管疾患と皮膚疾患の関連性。高緯度地域では、特に冬季における日照量の減少により、UVB光への曝露量が減少し、結果として血清ビタミンD濃度が低下します。この低下は、上皮タイトジャンクションタンパク質の減少など、消化管の変化につながります。炎症性腸疾患(IBD)患者の多くはビタミンDが不足または欠乏しており、潰瘍性大腸炎(UC)よりもクロストリジオイデス・ディフィシル大腸炎(CD)でその割合が高くなっています。UVB曝露量の減少は、慢性皮膚炎との関連が指摘されているトランスウロカニン酸(UCA)からシスウロカニン酸(UCA)への変換低下にもつながります。炎症性腸疾患患者では、腸内細菌叢の乱れが、腸と皮膚の健康に影響を与える重要な細菌代謝物である短鎖脂肪酸濃度の低下につながります。乾癬、ニキビ、アトピー性皮膚炎、白斑などの皮膚疾患は、アリール炭化水素受容体(AhR)の発現/活性化の低下と関連することがよくあります。インドール誘導体を含むいくつかのアリール炭化水素受容体(AhR)リガンドは、炎症や酸化ストレスを調節することで皮膚の健康に影響を与える可能性があります。 炎症性腸疾患患者は、便中の内因性アリール炭化水素受容体(AhR)リガンドの産生が低下していることが示されています。これはおそらく微生物叢の異常によるもので、粘膜治癒の障害に寄与していると考えられます。 |
| 広範な前臨床研究により、腸内細菌叢の調整は、特にプロバイオティクスとして知られる有益な微生物の投与を通じて、皮膚系にプラスの影響を与えることが示されています。 Levkovichら90は、プロバイオティクスであるラクトバチルス・ロイテリATCC 6475を高齢マウスに経口補給したところ、プロバイオティクスを投与されなかった高齢マウスと比較して、真皮の厚みの増加、毛包形成の促進、皮膚pHの酸性化、皮脂産生の増加など、皮膚の健康状態が改善されることを発見しました。プロバイオティクスを摂取したマウスでは、抗炎症性サイトカインIL-10の血清値が上昇し、炎症誘発性サイトカインIL-17の血清値が低下ことから、これらの効果は免疫介在性であると考えられます。マウスに経口投与された別のプロバイオティクス株(ラクトバチルス・アシドフィルスKBL409)は、アトピー性皮膚炎の症状を軽減し、皮膚組織への免疫細胞の浸潤を減少させることが示されました91。マウスにおいて、プロバイオティクスはIL-10レベルとFoxp3発現を上昇させるだけでなく、腸内細菌叢による短鎖脂肪酸やアミノ酸などの代謝産物の産生を調節することも示されています。これらの研究で認められた皮膚炎スコアの低下は、プロバイオティクス菌が免疫系と腸内細菌叢の両方を協調的に調節することにより、腸内環境を超えてプラスの効果を発揮できることを示しています。例えば、メンデルランダム化(MR)研究では、腸内細菌叢と湿疹、ニキビ、乾癬、酒さなどの皮膚疾患との因果関係が明らかになっています92。例えば、ユーバクテリウム・フィシカテナ(Eubacterium fissicatena)は乾癬のリスクと関連しており93、腸内細菌は皮膚線維症に影響を及ぼす可能性があります94。これらの知見は、腸内細菌叢の調節による治療の可能性を浮き彫りにしています。 |
| ヒトを対象とした研究でも、腸内環境と皮膚疾患の重複に免疫系と腸内細菌叢が重要な要因として挙げられています。例えば、最近の研究では、腸内細菌叢の乱れとアトピー性皮膚炎との関連性が明らかになっています。著者らは、インターロイキン4およびインターロイキン13を阻害するモノクローナル抗体であるデュピルマブという薬剤に対する皮膚症状の臨床的改善は、トリプトファン代謝のインドール経路を調節することにより、デュピルマブが腸内細菌機能に及ぼす影響によるものであることを明らかにした95。この効果は、デュピルマブによるTh2免疫応答の抑制と関連している可能性が高く、皮膚と腸内を含む全身に見られる多面的な抗炎症作用につながる96,97。さらに、複数の臨床試験で、経口プロバイオティクスの投与がアトピー性皮膚炎98、乾癬99、尋常性ざ瘡100などの皮膚疾患に有益な効果をもたらすことが示されている。経口プロバイオティクスの潜在的な効果は、皮膚疾患である酒さにも応用されており、標準的な抗生物質治療に加えてビフィドバクテリウム属の混合菌を摂取した患者において、より高い寛解率が観察されている101。 |
| 腸内細菌叢の構成とその代謝産物の影響は、アレルギー性皮膚疾患においても研究されています。トロンペットらの研究では、食物繊維またはその副産物である短鎖脂肪酸、特に酪酸の投与により、ヒトのアトピー性皮膚炎を模倣したマウスモデルにおいて、アレルゲン誘発性皮膚バリアの破綻が軽減されることが示されました102。この保護効果は、表皮ケラチノサイトの分化促進と関連しており、タンパク質や脂質などの重要な皮膚構成成分の産生増加につながりました。さらに、酪酸はケラチノサイトの代謝を直接的に制御し、ミトコンドリア依存性の分化プログラムを誘導することで、皮膚バリア機能を強化しました。これらの結果は、酪酸が皮膚の免疫反応を調節する可能性があること103,104、そしてアトピー性皮膚炎と診断された小児および乳児105,106、そして小児期後期にアレルギー反応を発症した小児においても酪酸が減少していることという、これまでの知見を裏付けています107。 |
| 6.腸-皮膚軸におけるコミュニケーション経路 |
| 腸と皮膚の関係は、腸内細菌叢がこれら2つのシステム間のコミュニケーションを促進する上で重要な役割を果たしていることによって明確に示されています。腸-皮膚軸の基盤となるコミュニケーション経路をさらに明確にすることは、腸-皮膚軸が疾患発症に果たす役割と、その潜在的な治療応用の両方を理解する鍵となります。マイクロバイオームに加え、様々な代謝物や微量栄養素が腸-皮膚軸間の対話において不可欠な要素として機能しており、その具体的な内容は以下に記載されています。 |
| 6.1.腸管と皮膚のコミュニケーション |
| 腸-皮膚軸に関する最も一般的な仮説は、コミュニケーションは主に一方向のみで行われる、つまり腸が皮膚とコミュニケーションを取り、それによって皮膚に影響を与えるというものです。この仮説は、腸内細菌叢が、全身に影響を及ぼし、ひいては皮膚の健康にも影響を与える可能性のある様々な代謝機能と免疫機能において重要な役割を果たしていることに由来しています。腸内細菌叢は、難消化性の複合多糖類をビタミンKや水溶性ビタミンB群などの必須栄養素に代謝します。ビタミンKは創傷治癒に、水溶性ビタミンB群はDNA複製、修復、メチル化などの代謝機能にそれぞれ関連しています108,109。さらに、腸内細菌叢は短鎖脂肪酸などの独自の(つまり細菌性の)代謝産物を産生します。短鎖脂肪酸は皮膚の炎症を緩和する可能性があるため、腸-皮膚軸における重要なシグナル伝達因子であると説明されています11。 |
| 食事は腸内細菌叢の構成と機能に影響を及ぼす主要な要因として認識されており、食生活パターンと 腸-皮膚軸における特定の栄養素の重要性が強調されています。飽和脂肪酸や精製炭水化物を多く含む西洋型の食生活は、微生物の多様性の低下や、リポ多糖類などの細菌細胞壁成分の内腔内濃度の上昇と関連していることが多く、これが腸のバリア機能に悪影響を及ぼし、全身性炎症を引き起こす可能性があります110。さらに、動物性タンパク質を過剰に含む食生活は、インドキシル硫酸、トリメチルアミン-N-オキシド(TMAO)、パラクレシル硫酸などの代謝物の生成を促進します。これらの代謝物は、乾癬性関節炎(関節や結合組織に影響を与える慢性炎症性疾患で、乾癬患者によく見られます)と関連しています111,112。一方、コラーゲンを多く含む食生活は、皮膚の老化や創傷治癒に有益であることが示されており、タンパク質源によって皮膚への影響が大きく異なる可能性があることが強調されています113,114。さらに、脂肪分の多い魚やオリーブオイルを多く含む食生活は、コラーゲン含有量が高いため、皮膚の炎症を軽減する効果があることが示されています。それぞれオメガ3脂肪酸と一価不飽和脂肪酸です115–119。主要栄養素に加えて、食物繊維の摂取は健康全般に有益であると広く考えられています。イヌリンや難消化性デンプンなどの食物繊維は人体では消化されず、腸内細菌叢によって発酵されます。その過程で、腸内細菌叢の有益な細菌数が増加し、その代謝産物(短鎖脂肪酸など)は皮膚の健康を促進します120。 |
| 食事は腸内細菌叢の調整を通じて皮膚の健康に間接的な影響を与えるだけでなく、摂取する様々な栄養素が皮膚の構造と機能を直接的にサポートします。多くの研究はサプリメントとしての食物化合物に焦点を当てていますが、皮膚疾患に対する的を絞った食事療法の推奨事項を探求する上で、ホールフードが腸-皮膚軸の特定の側面に及ぼす影響に注目することが重要です。植物性食品や健康的な脂肪分を豊富に含む地中海式ダイエットは、皮膚疾患を含むいくつかの慢性炎症性疾患の発生率が低いことが示されています121。野菜、果物、豆類、ナッツなどの植物性食品は、カロテノイド、ビタミン、ポリフェノールなどの生理活性化合物の豊富な供給源と考えられており、これらは皮膚の健康維持に重要な役割を果たします122,123。 |
| 多くの果物や野菜に豊富に含まれるビタミンCは、コラーゲンの合成に重要な役割を果たし、強力な抗酸化物質として作用し、活性酸素種(ROS)によるダメージから肌を守ります124。さらに、ビタミンCは、アボカドなどの果物に含まれる強力な抗酸化物質であるビタミンEと相乗効果を発揮し、肌の老化を抑制し、水分量を高める効果があります。ビタミンCを豊富に含む特定の食品の効果についても研究されており、特にアタウルフォ種のマンゴーは、閉経後女性の16週間の介入後、適度に摂取した場合、顔の深いシワを軽減することが報告されています125。しかし、食事に関する推奨事項では、1食分の量が重要です。250gのマンゴーを摂取した人はシワが増えたという結果が出ています。この結果は、果物に含まれる糖分に起因する可能性があります。ブドウ糖と果糖は、コラーゲンとエラスチン繊維の糖化を促進し、皮膚を支える皮下組織の構造的完全性を損なう可能性があるためです126。 |
| ポリフェノールも肌の健康に重要な役割を果たすようで、ある研究では、光老化した女性にココアフラバノールを補給したところ、わずか24週間で顔のしわが減り、肌の弾力性が向上したことが示されています127。さらに、アントシアニン、フラバノール、レスベラトロールなどのポリフェノールが豊富なブドウ種子エキスを補給すると128–130、黒ずみを伴う一般的な皮膚疾患である肝斑にも効果があることが示されています131。カロテノイドが豊富なトマトなどの食品は、リコピンも豊富で、強力な抗酸化作用を示し、紫外線による皮膚の紅斑を予防します132,133。また、カロテノイドが豊富なケールエキスを毎日摂取すると、コラーゲンとエラスチンのレベルが向上し、肌の健康が促進されることがわかっています134。 |
| アーモンドなどのナッツ類の摂取は、抗酸化防御作用やシワの軽減に寄与することで、肌の健康に良いとされています135。さらに、大豆などの豆類には、エストロゲン様作用を示す生理活性化合物であるイソフラボンが含まれています。その結果、これらの摂取は更年期に見られるエストロゲンレベルの低下を緩和し、典型的な肌のシワ、乾燥、傷の治りの悪さを改善する可能性があります136。このように、栄養価の高いホールフードを豊富に含む多様な食事は、腸内細菌叢の構成に良い影響を与えるだけでなく、肌の健康を促進し、老化の兆候を遅らせるために必要な必須栄養素と抗酸化物質を直接的に供給します。 |
| 6.2.皮膚と腸管とのコミュニケーション |
| 食事成分と腸内細菌叢が皮膚の健康に及ぼす影響はよく研究されているのに対し、腸-皮膚軸の逆方向の作用についてはあまり注目されていません。大気汚染、喫煙、気候、日光曝露など、様々な外的環境要因が皮膚に直接影響を与えることは知られています137。このセクションでは、特定の刺激に対する皮膚反応が腸管にどのような影響を与えるかを考察し、消化管と皮膚の双方向コミュニケーションの重要な例として、ビタミンDとトリプトファン代謝物の重要性に焦点を当てます。これらの化合物に焦点を当てることで、紫外線(UV)などの外的要因が皮膚に、ひいては腸管の健康にどのように影響するかを明らかにします。 |
| 6.3.ビタミンDシグナル伝達 |
| カルシフェロール(ビタミンDとも呼ばれる)は脂溶性ビタミンで、脂の多い魚や卵に自然に含まれているため、食事から摂取できます。また、朝食用シリアルや牛乳にはビタミンDが強化されていることが多いです。食事からの摂取に加え、ビタミンDは人体でも日光に反応して生成されます。UVB光に皮膚をさらすと、前駆色素である7-デヒドロコレステロールから表皮内でビタミンDが生成されます138。最近、ビタミンDが不足しているものの健康な女性において、UVB光に皮膚をさらすことで腸内細菌叢の構成が調整されることが示されました17。ビタミンDが腸内細菌叢の構成を変化させる正確なメカニズムは不明ですが、自然免疫シグナル伝達の増加、炎症の抑制、腸管バリア機能の強化などが関与していると考えられます139。 |
| 皮膚と腸の両方において、ビタミン D 受容体 (VDR) の活性化は、微生物叢の恒常性を維持し、病原体に対する防御を提供するカテリシジンなどの 抗菌ペプチド(AMP) の生成を調節する上で重要な役割を果たします140,141。ビタミン D 自体も、ヒトのケラチノサイト、単球、好中球で抗菌ペプチドの発現を誘発します142–144。これは、ヒトカテリシジン抗菌ペプチド (CAMP) とデフェンシン ベータ 2 (DEFβ2) 遺伝子のプロモーターに、その転写を調節するビタミン D 応答要素が含まれているためです。特に、皮膚で合成されたビタミンDは腸内のビタミン D 受容体シグナル伝達を活性化し、パネート細胞のデフェンシン産生を促進します。デフェンシンは腸内細菌叢と代謝の健康の重要な調節因子として機能します145。ビタミン D 受容体は、樹状細胞、マクロファージ、T細胞(特に制御性T細胞)、B細胞など、腸内の様々な免疫細胞によって発現されているため、免疫調節における役割が注目されています146,147。ビタミンDは、免疫寛容の維持と炎症の抑制に不可欠な制御性T細胞の機能を調節します148,149。さらに、ビタミンDは樹状細胞を調節してTregの発達を促進し、マクロファージを介した炎症を調節し、B細胞における抗体産生と免疫調節に影響を及ぼします。この免疫調節は、ビタミンD欠乏症が一般的であり、疾患の重症度の増加と関連する炎症性腸疾患(IBD)において特に重要です148,149。 |
| ビタミンDは、腸管粘膜バリア機能の維持において重要な役割を果たし、腸管粘膜におけるタイトジャンクションおよび接着ジャンクションタンパク質の発現を亢進させ、腸管粘膜のアポトーシスを抑制する。さらに、腸内細菌叢由来の発酵産物(短鎖脂肪酸酪酸など)は、腸管粘膜におけるビタミン D 受容体の発現を亢進させ、マウス大腸炎モデルにおいて炎症を抑制する150。これらのビタミンDの作用は、腸内細菌叢の微生物組成の変化に影響を及ぼす可能性がある139。 |
| ビタミンDと腸内細菌叢の関連性は興味深いものです。ビタミンD欠乏症は、炎症性腸疾患(IBD)や多発性硬化症(MS)といった腸内細菌叢の異常に関連する炎症性疾患の発生率増加と関連しているからです。これらの疾患は、冬季に日光への曝露が制限され、ビタミンD欠乏症につながる北欧諸国でよく見られます。例えば、炎症性腸疾患の発生率増加は、日光曝露量の少なさと高緯度と関連しており、潰瘍性大腸炎とクローン病という2つの炎症性腸疾患の病型は、北欧では南欧に比べてそれぞれ40%と80%多くなっています。さらに、米国では紫外線曝露量が少ない地域では、炎症性腸疾患の発生率と重症度が増加し、入院率も高くなっています151。炎症性腸疾患患者のビタミンD欠乏率は16%から95%の範囲で、潰瘍性大腸炎(UC)患者よりもクロストリジオイデス・ディフィシル大腸炎(CD)患者で多く見られます152–154。 |
| 特に、炎症性腸疾患(IBD)患者は、慢性の再発性腸炎の出現と消失を反映する皮膚病変をしばしば発症します。炎症性腸疾患の皮膚症状には、裂孔や瘻孔、結節性紅斑(皮下脂肪組織の炎症)、壊疽性膿皮症(潰瘍性疾患)、増殖性膿性口内炎(口腔および皮膚のしわの膿疱性発疹)、口腔アフタ性潰瘍、皮膚結節性多発動脈炎(皮膚の中型血管を侵す血管炎の一種)、壊死性血管炎、乾癬など、様々なものがあります86。乾癬を伴う炎症性腸疾患患者の血清ビタミンD値は、乾癬のない患者よりも有意に低いことが報告されています。さらに、これらの患者はビタミンDサプリメントを摂取した後、この治療を受けていない患者よりも臨床的に改善が見られました155。ビタミンDは免疫システムで非常に重要な役割を果たすため、乾癬以外にもアトピー性皮膚炎(湿疹)156、ニキビ157 、皮膚の色素沈着の喪失を特徴とする白斑158 など、いくつかの皮膚疾患にビタミンD欠乏が関係していることは驚くべきことではありません。 |
| 6.4.トリプトファン代謝物と芳香族炭化水素受容体シグナル伝達 |
| トリプトファンは必須アミノ酸であり、神経伝達物質であるキヌレニン、セロトニン、メラトニンの前駆体です159。また、UVB光に曝露されると重要な発色団として機能し、6-ホルミルインドロ[3,2-b]カルバゾール(FICZ)を生成します159。この分子はアリール炭化水素受容体(AhR)の強力な活性化因子であり、IL22(自然免疫サイトカインであり、アリール炭化水素受容体(AhR)制御による腸管免疫の重要な構成要素であるIL-22をコードする)を含む、様々な下流遺伝子の転写制御を促進します。 アリール炭化水素受容体(AhR)はさまざまな組織で発現しており、特に上皮バリアおよび腸管関連免疫系の細胞で高い発現が見られます160。さらに、キヌレニン、キヌレン酸、キサンツレン酸、シナバリン酸などの内因性宿主トリプトファン由来代謝物や、インドール-3-アルデヒド (IAd)、インドール-3-酢酸 (IAA)、インドール-3-プロピオン酸 (IPA)、スカトール、トリプタミンなどの多数の細菌代謝物があり161、腸管免疫を促進するという文脈でアリール炭化水素受容体(AhR)リガンドとして機能する可能性があります162–164。このように、腸内の常在微生物によってだけでなく、UVB 光に反応して皮膚によっても、アリール炭化水素受容体(AhR)を活性化するさまざまなトリプトファン代謝物が生成される可能性があります。 |
| アリール炭化水素受容体(AhR)は、皮膚の免疫介在反応を制御することが知られているため、皮膚バリアの重要な調節因子です165。たとえば、アリール炭化水素受容体(AhR)は、乾癬やアルツハイマー病などの皮膚疾患に見られる表皮病変で過剰発現しています166。さらに、インドール-3-乳酸による アリール炭化水素受容体(AhR)の活性化は、炎症を軽減し、皮膚と腸の上皮のバリア機能を高めることで、皮膚と腸の健康に影響を及ぼします167,168。乾癬患者と皮膚疾患のマウスモデルでは、アリール炭化水素受容体(AhR)の活性化が炎症性後遺症を改善することが示されています。たとえば、FICZ (訳者注:FICZ(6-ホルミルインドロ[3,2-b]カルバゾール)は、AHR 制御シトクロム P4501 酵素によって効率的に代謝される、 アリール炭化水素受容体 (AhR)の強力なアゴニストです)で患部の皮膚を刺激すると、アリール炭化水素受容体(AhR)経路の下流遺伝子である Cyp1a1 の発現が誘発され、乾癬トランスクリプトームに関与するいくつかの炎症誘発性ケモカインの発現の減少につながります169。アリール炭化水素受容体(AhR) 経路によって制御されるもう 1 つの皮膚疾患は白斑です。これは、アリール炭化水素受容体(AhR)がメラニン形成遺伝子の誘導を通じてメラニン形成に関与しているためです170。同様に、白斑の 2 つの主な治療法であるソラレン (UVA 光に敏感な植物由来の光感作物質) と、皮膚の再色素沈着を促進する UV 光線療法は、どちらも人間の皮膚内のアリール炭化水素受容体(AhR)シグナル伝達を活性化します171。 |
| トリプトファン代謝の変化は、炎症性腸疾患(IBD)、過敏性腸症候群(IBS)、大腸がんなど、いくつかの腸疾患においても報告されています172–174。マウスモデルを用いた研究では、炎症誘発性の腸内細菌叢の異常には、ラクトバチルス・ロイテリなどのトリプトファン代謝を行う腸内細菌叢の減少がしばしば関与していることが明らかになっています。この減少は、インドール酢酸(IAA)などのトリプトファン代謝物の減少とアリール炭化水素受容体(AhR)活性化の低下につながります。これらの微生物叢の変化は、腸管の第3群自然リンパ球(ILC3)の活性化を阻害し、アリール炭化水素受容体(AhR)制御による腸管免疫の主要成分である組織保護サイトカインIL-22の産生を減少させ、デキストラン硫酸ナトリウム(DSS)誘発性大腸炎に対する感受性の増加につながる175。同様に、炎症性腸疾患(IBD)患者の糞便サンプルでは、アリール炭化水素受容体(AhR)活性の低下とインドール酢酸レベルの低下がしばしば見られる175。同様に、研究では、アリール炭化水素受容体(AhR)活性化が炎症状態にある腸管におけるサイトカイン(TNF、IFNγ、IL-7、IL-12、IL-17、IL-6)の産生を減少させると同時に、T細胞調節細胞のFoxp3やTヘルパー17(Th17)/ILC3細胞のRORγTなどの主要な転写因子をリガンド特異的に制御することでT細胞の分化を促進することが示されている176–179。これらの細胞は、腸管免疫の促進に極めて重要である。それぞれ、恒常性の維持と侵入する病原微生物からの防御に関与している180。 |
| 腸管または皮膚におけるアリール炭化水素受容体(AhR)シグナル伝達に関する広範な評価にもかかわらず、ある部位におけるアリール炭化水素受容体(AhR)シグナル伝達が両臓器を同時に調節する可能性については十分に解明されていない。Memariらは、生体内での末梢組織におけるアリール炭化水素受容体(AhR)シグナル伝達誘導に対するUVB皮膚曝露の影響を調査した。彼らは、1.2 kJ/m2のUVB単回照射を用いて、UVB曝露3時間後および6時間後に、血液、肝臓、および腸管における複数のアリール炭化水素受容体(AhR)標的遺伝子の発現を調べた。その結果、腸管におけるIl22およびIl23a(そのシグナル伝達はIl-22の上流に位置する)を含むアリール炭化水素受容体(AhR)標的遺伝子が、皮膚へのUVB曝露後に発現上昇することが示された。これらの研究結果は、中程度の皮膚UVB曝露が、リガンド調節性環境センサーであるアリール炭化水素受容体(AhR)を介して内分泌シグナル伝達を誘発するという説得力のある証拠を提供している181。マウスとヒトの両方において、特にバリアー器官における免疫システムにおけるアリール炭化水素受容体(AhR)シグナル伝達の新たな役割を考慮すると、このデータは、全身免疫の内分泌調節を媒介する皮膚UVB曝露の役割をさらに裏付けている。 |
| 6.5.皮膚損傷 |
| 皮膚損傷は、皮膚と腸管の複雑な相互作用を引き起こし、腸内細菌叢と免疫バランスに重大な混乱をもたらすことが示されています。この現象は特にマウスモデルで顕著で、皮膚損傷は腸内細菌叢のディスバイオシスを悪化させ、免疫応答を変化させます。皮膚損傷が腸管の健康に影響を与えるメカニズムの一つは、炎症性メディエーターの全身循環です。例えば、横山らは、マウスにおけるインドメタシン投与によって誘発された皮膚損傷が、IgEやTNF-αなどの炎症性メディエーターの血漿レベルを上昇させることを実証しました182。これらのメディエーターは腸管に移行し、そこで腸の炎症を悪化させました。さらに、Galloらは、皮膚損傷が腸管の炎症を悪化させるメカニズムの一つは、炎症性メディエーターの全身循環を介したものであることを明らかにしました。局所的な皮膚損傷は腸内抗菌防御を弱め、腸内細菌叢を変化させ、デキストラン硫酸ナトリウム(DSS)誘発性大腸炎の感受性を高める可能性があることを示唆している183。ヒアルロン酸(HA)消化モデルを用いて、皮膚創傷時や乾癬などの症状時に起こる真皮からのヒアルロン酸断片の局所的放出を再現した184。このモデルは、皮膚炎症に一般的に関連する交絡因子をコントロールした。この研究では、ヒアルロン酸断片が腸内細菌叢を破壊し、大腸炎感受性を高めることが明らかになった。さらに、実験により、ヒアルロン酸断片はマウス大腸および培養されたヒト大腸上皮細胞においてReg3の産生を促進することが実証され、皮膚炎症と腸機能障害との関連が示された183。 |
| これらの研究結果は、皮膚と腸の密接な関係を実証しています。皮膚損傷は腸内細菌叢と免疫恒常性の繊細なバランスを崩す可能性があり、この相互作用が不適応状態になった場合に、それを標的とした治療戦略のさらなる探求の必要性を浮き彫りにしています。 |
| 7.紫外線放射 – 局所的および全身的影響 |
| 前節の知見を踏まえ、UVB光/放射線は皮膚と腸の両方に重大な影響を及ぼす可能性があることが分かっています。UVBは皮膚におけるビタミンDの産生を促進します。ビタミンDは様々な役割を担っていますが、中でも腸内細菌叢の健康維持に大きく貢献しています。ビタミンDの欠乏は、腸内細菌叢の乱れや炎症性腸疾患(IBD)と関連付けられています154。さらに、UVB曝露は、腸-皮膚軸で重要な役割を果たすアリール炭化水素受容体(AhR)リガンドの合成を促進することで、トリプトファン経路に影響を与えます。本節では、主に太陽から照射されるUVB放射が皮膚と腸の健康に及ぼす多面的な影響に焦点を当てます。 |
| 太陽光は、電磁放射の連続スペクトルとして定義され、紫外線(UV)、可視光線、赤外線という異なる波長域に分けられます。具体的には、UVスペクトル(200~400nm)はさらに3つの波長域、UVC(200~290nm)、UVB(290~320nm)、UVA(320~400nm)に細分化されます185。UVCは大気中のオゾン層に吸収されるため、皮膚を透過できるのはUVAとUVBのみです186。紫外線(UV)放射は、人体の健康に有益な影響と有害な影響の両方をもたらします。日焼け、免疫抑制、白内障、光老化、そして非黒色腫および黒色腫皮膚がんにつながる可能性のあるDNA損傷などは、望ましくない紫外線影響の例です。紫外線の有益な効果として広く認識されているのは、皮膚への曝露によるビタミンDの合成です187。さらに、白斑などの特定の皮膚疾患は、紀元前2000年からエジプト、ギリシャ、インドで光線療法(日光療法)による治療が行われてきました。20世紀以降、UVAスペクトルの光は、紅斑性角化症や湿疹の治療に頻繁に利用されるようになり、UVBは現在、乾癬、白斑、菌状息肉症(最も一般的な皮膚T細胞リンパ腫)などの症状の治療に用いられています185,188–190。 |
| 7.1皮膚治療としての紫外線照射 |
| 光線療法の効果は、光が皮膚に浸透する深さによって異なります。UVB光は通常、表皮と真皮上層で吸収されますが、UVAは波長が長いため真皮に効果的に浸透し、動脈血管を拡張させ、血圧を低下させます191–193。紫外線光が皮膚に浸透すると、発色団と呼ばれる分子と相互作用し、発色団は光を吸収して化学反応を起こします。UVBは主に核DNAを標的とし194、DNA光産物の形成とDNA損傷、そして皮膚の各層に存在するケラチノサイト、免疫細胞、線維芽細胞、および内皮細胞のアポトーシスを急速に引き起こします194。皮膚の健康への遅発性影響としては、抗炎症性プロスタグランジンとサイトカインの放出が挙げられます。 紫外線光の全体的な結果には、局所的および全身的な免疫抑制、サイトカイン発現の変化、細胞周期の停止が含まれ、これらはすべて疾患活動の抑制に寄与します。 |
| 特定の波長の紫外線を特定の量で照射すると、免疫抑制効果を示すことが研究で示されています。例えば、UVAの中でもより長く、紅斑を生じず、最も深く浸透する波長、特にUVA1(340~400nm)による治療は、全身性エリテマトーデス(SLE)患者の症状を改善する可能性があります。この効果は、UVA1 光が真皮深部と表皮の境界に到達し、全身の B 細胞と T 細胞の活動を抑制し、IFNγ 産生 Th1 細胞と細胞傷害性 T 細胞の数を減少させることによるものとされています195,196。乾癬の場合、紫外線は病気の症状を悪化させたり改善したりと、相反する効果を発揮する可能性があります190。過度の日光曝露は既存の乾癬プラークを悪化させることがありますが、ナローバンド UVB と UVA を皮膚の光感作を高めるソラレンと呼ばれる植物性物質と組み合わせた治療法は、中程度から重度の乾癬の治療に効果があることが証明されています185。乾癬は Th1 細胞と Th17 細胞由来のサイトカインのレベルの上昇によって引き起こされると考えられています。紫外線照射治療は、IL-4やIL-13などのTh2細胞関連サイトカインのバランスを傾けることでこのサイトカインプロファイルを修正し、それによって炎症誘発反応を減らし、IL-23-IL-17軸を抑制します197,198。 |
| フィラグリンは重要な皮膚バリアタンパク質で、アトピー性皮膚炎はフィラグリン遺伝子(FLG)の機能喪失変異と関連していることが多く、したがってアトピー性皮膚炎は表皮バリア機能の低下によって引き起こされる可能性がある156。フィラグリンが正常に発現している場合でも、主要なUVB光子吸収色素であるトランスウロカニン酸(トランスUCA)を含む皮膚のいくつかの「天然保湿因子」によって分解される可能性がある199。UVB光線療法は、12週間の治療後に患者のフィラグリンレベルを上昇させることが示されているため、アトピー性皮膚炎の治療によく使用されている200。これは、UVB放射線の吸収によりトランスUCAがシスウロカニン酸(シスUCA)に変換され、免疫抑制を引き起こす可能性があることを反映している可能性がある201。同様に、アトピー性皮膚炎患者に対するナローバンドUVB治療は、皮膚浸潤リンパ球、樹状細胞(DC)、および好酸球を減少させ、 Th2およびTh22免疫軸の抑制が見られ、Th1軸の抑制も軽度に抑えられます202。臨床的改善はIL-22レベルの低下202、IL-5、IL-13、IL-31などのTh2関連サイトカインの抑制203、およびIgE結合細胞数の減少と関連しています204。 |
| 7.2.紫外線は全身に影響を及ぼす |
| 紫外線がヒトの皮膚に及ぼす局所的な有益な影響については、広範囲に研究されている185。しかし、紫外線は皮膚以外にも、多様な全身的影響を及ぼす可能性がある。ビタミンDの合成を誘導するだけでなく、免疫系の調節205や、インスリンレベルの調節、脂肪肝などの代謝プロセスも促進する。さらに、天然の鎮痛剤および気分向上剤であるエンドルフィンの放出を促し、体内時計(概日リズム)の調整を助け、睡眠パターンおよびホルモン放出に影響を及ぼします206。さらに、いくつかの研究では、UVA 照射により一酸化窒素が放出され、血管が弛緩するため血圧の調整に役立つ可能性が示唆されています193。同様に、紫外線が特定の神経プロセスに影響し、気分および認知機能に影響を及ぼす可能性があることを示唆する新たな研究も登場しています207。紫外線への皮膚曝露が皮膚常在細菌叢に影響を及ぼすことは知られていますが、腸内などの離れた部位の細菌叢のメンバーに紫外線が及ぼす可能性のある影響は、刺激的な新しい研究分野です。 |
| 8.腸内細菌叢と皮膚細菌叢のコミュニケーション:紫外線による調節 |
| 前述のように、多くの研究で、皮膚細菌叢の乱れが、ニキビ、アトピー性皮膚炎、乾癬などの皮膚疾患と関連していることが示されています208。さらに、これらの疾患は、炎症性腸疾患(IBD)、過敏性腸症候群(IBS)、セリアック病などの併存する消化器疾患を伴うことがよくあります。このことから、これらの疾患に対する紫外線照射の改善効果が、紫外線によって引き起こされる皮膚および腸内細菌叢の変化を部分的に反映している可能性があるという疑問が生じます。私たちは、紫外線照射は、照射時間と強度に応じて、皮膚の微生物群集を直接変化させる可能性があると考えています205。紫外線が微生物に及ぼす主要な影響の一つはDNA損傷です。しかし、一部の細菌や真菌は、ライフサイクルの特定の段階で紫外線に対して選択的な耐性を示しますが、胞子形成、拡散、感染の段階では感受性が高いことがよくあります205。そのため、紫外線照射は、より感受性の高い微生物の死滅を引き起こす可能性があります209。Wang et al.はプロピオニバクテリウム・アクネス(P. acnes)が産生するポルフィリンが紫外線照射後に減少することが明らかになり、ニキビ患者の皮膚細菌が紫外線曝露に敏感であることを示す証拠が示された210。また、アトピー性皮膚炎患者の皮膚には黄色ブドウ球菌(S. aureus)が増殖していることも示されており、これはUVB照射後に減少した211。紫外線によって引き起こされる微生物組成の変化に伴い、微生物代謝物も変化すると考えられる。本節では、腸内細菌叢と皮膚細菌叢のコミュニケーションの基盤となる可能性のあるいくつかのメディエーターと、それらが紫外線曝露によって影響を受ける可能性について述べる(図2参照)。 |
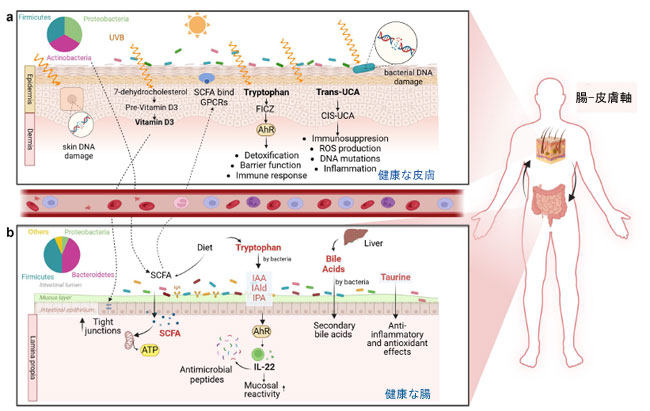 |
図2. UVBが皮膚に及ぼす影響とその潜在的影響 a) 皮膚がUVB光に曝露されると、表皮の7-デヒドロコレステロールからビタミンDが生成されることがあります。ビタミンDはまた、消化管の3つの主要構成要素である腸上皮バリア、腸管免疫、腸内細菌叢を標的として、腸の健康に影響を及ぼします。UVB光は、皮膚細胞と皮膚細菌のDNAに損傷を与える可能性があります。また、UVB光は皮膚でトランス-ucaをシス-ucaに変換し、活性酸素種(ROS)を発生させ、免疫抑制、DNA変異、炎症を引き起こします。トリプトファンはUVB光に曝露されると発色団として作用し、アリール炭化水素受容体(AhR)の強力な活性化因子である6-ホルミルインドロ[3,2-b]カルバゾール(FICZ)の生成を引き起こします。アリール炭化水素受容体(AhR)は解毒、バリア機能、免疫に関与しています。 b) 皮膚をUVB光に曝露すると、腸などの遠位臓器に影響を及ぼす可能性があります。 UVBは腸内細菌叢の構成を変化させ、短鎖脂肪酸の産生に影響を与えることが報告されています。短鎖脂肪酸は腸から皮膚へ輸送され、皮膚細胞上のGタンパク質共役受容体(GPCR)に結合し、組織の代謝と機能に直接影響を及ぼします。腸内では、トリプトファンが細菌によって代謝され、ILC3などの細胞を活性化するアリール炭化水素受容体(AhR)リガンドが生成され、IL-22が産生されます。IL-22は抗菌ペプチドの放出を制御し、それによって微生物の構成を調整し、免疫と微生物叢のバランスに影響を与えます。胆汁酸は、肝臓で一次胆汁酸として最初に産生され、腸内細菌叢(クロストリジウムや真正細菌など)によって結腸で二次胆汁酸へと代謝されます。胆汁酸は代謝と免疫プロセスにおいて基本的な役割を果たします。最後に、タウリンはビロフィラやエシェリヒアなどの硫黄由来の細菌によって分解されます。タウリンは、胆汁酸抱合、浸透圧調節、膜安定化、抗酸化、カルシウムシグナル伝達の調節に役割を果たします。 |
| トリプトファン経路からの代謝物が腸と皮膚の健康にとって重要であることは以前にも取り上げられてきたが、これらの代謝物の産生にどの程度まで微生物叢が必要なのかは不明である。最近、Patraらは無菌マウス(微生物叢を欠く)、消毒マウス(皮膚微生物叢を部分的に欠く)、および微生物叢が損なわれていないコントロールマウスをUVB照射(1回照射)に曝露した。これらのマウスの皮膚生検を調べたところ、著者らはUVB照射によってトリプトファン代謝が増加したが、これは微生物叢が損なわれていないコントロールマウスにのみみられたことを示した212。著者らは、紫外線照射によるトリプトファン代謝物の増加が微生物叢による産生によるものか、宿主の皮膚細胞による産生によるものかを判断することの難しさを指摘している。とはいえ、これらの結果は、独特のメタボロミクスプロファイルを促進する上での皮膚微生物叢の重要性を強調している。 |
| 腸内細菌のもう一つのよく知られた産物は、難消化性多糖類の発酵によって生成される短鎖脂肪酸です213。短鎖脂肪酸の中でも、酪酸は大腸細胞の代謝を促進し、免疫細胞に作用して炎症を抑えるため、腸の恒常性維持に特に重要です214。短鎖脂肪酸は、末梢循環を介して腸から遠位の臓器や組織に移動することが示されています215,216。短鎖脂肪酸は、皮膚細胞、白血球、好中球、その他の細胞型によって発現されるGタンパク質共役受容体(GPCR)に結合し、組織の代謝と機能に直接影響を与えます217,218。例えば、多くのアトピー性皮膚炎患者は、糞便中の短鎖脂肪酸レベルが低く、これは短鎖脂肪酸産生細菌の少なさと一致しており219、このパターンは動物モデルでも見られます220。ニキビは、アクネ菌(P. acnes)の過剰増殖によって引き起こされる炎症性皮膚疾患ですが、プロバイオティクスの表皮ブドウ球菌によって緩和することができます221,222。 このプロバイオティクスは、短鎖脂肪酸を産生することで、アクネ菌のコロニー形成と炎症誘発能を阻害します223。消化管疾患の観点から見ると、炎症性腸疾患(IBD)患者は健常者と比較して、便中の短鎖脂肪酸濃度が低いことがよくあります81。ヒトおよびマウスの研究では、紅斑下紫外線への複数回曝露が腸内細菌叢の多様性を高め、短鎖脂肪酸産生細菌の存在を増加させる可能性があることが示されています。しかし、これが短鎖脂肪酸濃度の測定可能な増加につながるかどうかは未だ検証されていません17,224。最近の研究では、マウスを週3回、8週間にわたりUVB放射線(75 mJ/cm2)に曝露し、盲腸内細菌叢への影響を分析しました。この研究では、驚くべきことに、UVB照射によってプレボテラ、ローズブリア、ルミノコッカス、アッカーマンシアといった短鎖脂肪酸産生に関与する細菌の数が減少することが明らかになった225。これらの結果は先行研究と矛盾するが、UVB光の強度と照射頻度を考慮することが重要である。本研究では8週間という長い照射期間が用いられており、これは長期にわたるUVB照射が短鎖脂肪酸産生細菌に有害な影響を及ぼす可能性があることを示唆している。 |
| 胆汁酸(BA)は、腸と皮膚の両方に影響を与える重要な代謝産物であり、これら2つの臓器間の情報伝達に役割を果たしている可能性があります。コレステロールに由来するこれらの天然サーファクタントは、肝臓で生成され、小腸に放出され、脂肪の消化と吸収を助けます71。これらの一次胆汁酸は小腸で完全には吸収されないため、一部は結腸に到達し、腸内細菌叢が脱抱合および脱水酸化と呼ばれるプロセスを通じてこれらの一次胆汁酸を代謝します。この微生物変換により、ケノデオキシコール酸(CDCA)やコール酸(CA)などの一次胆汁酸は、リトコール酸(LCA)やデオキシコール酸(DCA)などの二次胆汁酸に変換されます。このプロセスでは、細菌酵素、特に胆汁酸塩加水分解酵素(BSH)が胆汁酸塩を加水分解し、遊離胆汁酸を放出します。その後、主にクロストリジウム属とバクテロイデス属に属する特定の腸内細菌が、胆汁酸分子の7番目の位置にあるヒドロキシル基の除去を触媒し、リトコール酸やデオキシコール酸などの二次胆汁酸の形成につながります226–228。 |
| 胆汁酸(BA)は、脂質の消化とコレステロールの調節という主要な機能に加え、自然免疫の調節にも関与しています229。乾癬性関節炎や炎症性腸疾患(IBD)などの疾患で観察される胆汁酸バランスの乱れは、腸内細菌叢の不均衡と免疫異常を示唆し、サイトカイン産生の増加につながります230,231。アミノ酸であるタウリンは胆汁酸抱合に不可欠であり、潰瘍性大腸炎(UC)などの疾患の治療に治療効果があることが示されています232。 例えば、タウリン(0.05~0.15g/日)は、乾癬や湿疹に効果的に作用し233、刺激性皮膚炎を予防します234。マウスを用いた研究では、胆汁酸の補給、または胆汁酸を産生する遺伝子組み換え細菌の使用により、結腸のTreg細胞数が増加し、大腸炎に対する感受性が低下することが示されています235,235。 乾癬患者はしばしば胆汁酸プロファイルの機能不全を呈し、抱合型一次胆汁酸および二次胆汁酸のレベルが低い236。 初期の臨床研究では、デヒドロコール酸またはウルソデオキシコール酸の経口サプリメントが、腸内細菌叢に影響を与えるか、皮膚ホスホリパーゼA2の活性を阻害することによって、乾癬を治療できることが示唆されている237,238。 さらに、in vitro研究では、胆汁酸がT細胞によるIL-17A産生を直接抑制できることが示されており、胆汁酸と抗乾癬効果の間にメカニズム的な関連があることを示唆している239。食生活の改善と抗菌薬は、微生物叢-胆汁酸軸の調節に役立ち240、消化管の様々な疾患や皮膚疾患を治療できる可能性がある。皮膚へのUVB曝露が胆汁酸代謝を変化させるかどうかについては、まだ研究が行われていないため、紫外線照射による微生物叢の変化と胆汁酸代謝との潜在的な関連性を探るには、さらなる研究が必要である。 |
| トリメチルアミン N-オキシド(TMAO)は、腸と皮膚の健康に影響を与える可能性があるもう1つの腸内微生物代謝物です。コリン、ベタイン、カルニチンなどの食物源に由来し、トリメチルアミン N-オキシドレベルの上昇は炎症性腸疾患(IBD)および化膿性汗腺炎(HS)の病態に関係していることが示されています241。化膿性汗腺炎(HS)は、メタボリックシンドローム、高トリグリセリド血症、糖尿病、虚血性脳卒中、心筋梗塞などのいくつかの心血管疾患と代謝疾患に関連する、非常に障害を伴う炎症性皮膚疾患です242。化膿性汗腺炎(HS)と炎症性腸疾患(IBD)の間にも関連性があり、2つの疾患に共通の遺伝的感受性と免疫学的特徴があることを示唆していますが243、トリメチルアミン N-オキシド(TMAO)はこの関連性の一部として研究されていません。化膿性汗腺炎(HS)と炎症性腸疾患(IBD)の関係は、喫煙、遺伝、および瘻孔形成などの共通の疾患特徴などの共通のリスク要因の影響を受けます。ある研究により、化膿性汗腺炎患者の 炎症性腸疾患(IBD)(クロストリジオイデス・ディフィシル大腸炎(0.8%)および 潰瘍性大腸炎(1.3%))の有病率は一般人口(0.3%)よりも有意に高く、炎症性腸疾患を新たに発症するリスクも高いことが明らかになりました244。さらに、2018 年のコホート研究では、炎症性腸疾患(IBD)を患う 化膿性汗腺炎(HS)患者は主に若いアフリカ系アメリカ人女性で、喫煙者、肥満、糖尿病である可能性が高く、入院期間が長く、医療費も高いことがわかりました245。この関係は腸-皮膚軸によって説明できます。化膿性汗腺炎と炎症性腸疾患はどちらも、IL-1β、IL-17、TNF-α などの主要なサイトカインによって引き起こされる免疫調節異常を伴い、腸と皮膚の両方で慢性炎症の一因となります244,246,247。炎症性腸疾患で腸内細菌叢が乱れると、全身性炎症が悪化し、化膿性汗腺炎などの皮膚疾患に影響を及ぼす可能性があります。両疾患に共通する炎症環境は、皮膚と腸の両方に影響を及ぼす慢性の免疫反応の調節異常による瘻孔形成などの共通点も説明できる。TNFα阻害剤などの標的治療は化膿性汗腺炎と炎症性腸疾患の両方に効果があることが証明されており、相互に関連した炎症経路を示している244,246,247。そのため、消化管症状を伴う化膿性汗腺炎患者の腸-皮膚軸を認識することは、炎症性腸疾患のさらなる評価を正当化する可能性があり、両疾患に対する統合的ケアの重要性を浮き彫りにする。興味深いことに、ビタミンDサプリメントはTMAOレベルを低下させる効果が期待されており、炎症性腸疾患と化膿性汗腺炎の両方に対する新しい治療アプローチを示唆している248。これを考慮すると、トリメチルアミン N-オキシドレベルを低下させる可能性について、UVB放射線への曝露とそれによるビタミンDの誘導を研究する必要があると我々は提案する。 |
| 9. 腸-皮膚軸関連疾患に対する紫外線療法の可能性 |
| 腸-皮膚軸は近年、重要な研究分野として浮上しており、人体における臓器間の情報伝達メカニズムの解明に焦点を当てていることや、皮膚疾患と腸疾患の両方に対する治療法開発の可能性から、ますます注目を集めています。研究者らは、プロバイオティクスやプレバイオティクス249、食生活の改善250,251、局所療法252、糞便細菌叢移植 (FMT) 253 など、腸内細菌叢を調整するいくつかの療法を研究してきました。一方、光線療法は主に皮膚疾患に関して研究されてきました185,188–190。紫外線については、皮膚に対する潜在的な治療効果が調査されており、研究では腸-皮膚軸を介して皮膚免疫系に影響を与える可能性があることが示唆されています205。刺激的な概念は、日光、特に UVB 光が、ビタミン D の従来の役割を超えて、さまざまな免疫介在性疾患に対する保護特性を提供する可能性があるというものです254。この発見は科学者の間で新たな議論を引き起こし、潜在的な治療アプローチに対する理解を一変させました。 |
| 10.結論 |
| 結論として、本レビューは皮膚と腸管系における動的なコミュニケーションに焦点を当てています。様々な臓器が相互作用する中で、これら2つの臓器はそれぞれ独自の環境にさらされており、恒常性の維持、そして環境因子の有益な影響と有害な影響のバランスをとる上で重要な役割を果たしています。腸-皮膚軸には、微生物叢依存性メディエーターと非依存性メディエーターの両方が関与していることを明らかにし、このコミュニケーションの複雑さを強調しました。これらの相互作用を理解することで、治療法や精密医療の進歩が期待できます。最終的には、さらなる研究によって、紫外線治療などの環境刺激が、ヒトの健康と疾患を制御する複雑なシグナル伝達ネットワークをどのように制御できるかが明らかになり、患者の転帰改善と医療の質向上につながる可能性が高まります。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Gut Microbes. 2025 Mar 6;17(1):2473524.に掲載されたThe gut-skin axis: a bi-directional, microbiota-driven relationship with therapeutic potential.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |