
Lin Yuan et al., |
要約 |
| ヘリコバクター・ピロリ(ピロリ菌)は、胃炎、消化性潰瘍、胃がんの主要な原因菌と考えられており、世界人口の半数以上が罹患しています。抗生物質療法による除菌率は、耐性リスクの増大により徐々に低下しています。近年の研究では、プロバイオティクスがピロリ菌感染症の治療に大きな可能性を秘めていることが示されています。ヒトおよび動物モデルを用いた複数の研究では、プロバイオティクスによる介入がピロリ菌の増殖を抑制し、ピロリ菌誘発性胃炎を軽減し、抗生物質の除菌率を高めながら副作用を軽減できることが実証されています。しかしながら、プロバイオティクスの有効性については依然として議論が続いています。最近発表されたレビューでは、様々な種類や用量のプロバイオティクスの使用、あるいはプロバイオティクスと薬剤の併用による転帰の違いについて体系的に詳細に検討されていません。これらの研究は主に動物実験に焦点を当てており、臨床研究で観察された結果の異質性やその根底にあるメカニズムについては検討されておらず、より質の高いエビデンスを提供できていない。本レビューは、ヒトにおけるピロリ菌感染のメカニズム、ピロリ菌感染治療におけるプロバイオティクスの効果、そしてプロバイオティクスがピロリ菌を阻害する経路と分子メカニズムについて議論する。今後の課題としては、有効な菌株の特定、最適な投与量と治療期間の決定、実験プロトコルの標準化、個人差の考慮、そしてピロリ菌感染におけるプロバイオティクス療法の具体的な分子メカニズムと長期的な影響のさらなる解明が挙げられる。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.ヘリコバクター・ピロリ感染のメカニズムと制御戦略 |
| 3.プロバイオティクスによるヘリコバクター・ピロリの抑制効果 |
| 3.1. in vivoおよびin vitro実験 |
| 3.2.関連臨床研究 |
| 4.プロバイオティクスによるヘリコバクター・ピロリの増殖阻害メカニズム |
| 4.1.競合排除 |
| 4.2.胃酸環境の調節 |
| 4.3.抗菌物質の産生 |
| 4.4.免疫調節作用 |
| 4.5.胃の微生物生態系の制御 |
| 5.結論と今後の展望 |
| 本文 |
| 1.はじめに |
| ヘリコバクター・ピロリ(ピロリ菌)は、グラム陰性の微好気性らせん細菌であり、独特の形態と鞭毛を特徴としています。これらの鞭毛により、酸性の胃環境において粘液層を通過し、上皮細胞に付着することで局所的な炎症反応を引き起こします。ピロリ菌は、胃炎、消化性潰瘍、粘膜関連リンパ組織リンパ腫、および胃腺がんの発生における主要な病因と考えられています(図1)(Li et al., 2024)。ピロリ菌は、世界保健機関(WHO)によってグループIの発がん性物質に分類されています。最近発表された文献によると、 ピロリ菌感染率が低下した国では、胃がんの発生率も低下していることが示されています(Chen Y-C. et al., 2024)。世界的に、特に発展途上国や農村部では、この細菌は主に経口経路または糞口経路で伝染し、人口の半数以上が感染しています(Duan et al., 2023; Stefano et al., 2018)。ピロリ菌感染症は典型的には小児期に発症し、小児の30%以上が感染しています(Yuan et al., 2022)。感染初期の小児は合併症を発症する可能性が低いため、治療は不要とみなされることが多い(Saito et al., 2021)。さらに、ピロリ菌感染症は妊娠の結果に影響を及ぼす可能性があります(Masaadeh et al., 2023)。ピロリ菌感染症の臨床診断法には、尿素呼気試験、便抗原検査、血清抗体検査、内視鏡検査中の胃生検などがあります(図1)(Addissouky et al., 2023)。 |
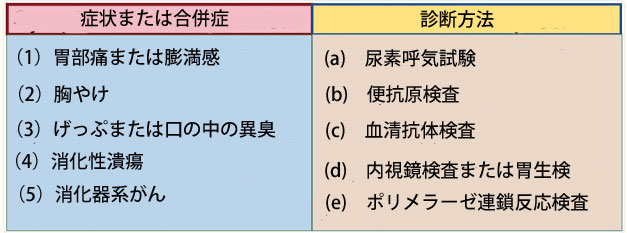 |
図1 ピロリ菌感染後の症状と対応する診断方法。 症状と診断ツールの関係は以下のとおりです。症状(1)は診断ツール(a)、(b)、(d)に対応します。症状(2)は診断ツール(a)と(d)に対応します。症状(3)は診断ツール(a)、(b)、(c)に対応します。症状(4)は診断ツール(a)、(b)、(d)に対応します。症状(5)は診断ツール(d)と(e)に対応します。(figdrawより) |
| ピロリ菌感染症の標準的な治療は、3剤併用療法または4剤併用療法です。3剤併用療法は通常、プロトンポンプ阻害剤(PPI)と2種類の抗生物質を7~14日間投与し、4剤併用療法では除菌率を高めるためにビスマス剤を追加します。これらのレジメンは臨床的に有効であるにもかかわらず、依然として重大な限界が存在します。第一に、特にクラリスロマイシンなどのマクロライド系薬剤に対する抗生物質耐性が増加しており、治療失敗率の上昇につながっています(Malfertheiner et al., 2024)。2050年までに、1,000万人が抗菌薬耐性感染症で死亡すると推定されています(de Kraker et al., 2016)。第二に、薬物療法の複雑さと治療期間の長期化が、患者の服薬遵守率の低下につながっています。さらに、下痢などの胃腸障害などの一般的な副作用も、服薬遵守をさらに低下させます(Chen Z. et al., 2024)。複雑な胃病変や感染症の場合、最近のレビューでは、牽引補助下内視鏡的粘膜下層剥離術が臨床治療の効率を改善する可能性があることが示唆されています(Niu C. et al., 2024)。同様に、微生物の調節は胃腸機能を促進することで治療結果を改善する可能性があります。これらの課題に対応するため、研究者は新しい抗ピロリ菌薬の開発や、新しい抗菌薬、天然植物抽出物、抗ピロリ菌プロバイオティクス、その他の抗ピロリ菌食品や薬剤など、よりシンプルで効果的な治療レジメンの検討を行っています(Zimmermann and Curtis, 2017; Takeuchi et al., 2014; El et al., 2023; Maria et al., 2023; Shadvar et al., 2024)(図2)。小児および妊婦に対する抗生物質の選択肢は限られており、プロバイオティクス療法が潜在的な代替アプローチとして浮上しています。 |
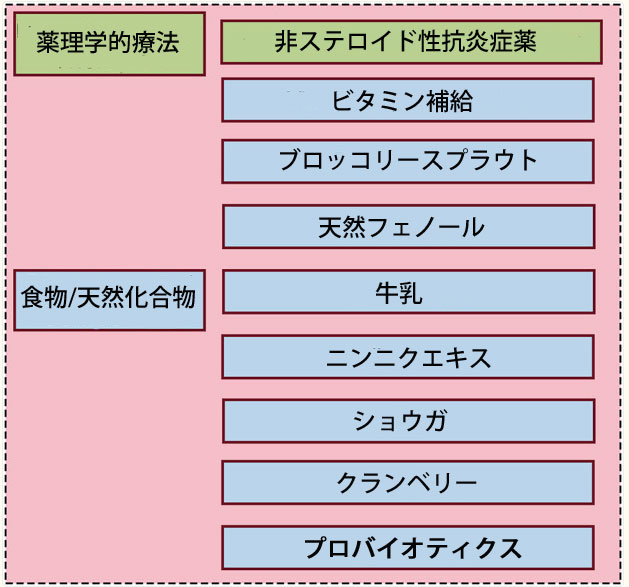 |
| 図2 ピロリ菌 感染の予防と治療の可能性のある方法 |
| プロバイオティクスは、主に乳酸菌やビフィズス菌など、宿主の健康に有益な活性微生物群です。プロバイオティクスは、病原微生物の競合阻害、腸内細菌叢の調整、免疫機能の増強など、様々なメカニズムを通じて有益な効果を発揮します。さらに、プロバイオティクスは粘膜バリアを強化し、病原体の侵入を防いだり、有害微生物の増殖を抑制する代謝物(短鎖脂肪酸や抗菌ペプチドなど)を産生したりします。ピロリ菌感染症の治療において、プロバイオティクスは重要な補助的役割を発揮します。特定のプロバイオティクス株は、ピロリ菌の増殖を直接阻害したり、胃のpHを調整したりすることで、ピロリ菌の生存に不利な環境を作り出します。さらに、プロバイオティクスは宿主の免疫応答を高め、ピロリ菌の排除を促進します。その結果、プロバイオティクスは抗生物質への依存を減らすだけでなく、その副作用も軽減し、ピロリ菌感染症の安全で効果的な治療の有望な代替戦略となります。 |
| 人体におけるピロリ菌感染のメカニズムと、ピロリ菌感染治療におけるプロバイオティクスの役割については、最近の文献(Shadvar et al., 2024; Dash et al., 2024; Huang et al., 2024; Liu et al., 2024)でレビューされており、プロバイオティクスによるピロリ菌感染抑制の実現可能性に関する理論的根拠が示されている。しかし、プロバイオティクスの種類や投与量の違い、また薬物との併用の有無による効果の違いについては、体系的に説明されていない。これらのレビューは動物実験に重点を置いており、臨床研究で得られた多様な結果や関連するメカニズムを整理し、より質の高いエビデンスと体系的な要約を提供することには至っていない。本稿は、ヒトにおけるピロリ菌感染のメカニズム、ピロリ菌感染治療におけるプロバイオティクスの生体内効果、そしてプロバイオティクスがピロリ菌の増殖を抑制する経路と分子メカニズムについて体系的にレビューすることを目的としています。さらに、ピロリ菌感染の予防と制御におけるプロバイオティクスの利用に関する今後の研究の方向性についても考察します。 |
| 2.ヘリコバクター・ピロリ感染のメカニズムと制御戦略 |
| 宿主におけるヘリコバクター・ピロリ(ピロリ菌)感染経路には、遺伝的に近縁な個体間の伝播と、社会経済的地位が類似する感染者との接触が含まれる(Stefano et al., 2018)。近年、ピロリ菌感染メカニズムの理解は大きく進展し、複雑な感染プロセスと免疫回避戦略が明らかになってきた。主なプロセスは、ピロリ菌が酸性の胃環境に適応し、上皮細胞に結合する接着因子を放出し、続いて毒素タンパク質を分泌することで持続感染を確立することである(図3)。まず、宿主細胞上のTlpB受容体が化学シグナルによって活性化され、胃上皮への走化性反応を促進する(Hanyu et al., 2019)。ピロリ菌は、鞭毛を介して酸性環境を移動することで胃酸による直接的なダメージを回避し、比較的中性の粘液層を通過した後、胃上皮細胞にしっかりと付着します(Gu, 2017)。ピロリ菌はウレアーゼを分泌し、尿素を加水分解してアンモニアと二酸化炭素を生成します。これにより、局所的に胃酸が中和され、生存に適した微小環境が作り出されます(Idowu et al., 2022; Elbehiry et al., 2023)。さらに、ピロリ菌は、抗原結合アドヘシン(BabA)、シアリン酸結合アドヘシン(SabA)、外側炎症性タンパク質(OipA)、外膜タンパク質(OMP)など、発現の異なるアドヘシン(訳者注:細菌が宿主の細胞表面や粘膜などに付着・定着するために必要な、細胞表面や付属器官を構成する分子です)を利用して、粘液層との結合から上皮細胞層への密着への移行を促進し、宿主の排除機構による細菌の影響を受けないようにします(Sharndama and Mba, 2022)。胃上皮細胞に密着すると、アドヘシンは空胞形成細胞毒素A(VacA)、細胞毒素関連遺伝子A(CagA)、細胞毒素関連遺伝子Lタンパク質(CagL)などの様々なエフェクタータンパク質を用いて宿主細胞のシグナル伝達を操作し、胃上皮細胞の挙動を変化させることで、長期的な定着を促進します(Salama et al., 2013)。これらのうち、CagA 病原性アイランドは中心的な調整役を果たし、IV 型分泌システムを介して CagA を宿主細胞に注入し、細胞機能を破壊して胃の病理を促進します (Hatakeyama、2017; Ali および AlHussaini、2024)。 |
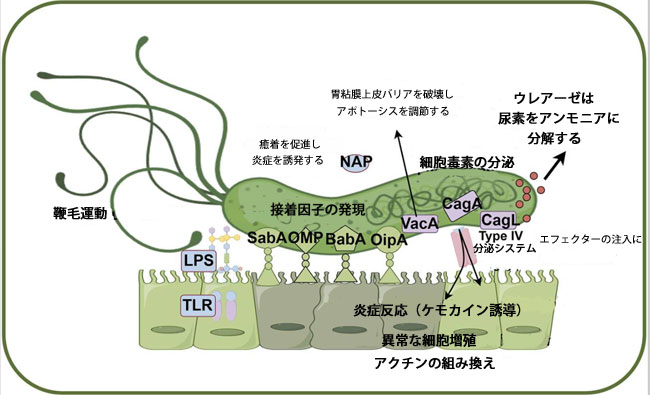 |
図3 宿主におけるピロリ菌感染の発症メカニズム。 ピロリ菌は、アンモニアを産生し鞭毛運動することで胃の酸性環境を通過し、宿主上皮細胞への接着を促進する接着因子を産生する。最終的に、ピロリ菌は一連の毒素タンパク質を分泌して上皮細胞を破壊し、宿主の炎症性免疫応答を活性化することで持続感染を引き起こす。 略語:BabA(血液型抗原結合接着因子)、CagA(細胞毒素関連遺伝子A)、CagL(細胞毒素関連遺伝子L)、NAP(好中球活性化タンパク質)、OipA(外膜炎症タンパク質A)、SabA(シアリン酸結合接着因子)、VacA(空胞形成細胞毒素A)、LPS(リポ多糖類)、TLR(Toll様受容体)、OMP(外膜タンパク質)。緑色でコード化された因子は主に接着に関連し(BabA、SabA、OipA、OMP)、ピンク色でコード化された因子は主に細胞毒素分泌に関連し(CagA、CagL、VacA)、青色でコード化された因子は主に免疫応答に関連します(LPS、TLR、NAP)。(figdrawより) |
| ピロリ菌は、宿主の免疫応答を調節することで持続感染を確立する。ピロリ菌の表面抗原(例:リポ多糖)は、TLR2やTLR4などのパターン認識受容体を介して宿主の自然免疫系を活性化する。一方、その毒性因子(例:VacAやCagA)は、上皮細胞の完全性を破壊し、アポトーシスを誘導し、炎症反応を誘発する。CagAがピロリ菌のシグナル伝達経路を阻害するには、上皮細胞がインテグリン1に直接結合する必要がある(Backert and Tegtmeyer, 2017)。宿主細胞に侵入した後、CagAタンパク質は様々なシグナル伝達分子と相互作用し、アクチン構造の再編成、炎症反応、異常な細胞増殖を引き起こす(Shakir et al., 2023)。 VacAタンパク質は、宿主細胞を突然死滅させ、複数の標的と相互作用し、免疫反応を回避する上で重要な役割を果たす孔形成毒素である。しかし、VacAは細胞膜にチャネルまたは孔を形成することで胃粘膜バリアの完全性を破壊し、透過性を高め、細胞の種類や環境条件に応じて宿主細胞のアポトーシスを制御する役割を果たす(Reyes, 2023; Foegeding et al., 2016)。VacAタンパク質はまた、貪食作用を阻害し、ピロリ菌の生存のために細胞質空胞を形成する機能も有する(Elbehiry et al., 2023; Baj et al., 2020)。VacA毒素は宿主細胞における空胞形成に寄与し、細胞の構造と機能に影響を与える(Foegeding et al., 2016)。さらに、NAP保存タンパク質はピロリ菌の胃粘膜への付着を促進し、IL-8、IL-6、TNF-αなどの炎症性物質の合成を誘導して胃粘膜を損傷する(Zhang et al., 2022)。ピロリ菌は、複雑なメカニズムを介してコロニー形成、免疫逃避、そして胃感染および病理学的変化を引き起こします。感染メカニズムは精力的に研究されていますが、細菌と宿主免疫系の相互作用の微細な制御は未だ解明されていません。 |
| ピロリ菌感染の検出方法には、便抗原検出、尿素呼気検出、組織生検の化学染色などがある(Shakir et al., 2023)。欧州、カナダ、米国、韓国のピロリ菌治療ガイドラインでは、耐性率が15%を超える地域では4剤併用療法が推奨されている一方、クラリスロマイシン耐性率が15%未満の地域では、まれではあるもののプロトンポンプ阻害薬をベースとした3剤併用療法が推奨されている(Jung et al., 2021; Deane et al., 2024)。日本では、4剤併用療法が日本人患者にとって3剤併用療法よりも優れていることを示す十分なエビデンスがないため、4剤併用療法の使用は認められていない(Cho and Jin, 2022)。フルオロキノロン系薬剤は、ピロリ菌感染症の第二選択治療として一般的に使用されており、第二選択治療を受けた患者5,055人を対象とした欧州の研究では、14日間のレボフロキサシン-ビスマス療法が最も効果的な4つのレジメンの1つであることが示されました(Nyssen et al., 2022a)。しかし、薬剤耐性と副作用のため、フルオロキノロンの臨床応用は限られています。リファブチン療法は、第二、第三、または第四選択治療としてよく使用されますが、骨髄抑制とマイコバクテリアに対する耐性のリスクを伴います(Deane et al., 2024; Gisbert, 2020)。ヨーロッパで行われた、ピロリ菌感染症の治療におけるリファブチン3剤併用療法の有効性に関する後ろ向き解析では、500人の患者を対象に、除菌率が66%~80%でした(Nyssen et al., 2022b)。抗生物質耐性は、ピロリ菌除菌率低下の主な原因の一つです。一般的な耐性メカニズムには、遺伝子組み換え薬剤の標的、膜透過性、排出ポンプシステム、バイオフィルム形成に影響を与える変異が含まれます(Hu et al., 2016; Srisuphanunt et al., 2023)。また、前述の病原性因子VacAをコードする遺伝子はメトロニダゾール耐性と関連し、CagAはレボフロキサシン耐性と関連することが明らかになっています(Wang et al., 2019)。抗生物質耐性の増加に直面している中、ピロリ菌感染症の除菌治療を根本的に改革する必要があります。この世界的な健康課題に立ち向かうために、個別化され、効果的かつ持続可能な方法を見つけることが、今後の研究の方向性です(Yamaoka, 2024)。 |
| 3.プロバイオティクスによるヘリコバクター・ピロリの抑制効果 |
| ヘリコバクター・ピロリ(ピロリ菌)感染は、腸内不快感などの症状を引き起こす可能性があり、その主な要因の一つとして腸内細菌叢の乱れが考えられています。特に、ヘモフィルス菌やストレプトコッカス菌などの病原菌は増加する一方で、フェカリバクテリウム菌、ラクトバチルス菌、アッカーマンシア菌は有意に減少することが報告されています(Li et al., 2022; Li et al., 2023)。したがって、プロバイオティクスの摂取はピロリ菌の抑制に役立ち、腸内細菌叢の調整にも役立つことが期待されます。これは、胃腸の不快感を軽減し、胃腸の健康を回復させるのに役立ちます。リモシラクトバチルス・ロイテリDSM 17648に代表される菌株は、確固たる科学的根拠を示しています。臨床的証拠の観点から、リモシラクトバチルス・ロイテリDSM 17648 は、ピロリ菌 感染症の治療における 3 剤および 4 剤療法の効果を高め、副作用を軽減することが証明されています (Liang et al.、2022)。 |
| 3.1. in vivoおよびin vitro実験 |
| Sunらは、中国東北部の発酵食品から4種類の乳酸菌株(ラクトバチルス・サケ、ラクトバチルス・プランタラム、ラクトバチルス・ラムノサス、ラクトバチルス・ブレビス)を分離し、いずれもピロリ菌の増殖を様々な程度に阻害することを明らかにした(Sunら, 2018)。ラクトバチルス・パラカゼイHP7は、in vitroおよびin vivoの両方でピロリ菌に対する阻害効果を示した。エゴマ(Perilla frutescens)およびウラル甘草(Glycyrrhiza uralensis)の抽出物と併用したところ、ピロリ菌感染マウスの胃炎および粘膜病変を軽減した(Lee and Kim, 2020)。発酵ココアジュースから分離された乳酸菌に関する研究では、65.52%の菌株がピロリ菌に対する阻害効果を示し、その一部はバクテリオシンまたは有機酸を介して作用を及ぼすことが示されました(Kouitcheu Mabeku et al., 2020)。ラクトバチルス・カゼイT1とその上清は、ピロリ菌の増殖を強力に阻害し、ピロリ菌感染による炎症や腸内細菌叢の異常を予防しました(Wu et al., 2021)。アモキシシリンおよびクラリスロマイシンにプロバイオティクスのラクトバチルス・サリバリウスLN12を加えることで、特にピロリ菌バイオフィルムに対する3剤併用療法の治療効果が向上しました(Jin and Yang, 2021)。プロバイオティクスのラクティプランティバチルス・ペントーサス SLC13はピロリ菌の増殖を阻害することが示されており、その細胞外多糖類はピロリ菌感染によって誘導されるインターロイキン8(IL-8)の発現を有意に減少させ、ピロリ菌感染および炎症軽減のための代替治療薬としての可能性を実証しています(Thuy et al., 2022)。ラクティプランティバチルス・プランタラム ZJ316は、ピロリ菌のコロニー形成の防止、毒性遺伝子のダウンレギュレーション、およびIL-8産生の減少などのメカニズムにより、in vitroおよびin vivoの両方でピロリ菌に対する阻害効果を示しました(Wu et al., 2023)。最近、Chenらは健康な胃粘膜から5つの新しい胃由来ワイツマニア・コアグランス株を単離し、その中でBCF-01が最も強い接着力とピロリ菌の増殖阻害を示しました。本株は、胃内細菌叢を効果的に回復させ、ピロリ菌による粘膜バリアの破壊を改善し、マクロファージTLR4-NFκB-ピロプトーシスシグナル伝達経路を阻害することで炎症を軽減しました(Chen Z. et al., 2024)。Xuらは、胃粘膜からラクトバチルス・パラガセリLPG-9株を単離し、in vitroおよびin vivoの両方でピロリ菌に対する優れた阻害効果を示しました。この株は、粘膜バリアタンパク質であるオクルディンおよびZO-1の発現をアップレギュレーションすることで粘膜バリアを修復し、胃炎を軽減しました(Xu et al., 2023)。Samy M et al.はピロリ菌に拮抗する様々なプロバイオティクス株のスクリーニングを実施し、ビフィドバクテリウム・ラクティスとラクトバチルス・アシドフィルスが最も高い阻害効果を示したことを明らかにしました(Abdelhamid et al., 2023)。結論として、プロバイオティクスは、特にラクトバチルス属菌において、様々なメカニズムを通じて、in vitroおよびin vivoにおいてピロリ菌に対して優れた阻害効果を示します。プロバイオティクスはピロリ菌の阻害において有望な可能性を示していますが、その広範な応用を検証するには、より多くの科学的エビデンスと臨床コホートが必要です。 |
| 3.2.関連臨床研究 |
| Yangらによるメタアナリシスでは、補助療法としてのプロバイオティクスの補充は、標準療法と比較して、除菌率(相対リスク1.10、95%信頼区間1.06~1.14)を有意に改善し、副作用の全体的なリスク(相対リスク0.54、95%信頼区間0.42~0.70)を低下させることが示されました。プロバイオティクスの中で、ビフィドバクテリウム属菌は最も高い除菌ポテンシャルを示しましたが、さらなる質の高い研究が必要です(Yangら、2024)。8,924人の患者を対象とした40の研究に基づく別の質の高いメタアナリシスでは、様々なレジメンによるプロバイオティクス治療後の除菌率は81.5%であったのに対し、対照群ではわずか71.6%でした(p < 0.001、I 2 = 52.1%)。除菌治療前および除菌治療中、特に2週間以上プロバイオティクスを使用した場合、優れた結果が得られ、ビスマス4剤併用療法とプロバイオティクスを併用した場合に最も良好な結果が得られました(Shi et al., 2019)。ラクトバチルス・アシドフィルス、ラクトバチルス・プランタラム、ラクトバチルス・ラムノサスは、ピロリ菌感染によって引き起こされる胃炎をラクトバチルス・アシドフィルスと同程度に改善することが分かっています(Asgari et al.、2020)。Saracino et al.(2020)の研究では、ラクトバチルス・カゼイ、ラクトバチルス・パラカゼイ、ラクトバチルス・アシドフィルス、ビフィドバクテリウム・ラクティス、ストレプトコッカス・サーモフィルスがピロリ菌に対して抗菌・殺菌活性を示すことが示されました。しかし、403人の患者を対象とした11の研究のメタアナリシスでは、プロバイオティクス治療(ラクトバチルスおよびサッカロミセス・ボウラディを含む)の平均加重除菌率はわずか14%(95%CI:2%~25%、p = 0.02)であることが明らかになりました(Losurdo et al.、2018)。全体として、表1(in vivo研究)に示すように、ほとんどの臨床研究では、プロバイオティクスが抗生物質によるピロリ菌の除菌率を高め、治療に伴う副作用を軽減することが示されています。ただし、同じ種類のプロバイオティクスを使用しても除菌率が向上しなかったり、副作用が軽減されなかったりする研究もあります。たとえば、ラクトバチルス・ロイテリ(n = 5)を使用した研究では、除菌率が65.22%まで上昇したという研究もあれば、有意な効果が見られなかったという研究もあります(n = 2)。これらの無効または矛盾する結果は、研究の異質性と使用された菌株の用量の違いに関連している可能性がある。 |
| 表1. ピロリ菌感染症の治療におけるプロバイオティクスの臨床試験 |
 |
 |
 |
 |
| 結論として、ピロリ菌の拮抗作用に関する現在の臨床研究は、主にラクトバチルス、ビフィドバクテリウム、サッカロミセスの特定の菌株に焦点を当てています。これらのプロバイオティクスは、ピロリ菌感染率を低下させ、胃腸症状を軽減するとともに、ピロリ菌感染に対する抗生物質治療の有効性を高めることが示されています(Baryshnikova et al., 2023)。最も広く使用されているプロバイオティクスの一つであるラクトバチルスは、ピロリ菌のコロニー形成を減少させ、胃腸の不快感を軽減することが実証されています。抗生物質と併用することで、ピロリ菌の除菌率を効果的に向上させ、治療中の副作用を軽減することができます。具体的には、ラクトバチルス・ロイテリは強力な抗菌物質を産生し、ムチンを分泌して粘膜バリアを強化することで、ピロリ菌対する有望な阻害効果を示しています(Dargenio et al., 2022; Dargenio et al., 2021)。プロバイオティクスが抗生物質の副作用を軽減する能力は、腸内細菌叢の調節に関連している可能性があります。Li et al.の解析では、胃におけるピロリ菌の増殖が消化管細菌叢の構成に影響を及ぼすことが明らかになりました(Li et al., 2023)。同様に、Bai et al.の研究結果は、プロバイオティクスが腸内細菌叢のバランスに寄与し、胃腸の不快感を軽減することを示唆していますが、除菌率を高めることができるかどうかを判断するにはさらなるデータが必要です(Bai et al., 2023)。しかしながら、上記の結論はすべて過去に発表された論文に基づいており、異なる研究間で異質性が存在する可能性があることを指摘しておくことが重要です。特に、メタアナリシスを参照する際には、研究間の異質性、出版バイアス、あるいは含まれる研究の質を十分に考慮する必要があります(Niu C. et al., 2024)。 |
| 4.プロバイオティクスによるヘリコバクター・ピロリの増殖阻害メカニズム |
| 4.1.競合排除 |
| ヘリコバクター・ピロリ(ピロリ菌)は、外膜タンパク質(OMP)などの接着因子を利用して胃粘膜に定着します。ほとんどの乳酸菌はヒトの腸管に定着しますが、一部の乳酸菌種は胃にも定着します(Ji and Yang, 2020)。プロバイオティクスは、胃上皮細胞上の接着部位をめぐってピロリ菌と競合し、その定着を阻害します。例えば、サッカロミセス・ボウラディは、主に十二指腸細胞上の ピロリ菌結合部位をセラミダーゼで修飾することにより、ピロリ菌が宿主細胞に結合するのを防ぐことができます (Czerucka および Rampal、2019)。 ラクトバチルス・ラムノサスATCC 7469、ラクトバチルス・アシドフィルスATCC 4356、および ラクトバチルス・ロイテリATCC 23272 は、ピロリ菌の胃上皮細胞への接着を阻害することがわかっています (Rezaee ら、2019)。 さらに、プロバイオティクスは、上皮接合タンパク質およびムチンの発現を変更し、粘膜バリアの損傷を保護し、ピロリ菌の定着を防ぐための活性物質を放出することができます (Qureshi ら、2019)。 |
| 4.2.胃酸環境の調節 |
| ピロリ菌が分泌するウレアーゼは尿素をアンモニアに分解し、酸性化した胃内環境を局所的に中和することで、ピロリ菌の生存を促進する。一方、プロバイオティクスは乳酸を産生するかウレアーゼ活性を阻害することでこの作用を打ち消し、胃内pHの上昇を防ぎ、胃内でのピロリ菌の生存機構を弱める。ラクトバチルス・プランタルムZJ316はピロリ菌のウレアーゼ遺伝子の発現を抑制し、ピロリ菌の定着を阻害する(Wu et al., 2023)。ラクトバチルス・アシドフィルスATCC 4356、ラクトバチルス・ロイテリATCC 23272、およびラクトバチルス・ファーメンタムATCC 9338は、8つの臨床ピロリ菌株のウレアーゼ活性を低下させることができた(Rezaee et al., 2019)。ラクトバチルス・ラムノサスGMNL-74およびラクトバチルス・アシドフィルスGMNL-185は、ピロリ菌の胃粘膜への付着を阻害し、感染による炎症を軽減する(Chen et al., 2019)。さらに、ピロリ菌は胃内酸塩基バランスを阻害し、胃酸分泌を変化させることで胃粘膜バリアをさらに弱め、消化性潰瘍やその他の病原体感染のリスクを高める可能性がある。 |
| 4.3.抗菌物質の産生 |
| プロバイオティクスは、生物学的代謝を通じて様々な抗菌物質を産生します。例えば、乳酸菌は炭水化物を代謝して酢酸、プロピオン酸、酪酸などの短鎖脂肪酸やその他の有機酸を生成します。また、乳酸菌はバクテリオシンや過酸化水素も産生し、いずれも優れた抗菌作用を示します(Kim et al., 2003; Homan and Orel, 2015)。乳酸菌によって代謝される有機酸は、胃のpHを下げるだけでなく、ウレアーゼの活性を阻害することで、ピロリ菌の増殖を阻害します(Rezaee et al., 2019)。Rezaee et al., 2019の研究では、ラクトバチルス・ロイテリATCC 23272が抗菌酸を産生することでピロリ菌の増殖を阻害できることが確認されました。最近の研究では、ワイツマニア・コアグランス BC99 が吉草酸などの腸内細菌叢由来の代謝産物を調節することで、ピロリ菌感染後の炎症と酸化ストレスを改善することが実証されています (Zhai et al., 2024)。プロバイオティクスによって生成される過酸化水素は、過酸化物イオンの生成を誘導して ピロリ菌の活動を阻害することで、ピロリ菌細胞の酸化ダメージを引き起こす可能性があります (Ji and Yang, 2020; Bai et al., 2022)。ピロリ菌自体の抗酸化システムでは、スーパーオキシドディスムターゼなどの酵素を生成して宿主の免疫応答に対抗することができます (Bereswill et al., 2000)。バクテリオシンは ピロリ菌の細胞壁と細胞膜の構造を破壊することができます。Hu et al. (2021)は、ラクトバチルス・プラジョミPW-7によって産生される細胞外多糖類がピロリ菌の増殖を効果的に阻害し、細胞膜の完全性を損なうことを報告した。 |
| ピロリ菌をラクトバチルス・ガセリの上清代謝物と共にインキュベートすると、耐酸性関連遺伝子arsSと鞭毛調節遺伝子flgRのダウンレギュレーションが起こり、ピロリ菌の活性が低下した。さらに、ピロリ菌の鉄吸収調節遺伝子もダウンレギュレーションされた。抗菌ペプチドLL-37に対する感受性が大幅に増加した(Zuo et al., 2022)。結論として、プロバイオティクスはさまざまな抗ピロリ菌抗生物質を生産することができるが、どの物質が主要な役割を果たしているか、複数の物質が相乗効果を持っているかどうかは、さらなる同定と実験的検証が必要である。合成生物学の活発な発展に伴い、今後の研究では、red / ETを介した相同組換えや形質転換関連組換えなどのクローニング戦略を用いて、拮抗的なピロリ菌を持つプロバイオティクス代謝物を合成することが考えられる(Alam et al., 2021)。 |
| 4.4. 免疫調節作用 |
| ピロリ菌感染後の持続的な炎症反応は、炎症性疾患を誘発する可能性がある(de Brito et al., 2019)。プロバイオティクスによる宿主免疫系の調節は、ピロリ菌の免疫逃避を減少させるのに役立つ。プロバイオティクスは、樹状細胞を調節してB細胞による免疫グロブリンA(IgA)産生を誘導することにより、ピロリ菌の慢性感染に対する宿主の抵抗性を高める(Dash et al., 2024)。ヒトの胃から分離されたラクトバチルス・ガセリKx110A1は、宿主マクロファージ上の腫瘍壊死因子α(TNF-α)変換酵素の発現を阻害し、結果としてTNF-αおよびインターロイキン-6(IL-6)の放出を減少させる(Gebremariam et al., 2019)。 IL-8は好中球および単球の粘膜への遊走を誘導します。ラクトバチルス・プランタルムZJ316は、ピロリ菌感染時の免疫細胞の浸潤およびIL-8産生を阻害することで、宿主を炎症性傷害から保護します(Wu et al., 2023)。研究結果によると、プロバイオティクスは抗炎症性サイトカインであるインターロイキン-10(IL-10)の発現を増強する可能性があることも示唆されています(Zhao et al., 2018)。Park et al.(2020)の研究では、ラクトバチルス・プランタルムAPSulloc 331,261を投与したマウス群は、ピロリ菌感染群と比較して、TNF-α、インターロイキン-1β(IL-1β)、インターロイキン-4(IL-4)などの炎症性サイトカインの顕著なダウンレギュレーションを示したことが実証されました。ラクトバチルス・プランタルムZJ316は、インターフェロンγおよびIL-6の発現を有意に低下させ、IL-10の発現を上昇させ、粘膜損傷を修復することで、ピロリ菌の菌数を減少させ、ピロリ菌感染による胃炎を軽減することが示されました(Zhou et al., 2021)。ラクトバチルス・アシドフィルスNCFMおよびラクトバチルス・プランタルムLp-115は、ピロリ菌の除菌率を向上させ、胃炎を軽減しました。この結果は、免疫調節プロセス(IL-8やTNF-αなどのサイトカインの発現低下)と関連しています(Shen et al., 2023)。ラクトバチルス・ファーメンタムUCO-979Cは、胃の自然免疫応答を調節することでピロリ菌感染に対する抵抗性を高め、感染マウスの胃粘膜におけるTNF-α、IL-8、単球走化性タンパク質1(MCP-1)のレベルを有意に低下させ、インターフェロン-γ(IFN-γ)およびIL-10の発現を増加させます(Garcia-Castillo et al., 2020)。ラクトバチルス・ガセリATCC 33323は、ピロリ菌に感染したヒト胃腺がん細胞におけるIL-8の分泌を阻害し、Bcl-2、β-カテニン、インテグリンα5、インテグリンβ1などの遺伝子のmRNA発現を有意に低下させます(Yarmohammadi et al., 2021)。ラクトバチルス・ラムノサス JB3は、ピロリ菌感染AGS細胞において、IL-8分泌、vacA、sabA、fucTのmRNAレベル、およびLewis (Le)x抗原とToll様受容体4(TLR4)の発現を抑制する(Do et al., 2021)。生菌および低温殺菌菌のラクトバチルス・クリスパタスRIGLD-1株は、AGS細胞においてIL-1β、IL-6、IL-8、TNF-αのmRNA発現を抑制し、IL-10および形質転換成長因子ベータ(TGF-β)サイトカインの発現を上昇させることで、ピロリ菌誘発性炎症を制御する(Fakharian et al., 2023)。Lin et al. (2020)は、複数の乳酸菌種がピロリ菌感染マウスの免疫応答と代謝バランスに及ぼす影響を調査しました。その結果、複数の乳酸菌種の介入により、血清中のアラニン、アルギニン、アスパラギン酸、グリシン、トリプトファンの濃度が回復し、酪酸、吉草酸、パルミチン酸、ステアリン酸、オレイン酸の含有量が増加することが示されました。これらは免疫と代謝に関連する重要な指標です(Lin et al., 2020)。 |
| 結論として、プロバイオティクスは宿主の胃粘膜における免疫細胞の活性化を促進し、IL-10やIgAなどのサイトカインの分泌を増加させ、宿主の免疫防御機能を高めます。さらに、乳酸菌やビフィズス菌などのプロバイオティクスは、自然免疫の調節、免疫応答の増強、粘膜バリアの強化を通じて、ピロリ菌の除去にも役立ちます。 |
| 4.5.胃の微生物生態系の制御 |
| GEOのデータ解析により、健常者とピロリ菌感染者の間で微生物叢に有意な差があることが明らかになりました。さらに、ピロリ菌感染と有意に負の相関を示し、ピロリ菌陰性群で特に多くみられる11の細菌集団が同定され、その大部分はラクトバチルス属やエンテロコッカス属などのプロバイオティクス属でした(Chen Z. et al., 2021)。腸内微生物叢と比較して、胃の微生物叢は密度が低く、特異性が低く、変動が大きいという特徴があります。健常成人の胃の微生物生態系における細菌数は大きく異なり、地域、文化、食習慣など多くの要因の影響を受ける可能性があります(Xu et al., 2022; Stewart et al., 2020)。He et al.はラクトバチルス・サリバリウスとラクトバチルス・ラムノサスの組み合わせは、ピロリ菌感染群の胃腸内微生物生態を改善できることがわかった。特に、ピロリ菌によって引き起こされた腸内の抗炎症細菌であるフェカリバクテリウムの減少が回復し、炎症性浸潤と前癌病変の発生率が減少した(He et al., 2022)。プロバイオティクスの補給は胃内細菌叢の構造を調節することもでき、胃内微生物生態の回復はピロリ菌の除菌に関連していると考えられている(Nabavi-Rad et al., 2022)。ピロリ菌感染症の治療における抗生物質の4剤併用療法は、胃腸微生物生態障害を悪化させる可能性がある。プロバイオティクスは、様々なメカニズムを通じて腸内細菌叢のバランスを回復させ、除菌率を向上させ、副作用の発生を減少させます(Xu et al., 2022)。結論として、プロバイオティクスは、胃pHの調節、抗菌物質の分泌、免疫反応の刺激、そして腸内細菌叢の調節を通してピロリ菌の定着を阻害し、消化器疾患の発生と進行に重要な役割を果たします(図4)。 |
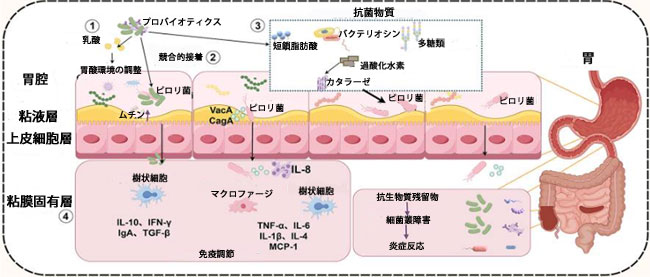 |
図4 プロバイオティクスがピロリ菌を抑制するメカニズム。 プロバイオティクスは、胃のpH値の変化(①)、ピロリ菌との競合的接着(②)、抗菌物質の分泌(③)、抗炎症因子の分泌増加と炎症誘発因子の分泌減少(④)によって胃腸内微生態環境を改善し、それによってピロリ菌感染を減弱させ、関連する合併症を軽減します。 略語:SCFAs、短鎖脂肪酸、IL-10、インターロイキン-10、IFN-γ、インターフェロン-ガンマ、IgA、免疫グロブリンA、TGF-β、形質転換成長因子ベータ、TNF-α、腫瘍壊死因子-α、IL-6、インターロイキン-6、IL-1β、インターロイキン-1β、IL-4、インターロイキン-4、MCP-1、単球走化性タンパク質-1。 VacA、空胞化細胞毒素)、CagA、細菌毒素関連遺伝子 A。(figdraw より)。 |
| 5.結論と今後の展望 |
| 本レビューでは、ピロリ菌感染のメカニズムとその予防・治療戦略を体系的にまとめ、特にピロリ菌感染管理におけるプロバイオティクスの役割に関する最新の研究成果に焦点を当てています。プロバイオティクスがピロリ菌の増殖を抑制するメカニズムと、今後の研究の方向性に重点が置かれています。多くの研究で、プロバイオティクスの補給がピロリ菌感染の予防と治療に有益であることが示されています。しかし、ピロリ菌除菌におけるプロバイオティクス療法の有効性は一貫しておらず、除菌率も低いことが知られています。これは、腸管由来のプロバイオティクスの定着を阻害する特殊な胃内環境に起因すると考えられます。したがって、酸性の胃内環境に耐え、ピロリ菌を効果的に除菌できるプロバイオティクスを特定することが不可欠です。自己プロバイオティクスは微生物療法における有望な新しいアプローチと考えられており、ピロリ菌の阻害に優れた有効性を示していますが、大規模な多施設ランダム化比較試験によるさらなる検証が依然として必要です(Baryshnikova et al., 2023)。プロバイオティクスは特定の状況(例:抗生物質関連下痢症および特定の種類の炎症性腸疾患)において有益であることが示されているものの、健康な個人におけるピロリ菌の補助療法としての日常的な使用は、強力な臨床的エビデンスによって裏付けられていません。ピロリ菌感染症の治療におけるプロバイオティクスの有効性に関する不確実性を考慮すると、いくつかのメタアナリシスでは矛盾する結論に達しています。マーストリヒトVI/フィレンツェコンセンサスレポート(2021)は、有効性に関する臨床的エビデンスに一貫性がないため、日常的なプロバイオティクスの補給は推奨していません(Malfertheiner et al., 2022)。アメリカ消化器病学会の2020年のガイドラインでも、プロバイオティクスはほとんどの胃腸疾患には推奨されないとされています(Su et al.、2020)。 |
| プロバイオティクス治療は、便秘の悪化や膨満感などの副作用を引き起こす可能性があり、その安全性プロファイルについては更なる調査が必要です。さらに、エンテロコッカス属菌は食品や飼料に広く使用されていますが、毒性因子を保有し、固有の抗菌薬耐性を持つことから、安全性に関する重大な懸念が生じています。注目すべきことに、エンテロコッカスは米国FDAのGRASリストおよびEUのQPSリストから除外されています(Franz et al., 2011)。したがって、プロバイオティクス使用の安全性に関する規制面では、菌株の同定と説明、製造工程と品質管理、臨床試験と有効性の検証、安全性評価、明確なラベル表示と指示、そして継続的なモニタリングとフィードバックの仕組みをさらに改善する必要があります。 |
| しかしながら、抗生物質療法で重篤な副作用を経験した患者や抗生物質の選択肢が限られている患者、そして感受性の高い腸内細菌叢を持つ患者にとって、プロバイオティクス療法は有望な代替療法となります。今後の研究では、症状のある感染者と無症状の感染者を区別し、特定のプロバイオティクスまたはその発酵産物を選択し、広く研究されている菌株を活用し、実験プロトコル(投与量、投与期間、臨床エンドポイントを含む)を標準化し、プロバイオティクス介入の長期的効果を評価する必要があります。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Front Pharmacol. 2025 Jul 11;16:1620870.に掲載されたBeyond antibiotics: probiotics as a promising ally against Helicobacter pylori.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |