
Remo Poto et al., |
要約 |
| 食物アレルギーは、欧米諸国で有病率が増加しており、公衆衛生上の懸念が高まっています。ヒトの腸内細菌叢のバランスと腸管バリアの健全性が食物アレルギーの発症に関与している可能性を示唆するエビデンスが増えています。工業化や高度に加工された食品の摂取といった環境要因は、腸内細菌叢と腸管バリアを変化させ、アレルギー感作に対する感受性を高める可能性があります。腸内細菌叢の組成および機能の変化も食物アレルギーと関連しています。さらに、腸管バリアの透過性が高まると、アレルゲン分子が転座し、Th2免疫応答が誘発されます。前臨床および臨床研究では、プロバイオティクス、プレバイオティクス、ポストバイオティクスが、腸管バリア機能の強化と健全な腸内細菌叢の回復を促進することで、食物アレルギーの予防と治療に有効であることが示唆されています。最後に、糞便微生物移植は、食物アレルギーを予防する有望な治療戦略として、実験研究と臨床研究の両方で現在検討されています。本レビュー論文では、食物アレルギーの発症における腸管透過性と腸内細菌叢の複雑な相互作用を探求し、潜在的な治療戦略を提示することを目的としています。 |
| 目次(クリックして記事にアクセスできます) |
| 1. 食物アレルギーにおけるリーキーガットと腸内細菌叢の概要 |
| 1.1. 腸内細菌叢 |
| 1.2. 腸管バリア |
| 1.3. 食物アレルギー |
| 1.4. リーキーガット |
| 1.5. リーキーガット、腸内細菌叢、そして食物アレルギーへの影響 |
| 2. 食物アレルギーにおける腸管バリアの完全性とマイクロバイオームの回復のための治療介入 |
| 2.1. 食事、プレバイオティクス、短鎖脂肪酸 |
| 2.2. プロバイオティクス、次世代プロバイオティクス、およびポストバイオティクス |
| 2.3. 糞便微生物移植 |
| 3. 結論 |
| 本文 |
| 1. 食物アレルギーにおけるリーキーガットと腸内細菌叢の概要 |
| 1.1. 腸内細菌叢 |
| 「腸内細菌叢」とは、腸内に生息する細菌、真菌、ウイルス、寄生虫などを含む複雑な微生物群を指します[1]。フィルミクテス門、バクテロイデス門、放線菌門、プロテオバクテリア門の4つの主要門が、細菌叢全体の90%以上を占めています[2]。腸内細菌叢の構成は部位によって異なり、年齢、食事、習慣、薬物使用など、非常に多くの要因によって非常に動的に変化します[3,4,5,6]。腸内細菌叢は、ヒトの健康と疾患において重要な役割を果たしています。腸内細菌叢の組成や構造の変化は、一般的にディスバイオシス(腸内毒素症)と定義され、疾患につながる可能性があります。健康な腸内細菌叢は、腸管上皮細胞への栄養作用、腸管バリアの完全性の維持、病原細菌の付着防止、ビタミンの生成などを通じて、腸の健康の促進と維持に役立ちます[7,8,9]。腸内細菌叢は体の他の部位ともつながっており、複雑な代謝系への影響を及ぼし[10,11,12]、いわゆる腸-脳軸によって神経系とも相互作用します[13,14]。 |
| 食物アレルギーの病因における腸内細菌叢の役割を裏付けるエビデンスが増加している[15]。第一に、腸内細菌叢は腸管バリアの完全性を維持するだけでなく、腸内炎症性微小環境の調節にも役割を果たしている。さらに、プレバイオティクスやプロバイオティクスから糞便細菌叢移植(FMT)に至るまで、腸内細菌叢の調節は、有病率と社会的影響が日々増大している疾患の治療において、これまで知られていなかった新たな可能性を切り開きつつある[16,17,18]。 |
| 1.2. 腸管バリア |
| 腸管バリアの主な機能は、栄養素や水分の吸収を促進すると同時に、毒素や病原体などの有害物質が腸管上皮を通して下層組織に侵入するのを防ぐことです[19]。さらに、腸管バリアは、腸管から侵入する潜在的に有害な物質から私たちを守り、吸収できる物質とブロックすべき物質を主に制御することで、体全体の健康と体力を維持する上で重要な役割を果たしています[20]。 |
| 腸管バリアは複数の成分から構成されています。外層には様々な細胞外成分が含まれており、その主役は粘液層です。これは高度にグリコシル化されたムチンタンパク質、すなわちMUC2で構成されています[21]。粘液層には「攪拌粘液層」と呼ばれる外層があり、分泌型免疫グロブリンA(sIgA)と抗菌産物の存在により、第一線の防御として機能します[22]。また、「非攪拌粘液層」または「グリコカリックス」と呼ばれる内層もあり、主に栄養吸収と上皮保護、および細胞の再生と分化に役立っています[23]。腸管バリアは、腸内細菌叢や、プロテアーゼ、リパーゼ、アミラーゼ、ヌクレアーゼなどの消化酵素を含む細胞外要素からも構成されています[24]。腸管バリアの内層は上皮細胞から構成され、これらの細胞は凝集性かつ極性を持った単層を形成し、分子の通過を厳密に制御する。この分子は、後述する接合複合体を介して消化機能と免疫機能の両方を担っている[25]。腸管バリアは主に腸管上皮細胞から構成されているが、杯細胞、パネート細胞、腸管クロム親和性細胞、M細胞も存在する。これらの要素の再生に重要な多能性幹細胞は、リーベルキューン陰窩内に存在している[26]。これらの2層の下には粘膜固有層があり、そこには腸管関連リンパ組織(GALT)[27]、結合組織、そして運動機能と分泌機能を制御している筋層(アウエルバッハ神経叢)と粘膜下(マイスナー神経叢)からなる腸管神経系を構成する自然免疫細胞と獲得免疫細胞が含まれている[28]。分子が上皮層を通過できる主な経路は3つあります。細胞間の細胞間空間を通過する物質の通過を可能にする細胞間経路、キャリアタンパク質の助けを借りて物質が輸送されるキャリア媒介経路、および物質が細胞を通過する細胞間経路です[29]。 |
| 隣接する細胞の細胞膜間の特殊な接触領域は、細胞間接合として知られています。細胞間接合には主に3つの種類があります。タイトジャンクションは、上皮細胞全体にわたる濃度勾配の形成と維持を可能にする閉塞接合です[30]。アンカージャンクションは、細胞が他の細胞または基質に接着することを促進し、組織全体にわたる局所的な張力を分散させます[31]。GAPジャンクションは、隣接細胞間のコミュニケーションを促進し、密接に結合した細胞間でのイオンや小分子の交換を可能にします[32]。 |
| 1.3. 食物アレルギー |
| 食物アレルギーは、通常は無害な食物タンパク質抗原によって引き起こされる病的な免疫反応です[33]。その有病率は毎年増加しており[34]、成人では5%、小児では8%と推定されています[35]。しかしながら、医療制度への多大なコスト[36]、患者の私生活および社会生活への影響、そして新たな治療法の可能性に関する知見により、食物アレルギーは関連性が高く、常に注目されているトピックとなっています。 |
| 食物アレルギーは、食物不耐症とは区別する必要がある。なぜなら、これらの状態では免疫系が関与していないからである。一方、セリアック病は、通常、食物アレルギー性疾患として分類されないからである[33]。食物アレルギーは、その免疫病原性経路に従って3つのカテゴリーに分類することができる。IgE媒介食物アレルギーグループでは、食物抗原が既に形成されたIgEに結合し、肥満細胞および好塩基球の脱顆粒を伴う1型過敏症反応を誘発し、その結果、通常は数分以内に症状が急速に出現する[37]。IgEを媒介しないグループは、アレルゲン特異的Tヘルパー2細胞の作用を特徴とし、症状はより遅れて現れる[38]。最終的に、混合食物アレルギーは、IgE依存性およびIgE非依存性経路が共存する3番目のグループを形成する。この種のアレルギーに罹患している患者は、通常、好酸球性食道炎などの好酸球性胃腸障害に罹患します[33]。 |
| 食物アレルギー反応は、食物特異的IgEの存在として定義される、過去の感作が既に起こっている場合にのみ起こり得る[39]。通常の状態では、腸管バリアに到達した抗原は直接通過することができない。しかし、杯細胞やCX3CR1マクロファージなどの細胞性メカニズムによって腸管バリアを通過し、抗原は樹状細胞やリンパ節へと輸送され[40,41]、ナイーブT細胞から食物抗原特異的制御性T細胞への分化が促進される[42]。上皮バリアが損傷すると、抗原だけでなく病原体も自由に通過できるようになり、IL-25、IL-33、胸腺間質性リンパ球形成因子(TSLP)などの炎症誘発性分子が放出されます。これらの分子は、ナイーブT細胞のT H2細胞への分化、IgEクラススイッチ、そして肥満細胞と好酸球の組織内蓄積を促進します[43,44,45]。感作が起こると、特定の食物抗原に対するアレルギー反応が起こり、皮膚発疹から持続性下痢、そして致命的なアナフィラキシーに至るまで、様々な症状が現れます[37]。 |
| 腸内細菌叢は、感作の複雑なメカニズムにおける主要な因子の一つである[46,47]。微生物多様性の低さと腸内細菌科/バクテロイデス科比の上昇は、小児におけるその後の食物感作と関連しており[48]、帝王切開で生まれた小児(母親の膣内細菌叢を受け継がない)はアレルギー疾患のリスクが高いことが知られている[49]。さらに、短鎖脂肪酸(SCFA)などの細菌代謝物も関与している。短鎖脂肪酸は細菌発酵の最終産物であり、主にフィルミクテス属によって生成され、その中で最も関連性の高いものは酪酸とプロピオン酸である[50]。これらの分子は抗炎症作用を発揮し、上皮バリアの完全性を改善して食物アレルゲンに対する感作の可能性を低減する[51,52]。 |
| 現在、食物アレルゲンの回避とアレルギー反応の治療は、食物アレルギー管理におけるマイルストーンであり続けています[53]。しかしながら、免疫療法は真の「根治的」治療の可能性を開きました[54,55]。また、ピーナッツなどの特定の食品を早期に摂取するなどの予防戦略もますます実践されつつあります[56,57]。これらの知見の中で、腸内バリアにおける重要な役割を担う微生物叢の役割は、これらの疾患の新たな研究分野および治療法として浮上しています。次章では、食物アレルギーの病態生理における微生物叢の関与、そしてその調節がこれらの疾患をどのように緩和できるかについて、より深く探っていきます。 |
| 1.4. リーキーガット |
| 「リーキーガット」とは、腸管バリアの弱体化または破壊状態を指し、通常は腸腔内に留まる物質が腸壁を通過して血流に入る状態を指します[58]。腸管バリアの破壊と血中毒素濃度の上昇は、局所的および全身的な影響を及ぼします[59,60]。まず、腸管粘膜固有層におけるToll様受容体(TLR4)の経路を介した免疫活性化の増加が報告されており、そのリガンドは主にリポ多糖(LPS)です[61]。リポ多糖がその受容体TLR4に結合することで、NF-κB経路が活性化され、炎症性サイトカインの濃度が上昇します[62]。この炎症性環境は、肝臓、脂肪組織、筋肉などの様々な臓器における免疫細胞量を増加させ、インスリン抵抗性を増強し[63]、動脈硬化のプロセスを促進します[64]。 |
| 腸管透過性の増加には、食事、炎症性腸疾患(IBD)、肝硬変とその合併症、火傷[65]、アルコール[66]など、様々な病態生理学的経路[67]を介した多くの要因が関与します。日常の食生活における特定の変化は、腸管透過性を変化させる可能性があります。ビタミンD受容体の減少は、タイトジャンクションの形成に関与するタンパク質であるクローディン2のダウンレギュレーションを引き起こし、腸管のリークを増加させます[68]。 |
| さらに、食物繊維の欠乏は、腸内細菌叢が宿主の粘液糖タンパク質を餌とすることを可能にし、粘膜上皮バリアを破壊し、腸管透過性を増加させます[69]。さらに、飽和脂肪酸を多く含む食事は、ラクトバチルス属細菌の量を減少させる一方で、オシロスピラ科細菌の数を増加させます。これは、バリア形成タンパク質であるゾヌリン-1(ZO-1)のmRNA発現と負の相関関係にあり、リーキーガット状態を引き起こします[70]。 |
| 炎症性腸疾患は腸管バリアの破壊により、著しい腸漏れを特徴とする[71,72]。炎症性腸疾患患者はタイトジャンクション数の減少とその構造の質的変化の両方を経験するとともに[73]、腸細胞の種類の変化を呈する。まず、炎症性腸疾患患者の上皮では杯細胞数の減少が観察され、これらの細胞は少量の粘液も産生する[74]。さらに、パネート細胞はリーベルキューン陰窩だけでなく結腸粘膜にも見られ、大腸での保護タンパク質の分泌が増加する[75]。この腸の炎症状態と腸管バリアの破壊は、血液循環における物質の通過の変化をもたらし、全身性炎症誘発性状態につながる[76]。 |
| 腸管透過性は肝疾患、特に肝硬変において変化します[77]。腸と肝臓は門脈循環によって密接な関係にあるため、大量の病原体関連分子パターン(PAMP)が肝臓に到達し、炎症を増強させ、肝疾患の進行を早めます[78]。肝硬変患者では、細菌学的プロファイリングが異なり、プロテオバクテリア門とフソバクテリア門の細菌が増加し、バクテロイデス門の細菌が減少します[79]。 |
| 腸内細菌叢のこれらの変化は、腸管透過性の低下に加えて、肝臓の炎症を促進し、それが病気を悪化させ、特発性細菌性腹膜炎(SBP)[80]や肝性脳症[81]などの合併症を引き起こします。 |
| このように、リーキーガットは多くの疾患の病因において重要な役割を果たしており、その多くは自己免疫疾患、あるいは炎症性腸疾患、セリアック病、自己免疫性肝炎、多発性硬化症といった免疫学的要素を伴う疾患である[71,82,83,84]。炎症誘発性分子の放出と上皮損傷は、これらの疾患の本質的にすべてに共通する因子である[85]。特に、食物アレルギーの炎症経路は他の疾患とは異なり、Th2経路とIL-4やIL-13といった関連サイトカインの過剰活性化を特徴とする。これについてはさらに説明されている[86]。 |
| 1.5. リーキーガット、腸内細菌叢、そして食物アレルギーへの影響 |
| リーキーガットは、食物アレルギーの発症に潜在的に関与していることから、大きな関心を集めています。「上皮バリア仮説」は、腸管バリアの機能不全が環境因子に対する感受性を高め、アレルギー疾患の感作および発症に寄与する可能性があると仮定しています[87]。この仮説は、リーキーガットとしばしば関連する腸管の完全性の変化が、観察されている食物アレルギーの有病率の上昇に何らかの役割を果たしている可能性を示唆しています[88]。工業化や超加工食品(UPF)の摂取といった環境因子や生活習慣因子は、腸管バリアの完全性を破壊する一因となっていると考えられています[87]。これらの外的因子は外部エクスポソームを構成し、腸内細菌叢と上皮バリアに影響を与え、アレルギー疾患の発症に重要な役割を果たします[89]。 超加工食品に含まれる食品乳化剤(ポリソルベート20および80など)は、腸管上皮の完全性に有害な影響を及ぼす[90]。超加工食品中の抗酸化物質およびビタミンの含有量の低下は、アレルギー性疾患に対する感受性を高めると考えられている[89]。さらに、終末糖化産物(AGE)への曝露量の増加が脂肪酸の有病率の増加と関連している可能性があるという仮説もある[91]。 |
| 上皮バリアが損なわれると、免疫反応が誘発され、アラーミンとして知られる炎症性メディエーターの放出につながる可能性があります[92]。アラーミンは、胸腺間質性リンパ球形成因子(TSLP)、インターロイキン33(IL-33)、IL-25などの上皮由来サイトカインであり、細胞ストレスや感染によって引き起こされる細胞損傷に反応して放出されます[93,94,95]。これらのサイトカインは腸管上皮の恒常性維持に重要な役割を果たす一方で、Tヘルパー2(図1 [96,97,98,99,100,101,102,103])および2型自然リンパ球細胞[99,104,105,106,107,108,109,110]を活性化することで、アレルギー誘発性の微小環境を促進することもあります。 |
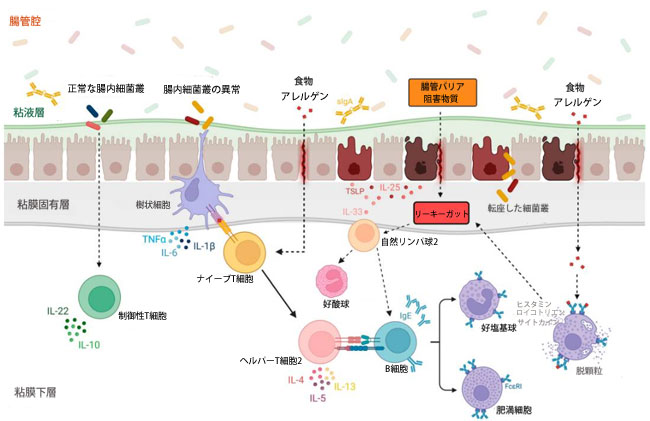 |
図1 食物アレルギーの発症における腸内細菌叢とリーキーガットの役割。 生理的条件下では、腸内細菌叢はTリンパ球から制御性T細胞への分化を促進し、腸の免疫寛容につながる[96]。一方、リーキーガットバリアと腸内細菌叢異常の状況下では、胸腺間質性リンパ球形成因子(TSLP)、インターロイキン33(IL-33)、IL-25などの上皮由来サイトカインが、様々な腸内バリア破壊因子への反応として放出される[97,98]。これらのアラーミンは、Tヘルパー2(Th2)と2型自然リンパ球(ILC2)を活性化することでアレルギー誘発性の微小環境を促進し、炎症誘発性サイトカイン(IL-4、IL-5、IL-13など)の放出につながる[95]。さらに、腸内細菌叢のディスバイオティックはTh2細胞の分化を誘導し、B細胞のIgEクラススイッチプロセスを促進する[100]。リーキーガットによっても好まれる特定の食物アレルゲンに対する感作後、アレルゲン特異的IgE抗体は好塩基球および肥満細胞の表面に固定化される。その後アレルゲンにさらされると、これらの細胞はヒスタミンおよびその他の炎症性メディエーター(ロイコトリエンおよび2型サイトカインなど)を放出し[101,102]、腸管透過性を悪化させ、2型炎症を増幅させる[103]。 略語:FcεRI、高親和性IgE受容体、IL、インターロイキン、IgE、免疫グロブリンE、ILC2、自然リンパ球2、Th0、ナイーブT細胞、Th2、ヘルパーT細胞2、Treg、制御性T細胞。 TLSP、胸腺間質リンパ球形成因子、sIgA、分泌型IgA。 |
| マウスおよびヒトを対象とした複数の研究では、腸管バリアの透過性亢進と食物アレルギーとの関連が指摘されている[111,112,113,114,115,116]。この透過性亢進により、食物タンパク質、毒素、微生物産物などのアレルゲン分子が腸管上皮を通過し、腸管関連リンパ組織の免疫細胞と相互作用する可能性がある[117]。その結果、異常な免疫反応が誘発され、アレルゲン特異的免疫グロブリンE(IgE)抗体の産生と、それに続く肥満細胞および好塩基球の活性化につながる。アレルゲンに再曝露されると、IgE抗体は肥満細胞および好塩基球の表面に結合し、プロテアーゼやヒスタミンなどの炎症性メディエーターを放出する[95,118]。この免疫反応は腸管透過性にも影響を与え、アレルゲン通過の増加は即時型過敏反応を通じて炎症反応を持続させます。実際、アレルギー反応中に腸粘膜バリア機能が損なわれると、腸管透過性が亢進する可能性があります[119,120,121]。 |
| 上皮バリアの破綻は、Th2免疫応答または肥満細胞の活性化によって引き起こされる過剰な反応によって引き起こされる可能性があります。IL-4やIL-13などの2型サイトカインは、腸管上皮細胞の透過性に直接影響を与えることが示されている[86,122,123]。これらのサイトカインは、上皮透過抵抗を低下させ、上皮を通過する高分子の移動を増加させます[86,122]。また、タイトジャンクションタンパク質の発現にも影響を与え、透過性の向上につながります[124]。感作マウスでは、オボアルブミン(OVA)がタイトジャンクション透過性の調節に重要な役割を果たすゾヌリン(ZO)-1の発現をダウンレギュレーションします[125,126]。 |
| 腸管バリアが損なわれて「漏れやすい」状態になると、腸管上皮層の透過性が高まります [127]。つまり、摂取した食物中のアレルゲンタンパク質がこの損なわれたバリアを通過して血流に入る可能性が高くなります。いくつかの研究により、食物アレルギー患者はアレルゲンを輸送するための独特の細胞透過促進輸送経路を持っていることが実証されています [127]。このタンパク質の取り込みは特異的かつ完全に細胞を透過するもので、アレルゲン曝露から数分以内に起こり、IgE/CD23複合体によって促進されることが実証されています [128,129,130]。対照的に、健康な人はタンパク質取り込みの主な経路として腸管上皮細胞を介したトランスサイトーシスに依存しています [131,132]。さらに、食物アレルギー患者では、肥満細胞からのメディエーターの放出により、傍細胞経路を介したアレルゲン輸送が増強されることが観察されています [127]。 |
| 心理的ストレスや肥満細胞の活性も、腸管バリアの欠陥や腸管感作に関与している可能性がある[133]。しかし、腸管バリアの機能不全が食物アレルギー感作の主な開始因子であるかどうかはまだ明らかではない[134]。最近の研究では、消化管細菌感染がマウスの食物抗原に対する経口耐性を潜在的に破壊する可能性があることが示唆されている[135]。この破壊は食物抗原に対する適応免疫応答を誘発し、腸管透過性の亢進と、その後同じ抗原に曝露された際の異常な疼痛シグナル伝達を引き起こす可能性がある[135]。透過性の変化とアレルギー感作の間の事象の順序を決定するには、実験モデルとプロテアーゼ活性を持つ抗原を用いたさらなる研究が必要である。 |
| 新たな証拠は、腸内細菌叢の構成的および機能的変化(ディスバイオシスとも呼ばれる)が、他の疾患と同様に、食物アレルギーの発症および進行に寄与していることを示唆している [82,136,137,138]。無菌マウスを使用した初期の研究では、食物アレルギーの調節における腸内細菌叢の重要性について最初の洞察が得られました。これらの研究では、無菌マウスは食物アレルゲンに対する経口耐性を達成できず、腸内細菌叢の再構成による経口耐性の誘導は新生仔マウスでのみ可能であることが示されました [139]。最近の研究では、食物アレルギー患者の腸内細菌叢を無菌マウスに移すと、食物アレルギーに対する感受性が伝達されることがさらに示されています [140,141]。一方、食物アレルギー乳児ではなく健康な乳児の細菌を定着させた無菌マウスは、牛乳アレルゲンに対するアナフィラキシー反応から保護されました [141]。クロストリジウム目やラクトバチルス目を含む複数の微生物群が食物アレルギーに関与し、有益な効果を示している。同様に、バクテロイデス目や腸内細菌目も有益な効果と有害な効果の両方を持つことが報告されている[142]。ヒトを対象とした観察コホート研究でも、食物アレルギーの有無による腸内細菌叢の構成の違いが明らかにされており、異なる微生物叢プロファイルが食物アレルゲン耐性に異なる影響を及ぼす可能性が示唆されている[143,144,145]。さらに、これらの研究における腸内細菌叢の直接プロファイリングにより、食物アレルギー罹患者では食物アレルギー発症前に微生物バランスの乱れを特徴とするディスバイオーシス(腸内細菌叢の乱れ)が発生することが明らかになっている。 |
| 微生物叢と宿主の相互作用は、免疫系の調節において重要な役割を果たしている。腸内微生物叢と脂肪酸産生の相互作用は、微生物が食物アレルゲン耐性に及ぼす免疫調節作用を介して起こると考えられている[146]。腸内微生物叢は、レチノイン酸オーファン受容体γT(ROR-γt)+制御性T細胞を誘導することで耐性を促進し、これは酪酸などの短鎖脂肪酸の微生物産生によって促進される可能性がある[147]。さらに、腸内微生物叢は、腸管免疫細胞によるIL-22の産生を刺激することで食物抗原に対するアレルギー感作を予防し、腸管上皮の完全性を改善し、免疫系とアレルゲンの相互作用を減少させる可能性がある[148]。 |
| 幼少期の腸内細菌叢へのダメージは、レチノイン酸オーファン受容体γT +制御性T細胞(Treg)の分化を阻害し、食物抗原に対する経口耐性の発達を阻害します。特に、この免疫応答の異常は、腸内細菌叢へのIgA結合の減少とIgE結合の増加を特徴とし、抗菌抗体反応の障害を示しています。さらに、食物抗原に対する濾胞性ヘルパーT細胞(Tfh)反応が発達し、アナフィラキシー反応を引き起こす可能性のある高親和性IgE抗体の産生を促進します。 |
| リーキーガット、腸内細菌叢、そして食物アレルギーの複雑な相互作用を理解することは、予防および治療戦略に重要な意味を持ちます。腸管バリアの完全性を回復し、腸内細菌叢の構成と機能のバランスを整える治療介入は、食物アレルギーの症状改善に有望です。特定のプロバイオティクス株、プレバイオティクス、シンバイオティクス、ポストバイオティクス、そして食生活の改善といったアプローチは、前臨床研究および臨床研究において、健全な腸内細菌叢の促進、腸内バリア機能の強化、そして免疫応答の調節によって食物アレルギーのリスクを低減し、既存のアレルギーの管理を改善する可能性を示しています。 |
| 2. 食物アレルギーにおける腸管バリアの完全性とマイクロバイオームの回復のための治療介入 |
| 2.1. 食事、プレバイオティクス、短鎖脂肪酸 |
| プレバイオティクスは通常、オリゴ糖と短鎖多糖類から構成され、腸内細菌叢の有益な栄養基質として働き、その増殖を促進します[149]。フルクタン、特にイヌリンとフラクトオリゴ糖(FOS)、そしてガラクトオリゴ糖(GOS)などのガラクタンは、ニンニク、チコリ、タマネギ、アーティチョーク、アスパラガスなどの野菜、バナナ、ライ麦やトウモロコシなどの穀物などの食品に含まれるため、最も研究されているプレバイオティクスです。 |
| 母乳には、ヒトミルクオリゴ糖(HMO)と呼ばれるプレバイオティクスも含まれています。イヌリン[150,151,152,153]、フラクトオリゴ糖[154]、またはガラクトオリゴ糖[154,155,156,157]を1~2週間補給する介入は、ビフィドバクテリウム、ラクトバチルス、アッカーマンシア、またはローズブリアの存在量の増加と有意に関連していました。ビフィドバクテリウム属は、ヒトミルクオリゴ糖分解の主要な常在菌です[158]。妊娠中の母親へのプレバイオティクス補給は、小児のアレルギー予防のために腸内細菌叢の構成と機能を調整する最良の機会であると考えられます[159]。 |
| 腸内細菌はプレバイオティクスを発酵し、腸管腔内での短鎖脂肪酸の産生と放出を誘導する[50,160]。短鎖脂肪酸は腸管上皮細胞および自然/獲得免疫細胞と特異的に相互作用し、細胞の分化、増殖、アポトーシスに影響を与える[161]。短鎖脂肪酸は、タンパク質キナーゼ[162]、哺乳類ラパマイシン標的タンパク質(mTOR)[163]、活性化B細胞核因子κ軽鎖エンハンサー(NFκB)[164]の産生を刺激することによりシグナル伝達経路を誘導する一方、短鎖脂肪酸は遺伝子発現の調節に関与するヒストンアセチルトランスフェラーゼ(HAT)およびヒストン脱アセチル化酵素(HDAC)の機能も調節する[165]。前臨床研究では、酪酸は食物アレルギー反応を有意に減少させ、寛容原性サイトカインの誘導、Th2サイトカイン産生の抑制、酸化ストレスの調節を示した[166]。酪酸およびナイアシン受容体(GPR109A)は、上皮機能の維持に重要な役割を果たし、免疫応答の負の調節因子となる可能性がある[167]。最近、Wangらは、酪酸放出ミセルによる治療がクロストリジウム・クラスターXIVaにおける酪酸産生分類群の存在量を増加させ、マウスをピーナッツ曝露に対するアナフィラキシー反応から保護することを示した[168]。 |
| 興味深いことに、マウスにおける経口免疫療法とフラクトオリゴ糖投与は、盲腸内容物中の酪酸濃度の上昇に関連する潜在的な微生物変化を誘発し、食物アレルギーを治療するためのヒト研究において経口免疫療法の有効性を改善する有望な戦略となっている[169]。ヒトでは、最近の研究で酪酸が高親和性IgE受容体を介したシグナル伝達分子をエピジェネティックに制御することにより、肥満細胞に直接影響を及ぼす可能性があることが示唆されている[170]。このように、酪酸はIgEを介した肥満細胞の脱顆粒とアレルゲン誘発性ヒスタミン放出を阻害することにより、ヒト食物アレルギーに治療効果をもたらす可能性がある[171]。さらに、ヒト腸管上皮細胞では、酪酸がムチン産生、タイトジャンクション、およびヒトβデフェンシン3の発現を刺激することが示されている。食物アレルギーの小児の末梢血単核細胞では、酪酸がエピジェネティックなメカニズムを介してIL-10、IFN-γ、およびフォークヘッドボックスP3(FOXP3)の発現を増強した[166]。さらに、樹状細胞、制御性T細胞(Treg)、およびM2マクロファージの前駆細胞を促進した[166]。 |
| これらの最近の知見はすべて、プレバイオティクスと短鎖脂肪酸が上皮バリアの完全性、経口耐性、および脂肪酸に対する防御を促進する上で重要な役割を果たすことを強調しています。これらの観察結果は、少なくとも部分的には、Treg細胞、B細胞、肥満細胞などの様々な免疫細胞におけるヒストン脱アセチル化酵素に対する短鎖脂肪酸の阻害効果、および様々な短鎖脂肪酸受容体の刺激によって説明できます。しかし、最近の研究[172,173]では、高用量のプレバイオティクス(特にイヌリン)の補給が、短鎖脂肪酸の過剰蓄積と腸内細菌叢の乱れという状況下でアレルギー性炎症を悪化させることが示されており、脂肪酸を安全に緩和するためにプレバイオティクスを個別化して使用することの重要性が強調されています。実際、腸内微生物間の種間相互作用は依然として不明であり、考慮する必要があります。高短鎖脂肪酸産生細菌の過剰増殖による有害な影響の可能性を軽視すべきではありません。 |
| 2.2. プロバイオティクス、次世代プロバイオティクス、およびポストバイオティクス |
| プロバイオティクスは、適切な量を投与することで宿主の健康に有益な可能性のある生きた微生物です[174]。この用語にはサッカロミセス・ボウラディ[175]などの酵母も含まれますが、食物アレルギーにおいて研究されている最も重要なプロバイオティクスは、ラクトバチルス属とビフィドバクテリウム属の2つの属に分類される細菌です。正確な作用機序はまだ十分に解明されていませんが、プロバイオティクスの補給は、いくつかの方法で食物アレルギーの症状を予防または軽減する可能性があります。まず、プロバイオティクスは、栄養素をめぐって競合し、抗菌性代謝産物を産生する病原性微生物の増殖を阻害します。また、表面糖タンパク質または多糖類を介して腸管上皮細胞に付着し、病原性細菌が上皮細胞に結合するのを阻害します。さらに、乳酸菌(LAB)とビフィズス菌は、有益な種にとって理想的な生息地として、低酸素圧と酸性の腸内環境を維持するのに貢献しています[176]。 |
| この目的のために、牛乳アレルギー(CMA)に罹患した乳児を対象に、高度加水分解カゼイン配合乳(EHCF)を用いた食事介入中にL.ラムノサス GG(LGG)を補給したところ、ブラウティア、ローズブリア、その他の酪酸産生菌の増殖と糞便中の酪酸値の上昇が認められた[177]。プロバイオティクスは腸管バリアを強化し、主要代謝物として短鎖脂肪酸(上記参照)とムチン(MUC2、MUC3、MUC5AC)の発現を増加させる[178]。したがって、オクルディンやゾヌリンタンパク質(Zonula Occludens-1、ZO-1)などのタイトジャンクションタンパク質の発現を促進する[179]。このようにして、細菌やペプチドが内部バリアに移行する主な原因である上皮バリアの乱れを軽減し、微小炎症や免疫化につながります(アレルギー疾患の発症に関するいわゆる「上皮バリア仮説」)[176]。 |
| ほとんどの食物アレルギー反応の基礎として、腸管関連リンパ組織(GALT)の発達中にTh2表現型に向かう免疫不均衡が生じる。子宮内では母体拒絶反応を防ぐためにTh2パターンが優位であるのに対し、出生後早期には、ラクトバチルスなどの膣細菌を含む微生物刺激が、免疫系をTh1プロファイルに向けて再プログラムする [16]。食物アレルギーからオボアルブミン(OVA)への変換のマウスモデルで実証されているように、帝王切開(CS)は糞便中のラクトバチルス属およびビフィズス菌株の減少をもたらし、アレルギー症状の重症度を悪化させる。L.アシドフィルス、B.ロンガム亜種をベースとしたプロバイオティクス補給は、アレルギー反応の重症度を軽減する。生後21日目までのプロバイオティクス、E.フェカリス、B.セレウスの投与は、帝王切開関連の腸内細菌叢の乱れを改善し、アレルギー症状を改善し、IgEおよびIgG産生を減少させ、ZO-1、閉塞性、クローディン-1などのタイトジャンクションタンパク質の発現を増加させる可能性がある[180]。これらの結果は他の動物実験の結果と一致しており、抗生物質療法を受けた新生マウスおよび無菌マウスはTh2免疫表現型を維持し、経口抗原に対するアレルギー反応のリスクが上昇することを示しています。このリスクは、多くの場合、生後早期のプロバイオティクス補給によってTh1/Th2バランスが回復し、Th1パターンが促進されます[181,182,183]。 |
| このような結果は、過去20年間に、主に牛乳アレルギーの管理を対象とした、後ろ向きおよび前向き(非ランダム化およびランダム化試験)のいくつかのヒト研究によって確認されています[176]。研究のほとんどは、L.ラムノサスGG、L. カゼイ、L. プランタルム、B. ラクティス、B. ビフィダム、B. ブレーベ、に焦点を当てており、牛乳アレルギーに罹患し少なくとも1週間[184]から36か月[185]の期間にわたり経口的にプロバイオティクスを補給された乳児が含まれています。研究の種類に応じて、その後、小児は72時間[184]から5年間[186]の期間追跡されました。これらの研究は、補給初期における毎日の嘔吐と下痢の減少[184]から12か月での臨床的食物耐性の達成[187]まで、さまざまなエンドポイントを持っていました。いくつかの研究では、L. ラムノサス GG [188]のような独自の菌株、またはとB. ラクティス [187] の混合物が使用されました。また、イヌリンやオリゴフルクトースなどのプレバイオティクスを含む研究もありました [189]。これらの研究のほぼすべてにおいて、プロバイオティクスの補給が牛乳アレルギーに罹患した乳児の臨床症状の改善とアレルギー反応の軽減に有意な影響を与えることが確認され、その有益性が示唆されました。しかしながら、現時点では、食物アレルギーの予防または治療におけるプロバイオティクスの使用に関する明確な推奨を裏付けるエビデンスは科学界には存在せず、特定の菌株、投与量、適切な治療期間に関する明確な情報が不足しています [16]。 |
| 新たな関心分野として考えられるのは経口食物免疫療法(OIT)で、これは食事性抗原への経口または腸管からの漸進的かつ継続的な曝露が食物耐性につながるという考えに基づいています [190]。この概念では、プロバイオティクスは抗原提示細胞とともに免疫応答を調節する微生物由来(細菌自体)の化合物群である免疫応答修飾因子(IMR)として位置づけられる可能性があります [16]。卵アレルギーのマウスモデルでは、L. カゼイ亜種ラムノサス(Lcr35)を摂取した動物は、対照群(経口食物免疫療法なし、または経口食物免疫療法のみ)と比較して、経口食物免疫療法中のアナフィラキシー反応が減少しました [191]。ピーナッツアレルギーの小児を対象としたランダム化比較試験では、プロバイオティクス(L. ラムノサスCGMCC 1.3724)とピーナッツ経口食物免疫療法を併用した患者(82.1%)は、プラセボ群(ピーナッツ経口食物免疫療法のみ)と比較して、アレルギー反応の持続が見られました [192]。しかし、最近の多施設ランダム化試験ではこれらの知見は確認されず、経口食物免疫療法と経口食物免疫療法 +プロバイオティクス(L. ラムノサス ATCC 53103)補給の両方で持続的な無反応率が同程度であることが示された[193]。 |
| 次世代プロバイオティクス(NGP)は、食物アレルギー治療における新たな研究分野です。従来のプロバイオティクスとは異なり、次世代プロバイオティクスに含まれる微生物は、次世代シーケンシング技術とバイオインフォマティクスを用いて同定されています。次世代プロバイオティクスには、ポストバイオティクスも含まれる場合があります。ポストバイオティクスとは、「宿主内で生物活性を有する微生物由来の非生存性細菌産物または代謝産物」を指します[194]。これらの微生物は、プロバイオティクス製品の保存期間を延長する可能性があり、免疫不全者への投与も一般的に安全です[195]。 |
| アッカーマンシア・ムシニフィラは次世代プロバイオティクスのプロトタイプであり、欧州食品安全機関(EFSA)によって最初に承認されたものです[196]。その作用は、表面タンパク質(Amuc_1100)を介して非生体細胞にも発揮され、2型糖尿病と肥満において広範囲に文書化されています[197]。A. ムシニフィラは短鎖脂肪酸を産生し、IL-10合成とTreg細胞の増殖を刺激することで、腸管バリアを強化することが証明されています[198]。オボアルブミンのマウスモデルでは、生菌A. ムシニフィラを補給すると、アレルギーマウスの血清中の抗オボアルブミンIgEレベルと体重減少(病気のマーカー)が減少し、腸管炎症と白血球浸潤が対照群と比較して減少しました。さらに、不活化細菌はアレルギーマウスの抗オボアルブミン IgEレベルと好酸球動員を有意に減少させました。このことから、この状況におけるポストバイオティクスの役割も確認された[199]。同じモデルにおいて、ビフィドバクテリウム・ロンガム亜種ロンガム51A(BL51A)を生菌としてのみ補充した場合でも同様の結果が得られたが、結果は菌の投与量と生存率に依存していた。この症例では、抗炎症性IL-10の増加が認められた。しかし、不活化菌による治療では有益な効果は認められなかった[200]。 |
| これらの結果はすべて、食物アレルギーの管理におけるプロバイオティクスとポストバイオティクスの潜在的な役割を裏付けています(表1)。しかし、これらを治療の一部として検討するには、菌株の種類、投与量、治療期間に関するさらなる研究が必要です。 |
| 表 1. 食物アレルギーの緩和または予防におけるプレバイオティクス/プロバイオティクスの潜在的な役割。 |
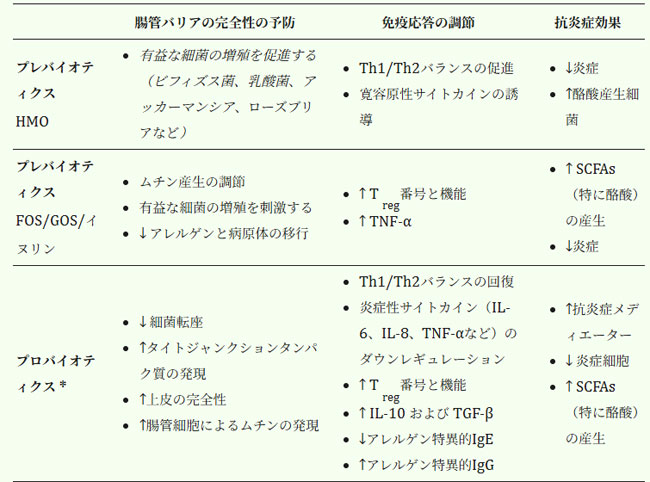 |
* プロバイオティクス療法の適切な菌株、投与量、および適切な投与期間に関する明確な情報が不足している。 略語:↑:増加;↓:減少;FOS:フラクトオリゴ糖;GOS:ガラクトオリゴ糖;HMO:ヒトミルクオリゴ糖;IFN:インターフェロン;IL:インターロイキン;SCFA:短鎖脂肪酸;TGF:形質転換成長因子;TNF:腫瘍壊死因子。 |
| 2.3. 糞便微生物移植 |
| 糞便微生物移植(FMT)は、健康なドナーの糞便をレシピエント患者の消化管に注入し、腸内細菌叢を改善し、腸内細菌叢異常(dysbiosis)を回復させることを目的としている[201]。糞便微生物移植は、大腸内視鏡検査、経口カプセル、または経鼻胃管によって行うことができる[202]。現在、糞便微生物移植はクロストリディオイデス・ディフィシル感染症における抗生物質の潜在的な代替療法としての有効性が証明されており、国際ガイドラインにも組み込まれている[203]。消化管疾患(炎症性腸疾患(IBD)や過敏性腸症候群など)[204]、肝疾患[205]、代謝性疾患[206]、悪性腫瘍[207]など、他の疾患における糞便微生物移植の使用を示唆するエビデンスが増加している。 |
| 糞便微生物移植は腸内細菌叢を調節する能力があることから、食物アレルギーの治療法として提案されている。この提案は、食物アレルギー患者における腸内細菌叢の異なる構成の役割を明らかにした研究に基づいている[208]。 |
| 予備的な前臨床的証拠は、食物アレルギーにおける糞便微生物移植の潜在的な役割を示唆している。2つの論文では、食物アレルギーに罹患した患者からの糞便微生物移植を受けたマウスで体幹体温の低下が報告されたのに対し、健康なドナーからの糞便微生物移植を受けたマウスでは一時的な低下のみが観察され、経口食物負荷後のアナフィラキシーに対する保護的役割を示唆している[140,141]。さらに、経口アレルギー感作を受けた際、食物アレルギーの糞便を注入されたマウスは健康な対照マウスと比較して、糞便スコアの上昇と消化管症状(掻破、下痢など)の増加が観察された[209]。さらに、食物アレルギー患者および健康なドナーからの糞便微生物移植を受けたマウスでは、αおよびβ多様性の低下、バクテロイデス科およびラクノスピラ科の増加、そしてクロストリジウム科、腸内細菌科、ビフィドバクテリア科の増加が観察された[210]。 |
| 糞便微生物移植の食物アレルギーにおける新たな役割とマウスモデルで得られた知見は、ヒトにおける新たな研究への道を開いた。ピーナッツアレルギーの治療を目的として、10人の成人被験者(18~40歳)を対象に、2日間かけて経口カプセル化糞便微生物移植を投与した場合の安全性と忍容性を評価する第I相オープンラベル試験はすでに終了しているが、データはまだ公表されていない[211]。さらに、24人のピーナッツアレルギー患者(12~17歳)を対象に、経口カプセル化糞便微生物移植の安全性と忍容性を評価する第II相ランダム化二重盲検プラセボ対照試験が進行中である[212]。 |
| 3. 結論 |
| 本稿で検討したように、腸内細菌叢の不均衡と腸管バリアの破壊が食物アレルギーの病因に関与していることを明確に裏付けるエビデンスが増えている。 |
| これらの病因経路は、工業化や不均衡な食事(高度に加工された食品の摂取など)などの環境要因によって引き起こされ、Th2 免疫反応を誘発し、アレルギー感作に対する感受性を高める可能性があります。 |
| 前臨床および臨床経験からの予備的な証拠は、食事、プレバイオティクス、プロバイオティクス、ポストバイオティクス、糞便微生物移植を含む腸内細菌叢のさまざまな調節因子が 食物アレルギーの潜在的な治療ツールとして使用できる可能性を支持していますが、これらの洞察を確認するには、さらに適切に設計された研究が必要です。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Nutrients. 2023 Dec 27;16(1):92.に掲載されたThe Role of Gut Microbiota and Leaky Gut in the Pathogenesis of Food Allergy.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |