
Giuseppe Marano et al., World J Gastrointest Pathophysiol. 2025 Sep 22;16(3):107823. |
要約 |
| 腸内細菌叢はヒトの健康において極めて重要な役割を果たし、性機能を含む多様な生理学的プロセスに影響を与えています。近年のエビデンスは、腸内細菌叢と性機能の間に双方向の関係があることを示唆しており、全身性炎症、ホルモン調節、免疫機能への影響がその媒介となっています。バランスの取れた腸内細菌叢は、性機能と生殖機能の健康に不可欠なエストロゲンやテストステロンなどの性ホルモンの最適なレベルを維持します。さらに、短鎖脂肪酸などの腸管由来代謝物は、粘膜バリアの完全性の維持と免疫応答の調節に寄与し、性機能を損なう可能性のある感染症の予防に不可欠です。一方、腸内細菌叢の不均衡であるディスバイオシスは、勃起不全、多嚢胞性卵巣症候群、性欲減退などの症状と関連付けられており、性機能障害における役割が強調されています。食事、ストレス、抗生物質の使用といったライフスタイル要因は、腸内細菌叢を変化させ、ひいては性機能にも影響を及ぼす可能性があります。プロバイオティクス、プレバイオティクス、糞便細菌叢移植といった最近の治療法は、腸内バランスの回復と性機能の改善に期待が寄せられています。本レビューでは、腸内細菌叢が性機能において中心的な役割を果たしていることを強調し、全体的な健康状態の向上を目的とした治療介入の標的としての重要性を強調します。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.ヒトマイクロバイオータと膣マイクロバイオーム:構成、多様性、そして健康への影響 |
| 3.ヒト膣微生物叢の組成と分類 |
| 4.新たな膣内細菌種の発見 |
| 5.健康なヒト膣微生物叢におけるラクトバチルス優位性に寄与する要因 |
| 5.1.乳酸 |
| 5.2.バクテリオシン |
| 5.3.過酸化水素 |
| 6.1.再発性外陰膣感染症におけるヒト膣微生物叢 |
| 6.2.細菌性膣症-ヒト膣微生物叢組成 |
| 6.3.外陰膣カンジダ症 |
| 7.腸内細菌叢 |
| 7.1エストロゲンと腸内細菌叢の相互作用 |
| 8.腸内細菌叢、女性生殖器、そして胎児の発育 |
| 9.短鎖脂肪酸と腸・脳・性のつながり:神経生物学的視点 |
| 10.腸内細菌叢と性的幸福の相互作用における心理的側面 |
| 11.腸内細菌叢、食事、そしてメンタルヘルス:全身的および性的健康への影響 |
| 12.心理療法とサイコバイオティクスの統合:脳-腸軸と性機能への新たなアプローチ |
| 13.結論 |
| 本文 |
| 1.はじめに |
| 人体には数兆個もの微生物細胞が存在し、主に消化管に存在し、腸内細菌叢を形成しています。この複雑で動的な生態系は、代謝活動や宿主との相互作用を通じて、生理機能の調節や疾患感受性への影響において重要な役割を果たしています[1]。腸内細菌叢は、細菌、古細菌、真菌、原生動物、ウイルスなど、最大100兆個もの微生物で構成され、腸管バリア内に存在し、人体の主要な生態系を構成し、「独立した臓器」とさえ考えられています[2]。この微生物叢は、人体自身の細胞の10倍にも達し、「マイクロバイオーム」と呼ばれる集合的な遺伝子レパートリーを有しており、その規模はヒトゲノムの少なくとも150倍に相当します[3]。 |
| エンテロコッカス属、ルミノコッカス属、バクテロイデス属、ビフィドバクテリウム属、アッカーマンシア・ムシニフィラ属などの細菌属は、免疫調節や健康全般を支える必須の代謝プロセスに寄与します。しかし、クロストリディオイデス・ディフィシル、サルモネラ菌、ヘリコバクター・ピロリ菌、大腸菌O157、バクテロイデス・フラギリス、フソバクテリウム・ヌクレアタムなどの細菌種は、感染症や腸の炎症から腫瘍の発生に至るまで、様々な疾患と関連しています[4]。 |
| 近年、腸内細菌叢をめぐる科学的関心は飛躍的に高まっており、その背景として、腸内細菌叢が全身の健康だけでなく、性的な健康にも影響を与えるという発見が挙げられます。この関係は身体的な側面をはるかに超え、性における感情的・心理的な側面にも深く影響を与えています。性的な健康は、性に関する身体的、精神的、そして社会的に完全な幸福感を備えた状態と定義され、現在では免疫系、内分泌系、神経心理学的システムと相互作用する、健康全般の多面的な要素として理解されています[5]。 |
| 腸内細菌叢と性機能の間には、全身性炎症、ホルモン調節、免疫機能への影響を介した双方向の関連性があることが、新たなエビデンスによって示唆されています[6]。腸内細菌叢のバランスを維持することは、性機能と生殖機能の健康に不可欠なエストロゲンやテストステロンなどの性ホルモンの調節に不可欠です。短鎖脂肪酸などの腸内代謝産物も、粘膜バリアと免疫システムのバランスを維持する上で重要な役割を果たし、性機能に影響を与える感染症のリスクを低減します[7]。 |
| 腸内細菌叢と性的健康の相互作用には、中枢神経系(CNS)との相互作用も含まれます。腸-脳軸として知られるこの複雑なコミュニケーション経路は、気分、欲求、性的反応に関連する神経学的および神経化学的プロセスを調節することで、性行動に影響を与えます[8]。最近の研究では、腸内細菌叢の変化が、感情状態や性的動機に影響を与えることが知られているセロトニンやドーパミンなどの神経伝達物質レベルの変化と関連していることも示されています[9]。したがって、腸内細菌叢は身体と心の間の重要な仲介者として機能し、生理学的調節だけでなく、感情的および人間関係の幸福感も形作ります。 |
| 腸内細菌叢の構成は、様々な要因によって形成されます[10]。例えば、抗生物質[11]、ストレス[12]、年齢[13]、身体活動[14]などが挙げられます。バランスの取れた食物繊維を豊富に含む食事は善玉菌の増殖を促進しますが、抗生物質の使用やストレスへの曝露は微生物バランスを崩し、腸内細菌叢の構成に変化をもたらす可能性があります。微生物叢の多様性は、生涯を通じて年齢や遺伝的素因によってさらに影響を受けますが、定期的な身体活動は腸内細菌叢の多様性の向上につながることが示されています。 |
| 腸内細菌叢の乱れは、勃起不全(ED)、多嚢胞性卵巣症候群(PCOS)、性欲減退といった性機能障害と密接に関連しています。全身性炎症、ホルモン調節、免疫機能への影響を通じて、性機能にも悪影響を及ぼします。 |
| 勃起不全では、腸内細菌叢の乱れが炎症を増強し、血流に不可欠な一酸化窒素の産生を阻害することで、内皮機能不全を悪化させます[15]。多嚢胞性卵巣症候群では、インスリン抵抗性やアンドロゲン値の上昇などのホルモンバランスの乱れを悪化させ、慢性炎症を助長することで症状と生殖能力を悪化させます[16]。また、腸内細菌叢の乱れは、気分、ストレス、テストステロンやエストロゲンなどの性ホルモン代謝を変化させることで、脳腸相関を介して性欲にも影響を与え、性欲と性機能をさらに低下させます[17]。これらの知見は、腸内細菌叢が性機能障害の治療や生殖および人間関係の健康改善のための新たな治療ターゲットとなることを示唆しています。 |
| 腸内細菌叢とセクシュアリティの複雑なつながりは、微生物バランスを回復し、性機能を高めるための治療介入の必要性を浮き彫りにしています。プロバイオティクス、プレバイオティクス、糞便細菌叢移植といった新たな戦略は、全身の健康状態と性機能の両方を改善するための有望な道筋を示しています[18]。この軸をより深く理解することで、生物学的ケアと心理的ケアを統合した革新的で個別化された治療法の開発が促進される可能性があります。さらに、これらのダイナミクスを理解することで、身体的、感情的、心理的要因を含むセクシュアリティの多面的な性質に対する新たな視点が得られます。科学界が腸内細菌叢の全身的役割を探求し続ける中で、セクシュアリティへの影響は、ホリスティックヘルスケアに影響を与える重要なフロンティアとして浮上しています。腸内細菌叢が性機能に与える影響、そして腸-脳軸におけるメディエーターとしての役割に関する知識を深めることで、研究者や臨床医は、全体的な健康と生活の質の向上を目的とした個別化された介入を開発することができます。この総合的なアプローチは、身体の健康、精神の健康、性行動の間のつながりを橋渡しする上で腸内細菌叢が中心的な役割を果たすことを強調しています。 |
| 2.ヒトマイクロバイオータと膣マイクロバイオーム:構成、多様性、そして健康への影響 |
| ヒトマイクロバイオータは、人体の内外両面に生息する多様な微生物群です。これらの微生物の集合的な遺伝物質がヒトマイクロバイオームを構成しています。マイクロバイオータは主に共生関係にあり、宿主から利益を得ています。宿主と微生物の相互作用は、中立的(片利共生)、有益(相利共生)、あるいは特定の状況下では有害(病原性)となることもあり、生理学的プロセス、免疫応答、そして栄養獲得に影響を与えます[19]。マイクロバイオームは出生時に形成され始めますが、その構成は抗生物質投与を含む様々な外因性因子によって変動するため、常に変化し続けます。 |
| ヒト膣微生物叢(VMB)は、膣環境内で共存する有益な微生物と日和見病原体からなる複雑で動的な生態系を構成しています[20,21]。この生態系において、宿主とその微生物群との協力関係は、日和見病原体の増殖に対する主要な防御機能となります。この安定した健康増進をもたらす微生物の均衡は、ユービオシスと呼ばれています。逆に、日和見病原体が有益な細菌を圧倒すると、このバランスが崩れ、ディスバイオシスを引き起こします。ディスバイオシスは、炎症や感染症に対する脆弱性の増加を伴うことが多い状態です。ヒト膣微生物叢と女性の生殖生理機能の相互作用は双方向です。つまり、出生から閉経後までの生涯にわたる生理学的変化はヒト膣微生物叢に影響を与え、ヒト膣微生物叢自体も生殖の健康に影響を与える可能性があります[22]。 |
| 3.ヒト膣微生物叢の組成と分類 |
| ヒト膣微生物叢の組成と構造は、従来の顕微鏡検査から高度な次世代シーケンス技術に至るまで、幅広い手法を用いて詳細に解析されてきました[19]。歴史的に、健康な生殖年齢の女性のヒト膣微生物叢は、乳酸菌が優勢であることが特徴とされ、これは乳酸の産生によって膣pHが4.5未満に維持されるためと考えられてきました[23]。しかし、分子生物学的手法の進歩により、これまで検出できなかった細菌種の同定が容易になり、明確な微生物群集状態(CST)の分類につながりました。 |
| 生殖年齢の女性においては、膣内細菌種の相対的な存在量と構成に基づき、5つの主要な微生物群集状態が同定されている[21,24]。具体的には、微生物群集状態-Iはラクトバチルス・クリスパタスが優勢、微生物群集状態-IIはL.ガセリが優勢、微生物群集状態-IIIはL. イナーズが優勢、微生物群集状態-VはL. ジェンセニが優勢である。一方、微生物群集状態-IVはラクトバチルス属が減少し、多様な通性嫌気性細菌が共存する。微生物群集状態-IVはさらに2つのサブタイプに分類され、微生物群集状態IV-Aはアナエロコッカス属、ペプトニフィラス属、コリネバクテリウム属、プレボテラ属、フィネゴルディア属、ストレプトコッカス属の菌種を含む。 微生物群集状態 IV-Bには、アトポビウム、ガードネレラ、スニーシア、モビルンカス、メガスファエラ、およびクロストリジウム目の他の分類群が含まれます[21,24]。 |
| 微生物群集状態-IVは、ニュージェントスコアリングシステムによると、膣内細菌叢異常、特に細菌性膣症(BV)と強く関連しているとされています。しかしながら、研究では、無症状の個人、特に黒人およびヒスパニック系女性において微生物群集状態-IVの有病率が約40%を占めていることが示されています[24]。この観察結果から、微生物群集状態-IVを細菌叢異常として分類すべきか、それとも細菌性膣症の無症状の変異体として分類すべきかという疑問が生じ、真に健康な状態と無症状の微生物プロファイルをより正確に区別する必要があることが浮き彫りになっています。 |
| 4.新たな膣内細菌種の発見 |
| 最近の研究により、健康な女性の膣サンプルから分離された新しい細菌属、ヴァギネラ・マシリエンシスが同定されました。この桿菌は、運動性、胞子形成性のない、偏性好気性グラム陰性細菌で、バクテロイデス門フラボバクテリア科に属します。この属の基準株はマルセイユ P2517です[25]。ヴァギネラ・マシリエンシスの発見は、膣マイクロバイオームの複雑性と多様性をさらに強調するものであり、これまで認識されていなかった細菌種が膣の健康において果たす役割の可能性を浮き彫りにしています。 |
| 5.健康なヒト膣微生物叢におけるラクトバチルス優位性に寄与する要因 |
| バランスの取れたヒト膣微生物叢においてラクトバチルス属が優位であるのは、主に抗菌化合物を産生する能力によるものです[26]。これらの抗菌化合物には、病原菌の増殖を抑制する酸性膣環境の維持に寄与する乳酸、有害細菌を選択的に標的とする狭域抗菌ペプチドであるバクテリオシン、そして感染に対する宿主防御において重要な役割を果たす過酸化水素(H2O2)が含まれます。これらの抗菌物質は、ヒト膣微生物叢の安定性と回復力に総合的に寄与しており、膣の健康維持におけるラクトバチルス優位性の重要性を強調しています。この優位性は、膣感染症の予防、性感染症のリスク低減、そして生殖機能の向上と婦人科治療への反応促進に役立ちます[27]。このバランスは膣内生態系の安定性と回復力に不可欠であり、性機能の維持と感染症予防において、ラクトバチルスが十分に存在することが重要であることを改めて強調しています[28,29]。ラクトバチルス属菌の不均衡や減少は、これらの防御機構を損ない、感染症やその他の合併症のリスクを高める可能性があります[30]。 |
| 5.1.乳酸 |
| ラクトバチルスは、生殖年齢の女性の膣上皮において、主にグリコーゲンを発酵させることで乳酸を産生します。この酸性環境は感染に対する保護バリアとなり、潜在的な膣病原体の定着を阻害します。研究では、ラクトバチルスの豊富さが膣の酸性化に寄与し、その結果、平均pHは3.5±0.2に達しますが、これは主に乳酸の蓄積によるものであることが示されています[31]。膣乳酸の保護レベルは主にヒト膣微生物叢に依存しており、宿主の上皮細胞は産生される乳酸全体のわずか4%~30%に過ぎません[32]。 |
| 膣内の乳酸は、D(-)型とL(+)型の2つの異性体で存在します。膣腔内のグリコーゲンの利用可能性は、グリコーゲンを豊富に含む上皮細胞の剥離によって増加すると考えられており、このプロセスはヒアルロニダーゼ-1とマトリックスメタロプロテアーゼの活性によって媒介されます。これにより、利用可能なグリコーゲンはα-アミラーゼによって分解され、その後、ラクトバチルスによってD(-)型乳酸に変換されます。 |
| 最近の研究では、乳酸、特にL(+)型乳酸はpH低下とは独立してヒト免疫不全ウイルス(HIV)1の感染を阻害することが示唆されている[33]。さらに、D(-)型乳酸とL(+)型乳酸はともに、ヒト子宮頸膣上皮細胞においてヒト免疫不全ウイルスに対する抗炎症反応を刺激する[34]。両異性体はヒストン脱アセチル化酵素を阻害し、関連遺伝子の転写制御を介してDNA修復を促進することが示されている[35]。 |
| 乳酸は、クラミジア・トラコマティス、単純ヘルペスウイルス2型、ヒト免疫不全ウイルス-1、およびさまざまな細菌性膣症関連微生物を含むさまざまな感染症を阻害することも示されています[33,36-38]。 乳酸はさまざまなメカニズムを通じて宿主の免疫応答を調節します。 乳酸は、膣上皮細胞での抗炎症メディエーターであるインターロイキン(IL)-1受容体拮抗薬の産生を増加させる一方で、IL-6、IL-8、腫瘍壊死因子α、活性化制御性T細胞発現分泌型正常T細胞(RANTES/CCL5)、マクロファージ炎症性タンパク質-3などの炎症誘発性メディエーターを阻害します[34]。 また、抗ウイルス応答を刺激する形質転換成長因子βの放出を誘導し[39]、細菌性リポ多糖(LPS)に反応してIL-23産生を介してTh17リンパ球経路を活性化します[40]。細胞質乳酸を増加させ、cAMP産生を阻害することで上皮細胞におけるオートファジーを促進し、細胞内微生物の分解と恒常性の維持を促進する[41]。これらの研究は、乳酸の多様な防御特性を総合的に示している。これらの特性は乳酸の異性体によって異なり、宿主感受性および宿主-微生物叢相互作用に単独または相乗的に影響を及ぼす。 |
| 5.2.バクテリオシン |
| バクテリオシンIIa、IIc、J46、アシドシンLF221A、ガセリシンT、A型ランチビオティックなどのバクテリオシンは、殺菌活性を有するタンパク質性物質です。これらは乳酸菌、特にL. クリスパトゥスおよびL.ガセリによって産生されます[42]。これらの分子は、黄色ブドウ球菌、クレブシエラ属、E. フェカリス、大腸菌などの非常在病原菌の細胞膜を破壊し、それらの増殖を阻害する上で重要な役割を果たします[42]。 |
| 5.3.過酸化水素 |
| 過酸化水素(H2O2)は、多くのラクトバチルス属菌が酸素(O2)存在下でin vitroで産生するもう一つの抗菌化合物です[43]。しかし、膣内の酸素濃度が低いと嫌気性環境となり、H2O2が膣内病原菌に対して毒性を発揮するのに十分な濃度に達するかどうかという疑問が生じます。この考えは、O'Hanlonら[36]によってさらに裏付けられ、彼らは膣に特徴的な低酸素条件下では、H2O2は細菌性膣症関連細菌に有意な影響を与えないことを実証しました。さらに彼らは、高H2O2濃度は、腸内細菌叢の維持を担うラクトバチルス属菌にとって、腸内細菌叢の乱れに関連する細菌よりも有害であることを発見しました[36]。 |
| 対照的に、以前の研究では、過酸化水素を産生する膣内乳酸菌は、細菌性膣症に対するより強力な防御力を発揮し、カンジダの増殖を阻害して侵入性菌糸の形成を防ぐことが示唆されていました[44]。これらの知見を総合すると、乳酸とバクテリオシンの産生がヒト膣微生物叢における乳酸菌の主要な防御機構を構成していることが示唆されます。一方、ヒト膣微生物叢防御における過酸化水素の役割については議論が続いており、未だ特定されている他の生理学的因子のマーカーとして機能する可能性があります。 |
| 6.カンジダと膣真菌叢におけるその役割 |
| 健康な生殖年齢の女性の膣真菌叢には、一般的に膣真菌叢と呼ばれる真菌成分が含まれており、そのゲノムプロファイルは膣真菌叢として知られています[45]。初期の培養研究では、無症状の女性の約20%に膣真菌が検出され、カンジダ・アルビカンスが優勢(72%~91%)で、次いでカンジダ・グラブラタ、カンジダ・トロピカリス、カンジダ・パラプシロシスなどの非アルビカンス系カンジダが続いていました[46]。しかしながら、これらの従来の技術の限界により、膣真菌叢の複雑さの全体像は十分に理解されていません。 |
| 次世代シーケンスの近年の進歩により、膣真菌群の多様性についてより深い知見が得られている。2013年に発表された画期的な研究では、ピロシーケンシングを用いてエストニアの無症状女性の膣真菌叢を解析し、参加者の64.5%にカンジダ属が検出された。これは、培養法を用いた従来の報告値20%を大幅に上回る有病率である[45,46]。先行研究と一致して、C.アルビカンスが最も多く検出された種(82%)であったが、C. ダブリニエンシス、C.パラプシロシス、C. クルセイ、未分類株(カンジダ属VI04616)など、アルビカンス以外のカンジダ属も検出された。特筆すべきことに、本研究で特定された運用分類単位の38%には適切な分類がなく、分子に基づく真菌分類に固有の課題が浮き彫りになった[45]。 |
| 近年の研究では、膣真菌叢がこれまで認識されていたよりも多様であることが明らかになっているが、カンジダ・アルビカンスが依然として優勢な種であり、その生態学的重要性を強調している[45,47]。カンジダは健康な女性によく見られるにもかかわらず、外陰膣カンジダ症(VVC)(細菌性膣症に次いで2番目に多い膣ディスバイオシス)の症例で高い有病率(85%~95%)を示すため、依然として日和見病原体に分類されている[48]。このことから、カンジダの存在が安定した微生物叢(ユーバイオシス)に寄与するのか、それとも宿主をディスバイオシスや疾患にかかりやすくするのかという重要な疑問が生じる。その答えは、カンジダの二重生活様式の重要な要因である二形性転換能にあると考えられる。この転換により、カンジダは酵母型と糸状菌糸型を切り替えることができ、無害な常在菌としても毒性のある病原体としても存在することができる。酵母型は典型的には健康で無症状の女性に観察されるが、菌糸型は重度の外陰膣カンジダ症と強く関連しており、酵母の形態と片利共生、菌糸の増殖と病原性との間の関連を強めている[49]。 |
| カンジダが常在菌として生存する能力には複数の要因が影響を及ぼしますが、栄養は重要な役割を果たします。研究によると、様々な炭素源がカンジダの細胞壁構造に影響を与え、それが毒性や宿主免疫系との相互作用に影響を与えることが示されています[50,51]。この真菌は驚くべき代謝柔軟性を示し、グリコーゲン、代謝副産物、さらには乳酸など、多様な炭素源を利用することで、膣内環境の変動に適応することができます[52]。 |
| 最近の研究では、カンジダが乳酸を唯一の炭素源として利用すると、貪食作用を抑制し、IL-10産生を増加させ、IL-17レベルを低下させることで免疫応答を調節することが示唆されています[51]。この調節により、カンジダは免疫攻撃に対する感受性が低下し、強力な炎症反応を引き起こすことなくヒト膣微生物叢内での生存が促進されます[51]。さらなる研究によってこの観察結果は裏付けられ、カンジダは長期的な共生関係を促進するために免疫応答を積極的に抑制していることが示唆されています[53,54]。 |
| 6.1.再発性外陰膣感染症におけるヒト膣微生物叢 |
| ヒト膣微生物叢の崩壊は、競合する微生物群集が、より不利な環境に適応した微生物群集を優勢にする状態であるディスバイオシス(腸内細菌叢の乱れ)を引き起こす可能性があります。このプロセスは有益なラクトバチルス属菌の減少につながり、膣環境に低濃度で自然に存在するものや性行為によって感染するものなど、日和見病原体に対する宿主の感受性を高めます。持続的な不均衡はディスバイオシスを悪化させ、慢性炎症や、膣炎やその他の外陰膣感染症などの持続性膣感染症につながる可能性があります。これらの感染症は通常、優勢な微生物群集または原因病原体によって分類され、過度の膣分泌物(悪臭の有無にかかわらず)、外陰そう痒、亀裂、疼痛、紅斑、浮腫、排尿困難、性交痛、皮膚病変などの症状の一因となります。これらのうち、異常な膣分泌物は感染症の最も一般的な兆候である[55-58]。 |
| 外陰膣感染症で最もよく見られる3つのタイプは、細菌性膣症(BV)、外陰膣カンジダ症(VVC)、そしてトリコモナス症です[55-58]。これらの疾患が繰り返し発症する再発性外陰膣感染症は、研究対象としてますます関心が高まっています。例えば、細菌性膣症は3ヶ月以内に再発率が30~50%に達すると再発性とみなされ、再発性外陰膣カンジダ症は12ヶ月以内に4回以上の発症があると診断されます[59]。同様に、再発性トリコモナス症も、初回診断から2ヶ月以内の再発率が5~8%と報告されています[60]。 |
| 6.2. 細菌性膣症-ヒト膣微生物叢組成 |
| 細菌性膣症は、乳酸産生細菌の減少とそれに伴う嫌気性細菌の多様性の増加を特徴とするディスバイオティック状態です。この多様な細菌群集には、アナエロコッカス属、アトポビウム属、バクテロイデス属などの菌種、細菌性膣症関連細菌(BVAB1、BVAB2、BVAB3)に加え、ガードネレラ属、レプトトリキア属、モビルンカス属、マイコプラズマ属、ペプトストレプトコッカス属、ペプトニフィラス属、プレボテラ属、スネアチア属などの菌種が含まれます。 |
| 分子生物学的手法の進歩により、細菌性膣症に関連する可能性のある病原体のリストは継続的に拡大しており、培養不可能な微生物も含まれるようになりました。これは、従来の培養法の限界でした[61]。例えば、最近、細菌性膣症に罹患した女性の膣粘膜から、オレグセラ・マシリエンシス(KHD7T株)、エザキエラ・マシリエンシス(マルセイユ P2951T株)、コリネバクテリウム・フルニエリ(マルセイユ P2948T株)という3つの新規株が分離されました[62-64]。さらに、細菌性膣症に罹患した女性では、両方の乳酸異性体のレベルが低下し、膣pHが4.5を超えます[65]。 |
| 6.3. 外陰膣カンジダ症 |
| 外陰膣カンジダ症は、カンジダ属の過剰増殖を特徴とする細菌叢の異常(ディスバイオティック)な状態であり、菌糸体への移行が病態形成の重要な初期段階となる[66]。外陰部の掻痒感、灼熱感、カッテージチーズ状の粘稠で白い膣分泌物などの症状は、生活の質に重大な影響を与え、しばしば社会生活や親密な関係における不快感につながる[67]。さらに、外陰膣カンジダ症は、羊膜内感染症、早産、新生児の低出生体重など、生殖および産科合併症のリスク増加と関連していることが報告されている[68]。 |
| 細菌性膣症と同様に、外陰膣カンジダ症の病因は主に3つの段階に分けられます。上皮細胞への付着、侵入、バイオフィルム形成、そして病原性因子の分泌です。「侵入」プロセスにおいては、凝集素様配列タンパク質(Als3)と分泌型アスパラギン酸プロテアーゼ1(Sap 1)、という2つの重要なタンパク質が機能します[69,70]。 |
| 研究によると、栄養分の枯渇、中性pH、37℃の温度、低いカンジダ細胞密度(107個/mL未満)などの環境要因が相まってカンジダ遺伝子の発現に影響を及ぼし、菌糸形成を誘発することが示されています。これにより、膣上皮細胞への付着が促進され、感染がさらに進行します[71]。これらの遺伝子は、凝集素様配列タンパク質(Als3)、分泌型アスパラギン酸プロテアーゼ(Sap 4~6)、菌糸壁タンパク質、菌糸関連タンパク質(Hgc1、Ece1、Hyr1)などのタンパク質をコードしています[72]。これらのうち、凝集素様配列タンパク質と菌糸壁タンパク質は「接着因子」として機能し、カンジダ・アルビカンスの宿主上皮細胞への付着を促進します[73]。付着後、カンジダは宿主細胞に侵入し、さらなる病原性プロセスを開始します。 |
| 外陰膣カンジダ症の主な治療は依然として抗真菌薬ですが、再発率の高さや薬剤耐性カンジダ株の出現により、その有効性がますます疑問視されています[74]。プロバイオティクスは、最も広範に研究されている代替療法の一つであり、プレバイオティクスや従来の抗真菌治療と併用することで、より良い結果をもたらす可能性があります。免疫調節作用、抗バイオフィルム作用、抗真菌作用に加え、健康な膣マイクロバイオームを回復させる能力があることから、外陰膣カンジダ症の管理に有望な候補となっています[74]。ヒト膣微生物叢移植も、膣エコシステムのバランスを回復させる上で大きな期待が寄せられています。しかし、この分野の研究はまだ初期段階にあり、臨床データや生体内データが限られているため、標準治療としての適用は現時点では制限されています[74]。 |
| 7.腸内細菌叢 |
| 腸内細菌叢は腸内環境に多様な影響を与え、遠隔臓器や系にも影響を及ぼすことから、現在では機能的な内分泌器官として認識されています。腸内細菌叢は、女性の内分泌生殖系において生涯を通じて極めて重要な役割を果たし、エストロゲン、アンドロゲン、インスリンなどのホルモンと相互作用します。腸内細菌叢の乱れは、妊娠合併症、多嚢胞性卵巣症候群、子宮内膜症、がんなど、多くの疾患や病態と関連しています。しかし、これらの相互作用の根底にあるメカニズムは、未だ完全には解明されていません。 |
| 人体に存在する微生物の数はヒト細胞の数とほぼ等しく、これらの微生物の遺伝子含有量はヒトゲノムの少なくとも150倍を上回っていることが広く認識されている[75]。マイクロバイオームは補助的な器官として機能し、生理学的プロセスの調節と維持に積極的に寄与していることを示唆する証拠が増えている。食事、宿主の遺伝的特性、ホルモン調節など、数多くの宿主および環境要因がマイクロバイオームに影響を与える。エストラジオール、プロゲステロン、テストステロンなどの性ホルモンは、宿主と微生物叢とのコミュニケーションにおいて重要な役割を果たし、生殖、細胞分化、アポトーシス、炎症、代謝、脳機能などの重要な生理機能に影響を与える[76]。女性においては、マイクロバイオームは卵胞の成熟、卵母細胞の成長、受精、胚の移動、着床、妊娠、出産など、生殖のあらゆる段階に影響を与える。注目すべきことに、腸内細菌叢と血清ホルモンレベルの間には直線関係が確立されており、「マイクロジェンダーローム」(訳者注:マイクロジェンダーロームとは、性ホルモンによって形成される、性別特異的な生体内の微生物叢(マイクロバイオーム)を指す言葉です。具体的には、男性ホルモンと女性ホルモンが、それぞれ異なる微生物叢の構成に影響を与えることを示しています。この概念は、性別と微生物叢の関係を理解する上で重要です)という新しい概念が生まれています[77]。 |
| 7.1エストロゲンと腸内細菌叢の相互作用 |
| エストロゲンと腸内細菌叢の関係は双方向性があります。エストロゲンは腸内細菌叢に影響を与え、腸内細菌叢はエストロゲンレベルを積極的に調節します。エストロゲンは腸内細菌叢の構成を調節する上で重要な役割を果たしており、エストロゲンを代謝できる微生物群はしばしば「エストロボローム」と呼ばれます[78]。エストロゲン受容体βの発現と血清中のステロイドホルモン濃度、特にエストラジオールは生涯にわたって変動するため、女性の健康全般にとってエストロゲン調節が重要であることが強調されます。腸内細菌叢はエストロゲン代謝に寄与しており、例えば抗生物質の使用はエストロゲンレベルを低下させることが示されています[79]。 |
| 腸内細菌叢は、抱合型エストロゲンを活性な脱抱合型に変換する酵素であるβ-グルクロニダーゼを分泌する[78]。腸内細菌叢の乱れや多様性の低下はβ-グルクロニダーゼの活性を低下させ、エストロゲンと植物性エストロゲンの脱抱合を減少させ、結果として循環する活性型を減少させる。循環エストロゲン濃度の低下はエストロゲン受容体の活性化を阻害し、肥満、メタボリックシンドローム、心血管疾患、認知機能低下などの低エストロゲン状態の一因となる可能性がある[78,80]。逆に、β-グルクロニダーゼ産生細菌の過剰は循環エストロゲン濃度を上昇させ、子宮内膜症や特定の癌などの状態を促進する可能性がある。さらに、エストロゲン濃度は、多嚢胞性卵巣症候群、子宮内膜増殖症、不妊症などの疾患の発症に関与していることが示唆されている[81]。 |
| 研究では、ラクトバシラ目などの特定の細菌目、およびプロテオバクテリア門、バクテロイデス門、フィルミクテス門などの門が、マウスにおけるエストロゲン受容体βの状態によって変化することが示されており、ステロイド受容体の活性と食事組成が腸内細菌叢の多様性に影響を与える可能性が示唆されています[82]。腸内細菌叢のα多様性とエストラジオール濃度の間には負の相関関係が認められており、さらなる調査が必要です。細菌叢の構成は性ホルモンの調節に関与している可能性があり、逆に性ホルモンは微生物の多様性に影響を与える可能性があります[83]。 |
| 最近の研究では、17β-エストラジオールの代謝性エンドトキセミアおよび慢性低度炎症に対する保護効果を媒介する腸内細菌叢の役割も強調されています。実験では、17β-エストラジオールを投与された雄マウスと卵巣摘出雌マウスにおいて、プロテオバクテリアおよびリポ多糖生合成レベルの低下が見られ、これは正常な雌マウスで観察された結果と一致しています。エストロゲンまたはエストロゲン様化合物はリポ多糖産生および腸管透過性を低下させ、代謝性エンドトキセミアのリスクを低下させる可能性があります[84]。さらに、エストロゲンは腸管上皮バリアの完全性を高め、雌は雄と比較して腸管損傷に対する抵抗力が高いことが示されています[85]。 |
| エストロゲンは、子宮内膜がん、子宮頸がん、卵巣がん、前立腺がん、乳がんなど、いくつかのホルモン依存性がんとも関連しています。これらのがんの多くでは腸内細菌叢の組成変化が観察されており、腸内細菌叢ががんの発生と進行に関与している可能性を示唆しています[86]。例えば、高脂肪食に関連するステロイドホルモンが腸内細菌叢に影響を与え、乳がん組織やエストロゲン代謝に影響を与える可能性のある発がん物質を誘導し、腫瘍の増殖に寄与する可能性があると提唱されています。 |
| 腸内細菌叢は、妊孕性、肥満、糖尿病、がんなど、女性の健康の様々な側面に影響を与えます。エストロゲンは腸内細菌叢を調節するだけでなく、エストロゲンの代謝やレベルも調節し、様々な病態に重大な影響を与えます。例えば、エストロゲン代謝物と親化合物の比率の低下と、糞便中の細菌叢の多様性の低下は、閉経後女性の乳がんリスク増加と関連付けられています[87]。 |
| 閉経後女性では、腸内細菌叢の多様性の増加と尿中エストロゲン代謝物の比率の上昇が正の相関関係にあることが示されています[88]。さらに、インスリン抵抗性と2型糖尿病の発症に重要な因子である総脂肪量と腹部脂肪は、閉経後女性では閉経前女性と比較して増加しています[89-91]。これは、腸内細菌叢が閉経期におけるエストロゲンレベルと代謝の調節に重要な役割を果たしている可能性を示唆しています。 |
| さらに、腸内細菌叢は、大豆イソフラボンなどの食品由来のエストロゲン様化合物を代謝することができ、それが善玉菌の増殖を促進します[92]。大豆イソフラボンのサプリメントは、閉経後女性においてビフィズス菌濃度を高め、未分類のクロストリジウム科細菌の増殖を抑制することが知られています[92,93]。この点において、ビフィズス菌は栄養吸収を促進し、免疫機能をサポートし、感染症を予防する一方、クロストリジウム科細菌は炎症や肥満と関連しています。これらの知見は、宿主、腸内細菌叢、そしてエストロゲンの複雑な相互作用が、女性の健康と疾患に影響を与える幅広い経路に影響を及ぼすことを示唆しています。 |
| エストロゲンと腸内細菌叢は相乗的に作用し、妊孕性、肥満、糖尿病、がんなど、女性の健康の様々な側面に影響を与える可能性があります。エストロゲンと腸内細菌叢の相互作用をより深く理解することで、貴重な知見が得られ、女性の内分泌疾患リスクを低減するための新たな戦略につながる可能性があります。 |
| 8.腸内細菌叢、女性生殖器、そして胎児の発育 |
| 腸内細菌叢とその代謝物は、配偶子形成から受精、着床、胎盤形成、流産、出産に至るまで、胎児発育の様々な段階に大きな影響を与えます。多くの研究により、女性生殖器系に腸内細菌が存在することが実証されています[94-96]。早産を経験した女性は、しばしばヒト膣微生物叢中のラクトバチルス・クリスパタス値が低く、スネアシア・アムニ値が高くなります(訳者注:スネアチア・アムニは、フランスのストラスブールでヒトの血液から分離されたスネアチア属の細菌です。スネアチア・アムニは女性の泌尿生殖器の病原体です )。これらの変化は、膣液中の炎症性サイトカインの増加と関連しています[97]。3,201検体を対象とした5つの独立した研究のメタアナリシスでは、早産した女性と正期産まで出産した女性の間で、細菌叢の構成に大きな違いがあることが明らかになりました。さらに、母体の膣内細菌叢は新生児の腸内細菌叢に影響を与える可能性があります。帝王切開で生まれた新生児は、経膣分娩で生まれた新生児に比べて微生物の多様性が著しく低下し、微生物叢が変化していることが示されています[98]。 |
| 最近の分子解析により、子宮腔は無菌ではないことが確認されており、子宮内膜の微生物群集は特定のマクロフローラに由来し、特にバクテロイデス門とプロテオバクテリア門といった消化管微生物叢との関連が顕著であることが実証されている[99]。子宮内微生物叢は安定した集団ではなく、一時的または侵入性の細菌である可能性を示唆する研究者もいるが、子宮の健康と恒常性に対するその潜在的な貢献については依然として議論が続いている[100]。体外受精を受ける女性では、子宮腔内に特定の細菌種が存在することが、着床率や妊娠成功率の低下と関連付けられている[101]。具体的には、ラクトバチルス属が優勢でない子宮内膜微生物叢は、着床率、妊娠率、出生率の低下と関連付けられているが、細菌が胚の着床を妨げる具体的なメカニズムはまだ完全には解明されていない。腸内細菌叢とその代謝物は、着床と胎盤形成中の子宮内膜と子宮の免疫にも影響を与え、局所的な微生物叢の相互作用の媒介として作用する可能性がある[102] |
| 例えば、Th1細胞はヒト子宮内膜における免疫システムの重要な構成要素であり、Th1/Th2比のバランスは適切な着床に不可欠です。腸内細菌叢の乱れは、自然免疫と獲得免疫の両方を活性化する免疫刺激シグナルを発する可能性があります。腸内細菌叢が変化したマウスでは、様々なT細胞サブタイプの分化が阻害されています[103,104]。T細胞は主に子宮内膜の深層に存在するため、着床後の早期胎盤形成において重要な役割を果たしていると考えられています。 |
| 胎盤の健全性と機能は、胎児の成長と発達に極めて重要です。ある研究では、胎盤には代謝産物を豊富に含む微生物叢が存在し、その変動は出生前感染症の既往歴と関連しており、子宮内感染症や早産に影響を与える可能性があることが示されています[96]。最近の研究では、胎便中に大腸菌属細菌が豊富に存在し、極低出生体重児の早期発症型敗血症の重要な原因となっていることが明らかになっています。胎盤は新生児胎便中の大腸菌の感染源として最も可能性が高いと考えられています[105]。 |
| 腸内細菌叢の乱れは、卵母細胞発育障害や排卵異常など、卵巣機能障害を引き起こす可能性があります。ショウジョウバエを用いた研究では、腸内細菌の変化が生殖細胞系列に影響を及ぼすことが示されています。アセトバクターなどの特定の腸内細菌の不在は、卵形成を抑制し、表現型特性を変化させることが分かっています[106]。マウスにおける抗生物質誘発性のディスバイオシスは、発情周期の変化を招き、ディスバイオシス群では卵母細胞面積の減少と透明帯厚の増加が認められました[107]。卵巣疾患を持つ女性の糞便微生物叢をマウスに移植すると、卵巣機能障害と生殖能力の低下が起こります[108]。一方、ラクトバチルス属菌または健康なラットの糞便微生物叢を投与すると、発情周期が回復し、卵巣の形態が正常化します[109]。さらに、肥満に関連する腸内細菌叢の乱れは、メタボリックシンドロームに伴う卵巣機能障害に重要な役割を果たしている[110]。肥満は卵巣機能と卵母細胞の質に悪影響を及ぼしますが、肥満女性に対する減量手術は排卵パターンの正常化、妊孕性の向上、胎児の健康増進に効果があることが示されています。これらの改善は、腸内細菌叢の変化に起因する可能性があります[111]。 |
| 卵胞液中の微生物叢は、体外受精の結果に影響を与えることが示されています。特に、特定の微生物、特にラクトバチルス属は、胚の質の向上、胚移植率および妊娠成功率の向上と関連しています[112]。最近の研究では、卵胞液中のトリメチルアミンN-オキシドおよびその腸管前駆物質であるガンマブチロベタイン濃度の低さが、高品質の胚の発育と関連していることが示唆されており、微生物叢依存性代謝物が胚発育を予測する貴重なバイオマーカーとなる可能性を示唆しています[113]。結論として、腸内微生物叢は女性の生殖器系の健康と密接に関連しています。今後の研究では、生殖障害のある女性の妊孕性を高めるために治療的に標的とすることができる、特定の微生物叢関連因子の特定に焦点を当てるべきです。 |
| 9.短鎖脂肪酸と腸・脳・性のつながり:神経生物学的視点 |
| 腸-脳系は、気分や全体的な健康状態を調節する重要な因子として浮上しており、性機能に直接的な影響を及ぼします。腸内細菌叢は宿主の生理機能において基本的な役割を果たし、行動や感情反応を調節する神経化学的および内分泌的プロセスに影響を与えます。腸内細菌叢の乱れは、この双方向のコミュニケーションを阻害し、気分障害の一因となり、モチベーションや機能など、性生活の重要な側面に影響を及ぼす可能性があります[114]。 |
| この関係性を理解する上で重要な要素は、腸内細菌による難消化性繊維の発酵であり、酪酸、酢酸、プロピオン酸などの短鎖脂肪酸の生成につながります(表1)。これらの短鎖脂肪酸は、腸管の健全性の維持や免疫系の調節から、脳の健康に不可欠な神経活性特性の発揮まで、宿主内で多様な機能を果たします[115]。腸-脳軸におけるその役割は、主に2つの主要なメカニズムによって媒介されます。第一に、短鎖脂肪酸は神経伝達に不可欠な特定のGタンパク質共役受容体のリガンドとして機能します[116]。第二に、短鎖脂肪酸は脳の発達、神経可塑性、および神経精神疾患の重要な調節因子であるヒストン脱アセチル化酵素を調節します[116]。 |
| 表1. 短鎖脂肪酸:組成、吸収、循環レベル |
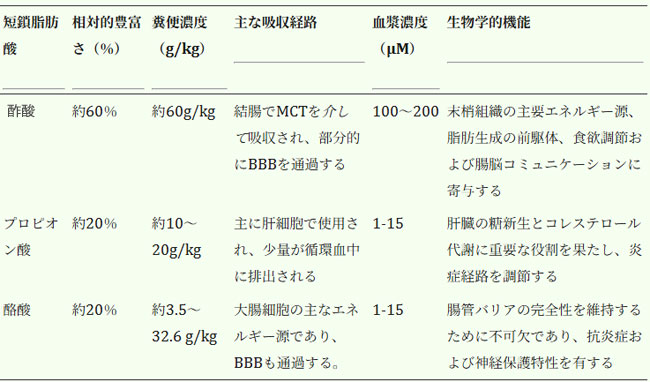 |
| MCT: モノカルボキシレートトランスポーター、BBB: 血液-脳関門。 |
| 短鎖脂肪酸は主に結腸で合成されるため、血液-脳関門を通過する能力は研究対象となっている。腸管および内皮細胞に存在する特定のトランスポーターが短鎖脂肪酸の吸収を促進し、代謝物が脳に到達することで血液-脳関門の健全性維持に寄与し、神経伝達物質のレベルを調節し、神経活動に影響を与える[117]。神経伝達物質の恒常性維持における役割を考えると、短鎖脂肪酸は気分関連の神経化学に直接影響を与え、グルタミン酸、グルタミン、γ-アミノ酪酸(GABA)、セロトニン、ドーパミン、ノルエピネフリン、エピネフリンのレベルを調節する[117]。これらの神経伝達物質は性行動と密接に関連しており、欲求、覚醒、報酬処理に影響を与える。その結果、短鎖脂肪酸の産生に変化が生じると、性的な動機、快楽、そして全体的な満足度が低下する可能性がある。 |
| 腸内細菌叢はミクログリア細胞の恒常性維持にも重要な役割を果たし、シナプス刈り込みや神経免疫調節に影響を与えます。ミクログリアは中枢神経系の主要な免疫細胞として機能し、神経接続とシナプス機能を積極的に調節しています[117]。短鎖脂肪酸の不均衡によるミクログリア活動の調節不全は、感情的および社会的機能不全の一因となり、個人の性体験にもさらに影響を及ぼす可能性があります。短鎖脂肪酸は神経炎症やミクログリアの恒常性維持に影響を及ぼすだけでなく、神経内分泌経路、特に身体のストレス反応の中心的な調節因子である視床下部-下垂体-副腎(HPA)系にも影響を与えます。研究では、短鎖脂肪酸の投与が急性の心理社会的ストレスに対するコルチゾール反応を弱めることができることが示されており、短鎖脂肪酸が腸と脳の双方向コミュニケーションに寄与し、気分調節や感情的回復力に影響を与えることが示唆されています[118]。短鎖脂肪酸、ミクログリア、そして性的健康の関連性は依然として研究途上の分野ですが、腸内細菌叢の構成が神経精神医学的および行動学的結果に大きく影響し、ひいてはヒトの性的側面に影響を及ぼすことは明らかです。短鎖脂肪酸産生における役割に加え、一部の腸内細菌は神経伝達物質を直接合成し、宿主の生理機能や行動に影響を与えることができます。特に、ビフィドバクテリウム属菌とラクトバチルス属菌は、ストレス調節に関与する抑制性神経伝達物質であるγ-アミノ酪酸を産生します。一方、大腸菌属菌、ストレプトコッカス属菌、カンジダ属菌、バチルス属菌は、セロトニンとドーパミンの生合成に寄与します[119]。これらの微生物由来の神経伝達物質は、快楽、動機づけ、そして性的報酬経路において基本的な役割を果たしています。脳への直接的な影響はBBBの選択的透過性により限定的であるものの、腸管神経系や迷走神経シグナル伝達との相互作用を介して間接的な影響を及ぼす。さらに、ビフィドバクテリウム・インファンティスなどの特定の細菌株は、循環トリプトファン濃度を高め、脳内のセロトニン利用能を高め、気分や性欲の改善につながる[119]。同様に、フェニルアラニン生合成への微生物の関与は、ドーパミンとノルエピネフリンの産生を促進し、性欲と性衝動をさらに増強する可能性がある[119]。 |
| 炎症と腸管透過性も、性機能の調節において重要な役割を果たしている。腸内炎症は、しばしば腸内細菌叢の乱れと関連し、リポ多糖などの細菌性エンドトキシンの産生増加を招き、免疫経路を活性化し、神経炎症の一因となる[120]。これらの炎症カスケードには、Toll様受容体4の活性化と炎症性サイトカイン(IL-1β、IL-6、腫瘍壊死因子α)の放出が関与し、最終的には感情調節を担う大脳辺縁系の構造に影響を及ぼす[120]。 |
| 動物モデルは、全身性炎症と性行動障害の関連性を強力に裏付けています。ラットでは、新生児期のリポ多糖曝露は思春期の時期に影響を与え、成体期の性機能を阻害し、精子の生存率を低下させます。これらの影響は、視床下部-下垂体-性腺系およびホルモン調節における長期的な変化を伴い、早期の免疫活性化がその後の人生における生殖および性機能に悪影響を及ぼす可能性があることを浮き彫りにしています[121]。炎症性腸疾患患者の臨床データは、この関連性をさらに強調しています。女性では、活動性胃腸症状が性機能障害と有意に関連し、重度のうつ症状が最も強力な独立予測因子として浮上しました。男性では、不安症状が勃起不全と最も強く関連していました。興味深いことに、これらの心理的変数は粘膜炎症の客観的指標よりも予測力が高く、腸の免疫活性、感情面の健康状態、および性機能の健康状態の間に複雑な相互作用があることを示唆しています[122]。これらの研究結果を総合すると、炎症と腸管透過性が、特に気分、ストレス反応、ホルモン調節を変化させることにより、神経免疫経路と神経内分泌経路を通じて性機能に間接的に影響を及ぼす可能性があるという考えが裏付けられます。 |
| 次の表は、腸内細菌叢、炎症、そして性的健康を結びつける主要なメカニズムをまとめたものです(表2)。腸の炎症によるドーパミンとセロトニンの伝達の調節不全は、快楽の知覚を損ない、性的な関心と満足度を低下させる可能性があります。腸と脳のつながりは、主に腸管神経系と自律神経系、特に腸から脳へ情報を伝達する迷走神経求心性神経によって媒介されています[123]。迷走神経線維の約80%が求心性シグナルを伝達しており、腸内細菌叢由来の代謝物と免疫因子が中枢神経系機能に強い影響を与えていることが示唆されています。この双方向のコミュニケーションは、迷走神経シグナル伝達の乱れが気分障害と関連付けられているため、感情的な幸福感と性機能にとって不可欠です[123]。迷走神経の刺激は、報酬処理と性的興奮に不可欠な神経伝達物質、特にセロトニンとドーパミンのレベルを正に調節することが示されています。蓄積された証拠は、腸内微生物の活動が、性的健康に関連するものも含め、感情的および行動的反応を形作ることを示唆していますが、正確なメカニズムはまだ完全に解明されていません (図 1)。 |
| 表2.腸内細菌叢の炎症と性機能への影響 |
 |
| SCFA: 短鎖脂肪酸; IL: インターロイキン; TNF-α: 腫瘍壊死因子α; GPCR: Gタンパク質共役受容体; NF-κB: 核因子κB; TLR4: Toll様受容体4; HPA: 視床下部-下垂体-副腎; 5-HT: セロトニン; DA: ドーパミン; NE: ノルエピネフリン; Ach: アセチルコリン; NO: 一酸化窒素; PG: プロスタグランジン; LPS: リポ多糖; Treg: 制御性T細胞; GABA: ガンマアミノ酪酸。 |
 |
図1 短鎖脂肪酸と腸・脳・性のつながり。 短鎖脂肪酸の産生、性ホルモン、免疫シグナル伝達、迷走神経によるコミュニケーションの複雑な相互作用は、腸内細菌叢が気分と性機能の調節に重要であることを強調しています。 SCFA:短鎖脂肪酸。 |
| 10.腸内細菌叢と性的幸福の相互作用における心理的側面 |
| 腸内細菌叢は、脳-腸軸を通じて、テストステロンやエストロゲンなどの性ホルモンの産生と代謝を調節し、健康な性機能に不可欠な役割を果たします。腸内細菌叢の乱れは、短鎖脂肪酸などのホルモン調節と血管の健康維持に不可欠な微生物代謝物の産生を阻害する可能性があります[124]。これらの阻害は、性ホルモンレベルの不均衡、炎症の増加、内皮機能不全につながる可能性があり、これらはすべて性機能にとって重要な要因です[125]。さらに、腸内細菌叢が脳-腸軸に及ぼす影響は、性機能不安(SPA)や性欲減退などの心理的要因にも寄与する可能性があり、腸内細菌叢の健康と性的幸福の相互関連性を強めています(図2)。 |
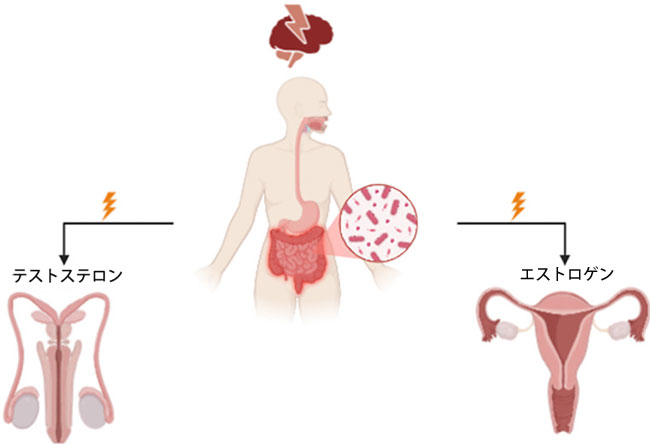 |
図2. 腸内細菌叢と性的健康の関係における心理的要因。 性的健康は腸内細菌叢と密接に関連しており、腸内細菌叢は腸-脳軸を通じてホルモンバランスと精神的健康を調節します。このシステムは、テストステロンやエストロゲンなどの性機能に不可欠な性ホルモンの産生と代謝に影響を与えます。腸内細菌叢の乱れは、ホルモンバランスの乱れ、炎症、内皮機能不全を引き起こし、性的機能に悪影響を及ぼす可能性があります。さらに、腸内細菌叢は精神的健康にも影響を与え、パフォーマンス不安や性欲減退などの問題の一因となることから、性的健康における腸内細菌叢の重要な役割が改めて強調されます。 |
| 性機能不安は最も一般的な性障害の一つです。性行為中または性行為前に生じる一種の不安として現れます。性機能不安に苦しむ人は、自分のパフォーマンス、パートナーの満足度、勃起、またはオーガズムについて不安を抱えることがあります。この症状は男女ともに発症する可能性があり、性生活の質や人間関係の質に悪影響を及ぼします。主な原因としては、パートナーを満足させたいというプレッシャーや、理想的な性行為の基準を満たさなければならないというプレッシャーが大きな役割を果たしている、高い期待感などが挙げられます。過去の性的な問題を含む否定的な経験は、恐怖と不安の悪循環を引き起こす可能性があります。精神的および肉体的なストレス、そして疲労は、不安関連の症状を悪化させる可能性があります。特に低い自尊心や外見への不満といった、身体イメージに関する懸念は、しばしば不安感を高めます。感情的な葛藤やコミュニケーションの障壁に起因する人間関係の困難は、パフォーマンス不安をさらに助長する可能性があります。さらに、セクシュアリティやパフォーマンスに関する誤った情報や非現実的な信念は、心理的苦痛を悪化させる可能性があります[126,127]。 |
| 男性では、勃起不全、早漏、射精遅延などの症状がよく見られます。女性の場合、この症状は性欲減退、性的興奮困難、性交痛のような性交時の痛みとして現れることが多い[128]。性機能不安に伴う身体的反応としては、発汗、心拍数の増加、震え、性行為前または性行為中の筋肉の緊張などが挙げられます。心理的反応としては、強迫的な心配、集中力の低下、羞恥心、罪悪感などが挙げられます。性機能不安は性体験にいくつかの悪影響を及ぼす可能性があり、例えば、失敗への恐怖が緊張を高め、それが性交困難のリスクを高め、不安の悪循環を悪化させるという悪循環に陥ることがあります。性機能不安は回避行動につながる可能性があり、不安から逃れるために親密な関係を避け始め、最終的には関係に影響を与える可能性があります。さらに、不安が今この瞬間から気をそらし、感情的なつながりや関与を弱めるため、快感も減少します。 |
| これらの不安は、血管を収縮させるエピネフリンやノルエピネフリンなどのストレスホルモンの分泌を誘発する可能性があります。このメカニズムは性機能の低下を招き、不安とストレスの悪循環を引き起こし、性機能障害を悪化させ、持続させる可能性があります[129]。また、腸内細菌叢は腸脳相関を介して作用し、心理的勃起不全だけでなく器質的勃起不全の発生にもつながり、血管内皮機能障害や性ホルモン代謝の異常を引き起こし、脂質代謝、免疫、内分泌調節に影響を及ぼす可能性があります[130]。 |
| 勃起不全患者の遺伝子配列解析研究で特定された腸内細菌叢の多様性の低下は、性ホルモンレベルおよび全体的な性的健康の変化と相関している[131]。性機能不安に関する研究のほとんどは、男性の経験、特に勃起機能と早漏に焦点を当てている。しかし、女性の経験や性機能不安関連の問題における人間関係のダイナミクスの役割についてはほとんど注目されていない[132]。女性の視点から見ると、性的幸福感は、ホルモン、身体、感情的要因の影響を受け、人生の様々な段階を通して変化する。月経周期においては、ホルモンの変動が性欲に影響を与える[133]。排卵期はエストロゲンレベルの上昇により性欲が高まることが多い一方、黄体期および月経期は、一部の女性において性欲減退や不快感につながる可能性がある。妊娠初期には、吐き気、疲労、不安により性的関心が低下する可能性がある。中期には、血流と潤滑の増加により性欲と性的満足度が向上することが多い。妊娠後期には、身体的不快感、身体の変化、出産に対する心理的な不安から、親密な関係が減退する可能性があります[134]。出産後、女性の身体は大きな身体的・精神的変化を経験し、それが性生活に影響を及ぼす可能性があります。エストロゲンの低下やオキシトシンの変動といったホルモンバランスの変化によって性欲が減退し、膣の乾燥が起こり、性交時の快適さが損なわれます。会陰損傷や帝王切開などの出産後の身体的回復は、痛みや親密な関係への恐怖につながる可能性があります。体重の変化、ストレッチマーク、自己認識などからくる身体イメージへの不安は、自信や性欲に影響を与えることがよくあります。疲労、新生児の世話によるストレス、産後うつ病などの感情的要因も、性的関係にさらに影響を与える可能性があります[135]。更年期には特有の問題があり、エストロゲンの減少によって膣の乾燥、組織の菲薄化、性交時の不快感などが生じます[136]。テストステロン値の低下は性欲を減退させる可能性があり、ほてり、気分のむら、自尊心の問題などの身体的および感情的な変化も性的健康に影響を与える可能性があります。しかし、ホルモン補充療法などの治療やパートナーとのオープンなコミュニケーションは、満足のいく性生活を維持するのに役立ちます。性的問題の有病率は加齢とともに増加します(45歳から64歳の間では44.6%ですが、65歳以上では80.1%)[137]。最近の研究では、健康不安と性欲の間に逆相関関係があること、および健康不安と性交痛の間には直接的な関係があることが示されました[138]。更年期における腸内細菌叢の多様性の変化は健康不安と相互作用し、性欲の低下につながる可能性があります[139]。細菌叢を標的とした介入を通じてこれらの不均衡に対処することで、女性の不安を軽減し、性的健康の改善を促進する可能性があります[140]。 |
| 腸内細菌叢、腸管、脳の双方向の相互作用は、このシステムが性的健康において重要であることをさらに強調しています。心理的ストレスは腸内細菌叢に重大な影響を及ぼし、微生物の多様性を減少させ、腸内細菌叢の乱れ(ディスバイオシス)を促進し、それが性的健康に直接影響を及ぼします[141,142]。慢性的なストレスは、男女ともに性欲維持に不可欠なホルモンであるテストステロン値を低下させる傾向があります。この影響は、性ホルモン産生を阻害するコルチゾールの増加によって増幅され、性欲減退につながります。男性の場合、ストレスは勃起障害、早漏、射精遅延を引き起こす可能性があり、これらは交感神経系の活性化によって引き起こされる性器への血流減少や筋緊張と関連していることが多いです[143]。女性の場合、性的興奮障害、潤滑不足、性交痛などの性交痛として現れることがあります[144,145]。ストレスは、今この瞬間に集中する能力を低下させ、肉体的・感情的な関与を弱めることで、性体験の質にも悪影響を及ぼします。パフォーマンスへの不安や外的要因に関する侵入的な思考は、親密な関係への注意を逸らし、パートナーとの繋がりを損ないます。さらに、長期にわたるストレスは、性生活における不満やフラストレーションを助長し、感情的な人間関係に悪影響を及ぼし、葛藤や感情的な距離感のリスクを高めます。 |
| 腸内細菌叢の乱れは、免疫活性化や炎症など一連の生理的・心理的混乱を引き起こし、全身機能障害や性機能障害につながります。また、気分、行動、性欲に影響を与える神経伝達物質(特にセロトニン)の調節が乱れ、ストレス反応が亢進し、性機能不安やその他の精神的健康問題に対する脆弱性が高まります[146]。性ホルモンとの相互作用を通じて、腸内細菌叢は性的健康の重要な側面を調節することができます。実際、性ホルモンの調節は、テストステロン、エストロゲン、その他の必須ホルモンの産生と代謝を阻害し、男性と女性の両方の性欲と性的機能に影響を及ぼす可能性があります。腸内細菌叢の乱れが勃起機能に及ぼす影響は、勃起不全の一因となる内皮機能障害や代謝障害と関連付けられており、既存のストレスや不安の状態を悪化させます[147]。腸内細菌叢は、精神的健康、身体的健康、性的健康の間の重要な架け橋として機能します。ストレス、微生物叢、性ホルモンの相互作用を理解し、調整することで、男性と女性の両方の生活の質と性的健康を向上させる新たな機会が生まれます[148]。 |
| 性欲減退、早漏、勃起不全などの性機能障害は、感情障害と関連することが多い[149]。うつ病は性的健康と密接に関連しており、性機能の身体的側面だけでなく、感情的および人間関係のダイナミクスにも影響を及ぼす。この関係は特に無快感性うつ病において顕著であり、顕著な快楽の喪失は深刻な性的問題と特に関連していることが報告されている[150]。うつ病は、ホルモンの不均衡、神経伝達物質の攪乱、気分の落ち込み、疲労、自尊心の低下といった心理的影響など、複数の経路を通じて性的健康に影響を与える。うつ病と性機能障害の関連性を裏付ける重要なメカニズムの一つは、神経化学的経路の変化である。うつ病は、気分調節、覚醒、性欲に不可欠な神経伝達物質であるセロトニン、ドーパミン、ノルエピネフリンの濃度低下と関連している。例えば、ドーパミンの活動低下は性欲減退や快楽を感じにくくなることと関連付けられており、セロトニンの不均衡はオーガズム遅延や無オーガズム症の一因となる可能性がある。うつ病はしばしば視床下部-下垂体-副腎軸の調節不全などのホルモンの混乱を引き起こす[151]。ストレスやうつ病エピソードによる視床下部-下垂体-副腎軸の慢性的な活性化はコルチゾール値の上昇につながり、性ホルモンの生成に悪影響を与える可能性がある。男性では、これがテストステロン値の低下につながり、勃起不全や性欲減退につながる可能性がある。女性では、ホルモンの不均衡により排卵、覚醒、潤滑が妨げられ、性的満足度が低下する可能性がある。心理的要因が問題をさらに複雑にする。うつ病によく見られる無価値感、罪悪感、自尊心の低さは、親密な関係における自信を損なう可能性がある。否定的なボディイメージや拒絶への恐怖はこれらの問題を悪化させ、性的親密さへの障壁を作り出す。さらに、うつ病に伴う疲労感や意欲の欠如は、性行為への関心を減退させ、パートナーとの回避や断絶の悪循環に陥らせる可能性があります。うつ病と性機能障害の関係は双方向です[152]。うつ病は性的な困難につながる可能性がありますが、性機能障害が解決されない場合、うつ病の症状が悪化することがよくあります[153]。例えば、勃起不全の男性は、不十分さや不安を感じ、気分が悪化する可能性があります。同様に、性欲減退や性交痛などの問題を抱える女性は、フラストレーションや孤立感を感じ、悲しみや絶望感を強める可能性があります[154]。抗うつ薬はうつ病の治療に不可欠ですが、性機能障害を悪化させる可能性もあります[155-157]。これらの副作用は、治療の継続を阻害することが多く、うつ病エピソードやそれに伴う性的な健康問題を長期化させる可能性があります。 |
| 女性性機能障害(FSD)は、この相互作用における重要な側面ですが、しばしば見落とされています。女性の場合、うつ病は主に性欲と覚醒に影響を及ぼし、オーガズムに達したり快感を経験したりすることが困難になります。女性の性機能障害の心理的負担は、社会的な偏見と相まって、女性が助けを求めることを躊躇させることが多く、親密な関係における苦痛と不満の連鎖を永続させています[158]。うつ病に関連する男性の性機能障害は、通常、性欲減退、勃起不全、射精障害の組み合わせとして現れます。男性にとって、精神的健康と性的パフォーマンスの両方を取り巻く偏見は特に困難であり、治療を求めるのが遅れ、問題をさらに悪化させる可能性があります[159]。 |
| 腸の健康は、身体的な側面だけでなく、自己認識にも大きく影響し、自信や性的な関係にも影響を与えます。この関係は摂食障害において特に顕著であり、腸内細菌叢の乱れ、心理的ストレス、性機能障害が複雑で多面的な課題を引き起こします。神経性無食欲症(AN)、神経性過食症(BN)、肥満は、これらの相互作用が異なるメカニズムを通じてどのように現れるかを例示しています[160]。エストロゲンやテストステロンの低下などのホルモンの不均衡はANによく見られ、性欲減退、親密な関係の困難、性機能障害の一因となります。神経性無食欲症の女性は内分泌のかく乱により無月経を経験することが多く、性的健康をさらに低下させます。一方、男性はテストステロンの低下に苦しみ、性欲減退や勃起不全につながる可能性があります[161]。 神経性無食欲症に伴う激しいボディイメージの歪みと低い自尊心は、親密な関係を築く上での困難を増幅させ、健全な人間関係への障壁となり、孤立を強めます[162]。神経性無食欲症では、厳しいカロリー制限と偏食は腸内細菌叢の多様性の低下につながり、健康状態の悪化と関連しています[163]。この腸内細菌叢の乱れは、不安、抑うつ、ボディイメージの歪みといった症状を悪化させ、性的な健康にも悪影響を及ぼします[164]。腸と脳の双方向のコミュニケーションは、腸の健康が精神的および性的健康の両方において重要な役割を果たすことを強調しています。 |
| 過食症(BN)は、過食の後に自発的な嘔吐や下剤の使用といった代償行動を伴う症状を特徴とし、深刻な胃腸障害とホルモンの不均衡を引き起こす[165]。これらのメカニズムはドーパミン系を変化させ、衝動制御、快楽、性的満足感に影響を与える[166,167]。過食行動に伴う罪悪感や羞恥心は、自尊心の低下や健全な性欲の発現の困難につながり、自身の身体との葛藤を生み出す。過食症に典型的な体重の変動は、身体に対する否定的な認識をさらに悪化させ、性行為における不快感やパートナーからの非難への恐怖を増大させる[168]。生理学的には、過食症に伴う電解質の枯渇とホルモンの変化は、膣の潤滑を減少させ、月経不順を引き起こし、女性の性機能をさらに損なう可能性がある[169]。男性では、ホルモンの変動により性欲が低下し、勃起不全や射精障害になりやすくなる[170]。肥満は過食症に見られるものと同様の心理的・代謝的ダイナミクスを伴うことが多く、性的な健康に重大な影響を及ぼす。過剰な脂肪組織は、男性ではエストロゲンレベルの上昇、テストステロンレベルの減少につながり、性欲と勃起機能に悪影響を及ぼす。女性では、ホルモンの不均衡により月経周期の不規則化、性的興奮の困難、性器の感度の低下が生じる可能性がある[171,172]。肥満によく見られるインスリン抵抗性と慢性炎症は血液循環を悪化させ、男女ともに性的反応をさらに損なう[173,174]。心理的には、身体イメージへの不満、判断への恐怖、性機能不安が性活動の低下、不満、親密な関係の困難につながる可能性がある[175]。 |
| 腸内細菌叢が性機能の調節に果たす役割は、これらの疾患の重要な要因としてますます認識されています。摂食障害のある人によく見られる腸内細菌叢の組成変化は、気分調節、性欲、快楽の知覚に不可欠なセロトニンやドーパミンなどの神経伝達物質の産生に影響を与えます[176,177]。腸内細菌叢の乱れは性ホルモンや代謝にも影響を与え、性機能障害と心理機能障害の両方の持続に寄与します[178-180]。摂食障害、肥満、性機能障害の関連性を理解することは、標的を絞った介入戦略の開発に不可欠です[181]。心理的、栄養学的、内分泌学的サポートを組み合わせた学際的な治療アプローチは、身体と性生活との健全な関係を回復するのに役立ちます。腸内環境の回復は、うつ症状を緩和すると同時に、性欲、性的興奮、そして全体的な満足度を向上させる可能性があり、精神的および性的健康を向上させるための包括的な道筋を築くことができます[182]。体のイメージに関する懸念に対処し、自尊心を強化することは、充実した、条件付けのないセクシュアリティを促進するための基本的なステップです。 |
| 11.腸内細菌叢、食事、そしてメンタルヘルス:全身的および性的健康への影響 |
| ヒトの腸内細菌叢の恒常性維持は、健康全般にとって極めて重要です[183]。この均衡が崩れると、腸管バリアの完全性が損なわれ、慢性炎症が促進される可能性があります[184]。その結果、肥満、メタボリックシンドローム、肝硬変、神経変性疾患、心血管疾患、炎症性腸疾患、セリアック病、過敏性腸症候群、糖尿病、そして様々な自己免疫疾患など、腸内細菌叢に関連する様々な疾患の発症につながる可能性があります[185]。腸内細菌叢の構成には、いくつかの要因がプラスの影響を与え、全身的な健康効果をもたらします。その中でも、食事介入は、細菌叢の動態を調整する上で重要な役割を果たします。これらの戦略には、発酵食品の摂取、食物繊維を豊富に含む食事の遵守、プロバイオティクス、プレバイオティクス、シンバイオティクスの摂取など、幅広いアプローチが含まれます[186]。こうした介入は、日常的な食品から専門的な医薬品や医薬品に至るまで、多様かつ多様な形で利用可能であり、個人の健康ニーズや好みに合わせて適応させることができます。 |
| プロバイオティクス、プレバイオティクス、シンバイオティクスは、科学文献において明確に定義されています。プロバイオティクスとは、「適切な量を投与することで宿主に健康上の利益をもたらす生きた微生物」[187]のことです。プレバイオティクスは、宿主微生物が選択的に利用して健康上の利益をもたらす基質と定義されています。シンバイオティクスは、当初はプロバイオティクスとプレバイオティクスの単なる組み合わせと考えられていましたが、現在では、生きた微生物と、宿主微生物が選択的に利用して宿主に健康上の利益をもたらす基質を含む混合物と定義されています[188]。ポストバイオティクスとは、微生物由来の健康促進性生理活性化合物を指し、微生物叢の調節における重要な革新を表しています。生菌として投与する必要があるプロバイオティクスとは異なり、ポストバイオティクスは不活性化された微生物とその成分で構成されており、宿主に有益な効果をもたらします[189]。 |
| 最近の研究では、特定のプロバイオティクス株、特にラクトバチルス属やビフィズス菌属のサプリメントを摂取すると、気分調節や認知機能に不可欠なセロトニンやドーパミンなどの主要神経伝達物質のレベルが上昇することが示されています[190-192]。これらの効果は気分に良い影響を与え、間接的に性機能にも影響を与えます。これらの効果の根底にある主要なメカニズムは、脳-腸軸の調節です[9]。生理的に健康な状態では、微生物群集と宿主細胞がバランスよく相互作用し、脳-腸軸内の恒常性を維持しています。この均衡は、相互につながった生物学的ネットワークが適切に機能するための基礎であり、全体的な健康と幸福に重要な役割を果たしています。新たな証拠は、腸内細菌叢が脳-腸軸と共進化し、脳の発達、機能、そして気分関連のプロセスに影響を与えていることを示唆しています。腸管-脳-微生物叢軸の調節不全は、大うつ病[193]、不安障害[194]、双極性障害[195]などの神経精神疾患との関連が示唆されており、精神衛生におけるその重要性を改めて強調しています。さらに、プロバイオティクスは、気分障害や性機能障害と密接に関連する因子である酸化ストレスと全身性炎症の軽減に寄与します。γ-アミノ酪酸、オキシトシン、脳由来神経栄養因子(BNR)を介したシグナル伝達経路を調節することで、プロバイオティクスは不安、食欲、気分といった宿主の行動に影響を与えます[196,197]。これらの効果は迷走神経の活性化を介して媒介されるため、腸管-脳軸が神経行動調節において果たす役割がさらに強調されます。 |
| バランスの取れた食事に加えて、プロバイオティクスのサプリメント摂取は腸内細菌叢の健康維持に不可欠であり、気分障害や性機能障害の管理における有望な非侵襲的治療戦略となります。プロバイオティクスは、腸-脳軸の調節、酸化ストレスの軽減、全身性炎症の緩和により、これらの疾患への介入として大きな可能性を秘めています。しかし、最も効果的なプロバイオティクス株を特定し、臨床的に意義のある結果を得るための最適な投与量を確立するには、さらなる研究が必要です。プロバイオティクスの使用を補完するバランスの取れた食事は、健康な腸内細菌叢の維持に重要な役割を果たしており、この関係性は十分に裏付けられています[198,199]。Wilsonら[200]が指摘したように、地理的な食習慣は腸内細菌叢の構成に大きな影響を与え、地域の食習慣と微生物生態との相互作用を反映しています。例えば、アフリカの農村部では、伝統的な高繊維食は、非感染性疾患に対する保護効果を持つフェカリバクテリウムなどの酪酸産生細菌の優位性と関連しています。一方、都市化と高脂肪・低繊維摂取を特徴とする西洋化された食生活の採用は、微生物多様性の減少と、肥満や大腸がんなどの腸内細菌叢異常(ディスバイオシス)関連疾患の有病率の増加につながっています。同様の傾向はアジアでも見られ、低脂肪・高炭水化物食から高脂肪の西洋化された食生活への移行は、短鎖脂肪酸産生細菌の減少と炎症性疾患の増加に関連しています。これらの知見は、地域的な食生活パターンが腸内細菌叢の構成に及ぼす重要な影響と、それが健康に及ぼすより広範な影響を強調しています。 |
| 全粒穀物、果物、野菜、豆類などの高繊維食は、腸内細菌、特にビフィドバクテリウムやフェカリバクテリウムといった短鎖脂肪酸産生菌の増殖を促進します。Tanら[201]によると、食物繊維と腸内細菌叢による発酵で生成される短鎖脂肪酸は、粘膜免疫の調節と慢性疾患の予防に重要な役割を果たします。短鎖脂肪酸は、腸管上皮細胞および免疫細胞上の特定の受容体(Gタンパク質共役受容体(GPR)41、GPR43)と相互作用し、バリア機能の強化、炎症の軽減、血管機能の改善をもたらします[202]。これは特に性機能の向上と炎症の軽減に関連し、性機能の最適化に寄与します。さらに、ヨーグルト、ケフィア、ザワークラウト、味噌などの発酵食品は、天然のプロバイオティクス源として機能し、腸内細菌叢の安定性と回復力をさらに促進します。予備的な研究では、発酵食品を食事に取り入れることで、腸-脳軸シグナル伝達と代謝プロセスに影響を与えるため、心臓血管パラメータの改善、エネルギーレベルの向上、性欲の増進につながる可能性があることが示唆されています[203]。 |
| これらの効果は性的な健康にも重要な意味合いを持つ。食物繊維の発酵によって生成される短鎖脂肪酸は、健康な性機能に不可欠な2つの要素である内皮機能を改善し、全身性炎症を軽減する[7]。内皮機能の向上は、覚醒と勃起機能の基礎となる性器の血流をサポートする。同時に、炎症状態の軽減はホルモンバランスと性欲の維持にも役立つ。短鎖脂肪酸は、Gタンパク質共役受容体(GPR41およびGPR43)の活性化や一酸化窒素のバイオアベイラビリティの向上など、複数の経路を通じてこれらの効果を発揮し、これらが相まって血管緊張の改善と抗炎症シグナル伝達に寄与する[204]。最近の研究では、短鎖脂肪酸が生殖管の粘膜の完全性と免疫反応にも影響を与え、性的な健康に好ましい環境をもたらす可能性が示唆されている[205]。逆に、腸内細菌叢の乱れや短鎖脂肪酸産生細菌の減少は性機能障害と関連付けられており、これはおそらく、微生物バランスの乱れに伴う慢性的な低レベルの炎症や血管障害に起因すると考えられます。したがって、食物繊維由来の短鎖脂肪酸は、代謝や腸の健康における既知の役割に加え、食事と性機能の重要なメディエーターとして機能する可能性があります[206]。新たなエビデンスは、特に高繊維食を通じた短鎖脂肪酸レベルの回復を目的とした栄養介入が、性機能改善のための非侵襲的なアプローチとなる可能性を示唆しています。 |
| さらに、食物繊維を豊富に含む食事は短鎖脂肪酸の産生を維持し、腸内環境、全身、そして性機能の健康に対する幅広い効果を強化します。一方で、西洋化されたライフスタイルに特徴的な低繊維食は、短鎖脂肪酸レベルの低下と強く関連しています[207]。同時に、精製糖や飽和脂肪酸を多く含む食事は腸内細菌叢の乱れを悪化させ、微生物の多様性の低下と病原菌の過剰増殖を招き、炎症性疾患、代謝性疾患、神経変性疾患のリスクを高めます[208]。この腸内細菌叢の乱れは、代謝機能や性機能障害の一因として知られている慢性的な低レベルの炎症と密接に関連しています。腸内環境と性機能の健康をサポートするためには、微生物の多様性を促進し、炎症を軽減することに重点を置いた食事戦略が重要です。脂肪分の多い魚、亜麻仁、クルミに豊富に含まれるオメガ3脂肪酸は、抗炎症作用と血管の健康維持に寄与する役割により、大きなメリットをもたらします。血管の健康は、最適な性機能に不可欠です[209]。同様に重要なのは、精製糖や飽和脂肪酸を多く含む有害な食品の摂取を最小限に抑え、微生物叢の恒常性を維持し、全身性炎症を軽減することです。これらの食事介入は腸内環境の健康を促進し、全身の健康および性機能に連鎖的な効果をもたらし、栄養が全体的な健康に及ぼす大きな影響を強調しています。個人の健康成果を効果的に最適化するために、食事に関する推奨事項を洗練し、個別化するには、さらなる研究が不可欠です。 |
| 12.心理療法とサイコバイオティクスの統合:脳-腸軸と性機能への新たなアプローチ |
| サイコバイオティクスの統合は、ストレス、不安、そして全体的な精神的健康を調整することで性機能障害に対処する、革新的で学際的なアプローチです。これらはすべて性機能と密接に関連しています。サイコバイオティクスは、プロバイオティクスの特殊なクラスであり、脳-腸軸に影響を及ぼすことで精神的健康に有益な細菌として定義されます[210]。脳-腸軸は、迷走神経などの神経経路、コルチゾールとセロトニンを含むホルモン経路、そしてサイトカインを介した免疫経路を通じて、消化管と中枢神経系間の双方向のコミュニケーションを促進します。サイコバイオティクスは、脳-腸軸の主要な経路を標的とすることで、精神的および身体的健康に広範な影響を及ぼします。これらの作用機序には、認知機能や感情調節への心理的影響、視床下部-下垂体-副腎軸や身体のストレス反応への全身的影響、炎症マーカーの上昇を伴うことが多い炎症の調節などが含まれます[211]。これらの利点は、脳機能と感情の安定に重要な役割を果たすセロトニン、γ-アミノ酪酸、短鎖脂肪酸などの神経活性化合物の産生によって媒介されます[212]。さらに、サイコバイオティクスは腸管バリアの完全性を高め、視床下部-下垂体-副腎軸の活動を調節し、全身性炎症を軽減し、精神的および身体的健康を総合的に促進します。また、不安、うつ病、その他の心身症(性機能障害を伴うことが多い症状)を緩和する可能性も示されています。前臨床および臨床研究では、うつ病、不安、注意欠陥・多動性障害、自閉スペクトラム症、統合失調症、パーキンソン病、アルツハイマー病などの神経精神疾患の管理における役割が強調されています[213-215]。 |
| ラクトバチルス・ラムノサスやビフィドバクテリウム・ロンガムといった注目すべき菌株は、気分調節や精神的健康に重要な神経伝達物質であるγ-アミノ酪酸とセロトニンの産生を促進することで、不安やうつ症状を軽減する能力があることが実証されています[216-218]。これらの菌株は臨床研究において性機能と直接関連付けられたことはありませんが、心理状態への影響(特にストレス軽減、気分安定、視床下部-下垂体-副腎軸の過剰活性化の減少)は、性機能に対する間接的な有益性の可能性を示唆しています。精神的健康の改善は、特に心因性性機能障害のある人において、性欲、覚醒、満足度の向上と密接に関連しています。さらに、新たなエビデンスは、菌株が性生理学に関連する内分泌経路と血管機能に調節効果を発揮する可能性があることを示唆しています。例えば、全身性炎症およびコルチゾールレベルの低下は、血管緊張および神経伝達物質の利用可能性の改善とともに、性的反応を促す神経内分泌環境を作り出すのに役立つ可能性がある。 |
| これらの効果は、主にストレス軽減と精神力の向上を通じて、性欲、覚醒、満足度を向上させることで性機能にプラスの影響を与える可能性があります。アルツハイマー病やパーキンソン病などの神経変性疾患において、サイコバイオティクスは腸内細菌叢の構成と炎症を調節することで、認知機能の維持、酸化ストレスの軽減、神経保護に寄与します[219]。サイコバイオティクスは、微生物の多様性を回復し、有益な細菌の増殖を促進することで、腸-脳恒常性の回復を促します。しかし、費用対効果が高く非侵襲的な治療法としての可能性は有望ですが、臨床応用に向けて最も効果的な菌株、最適な投与量、そして長期的な効果を決定するには、さらなる研究が必要です。 |
| 脳-腸軸をターゲットとした心理療法、例えば消化管特異的認知行動療法(CBT)、腸に焦点を当てた催眠療法、マインドフルネスに基づくアプローチなどは、脳-腸軸の異常に関連する疾患の管理に効果があることが証明されている[220]。消化管特異的認知行動療法は、ストレスや腸内細菌叢の不均衡が症状を悪化させる過敏性腸症候群などの消化器疾患の治療に有効であることが実証されている。不安を軽減し、健康維持に役立つ行動を促進し、腸内細菌叢のバランスを回復させるライフスタイルの変化を促すことで、消化管特異的認知行動療法は症状、便の硬さ、生活の質、そして精神的な幸福感を改善させる[221]。こうした基盤の上に、心理療法とサイコバイオティクスを統合することは、新たな学際的アプローチとなる。サイコバイオティクスは、神経活性化合物を産生し、全身性炎症を軽減し、腸管バリアの完全性を強化することで、脳-腸軸を調節する。これらのメカニズムは、感情的な回復力や生理学的プロセス、特にストレス調節において重要な役割を果たす視床下部-下垂体-副腎に直接影響を与えます。自己認識を高めストレスを軽減するマインドフルネス[222]は、サイコバイオティクスと相乗的に作用し、気分をさらに安定させ、感情調節を改善し、全体的な精神的・身体的健康を促進する可能性があります。 |
| この統合アプローチは、様々な臨床場面、特に心理的ストレスに起因するパフォーマンス不安や性欲減退といった心因性性機能障害の治療において有望です。これらの症状の心理的要因と微生物学的要因の両方に対処することで、サイコバイオティクスを消化管特異的認知行動療法やマインドフルネスなどの療法と併用することで、性的な反応性と全体的な満足度を高めることができる可能性があります。心理的介入とサイコバイオティクスの融合は、神経科学、精神医学、微生物学の知見を統合し、複雑な疾患に対するより効果的な治療法を開発する、臨床研究における有望なフロンティアです。 |
| 将来的には、プロバイオティクス、食事療法、心理的介入を組み合わせた包括的な治療戦略が、腸内細菌叢の乱れに伴う性機能障害の管理における標準的なアプローチとなる可能性があります。微生物叢研究の進歩により、この複雑な微生物群集のマッピングが可能になり、各個人が遺伝的要因と環境的要因によって形成された独自の「微生物指紋」を持っていることが明らかになりました。これらの発見は、特定の有益な細菌株をサポートするカスタマイズされたプロバイオティクスとプレバイオティクス、微生物叢の構成を最適化して炎症を軽減することを目的とした個別化された食事介入、副作用を最小限に抑えながら治療効果を高めるように設計された微生物叢を標的とした医薬品、および腸内細菌叢の異常に関連する疾患に対する新しく効果的な治療法である糞便微生物叢移植など、革新的な治療戦略への道を開いた[223]。個人の微生物叢プロファイルに基づく個別化治療は、治療効果を高め、副作用を最小限に抑える大きな可能性を秘めています。これらのアプローチを検証し、その根底にあるメカニズムをさらに解明するには、長期的な臨床試験が不可欠です。同時に、微生物叢の健康における役割についての一般の認識が高まることで、より健康的なライフスタイルの採用が促進され、それによってこれらの統合戦略の予防効果が強化される可能性があります。 |
| 13.結論 |
| 腸内細菌叢は、性的健康と精神的健康の複雑な相互作用において中心的な役割を果たしています。腸-脳軸を介して作用し、神経伝達物質の産生、ストレス調節、ホルモンバランス、感情的回復力といった主要な神経生物学的プロセスに影響を与えます。これらはすべて、健康的な性機能にとって非常に重要です。腸内細菌叢の乱れは、勃起不全やホルモンバランスの乱れといった生理学的状態だけでなく、不安、うつ病、性機能不安といった精神疾患とも関連付けられています。サイコバイオティクスや腸内細菌叢を標的とした療法は、特に心理的介入と組み合わせることで、性機能障害の精神的側面と身体的側面の両方に対処するための有望な手段となります。腸内細菌叢が神経精神医学的および性的健康に及ぼす影響をより深く理解することで、より個別化された、効果的で包括的な治療戦略につながる可能性があります。今後の研究では、精神医学、性医学、マイクロバイオーム科学をつなぐ統合ケアモデルの発展を目指し、これらの関連性を探求し続ける必要があります。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、World J Gastrointest Pathophysiol. 2025 Sep 22;16(3):107823.に掲載されたDiscovering a new paradigm: Gut microbiota as a central modulator of sexual health.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |