
Hyun-Ji Bock et al., |
要約 |
| 本レビューでは、腸-脳軸、プロバイオティクス、およびアルツハイマー病の関連性について考察します。PRISMAに準拠した手法を用いて、PubMed、ClinicalTrials.gov、Google Scholarに掲載された文献を調査しました。研究によると、プロバイオティクスは神経炎症、微生物組成、神経伝達物質シグナル伝達を調節することでアルツハイマー病の症状を軽減する可能性があることが示されています。B. ブレーヴェやL. プランタルムなどのプロバイオティクス株は、初期のアルツハイマー病または軽度認知障害に有益であることが示されています。ただし、介入期間が短いことや株のばらつきが限界となっています。臨床ガイドラインと研究推奨事項についても考察します。メカニズムには、免疫シグナル伝達、神経伝達物質合成(γ-アミノ酪酸およびセロトニン)、全身性炎症の調節などが関与しています。 |
 |
| グラフィック アブストラクト |
| 目次(クリックして記事にアクセスできます) |
| 1.文献レビューの目的 |
| 2.方法 |
| 2.1. データベース |
| 2.2. キーワード |
| 3.問題の臨床的重要性 |
| 3.1. アルツハイマー病の概要 |
| 3.2. アルツハイマー病の段階 |
| 3.3. アルツハイマー病の診断 |
| 3.4. アルツハイマー病の治療 - 医薬品 |
| 3.5. アルツハイマー病の治療 - その他 |
| 3.5.1. 運動 |
| 3.5.2. 食事 |
| 4.腸-脳軸 |
| 5.腸内細菌叢 |
| 6.腸-脳軸とアルツハイマー病 |
| 7. プロバイオティクスとアルツハイマー病 |
| 8. 関連トピック |
| 9. 考察と臨床的推奨事項 |
| 本文 |
| 1.文献レビューの目的 |
| 本レビューでは、腸-脳軸に沿った相互作用、特に微生物による調節が、アルツハイマー病(AD)の発症または進行にどのように影響するかを検証します。腸-脳軸は、消化管と中枢神経系の間の複雑な双方向コミュニケーションに関与していますが、神経変性疾患におけるプロバイオティクスの臨床応用はまだ発展途上です。最近のいくつかの研究では、腸内細菌叢が神経炎症や認知機能低下に影響を与える可能性が示唆されていますが、知見は多様であり、さらなる検証が必要です。 |
| 本レビューでは、プロバイオティクスを用いた食事療法が、腸-脳軸への影響を通じてアルツハイマー病の認知機能低下に影響を与えるかどうかについても検討します。プロバイオティクスは、初期段階のアルツハイマー病における症状管理のための、安全かつ費用対効果の高い選択肢として研究されています。もう一つの目的は、腸-脳軸と神経変性疾患におけるその役割に関する最新のエビデンスを統合することです。本レビューは、一貫した知見と研究におけるギャップを特定することにより、将来の方向性を示すことを目的としています。この分野はまだ初期段階にあるため、この研究結果は決定的な結論を提供するというよりも、臨床医や研究者にとって有用なリソースとなる可能性があります。 |
| 本レビューは、増加傾向にある主要な健康問題を取り上げており、この分野の進歩に貢献することが期待されています。アルツハイマー病の一部の症状の治療に役立つ可能性のある薬物療法および非薬物療法はいくつかありますが、アルツハイマー病の治療法は未だ確立されておらず、進行を阻止または遅らせる方法さえも存在しません。しかしながら、腸-脳軸と食事介入がアルツハイマー病の病態に果たす役割に関する科学的研究とエビデンスは増加しています。腸-脳軸に関する科学的知識の向上と、アルツハイマー病の進行を予防または遅らせるための食事介入の利用は、医師、臨床心理士、神経心理学者、臨床医、その他の医療専門家が、エビデンスに基づいた治療プロトコルを用いてアルツハイマー病患者が腸-脳軸に有益な食事を取り入れ、アルツハイマー病の症状を緩和できるようにすることで、臨床的意義を持つ可能性があります。以下のセクションでは、プロバイオティクス介入が認知機能とアルツハイマー病の病態に及ぼす影響を調査した主要な臨床研究および前臨床研究をレビューします。多くの研究で認知機能や炎症の改善が報告されていますが、研究結果はまだ出つつある段階であり、方法論的変動や研究の限界に注意しながら解釈する必要があります。 |
| この文献レビューで提示された情報は、アルツハイマー病と診断される可能性の高い個人を対象とし、実際に発症する可能性を低減、あるいは発症時期を遅らせることで、この分野における予防的介入の指針としても活用できる可能性があります。これにより、患者が65歳前後で発症すると予想されるよりずっと前から、食事介入を実施することが可能になります。実験データと臨床データの増加は、高齢者における加齢と不健康な食生活の間に重要な関連性があり、これがアルツハイマー病の病因に寄与している可能性を示唆しています。 |
| 2. 方法 |
| 2.1. データベース |
| 本文献レビューは、Google Scholar、PubMed、APA PsychInfo、ClinicalTrials.gov のデータベースから収集した英語論文に基づいています。これらの主要な検索エンジンは、研究テーマに関連する論文やジャーナルにアクセスするために利用されました。参照された論文や研究のほとんどは、過去20年間のものです。 |
| 2.2. キーワード |
| 本レビューで使用したキーワードは、アルツハイマー病、腸-脳軸、マイクロバイオータ、マイクロバイオーム、プロバイオティクス、認知機能低下、認知障害、神経変性、認知症、腸脳連携などです。 |
| 3. 問題の臨床的重要性 |
| 3.1. アルツハイマー病の概要 |
| アルツハイマー病は進行性かつ不可逆的な脳疾患であり、認知症の主な原因であり、認知症診断の最大80%を占めています[1]。記憶、言語、実行機能など、複数の領域にわたる認知機能の低下を特徴とし、日常生活や介護者の負担に重大な影響を及ぼします[2]。アルツハイマー病は、細胞外アミロイドβ(Aβ)プラークと、過剰リン酸化タウタンパク質からなる細胞内神経原線維変化(NFT)という2つの特徴的な神経病理学的特徴によって定義されます。 |
| これらの病理学的変化は、臨床症状が現れる数十年前から始まることが多く、特に海馬や嗅内皮質などの記憶関連領域で顕著です[3]。2050年までに米国におけるアルツハイマー病患者の数は2倍以上に増加すると予測されており、アルツハイマー病は公衆衛生と経済における課題の増大を招き、より効果的でアクセスしやすい介入の緊急の必要性を浮き彫りにしています。 |
| アルツハイマー病は、記憶力や思考力を徐々に破壊し、最終的には単純な作業さえもこなせなくなってしまう脳の障害です。アルツハイマー病の症状は、発症が遅いタイプでは大多数が60代半ばに、より稀なケースでは、発症が早いタイプでは30代から60代半ばに現れます。アルツハイマー病は、認知症の臨床症状が現れる数十年前から、アミロイドβ沈着物や細胞内神経原線維変化からなるこの疾患の病理学的特徴の蓄積によって始まることが、近年、より明らかになっています[3]。これらのプラークや神経原線維変化は、アルツハイマー病の主な神経病理学的特徴と考えられています。損傷は、嗅内皮質や海馬など、記憶に関与する脳の部分に最初に発生します。その後、大脳皮質の、言語、推論、社会的行動を司る領域などに及びます。 |
| 3.2. アルツハイマー病の段階 |
| アルツハイマー病の進行は3つの段階に分けられます[4,5]。第1段階は前臨床段階アルツハイマー病と呼ばれ、臨床的変化が現れる前に発症します。バイオマーカーの測定可能な変化と、困難な認知機能検査におけるパフォーマンスの低下によって定義されます。バイオマーカーは、脳画像検査や脳脊髄液(CSF)中の分子変化によって検出可能です。現在、前臨床段階アルツハイマー病の診断基準は確立されていません。第2段階アルツハイマー病は、軽度認知障害(MCI)と呼ばれ、最初の臨床的変化が表面化することで特徴付けられます。患者や家族が認識できる記憶力やその他の認知能力の軽度の変化は、綿密な評価によって検出される可能性がありますが、日常生活に支障をきたすほどではありません[6]。言い換えれば、軽度認知障害は認知症の臨床診断に先立つ認知機能低下の状態を指し、症状がまだ個人の日常生活機能に支障をきたすほどではありません[7]。アルツハイマー病の第3段階であり最終段階である認知症は、記憶、認知、運動機能の重篤な障害を特徴とし、日常生活の質に影響を与える機能的活動を独立して実行する能力が低下します[8]。 |
| 以下はアルツハイマー病の臨床経過モデルです[9]。このモデルは、前臨床アルツハイマー病が軽度認知障害に先行し、軽度認知障害が認知症に先行する様子を示しています。この図はアルツハイマー病の病態と臨床の連続性に関する仮説的なモデルであり、アルツハイマー病の病態生理学的過程を示すバイオマーカーを有するすべての患者が必ずしも臨床段階に進むことを意味するものではないことに留意することが重要です[9]。 |
| 3.3. アルツハイマー病の診断 |
| 臨床的および神経心理学的検査はアルツハイマー病の検出に非常に有用ですが、確定診断には、2つの主要な神経病理学的バイオマーカーを観察するための脳組織の剖検評価が必要です。現在、早期発症型/家族性アルツハイマー病を引き起こす常染色体優性遺伝子変異として、アミロイド前駆体タンパク質(APP)遺伝子、プレセニリン1および2遺伝子の3つが知られています。これらの遺伝子の変異は、アミロイドβの産生および/または蓄積の増加と関連しています[10]。 |
| その他のバイオマーカー(例:生化学バイオマーカー、神経画像バイオマーカー)も追加情報を提供する可能性があります[10,11]。例えば、生化学バイオマーカーには、アルツハイマー病の病態に特異的なものと「非特異的」なバイオマーカーが含まれます。アルツハイマー病の病態に特異的なバイオマーカー(例:脳脊髄液(CSF)中のアミロイドβレベル)は診断マーカーおよび予後マーカーとして使用できますが、非特異的バイオマーカーは炎症や酸化ストレスなど、アルツハイマー病の病態における付随現象を測定するもので、疾患の進行や治療への反応をモニタリングするために使用できます[10]。 |
| 生きた患者における早期アルツハイマー病診断のための神経画像診断には、構造的および/または機能的画像診断が含まれる場合がある[5,10]。構造的画像診断には、コンピューター断層撮影(CT)と磁気共鳴画像診断(MRI)が含まれる。どちらの手法も、アルツハイマー病関連の萎縮に関連するシナプスとニューロンの喪失に関して同様の情報を提供する。機能的神経画像診断には、単一光子放出断層撮影(SPECT)と陽電子放出断層撮影(PET)が含まれ、どちらもアルツハイマー病関連の神経病理によって引き起こされる機能的差異を検出できる。さらに、ピッツバーグ化合物B(PiB)と呼ばれるアミロイド画像診断陽電子放出断層撮影(PET)トレーサーをアミロイド画像診断陽電子放出断層撮影スキャンで使用して、神経組織内のベータアミロイドプラークを画像化することができる[12]。Klunkらは、軽度アルツハイマー病患者16人と健康対照群9人を対象に、ピッツバーグ化合物B画像診断を使用した初のヒト試験を実施した。対照群と比較して、アルツハイマー病患者は、アルツハイマー病におけるアミロイド蓄積に典型的に関連する領域である連合皮質において、有意に高いピッツバーグ化合物B集積を示した。アルツハイマー病群において、ピッツバーグ化合物B集積レベルが最も高かったのは前頭皮質であった(p = 0.0001)。また、頭頂葉(p = 0.0002)、側頭葉(p = 0.002)、後頭葉(p = 0.002)、そして線条体(p = 0.0001)でも集積の上昇が認められた。全体として、これらの結果は、新規トレーサーであるピッツバーグ化合物B を用いたアミロイド画像診断陽電子放出断層撮影イメージングが、生体におけるアミロイド沈着に関する定量的な情報を提供できることを示唆している[12]。 |
| 3.4. アルツハイマー病の治療 - 医薬品 |
| 現在、アルツハイマー病を完治させる治療法はありません。現在承認されているアルツハイマー病の治療薬は6種類あり、モノクローナル抗体を用いてアミロイドβプラークの蓄積を標的とする薬剤(アデュカヌマブ/アデュヘルム)、コリンエステラーゼ阻害によって脳のシナプスにおけるアセチルコリンの分解を防ぐ薬剤(ドネペジル/アリセプト、リバスチグミン/エクセロン、ガランタミン/ラザジン)、NMDA(訳者注:「NMDA」は、NMDA受容体という神経伝達物質であるグルタミン酸を感知するタンパク質、または、この受容体を標的とする自己抗体が原因で起こるNMDA受容体脳炎の略称です)受容体を阻害することでグルタミン酸を調節する薬剤(メマンチン/ナメンダ)、ドネペジルとメマンチンの併用療法(ナムゼリック)などがあります。 |
| 現在、軽度から中等度のアルツハイマー病の管理には、ドネペジル、リバスチグミン、ガランタミンの3つのコリンエステラーゼ阻害剤(CI)が承認されています[13,14]。これらの薬剤は、アルツハイマー病の主要かつ標準的な第一選択治療薬と考えられています[15]。システマティックレビューのエビデンスは、3つの薬剤すべてが、軽度から中等度の疾患の患者に対する認知機能、日常機能、および全体的な全般的転帰に利益をもたらすことを示しています[13,16]。個々のコリンエステラーゼ阻害剤間で明確な有効性の違いは観察されていません。中等度から重度のアルツハイマー病患者の場合、追加の選択肢として、N-メチル-D-アスパラギン酸受容体の非競合的拮抗薬であるメマンチンがあります[17]。メマンチンはドパミン作動薬としての作用も示し、この段階の疾患の患者、特に注意力と覚醒度の障害を経験している患者への使用が承認されています[18]。アルツハイマー病の疾患修飾療法に関する研究は進行中であり、症状の根底にある主要な病理学的メカニズムを標的とした研究に注力しています。これらのメカニズムには、アミロイドβプラークの蓄積、神経原線維変化の形成、炎症、酸化ストレス、鉄の不均衡、コレステロールの調節異常といったプロセスが含まれます[15]。 |
| 新規にアルツハイマー病と診断された患者では、治療は通常、ドネペジル(アリセプト)、リバスチグミン(エクセロン)、ガランタミン(ラザダイン)などのアセチルコリンエステラーゼ阻害剤から開始されます。これらの薬剤は、有効性と安全性が実証されています(Joe & Ringman, 2019)[19]。メマンチン(ナメンダ)は軽度アルツハイマー病にはほとんど効果を示しませんが、中等度段階では認知機能の向上に寄与するため、コリンエステラーゼ阻害剤との併用療法は忍容性が高いため、ほとんどの患者に適しています。 |
| アルツハイマー病における重要な発症メカニズムの一つは、アミロイドβの沈着に寄与する神経細胞の慢性炎症です。興味深いことに、イブプロフェンなどの特定の非ステロイド性抗炎症薬(NSAID)を長期使用している患者は、アルツハイマー病の症状を発症するリスクが低下することが示されています[20]。しかし、非ステロイド性抗炎症薬の長期使用は、腎臓や肝臓など、体の他の部位に有害な影響を及ぼすことが知られています。 |
| 3.5. アルツハイマー病の治療 - その他 |
| 3.5.1. 運動 |
| 心血管リスク因子の管理は、脳血管疾患だけでなく神経変性疾患においても、脳全体の健康に寄与することが示されています[21]。定期的な有酸素運動(柔軟性、筋力、敏捷性)は、アルツハイマー病患者の神経精神症状の軽減と介護者の負担軽減に関連していました[22]。推奨される6ヶ月間の有酸素運動に加えて、研究者らは、易怒性、不安、無関心、食欲の変化が、主に改善された精神病理学的症状であることを発見しました[22]。実際、アルツハイマー病の遺伝的リスク因子を持つ患者が定期的に運動を行った場合、行わなかった場合と比較して、脳萎縮が少ないことが観察されており、有酸素運動が神経変性を予防することを示唆しています[23]。 |
| アルツハイマー病における認知機能のサポートにおける運動の役割については、いくつかの非薬理学的研究が検討されています。あるレビューでは6つの臨床試験を検討し、運動は一般的に認知機能低下の速度低下と関連していることが示されています[24]。追加の研究では、運動トレーニングはアルツハイマー病のリスクがある、または既にアルツハイマー病と診断されている人において認知障害の進行を遅らせる可能性があることが示されており、有酸素運動が最も大きな効果をもたらすようです[25]。運動はまた、脳の可塑性を高め、病理学的変化を軽減することで神経保護効果を発揮すると考えられています。臨床症状の発現前に運動介入を開始することは特に有益である可能性があります。なぜなら、身体活動は様々な組織から多数の生体分子の放出を刺激し、その一部は脳の健康に寄与するからです[26]。しかし、神経変性が一定の閾値を超えて進行すると、運動だけでは症状の回復または改善に十分ではない可能性があります[26]。また、これらの研究の多くは人種や性別に関する報告が不十分であり、その結果の一般化可能性が制限されていることにも留意する必要があります。 |
| 3.5.2. 食事 |
| 最近のシステマティックレビューによるエビデンスによると、果物、野菜、全粒穀物、オリーブオイル、豆類、魚介類を多く摂取し、乳製品、鶏肉、赤身肉、菓子類、加工食品の摂取を制限する地中海式食事の遵守は、認知機能低下およびアルツハイマー病のリスク低下と関連していることが示唆されています[5,27,28]。これらの食事は、代謝および血管系に広範なベネフィットをもたらし、標的を絞ったプロバイオティクス介入を補完する可能性があります。 |
| さらに、ケトジェニックダイエットは脳のグルコース代謝を改善することが示されています。アルツハイマー病のもう一つの特徴は、脳の低代謝、つまり脳のグルコース代謝の低下です。これは通常、症状の発症前に発生しますが、症状が進行するにつれて継続します。脳はエネルギー源としてグルコースに依存しているため、低代謝のようにグルコース供給が途絶えると、脳の認知機能が低下するリスクがあります。アルツハイマー病患者はミトコンドリア機能の欠陥とある種の代謝低下を示すことが知られているため、低代謝に関するさらなる研究が必要です[29]。著者は、ケトン体はグルコースを代謝できない細胞にとって効率的な代替燃料であり、ケトン体レベルを増加させることでアルツハイマー病患者の認知機能が改善されると示唆しています。Jensenらによる最近の論文[30]では、神経変性疾患におけるケトン体の脳代謝への影響について詳述しています。研究者らは、ケトジェニック介入により、脳のグルコース代謝の低下を特徴とする神経変性疾患のエネルギー危機が緩和され、治療上の利点が得られる可能性があると述べています。 |
| 漢方薬は、アルツハイマー病の病態および進行の改善に効果があることが分かっています。Santos-Netoら[31]が挙げた過去の研究では、5種類の主要な漢方薬がアルツハイマー病の認知機能障害に特に有効であることが示唆されています。メリッサ(レモンバーム)、サルビア(セージ)、易乾(セロトニン調節薬として機能する日本の伝統的な漢方薬)、八味地黄丸(認知症患者の認知機能と身体機能を改善することが知られている中国の伝統的な漢方薬)、そしてイチョウ(中国原産のイチョウの木)です。 |
| さらに、Hartmanら[32]は、ザクロジュースの食事性補給が、ザクロに含まれる高濃度の抗酸化ポリフェノール物質を介したトランスジェニックマウスモデルの行動およびアルツハイマー病様病態に影響を及ぼすかどうかを検証する研究を行った。その結果、ザクロジュースを摂取したマウスは、対照群と比較して水迷路課題の学習速度が速く、泳ぐ速度も速かった。また、対照群と比較して、海馬における可溶性アミロイドβの蓄積およびアミロイド沈着が有意に減少していたことが明らかになった。全体として、この特定の研究は、ザクロジュースがアルツハイマー病マウスモデルにおいてアミロイド量を軽減し、行動を改善することを実証した。さらに、ハートマン[33]は、植物化学物質を植物が産生する化合物、フェノール、テルペン、有機硫黄化合物と定義し、アルツハイマー病病態に関与することが知られている様々な植物化学物質を以下のように詳述した:イチョウ葉エキス(EGb761抽出物)、ザクロ、ウコン、クルクミン、ニンニク、ニコチン、その他の植物化学物質。その後のアルツハイマー病病態における植物化学物質に関する文献レビューでは、ビタミン(例:トコフェロール、葉酸)やその他の有機化合物(例:フェノール、テルペン、有機硫黄化合物)を含むいくつかの生理活性植物化学物質が、アルツハイマー病の病態過程に影響を及ぼす可能性があることが指摘された[34]。 |
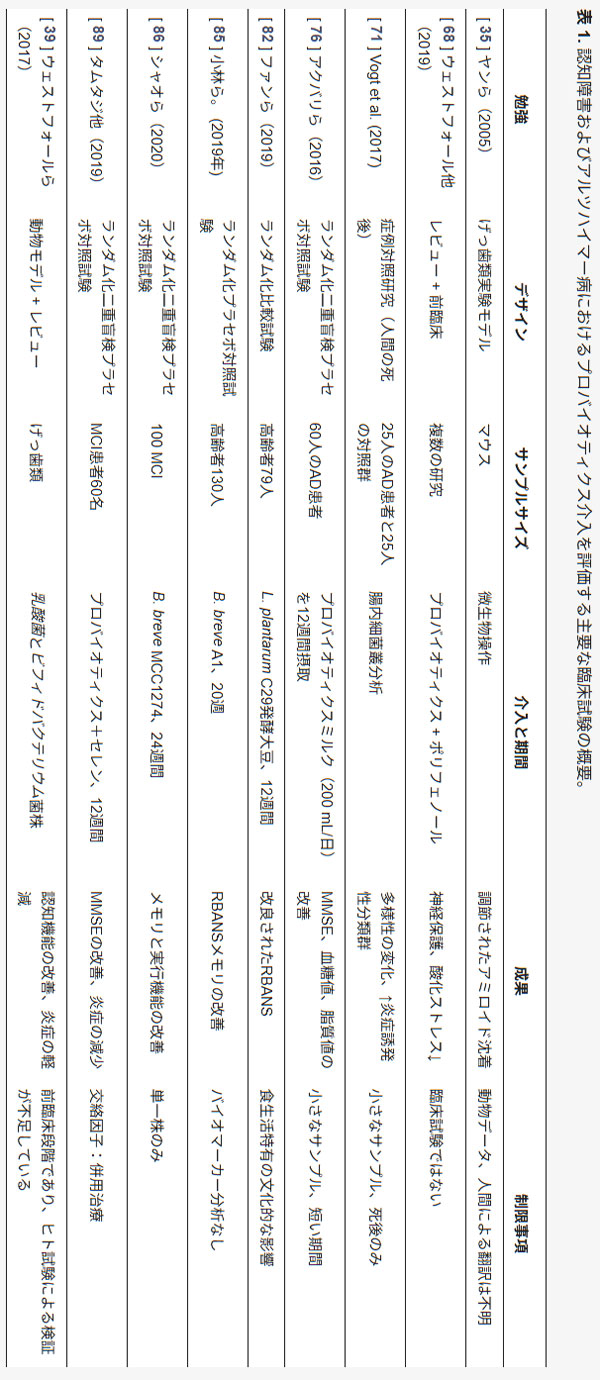
| さらに、研究者らは、天然の抗炎症化合物でありウコンの主な有効成分であるクルクミンのアルツハイマー病発症予防における重要性を研究した[35]。関連する知見の概要については、表1を参照のこと。抗酸化物質と抗炎症物質の摂取量が増えるとアルツハイマー病のリスクが減少することを考慮すると、フェノール性の黄色いカレー色素であるクルクミンは強力な抗炎症作用と抗酸化作用を持ち、酸化ダメージ、炎症、認知障害、アミロイド蓄積を抑制できる。研究者らは、マウスを用いて、クルクミンが小さなβアミロイド種に直接結合して、in vitroおよびin vivoで凝集と線維形成を阻害することを実証し、低用量のクルクミンがアミロイドβを効果的に分散させることを示唆するデータがあると結論付け、アルツハイマー病の予防または治療の臨床試験でクルクミンを使用する根拠を裏付けている[35]。 アルツハイマー病病理におけるクルクミンのメカニズムが研究され、クルクミンはベータアミロイドプラークを減少させ、ニューロンの分解を遅らせ、アルツハイマー病患者の全体的な記憶を改善する一方で、抗炎症作用と抗酸化作用があることも判明しました[20]。 |
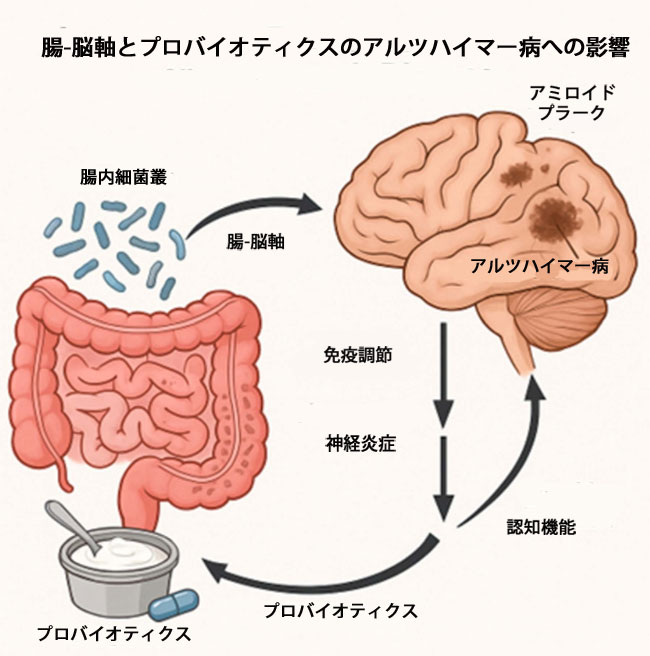
| 4. 腸-脳軸 |
| 腸-脳軸(GBA)は、消化管に生息する微生物と脳との間の双方向コミュニケーションシステムです[36]。消化管は、食物や液体が飲み込まれ、消化され、最終的に便として体外に排出される際に通過する一連の空洞器官です。腸神経系(ENS)は消化管に固有のものであり、運動や分泌を含む正常な腸機能に重要な役割を果たしています[37]。腸神経系は、消化管壁に埋め込まれた感覚ニューロン、運動ニューロン、および介在ニューロンで構成されています。簡単に言えば、腸神経系は私たちの腸の神経系と考えられています。腸神経系は中枢神経系(CNS)の影響を受けることもありますが、交感神経系と副交感神経系の両方から独立して機能することもあります。近年、脳-腸相互作用の分野は拡大し、腸内細菌叢の変化と神経変性疾患、精神疾患、炎症性疾患、摂食障害などの脳疾患との複雑な相互作用が認識されるとともに、ますます関心が高まっています[38]。腸-脳軸の主な役割は、神経免疫内分泌メディエーターを介して、腸管機能と感情・認知中枢をモニタリングし、統合することです[36]。 |
| 消化管は、腸-脳軸を介して中枢神経系と相互作用し、神経細胞の発達と維持に重要な役割を果たしています。このバランスが崩れると、腸内ディスバイオシス(腸内細菌叢の乱れ)が発生し、神経疾患の一因となります[39]。ディスバイオシスとは、微生物群集の不均衡から脳に有害なシグナルが送られ、低度の炎症、酸化ストレス、エネルギー調節の変化、および細胞の変性が進むことと定義されています[40]。研究により、腸と脳の間の主要なコミュニケーション経路は3つ特定されています。求心性および遠心性の結合を介した神経シグナル伝達、腸由来ホルモンを介したホルモンシグナル伝達、およびサイトカインを介した免疫シグナル伝達です[41,42]。これらのメカニズムが組み合わさって複雑なコミュニケーションシステムを形成し、全身の不均衡を神経変性プロセスに結び付け、インスリン調節、脂質代謝、酸化ストレス、および免疫応答に影響を及ぼします[39]。 |
| 5. 腸内細菌叢 |
| マイクロバイオームとは、消化管に生息する多様な微生物(細菌)の集団です。消化管には様々な微生物が生息しており、総称して腸内マイクロバイオームと呼ばれています[43]。マイクロバイオータとマイクロバイオームという用語は、研究では互換的に使用される傾向があります。より具体的には、マイクロバイオータはヒトなどの複雑な生物に関連する微生物分類群として定義され、マイクロバイオームはこれらの微生物とその遺伝子のカタログです[44]。加齢に伴い、マイクロバイオータの変化と腸内マイクロバイオームの加齢に伴う変化が見られ、心血管疾患、がん、糖尿病、神経変性疾患などの特定の疾患に対する素因の増加に寄与します[45]。言い換えれば、腸内マイクロバイオームの多様性は、有益な細菌を犠牲にして病原性細菌の増加によって乱されています[46]。マイクロバイオームは、有益な微生物と潜在的に有害な微生物の両方から構成されています。そのほとんどは共生関係にあり(人体とマイクロバイオームの両方に有益)、少数ではありますが病原性微生物、つまり病気を促進する微生物も存在します。ハーバード公衆衛生大学院[47]によると、健康な体内では病原性微生物と共生微生物は問題なく共存しています。しかし、そのバランスが崩れると(例えば、感染症、特定の食事、抗生物質やその他の細菌を破壊する薬剤の長期使用など)、ディスバイオシス(腸内細菌叢の乱れ)が発生し、正常な相互作用が阻害されます。その結果、体はより病気にかかりやすくなる可能性があります。 |
| プロバイオティクスについて詳しく説明する前に、プロバイオティクスと腸内マイクロバイオームの研究に関係する用語をいくつか知っておくことが重要です。すでに述べたように、腸内マイクロバイオータは、細菌、酵母、ウイルスなど、いくつかの微生物種で構成されています。分類学的には、細菌は門、綱、目、科、属、種に分類されます [48]。腸内微生物叢の主な門は、フィルミクテス門、バクテロイデス門、放線菌、プロテオバクテリア、フソバクテリア、およびヴェルコミクロビアで、フィルミクテス門とバクテロイデス門の2つの門で腸内細菌叢の90%を占めています [48]。細菌を分類する方法の1つは、細胞膜に基づいてグラム陽性細菌とグラム陰性細菌に分類する方法です。細菌がペプチドグリカンと呼ばれる厚い網目状の膜を持っている場合、それはグラム陽性として知られており、ペプチドグリカン層が薄い場合はグラム陰性に分類されます。グラム陰性の場合は、その硬くて保護的な外殻のために殺すのがより困難です[49]。 |
| プロバイオティクスは、体内に自然に生息する生きた微生物です。体が必要とし、健康全般の維持に利用する善玉菌、つまり「フレンドリー」な細菌と考えられています。プロバイオティクスには、サプリメントや、プロバイオティクスが天然に豊富に含まれる食品に含まれるものなど、様々な形態があります。プロバイオティクスサプリメントやプロバイオティクスを豊富に含む食品には、善玉菌を維持または改善することを目的とした生きた微生物が含まれています。プロバイオティクスによるバイオセラピーは、細菌群のバランスを整え、好ましい代謝作用を促進することで、健康な腸内環境を作り出すことが知られています[39]。プロバイオティクスを天然に多く含む食品には、ヨーグルト、ザワークラウト、ピクルス、テンペ、熟成チーズ、味噌などがあります。プロバイオティクスサプリメントに関しては、多くのドラッグストアで店頭販売されている様々な種類があります。プロバイオティクスは、腸-脳軸において非常に重要な役割を果たすことが分かっています。プロバイオティクスには、体内で異なる働きをする様々な菌株(サブタイプ)があります。プロバイオティクスの菌株名は、プロバイオティクスサプリメントのボトルラベルに記載されていることがよくあります。ラクトバチルスやビフィドバクテリウムなど、特定の菌株は他の菌株よりも有益であることが分かっています。 |
| プロバイオティクスは、腸内細菌叢のバランスを整えることで宿主に有益な生きた微生物サプリメントであり、大腸菌叢の構成を変えるために古くから使用されてきました [50]。一方、プレバイオティクスは消化されない食品成分で、大腸内にすでに存在する特定の細菌の増殖や活動を選択的に刺激することで健康をサポートします。プロバイオティクスは、消化を助け、腸管機能をサポートし、脳の健康に貢献するなど、さまざまな健康効果に関連しています [51]。1908年には早くも、後に食作用の発見でノーベル賞を受賞したロシアの動物学者エリー・メチニコフが、ヨーグルトの摂取を「健康食品」として推奨していました [52]。1世紀後、プロバイオティクスが微生物叢-腸管-脳軸を介して中枢神経系の機能にも影響を与える可能性があることが研究で明らかになり始めました。このように認識が高まっているにもかかわらず、認知症の高齢患者におけるプロバイオティクスの使用を評価する臨床研究は依然として限られています [53]。 |
| これまでの研究では、プロバイオティクス菌がアミロイドβ沈着によって引き起こされる炎症反応を調節することで、アルツハイマー病の症状を改善する可能性があることが示されています。さらに最近の研究では、腸内細菌叢の特定の細菌産物が脳内のアミロイドプラークの量と相関していることが示されています[54]。文献には、プロバイオティクス介入を用いてマイクロバイオームを標的とし、アルツハイマー病の有効な予防策として検討した研究がいくつか記載されています。 |
| Westfallら[39]は、加齢は神経伝達物質の活性低下、持続性炎症、酸化ストレス、アポトーシスなど、疾患の進行を悪化させるプロセスと関連しているため、神経変性疾患発症の主要因であると強調した。プロバイオティクスは、これらの有害な加齢関連変化の多くに対抗することが実証されている。アルツハイマー病では消化管合併症がよく見られ、腸内細菌叢の調節は症状の予防や軽減の戦略として提案されている。食事は腸内細菌叢の構成を決定するもう1つの重要な要因である。動物性食品から植物性食品に切り替えるなどの短期的な食生活の変化でも、微生物群集を大きく変化させ、遺伝子発現に影響を及ぼす可能性がある[55]。また、腸内細菌叢が感情調節や関連する神経経路を含む脳機能や行動に影響を与える可能性があることを示す証拠もある[56]。 |
| 2つの異なる研究において、著者らは出産方法が初期のマイクロバイオームと腸内細菌叢に影響を与えるという結論に達しました。経膣分娩で生まれた乳児は、帝王切開で生まれた乳児と比較して、腸内細菌叢の量が多かったことが示されました[57,58]。別の研究では、腸内細菌叢の構成が高齢者の食事と健康と相関していることが明らかになりました[59]。糞便サンプルは、地域、通院、リハビリテーション施設、長期入所施設に居住する178人の高齢者から採取されました。これらの研究者らは、長期入所施設の患者のマイクロバイオームの多様性は、地域住民のマイクロバイオームの多様性に比べて著しく低いことを発見しました。全体として、この研究データは、食事、マイクロバイオーム、そして健康状態の関係を裏付けています。 |
| 腸内細菌叢は中枢神経系(CNS)において重要な役割を果たします。中枢神経系は腸神経系からの信号に反応できるからです。つまり、中枢神経系と腸は相互に関連しており、その既存の接続により頻繁に情報伝達を行っています。健康な腸は健康な脳と相関関係にあることが多いため、腸-脳軸の研究は本実験に関連しています。したがって、腸を標的とすることで、神経変性疾患を標的とする別の方法が実現できるでしょう。腸と脳の関係は、神経伝達物質、ストレス、不安、気分、行動など、多くの要因に間接的な影響を及ぼす可能性があります。腸-脳軸に関与する主な神経伝達物質は、セロトニンとγ-アミノ酪酸の2つです。消化管におけるセロトニンの機能不全は、気分、睡眠、行動に関わる脳機能の障害につながる可能性があります。γ-アミノ酪酸は消化管機能に関与する神経伝達物質であり、その主な目的は腸神経系を媒介することです。γ-アミノ酪酸の低レベルは、うつ病や気分障害に関連しています[60]。研究によると、加齢は腸内微生物群集を変化させ、それが消化管障害だけでなく認知症などの中枢神経系疾患も引き起こすことが示唆されている[61]。同様に、アルツハイマー病モデルおよび患者における腸内細菌叢異常が神経炎症、脳血管変化、アミロイドβ形成に寄与し、それによってアルツハイマー病の病態生理および進行に影響を及ぼすという実験的証拠がある[62]。新たな研究分野では、腸内微生物叢を変化させることが他の生活習慣介入と同様の神経保護効果を発揮する可能性があることが示唆されている[63]。腸内微生物叢の変化は認知症リスクに関連する生理学的プロセスを標的とすることが判明しており、腸管–脳–微生物叢軸のシグナル伝達に影響を与え、認知機能に影響を与える可能性がある。サンボーンおよびガンスタッド[63]は、腸内微生物叢は、疾患、食事、プレバイオティクス、プロバイオティクス、および運動を含むいくつかの手段によって変化する可能性があることに同意している。 |
| 6. 腸-脳軸とアルツハイマー病 |
| 腸-脳軸に関する現在の知見の多くは、動物実験から得られたものです。例えば、ラクトバチルス・ラムノサス(JB-1)をマウスに投与すると、ストレス関連のコルチコステロン値と不安様行動が減少することが示されました[64]。無菌動物、抗生物質、プロバイオティクス、病原性微生物、または糞便微生物移植に曝露された動物を用いた研究では、腸内微生物叢がアルツハイマー病の病態に関与していることがさらに示唆されています[65]。ある研究では、無菌環境で飼育されたトランスジェニックアルツハイマー病マウスは、従来の飼育環境で飼育されたマウスと比較して、脳アミロイド沈着が少ないことが明らかになりました[66]。これは、微生物群集がアミロイド蓄積に影響を与えるという考えを裏付けています。研究者らは、細菌16S rRNAシークエンシングを用いてアミロイド前駆体タンパク質トランスジェニックマウスの糞便サンプルを解析した結果、非トランスジェニック(野生型)対照群と比較して、腸内細菌叢の構成に顕著な違いがあることを明らかにしました。無菌アミロイド前駆体タンパク質マウスを作製すると、腸内細菌叢を有するマウスと比較して、脳内のアミロイドβ病変が有意に減少しました。従来の方法で飼育されたアミロイド前駆体タンパク質マウスの腸内細菌叢を導入すると、アミロイドβ病変は増加しましたが、野生型マウスの細菌叢を導入した場合の影響は弱まりました。これらの知見は有益ですが、マウスとヒトの免疫機能と腸内生態の違いにより、直接的な一般化は困難です。 |
| さらに、小林らによる実験[67]では、ビフィドバクテリウム・ブレーベA1株(B. breve A1)の経口投与がアルツハイマー病モデルマウスの行動および生理学的プロセスに及ぼす影響を調査した。研究者らは、アルツハイマー病マウスにB. ブレーベA1を投与すると、行動テストの成績が改善したと報告した。この治療により、Y迷路テストにおける交替行動の欠陥が回復し、受動回避テストにおける潜伏時間が回復したことから、認知機能低下に対する保護効果が示唆された[67]。彼らはさらに、非生菌性細菌成分やB.ブレーベA1の代謝物である酢酸でさえ、認知機能障害の軽減に部分的な効果をもたらすことを示した。遺伝子発現解析により、B. ブレーベA1の摂取により、通常はアミロイドβによって誘発される海馬の炎症性遺伝子および免疫関連遺伝子が抑制されることが示された。要約すると、本研究では、アルツハイマー病モデルマウスにB. ブレーベA1を経口投与したところ、認知機能障害が軽減されただけでなく、アミロイドβによって引き起こされる炎症性遺伝子および免疫関連遺伝子の発現も低下することが示されました。これらの知見は、B. ブレーベA1がアルツハイマー病における認知機能低下を予防する治療選択肢となる可能性を示唆しています[67]。 |
| ショウジョウバエを用いた研究では、腸脳相関を標的とすることで、アミロイドβの蓄積とアセチルコリンエステラーゼの活性を低下させながら、生存率と運動能力が向上することが示された[68]。このモデルでは、3種類のプロバイオティクス株(ラクトバチルス・プランタルムNCIMB 8826(Lp8826)、L. ファーメンタムNCIMB 5221(Lf5221)、ビフィドバクテリウム・ロンガム亜種インファンチス NCIMB 702255(Bi702255))からなる共生混合物と、ポリフェノールを豊富に含むハーブ強壮剤トリファラ(TFLA)(訳者注:インドの伝統医学、アーユルベーダで処方されるハーブ。アーマラキー、ハリータキー、ビヒータキーという3つの果実を乾燥させたものの混合物。腸の働きを整えて、便秘を解消する)の抽出物を併用することで、腸脳相関シグナル伝達の複数の側面に影響を及ぼした。この介入は、おそらくペルオキシソーム増殖因子活性化受容体γ(PPARγ)を含む経路を介して、アルツハイマー病の発症を予防し、進行を遅らせると考えられた。同じ研究では、ペルオキシソーム増殖因子活性化受容体γが腸脳コミュニケーションの重要なメディエーターとして強調され、アルツハイマー病などの複雑な慢性疾患の管理におけるプロバイオティクスまたはシンバイオティクスアプローチの将来の治療ターゲットとして機能する可能性があることが示唆されました[68]。 |
| ヒトを対象とした研究はほとんど行われておらず、より多くの臨床研究が緊急に必要とされていることが示されています。いくつかの研究では、ヒトの脳の発達、行動、および/または気分に対する腸内細菌叢の役割について調査されています。ある臨床試験では、変化した細菌叢がエンドトキシン産生を増加させ、リーキーガットとして知られる腸管透過性を誘発する可能性があることが報告されています。リーキーガット状態はアルツハイマー病患者によく見られます。これらの状態は炎症反応を引き起こし、その結果として神経炎症を引き起こします。この研究では、炎症を標的として健康な腸内細菌叢を改善するためにオメガ3サプリメントを使用しました[69]。オメガ3脂肪酸(FA)は、鎖の末端から3番目の炭素に二重結合があることを特徴とする多価不飽和脂肪のグループです。最も生理学的に関連のあるオメガ3には、エイコサペンタエン酸(EPA)、α-リノレン酸(ALA)、およびドコサヘキサエン酸(DHA)があります。これらの脂肪酸は神経構造の重要な前駆物質であり、膜の構成と流動性に寄与するだけでなく、シグナル伝達、神経伝達、酵素活性の調節にも役割を果たしています[69]。研究によると、オメガ3脂肪酸は腸内細菌叢に主に3つの方法で影響を与えています。(1) 微生物の構成と存在量の調節、(2) リポ多糖類やIL-17などの炎症性メディエーターの減少、(3) 短鎖脂肪酸とその塩のレベル調節です[70]。 |
| ウィスコンシン州アルツハイマー病研究センターで行われた研究では、アルツハイマー病患者と健康な対照群の腸内マイクロバイオームを比較し、顕著な構成の違いが明らかになりました。アルツハイマー病患者では、フィルミクテスと放線菌のレベルが低下し、プロテオバクテリアとバクテロイデスが増加しており、これらは疾患の重症度と関連していました[71]。これらの微生物の変化を特徴付けるために、研究者らは、アルツハイマー病診断のある参加者とない参加者の糞便サンプルから抽出したDNAで細菌の16S rRNA遺伝子配列を使用しました[71]。彼らはさらに、アルツハイマー病の脳脊髄液バイオマーカーで測定した腸内微生物叢とアルツハイマー病病理の関係を調べ、アルツハイマー病患者の腸内マイクロバイオームは対照群と比較して微生物の豊富さと多様性が低下しており、独特の構成を示していることを発見しました。 |
| アルツハイマー病と健忘性軽度認知障害(MCI)を鑑別することを目的とした研究で、研究者らは97人の参加者を対象にRNAシークエンシングによる腸内細菌組成の評価、ならびにミニメンタルステート検査(MMSE)、モントリオール認知評価(MoCA)、臨床認知症評価(CDR)スケールによる認知機能検査を行った[72]。結果によると、アルツハイマー病患者は対照群と比較して微生物多様性が低下し、微生物プロファイルが異なっていた。腸内細菌叢の変化はアルツハイマー病と強く関連しており、グラム陰性細菌である腸内細菌科は、疾患の存在と進行の両方に関連していた。さらに、プロテオバクテリア門内のガンマプロテオバクテリア、腸内細菌目、腸内細菌科などの炎症誘発性細菌のレベルは、健常者から健忘性軽度認知障害患者、そして認知症患者へと徐々に上昇した。 |
| 中国で実施された別の研究では、43人のアルツハイマー病患者と、年齢と性別をマッチさせた認知機能正常対照群43人から糞便サンプルを採取しました。他の研究と同様に、16SリボソームRNAシーケンス法を用いて糞便中の微生物叢の構成を解析し、腸内微生物叢の構成がグループ間で異なることを発見しました。バクテロイデス属、放線菌属、ルミノコッカス属、ラクノスピラ科、セレノモナデール属などのさまざまな細菌群は、対照群と比較してアルツハイマー病患者でさまざまな違いがあることがわかりました。アルツハイマー病患者ではバクテロイデス属の存在量がわずかに減少し(p = 0.039)、放線菌属の存在量がわずかに増加し、ルミノコッカス科とラクノスピラ科が優勢な細菌でした。これらの結果から、著者らはアルツハイマー病患者では腸内微生物叢が変化しており、アルツハイマー病の病因に関与している可能性があると結論付けました[73]。中国で実施された研究は、アルツハイマー病患者の腸内細菌叢の変化に関する重要な知見を提供しているものの、生活習慣、食習慣、民族性、その他の併存疾患など、多くの質的変化は中国と米国で比較できない[74]。これまでの実験と入手可能なデータは、神経変性における腸内細菌叢と脳の相互作用の役割を確認し、高齢者の炎症反応、加齢、および不適切な食生活がすべてアルツハイマー病の発症に寄与していることを示唆している。腸-脳軸の双方向性の性質を考慮すると、脳の神経病理は細菌叢の変化を誘発し、細菌叢の変化は神経病理を誘発する可能性がある。 |
| 食物療法やプロバイオティクスのサプリメント摂取によって腸内細菌叢を変化させることで、アルツハイマー病の新たな予防・治療選択肢が創出される可能性がある[53]。腸内細菌叢がストレス反応や認知機能といった心理的プロセスに影響を与えることは、研究者の間で広く認められている[75]。別の研究では、糞便サンプルから採取したデータを解析し、アルツハイマー病患者と非アルツハイマー病患者の腸内細菌叢を比較した。その結果、特にアルツハイマー病患者では腸内細菌叢の微生物多様性が低下しており、年齢と性別を一致させた健常対照群とは異なることが明らかになった[71]。 |
| 食事は腸内マイクロバイオームの調節において中心的な役割を果たし、その下流には免疫系と中枢神経系への影響が及んでいます。腸内細菌叢の不均衡は消化管炎症の一因となる可能性があり、全身性炎症やアルツハイマー病に関与する神経炎症プロセスとの関連が指摘されています[65]。この知見は、腸脳連携が潜在的な治療介入の重要な標的となる可能性を示唆していますが、さらなる臨床的エビデンスが必要です。 |
| 7. プロバイオティクスとアルツハイマー病 |
| 科学者らは、ラクトバチルス属およびビフィドバクテリウム属の菌株を含むプロバイオティクスを12週間毎日摂取することで、高齢アルツハイマー病患者のミニメンタルステート検査スコアに中程度ではあるものの有意な改善をもたらすことを明らかにしました[76]。この無作為化二重盲検臨床試験では、60人の参加者が牛乳を摂取する対照群と、ラクトバチルス・アシドフィルス、ラクトバチルス・カゼイ、ビフィドバクテリウム・ビフィダム、ラクトバチルス・ファーメンタム(各2×10 CFU/g)を含むプロバイオティクス牛乳を1日200mL摂取する治療群に12週間割り付けられました。介入前後のミニメンタルステート検査スコアを収集し、代謝変化を測定するために空腹時の血液サンプルを分析しました。結果は、プロバイオティクス群は対照群と比較してミニメンタルステート検査において統計的に有意な改善を示した(p < 0.001)ことを示しました。しかし、スコアは依然として認知機能障害を反映しているため、変化の程度は臨床的に意味があるとは考えられませんでした。それでもなお、これらの知見は、プロバイオティクスの継続的な摂取がアルツハイマー病患者の認知機能と代謝状態に有益となる可能性を示唆しています。 |
| 別の研究では、L. プランタルム MTCC1325(グラム陽性菌のプロバイオティクス菌株)が、アルツハイマー病で誘導されるエネルギー源となる糖であるD-ガラクトースに対する抗アルツハイマー作用を持つ可能性があることが明らかになりました[77]。さらに、プロバイオティクスの経口投与によって腸内細菌叢を操作し、アルツハイマー病マウスモデルにおいて血糖恒常性を回復させるという研究結果も出ています[78]。また、動物にプロバイオティクスを投与すると、空間認知能力とアミロイドβの抗酸化バイオマーカー値が改善されることが実証されています[79]。この研究は、アルツハイマー病動物モデルにおいてプロバイオティクスがシナプス可塑性に及ぼすプラス効果を初めて証明したものです。これまでの研究では、ラクトバチルス・プランタラムC29が腸内細菌叢の過剰なリポ多糖による脳の炎症を抑制し、海馬の脳由来神経栄養因子(BDNF)の発現を回復させることで、老齢ラットの認知能力を効果的に向上させ、マウスのスコポラミン誘発性記憶障害を改善することが実証されています[80,81]。 |
| Hwangら[82]による臨床試験では、認知機能サポートのための栄養補助食品としてのラクトバチルス・プランタラムC29発酵大豆(DW2009)の安全性と有効性を評価しました。キムチから単離されたラクトバチルス・プランタラムC29は、抗炎症作用が知られています。この研究では、軽度認知障害の参加者100名を無作為に割り付け、ラクトバチルス・プランタラムC29発酵大豆(800 mg/日、n = 50)またはプラセボ(800 mg/日、n = 50)を12週間投与しました。認知機能は、記憶と注意力に焦点を当てたコンピューター化された神経認知テストを用いて評価され、血清中の脳由来神経栄養因子(BDNF)レベルも測定されました。 ラクトバチルス・プランタラムC29発酵大豆を摂取した被験者は、プラセボと比較して、全体的な認知機能スコアにおいて有意に高い改善を示しました(z = 2.36、p = 0.02)。特に注意力の向上が顕著でした(z = 2.34、p = 0.02)。これらの認知機能の改善は、ラクトバチルス・プランタラムC29発酵大豆摂取後の血清脳由来神経栄養因子値の上昇と正の相関を示しました(t = 2.83、p = 0.007)。この結果は、ラクトバチルス・プランタラムC29発酵大豆が軽度認知障害における認知機能の向上に安全に使用できること、そして脳由来神経栄養因子値の上昇がこれらの効果の根底にある可能性があることを示しており、認知機能低下への対処における脳腸相関の役割を浮き彫りにしています。著者らはまた、プラセボ効果が主観的な結果に影響を及ぼす可能性があることを指摘し、今後の研究において客観的なバイオマーカーの必要性を強調しています。 |
| 研究における既存のギャップを埋める方法の一つは、プロバイオティクスの効果を妨げる可能性のある活性微生物、食事成分、薬物、ライフスタイルなどの要因を報告しつつ、適正臨床基準(GCP)に従ってヒト介入研究を実施することです[83]。プロバイオティクスの効果と重要性、そして様々な脳機能や身体機能への影響については、明らかにエビデンスが存在します。より具体的には、アルツハイマー病症状に最も効果的な特定の菌株に関する更なる研究と、プロバイオティクスの長期的な効果に関するより深い理解が必要です。 |
| これまでアルツハイマー病、腸-脳軸、プロバイオティクスに関する研究は数多く行われてきましたが、アルツハイマー病患者の治療を目的としたエビデンスに基づく介入法を開発するためには、文献にはまだ多くの不足点があり、それらを埋める必要があります。本研究は、この分野における知見を広げ、プロバイオティクスサプリメント、アルツハイマー病の認知症状への効果、神経変性疾患における腸脳連携の関与に関する知見に貢献することが期待されます。本研究の目的は、腸内細菌叢を標的とすることで、アルツハイマー病患者の病態や症状の改善につながる可能性を明らかにすることです。本レビューの科学的知見は、プロバイオティクスまたはプレバイオティクスが、主に抗炎症作用および抗酸化作用により、アルツハイマー病治療における新たな生物学的安全策としての可能性を示唆しています。認知機能や代謝活性を改善する能力、そして腸管および脳関門の透過性に必須の代謝物を産生する能力は、有望であると考えられます[84]。 |
| Kobayashiらはその後、以前のマウス研究の結果を基に、無作為化二重盲検プラセボ対照臨床試験を実施し、12週間のビフィドバクテリウム・ブレーベA1補給が、記憶障害のある高齢者の認知機能に影響を与えるかどうかを検証した。認知能力は、ベースラインと介入後に、日本版神経心理学的状態評価のための反復性神経心理学的状態評価(RBANS)とミニメンタルステート検査(MMSE)を使用して評価された。合計121人の参加者が無作為化され、117人が研究を完了した。プロバイオティクス群の参加者は、毎日の研究日誌によってモニタリングされた通常の生活習慣を維持しながら、1日1回食後にB.ブレーベA1カプセルを2錠摂取した[85]。試験終了時には、両群とも神経心理学的検査のスコアに改善が見られ、全体的に有意差はなかった。しかし、層別分析により、ベースラインの 反復性神経心理学的状態評価スコアが低かった参加者は、プラセボと比較して、反復性神経心理学的状態評価即時記憶サブスケールと ミニメンタルステート検査合計スコアで大幅な向上を経験したことが明らかになりました。 |
| B. ブレーベA1による即時記憶サブスケールの改善は、この特定のプロバイオティクスが主に健忘性軽度認知障害および認知症の初期段階の治療に有効であることを示唆しています。Kobayasiらによる研究では、B. ブレーベA1の補給は安全であり、主観的な記憶障害を有する高齢者、特にベースライン反復性神経心理学的状態評価スコアが低い高齢者において即時記憶の改善をもたらすことが実証されました[85]。この知見は有望ですが、予防効果を評価するにはより長い介入期間が必要になる可能性があるため、介入期間が短いことは依然として制約となっています。ミニメンタルステート検査と比較して、反復性神経心理学的状態評価は早期の認知機能変化を検出する上でより高い感度を提供します。観察された認知機能の改善は、全体的なグループレベルの効果が依然として中程度であっても、菌株特有の利点の可能性を浮き彫りにしています。 |
| 日本の研究者Xiaoら[86]が主導したもう一つのランダム化二重盲検プラセボ対照試験は、身体的に健康な健忘性軽度認知障害の疑いのある患者集団において、プロバイオティクス株ビフィドバクテリウム・ブレーベA1(MCC1274)の認知機能回復能力を検証することを目的としていました。研究者らは、健忘性軽度認知障害を患う健康な高齢者80名を選び、2つのグループに分けました。1つのグループにはプロバイオティクスB. ブレーベを1日1回投与し、もう1つのグループには16週間プラセボを投与しました。認知機能を評価するため、研究者らは試験前後に反復性神経心理学的状態評価(RBANS)と日本版健忘性軽度認知障害スクリーン(JMCIS)検査を実施しました。 16週間の補給後、プロバイオティクス群の参加者はプラセボ群と比較して有意に高いRBANS合計スコアを示した(群間差の平均 = 11.3、95% CI: 6.7–15.8、p < 0.0001)。即時記憶、視空間/構成能力、遅延記憶領域(p < 0.0001)で顕著な向上が見られ、これは治療意図(ITT)解析とプロトコル適合(PP)解析の両方で一貫していた。日本版健忘性軽度認知障害スクリーンスコアもプロバイオティクス群でプラセボ群と比較して改善し、治療意図解析では有意に近づき(p = 0.052)、プロトコル適合解析では有意に達した(p = 0.036)。これらの知見は、ビフィドバクテリウム・ブレーベA1が、軽度認知障害が疑われる人の記憶機能を向上させるための安全で効果的な介入であることを示唆している[86]。 |
| Tonらによる追加研究[87]では、アルツハイマー病の高齢患者におけるケフィア補給の認知能力、炎症マーカー、酸化ストレスに対する潜在的な利点が検討されました。研究者らは、ケフィア粒で発酵させた牛乳を定期的に摂取することで、アルツハイマー病における認知機能、代謝機能、細胞障害の改善に役立つ可能性があると提唱しました。この非対照臨床試験では、参加者はプロバイオティクス発酵牛乳(1日2mL/kg)を90日間摂取しました。認知機能テスト、サイトカイン発現、酸化ストレスマーカー、血球損傷バイオマーカーが、ベースライン(T0)と補給後(T90)に測定されました。介入後、患者は8つの標準的な認知機能テスト、特に記憶、視空間認知能力と抽象化能力、実行機能/言語機能において有意な改善を示しました。サイトメトリー分析では、いくつかの炎症性サイトカインと酸化ストレスマーカーの減少と、一酸化窒素のバイオアベイラビリティの完全な(100%)増加が明らかになりました。これらの結果は、ケフィアの補給が認知機能障害を改善したことを示唆しており(p < 0.05)、これは全身性炎症、酸化ストレス、および血球損傷の調節によるものと考えられます。他の知見と一致して、本研究はプロバイオティクスがアルツハイマー病の進行を遅らせるための有用な補助療法となる可能性を示唆しました。 |
| Sanborn ら[88]は、ラクトバチルス・ラムノサスGGが中高年者の認知機能に及ぼす影響を調査するため、二重盲検プラセボ対照ランダム化臨床試験を実施した。この試験では、52歳から75歳までの200名の参加者が登録され、3ヶ月間毎日プロバイオティクスまたはプラセボを摂取する群に無作為に割り付けられた。認知機能は、NIHツールボックス・トータル・コグニション・スコアを用いて評価したほか、t検定、カイ二乗検定、反復測定分散分析などの統計的比較も行った。主要解析には145名(プロバイオティクス群77名、プラセボ群68名)が含まれ、認知障害は確立された基準(サブテスト1つ以上、tスコア≦35)に基づいて定義された。結果は、プロバイオティクスを摂取した認知障害のある人は、プラセボ群の障害のある人、および両群の認知機能に問題のない人と比較して、総認知スコアにおいてより大きな改善を示したことを示しました。この知見は、L.ラムノサスGGの補給が、高齢者の認知機能を向上させる可能性があり、加齢に伴う認知機能の健康維持のための新たなアプローチとしての潜在的な役割を裏付けていることを示唆しています[88]。本研究には、補給期間のわずかな違い、NIHツールボックスの実践効果の可能性、そしてDNAシークエンシングによる腸内細菌叢の変化に関するデータが不十分であることなど、いくつかの限界があります。 |
 |
| 8. 関連トピック |
| 腸-脳軸とプロバイオティクスがアルツハイマー病に及ぼす影響に関しては、他の食事介入、精神疾患、その他の神経変性疾患など、多くのサブトピックがこの文献レビューのトピックに該当します。プロバイオティクス以外の食事介入についても検討することは、本文献レビューの目的にとって重要です。研究によると、加齢に伴う腸管由来の炎症反応と高齢者の不適切な食生活がアルツハイマー病の発症に寄与することが示されています。そこで、アルツハイマー病にとって健康的な食事とはどのようなものなのかをさらに探求していきます。 |
| アルツハイマー協会によると、心臓に良い食事は体と脳の両方に有益であり、一般的に飽和脂肪酸の少ない食品を摂取することが推奨されています。アルツハイマー病に関して言及される2つの主要な食事は、高血圧を抑える食事療法(DASH)と地中海式ダイエットです。一般的に、これらの食事療法はどちらも心臓病の軽減に役立ち、ひいては認知症のリスクも軽減できる可能性があります。高血圧を抑える食事療法は、飽和脂肪酸、総脂肪、コレステロールが低く、果物、野菜、低脂肪乳製品を多く含む食品で構成されています[90]。さらに、地中海式ダイエットは、地中海沿岸地域で一般的に見られる健康的な食生活の異なる原則を取り入れています。より具体的には、果物、野菜、ナッツ、穀物を中心とし、バターの代わりにオリーブオイルなどの健康的な脂肪を使用します。また、地中海式ダイエットでは赤身の肉の摂取を制限し、少なくとも週に2回は魚や鶏肉を食べるようにしています。塩の代わりに、ハーブで料理に風味をつけることが推奨されています[90]。 |
| 前述のように、ハートマンら[32]は、ザクロジュースの食事性補給が、ザクロに含まれる高濃度の抗酸化ポリフェノール物質を介したトランスジェニックマウスモデルの行動およびアルツハイマー病様病態に影響を及ぼすかどうかを検証する研究を行いました。その結果、ザクロジュースを摂取したマウスは、対照群と比較して水迷路課題の学習速度が速く、泳ぐ速度も速かったことがわかりました。また、対照群と比較して、海馬における可溶性アミロイドβの蓄積とアミロイド沈着が有意に減少していました。この研究は、ザクロジュースがアルツハイマー病マウスモデルにおいてアミロイド量を軽減し、行動を改善することを実証しました[32]。その後のレビューで、ハートマンとロス[34]は、一般的に摂取されているいくつかの植物化学物質がアルツハイマー病の神経病理と転帰に及ぼす影響と潜在的なメカニズムに関する疫学的および実験的証拠を取り上げ、さまざまな果物や野菜に含まれる生理活性植物化学物質を定期的に摂取すると、アルツハイマー病における加齢や損傷に関連した神経病理が緩和されると示唆した。全体的に、高血圧を抑える食事療法/地中海式ダイエットやザクロ/ポリフェノールなどの食事因子は、腸内細菌叢を介して代謝機能の修正、抗炎症作用、神経新生のサポートを通じてその効果を発揮することを示唆する傾向がある。利点は、これらの食事因子は費用対効果が高く、実用的で、非薬理学的介入であるため、予防と治療の良い出発点となることが多いということである。 |
| 感情の調整という点では、腸内細菌叢は、腸-脳軸を介して不安、気分、認知、痛みを調整する役割を果たしています [91]。 うつ病や不安症などの他の精神疾患も、腸の健康が精神的健康に及ぼす影響についての研究により、言及する価値があります。 セロトニンやγ-アミノ酪酸などの特定の神経伝達物質は、腸が脳に及ぼす影響の背後にある神経科学に関する議論を導くことができます。 プロバイオティクスは、他の薬のサプリメントとして、または不安やうつ病の代替治療として使用されてきました [72]。 プロバイオティクスと免疫応答の関係を調べた動物実験では、乳酸菌を含むプロバイオティクスでマウスを治療した後、腸内細菌叢と視床下部-下垂体-副腎軸が回復したことがわかりました [92]。他の研究でも、わずか2週間の投与でラットのACTH(副腎皮質刺激ホルモン)値とコルチコステロン値が低下したことが実証されており、プロバイオティクスが視床下部-下垂体-副腎軸を抑制する効果があることが示されています[93]。同様に、ヒトの研究でも不安やうつ症状が同等に軽減されています。慢性ストレスに苦しむ患者に、牛乳飲料またはプラセボを毎日摂取する3週間のプロバイオティクス治療を受けました。気分と認知機能は、ベースライン、摂取10日後、摂取20日後に測定されました。患者は、元気/疲れている、落ち着いている/不安、高揚している/落ち込んでいる、頭がはっきりしている/混乱している、自信がある/自信がない、快活/怒りの6つの気分の要素を使用して、毎日のアナログスケールで全体的に幸せな気分を評価しました[94]。全体的に、この研究では、気分が悪い状態で研究を開始した人の気分がプロバイオティクスの摂取によって改善されたと結論付けられています。 |
| さらに、過去にうつ症状のない健康なボランティアを対象に、プロバイオティクスまたは抗うつ薬を投与した30日間の研究が行われました。プロバイオティクスを投与された被験者は、抗不安薬として一般的に使用されるジアゼパムを投与された被験者と同様に、コルチゾール値が低下し、自己申告による心理的効果の改善が見られました[95]。プロバイオティクスサプリメントをうつ病の改善または予防に利用できる可能性を発見した別の研究では、気分障害のない健康な被験者20名に4週間のプロバイオティクス食品サプリメント介入を実施し、対照群の被験者20名には同期間、不活性プラセボを投与しました。介入前後の評価では、改訂版ライデンうつ病感受性尺度[96]を用いて、悲しい気分に対する認知反応を評価しました。研究者らは、プロバイオティクス介入を受けた被験者は悲しい気分に対する全体的な認知反応が有意に低下したと結論付け、この研究はプロバイオティクスの摂取が不幸な気分に関連する否定的な思考を軽減する可能性があることを示す証拠を提供していると述べています。これらの研究により、健康な腸内細菌叢の重要性と、中枢神経系の細菌叢異常と炎症が精神疾患の潜在的な原因として関連付けられ、不安やうつ病に苦しむ患者にプロバイオティクスがどのように使用されているかが明らかになった[97]。 |
| アルツハイマー病と並んでパーキンソン病(PD)も進行性神経変性疾患であり、臨床的には仮面様表情、振戦(典型的には発症時に片側性)、手足、体幹、または首の硬直、無動(随意運動の低下)、および姿勢またはバランスの困難を特徴とする。これらの症状は、基底核内の変性およびドーパミン産生の低下に起因する。パーキンソン病の病因として広く支持されている仮説の1つは、多くの細胞型に存在するタンパク質であるα-シヌクレイン(αSYN)の異常な蓄積であり、パーキンソン病患者はシナプス前終末および神経突起投射においてα-シヌクレインの発現上昇を示すという[98]。通常、α-シヌクレインはドーパミンなどの神経伝達物質のシナプス前放出を制御しているが、その過剰発現および凝集が疾患の進行に関与していることが示唆されている。脳-腸管-腸内微生物叢軸の崩壊とパーキンソン病との関連を示す証拠も増えており、消化管症状はしばしば運動障害に先行する。これは、疾患病態が腸から脳へ伝播する可能性があるという説を裏付けている[99]。このモデルによれば、腸内細菌叢の乱れ、小腸内細菌の過剰増殖、そして腸管透過性亢進は、自然免疫系を過剰に刺激し、全身性炎症を誘発する可能性がある。さらに、腸管神経系とグリア細胞の活性化はα-シヌクレインのミスフォールディングに寄与し、パーキンソン病の進行をさらに促進する可能性がある[99]。 |
| 神経炎症および運動障害における腸内細菌叢の役割は、パーキンソン病の動物モデルで実証されています。研究により、正常な腸内細菌叢の存在は、パーキンソン病関連の運動および脳病理、ならびにミクログリア活性化を引き起こし、パーキンソン病症状を悪化させる短鎖脂肪酸の産生に不可欠であることが示されました[91]。これらのマウスから細菌叢を除去したとき、ミクログリア活性化および病理学的変化の両方が減少したことから、腸内細菌叢がパーキンソン病病態生理に直接寄与しているという強力な証拠が得られました[100]。さらに、パーキンソン病患者の糞便を輸送されたマウスは、健常対照者の糞便サンプルを輸送されたマウスと比較して、運動機能の顕著な障害を示し、パーキンソン病病態における腸内細菌叢の関与をさらに強力に裏付けています。 |
| この文献レビューの参考になり得る他のトピックには、腸-脳軸を理解することでさらに探求できる他の脳疾患の研究が含まれます。これには、他の神経変性疾患、自閉症スペクトラム障害、うつ病、不安症などが含まれます。脳と行動に影響を与えるこのようなトピックに関するこれらの他の要因をよりよく理解するために行われた研究を結び付けることは、アルツハイマー病の研究を理解する上でも有望です。さらに、アルツハイマー病を発症する可能性を高める可能性のある腸脳接続の変化に影響を与える可能性のあるライフスタイル要因の研究を調査することで、このレビューに役立つ可能性があります。このレビューに役立つ可能性のあるもう1つのより広範なトピックは、腸内微生物叢が体の他の部分に及ぼすさまざまな影響です。微生物叢が体にプラスとマイナスにどのように影響するかを理解することは、対象の器官である脳への理解を深めることができます。 |
| 9. 考察と臨床的推奨事項 |
| 本文献レビューの目的は、アルツハイマー病の病態、腸-脳軸、そしてプロバイオティクスを用いた食事療法の潜在的な役割に関連する因子を探求することです。初期の研究、特に動物モデルを用いた研究では有望な兆候が示されていますが、ヒトを対象とした大規模かつ適切に管理された臨床試験はまだ実施されていません。そのため、記憶喪失や認知機能低下といったアルツハイマー病関連症状の改善におけるプロバイオティクスの有効性について、明確な結論をまだ導き出すことはできません。 |
| プロバイオティクスは、腸の健康に良いことが知られており、腸と脳のつながりを通じて脳機能にも影響を与える可能性があるため、注目を集めています。しかし、ヒトを対象とした研究では、結果はまちまちです。使用される菌株、投与量、治療期間、そして結果の測定方法には大きなばらつきがあります。プロバイオティクスは安全で手頃な価格の選択肢となるかもしれませんが、アルツハイマー病の効果が実証された治療法ではなく、補助的なアプローチとして捉えるべきです。プロバイオティクスは一般的に安全であり、特に健康な人にとっては安全ですが、高齢者は消化不良や、まれに全身感染症などのリスクに直面する可能性があります。臨床医は、軽度認知障害の患者に対して、理想的には食事や生活習慣の改善を含むより広範なケアプランの一環として、短期間のプロバイオティクス療法を検討する場合があります。 |
| このレビューのもう一つの目的は、腸-脳軸に関する最新の証拠をまとめ、それがアルツハイマー病のような神経変性疾患とどのように関係するかを明らかにすることです。 |
| この分野におけるヒト研究はまだ発展途上であるため、確固たる結論を導き出すことよりも、将来の研究に向けた準備に重点が置かれています。腸と脳の関係は確かに存在しますが、その影響は、脳損傷が不可逆的となるアルツハイマー病の後期段階では限定的であるようです。 |
| 現在のプロバイオティクス研究は、そのデザインが大きく異なっており、サンプル数が少ない、研究期間が短い、あるいはアウトカム指標が一貫していないといった問題が多く見られます。今後の研究では、標準化された認知機能評価、腸内環境のより適切な追跡、そしてより大規模で長期的な試験の実施などを通じて、これらの問題の解決を目指すべきです。初期の知見は有望ですが、プロバイオティクスは実験的かつ補完的なツールと捉えるべきであり、健康的な食事や定期的な運動といった実証済みの戦略の代替となるものではありません。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Neurol. Int. 2025, 17, 153に掲載されたImpact of Gut–Brain Axis and Probiotics on Alzheimer's Disease.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |