| 1. はじめに |
| 腸内細菌叢と、自然免疫および獲得免疫システムの機能との関係は、科学研究の活発な分野を構成しています[1]。 免疫系の恒常性は、腸内細菌叢と粘膜免疫系の間の幅広い相互作用によって部分的に達成されます[2]。 腸内に存在する微生物は、腸管関連リンパ組織(GALT)として知られる腸管リンパ組織、したがって免疫系を継続的に刺激する抗原の供給源です[3]。 遺伝的データによると、人体には人間の遺伝子が1%しか含まれておらず、遺伝子の99%は宿主に生息する微生物に属しています[4]。したがって、個人の腸内微生物叢は、宿主ゲノムの150倍以上の遺伝子をコードすることができます。宿主ゲノムとは対照的に、微生物叢の量的および質的組成は動的であり、食事、抗生物質への曝露、特に病気への反応などの環境要因の影響下で変化します[5]。 |
| SARS-CoV-2ベータコロナウイルスによって引き起こされるCOVID-19のパンデミックに直面して、ウイルスとの接触によって引き起こされる宿主の免疫応答の原因となるメカニズムを認識することが不可欠です。 SARS-CoV-2に感染した患者の呼吸器疾患を示す頻繁な症状のため、肺はCOVID-19疾患の影響を受ける主要な臓器であるように思われます。 しかし、腸や肝臓の機能不全や多臓器不全など、病気の経過中に臓器機能障害が発生することが報告されています[6、7、8、9、10]。 COVID-19患者の下痢の発生と高齢患者の高い死亡率は、COVID-19の経過中に腸と肺の軸が相互作用する可能性があることを示しています。 腸内細菌叢の多様性は年齢とともに減少します。 したがって、腸内毒素症は、高齢者のSARS-CoV-2によって引き起こされる重症疾患のリスクが高い原因の一部である可能性があります。 腸内毒素症による腸内バリアの完全性の崩壊は、SARS-CoV-2ウイルスの肺から循環系およびリンパ管を介した腸管腔への移行をもたらす可能性があります[6]。 個別栄養による腸内細菌叢システムの改善は免疫力を高めると考えられており、特にCOVID-19パンデミックに直面した高齢者や免疫不全患者におけるウイルス感染の影響を最小限に抑える重要な予防要因となる可能性があります[1]。 腸と肺のクロストーク、および腸内細菌叢とCOVID-19の関連の可能性に関する情報はほとんどありません。 このレビューは、SARS-CoV-2感染およびCOVID-19重症度に対する免疫応答と腸内細菌叢の利用可能な知識と可能なリンクをまとめたものです。 |
| |
| 2. SARS-CoV-2感染における腸内細菌叢 |
| 腸内細菌叢は、人体に生息する微生物(細菌、古細菌、ウイルス、真菌)の最大の貯蔵庫です[1,5]。 健康な被験者の腸内細菌は主に放線菌、ファーミキューテス、プロテオバクテリア、バクテロイデス門で構成され[11]、結腸にはバクテロイデス門、プレボテルレース科、リケネラ科、ラクノスピラ科、ルムニオコッカス科の細菌が生息しています[12]。 これらの微生物のこれまでに知られている機能には、栄養素の代謝、消化過程、自然免疫系および獲得免疫系の発達と機能の調節など、宿主の生理学的機能の調節が含まれます[1,13]。 さらに、共生腸内細菌叢は、エネルギー生産、酸化還元バランス、ミトコンドリア生合成、および炎症カスケードに関連するミトコンドリア機能に影響を及ぼし、短鎖脂肪酸(SCFA)や二次胆汁酸などの代謝物の合成を促進します。 ウイルス感染症または細菌感染症は、生物にとってストレス要因であり、ミトコンドリアによる免疫応答の調節を誘発し、炎症を引き起こす可能性があります。 ミトコンドリアは、免疫細胞や上皮腸クロム親和性細胞などの腸のエフェクター細胞を活性化することにより、微生物系に影響を与えることが報告されています[14,15]。 |
| Groves et al [16]は、ウイルス感染、食物消費、腸内細菌叢、および腸内メタボロームの間の関係を分析しました。 この研究は、ウイルス感染後の腸内細菌叢の組成の変化は、CD8 + T細胞の活性や、肺感染後の腸内メタボロームの有意な変化にも関連する食物摂取量の減少など、複数の要因によって引き起こされる可能性があることを示しました。生成された脂質のレベルを増加させることが報告されています。 現在の研究では、SARS-CoV-2は、複数の細胞型にアンジオテンシン変換酵素2(ACE2)として知られる受容体が存在するため、人体のほぼすべての臓器に影響を与える可能性があることが示されています[17、18、19、20]。 この受容体は、腸細胞、繊毛細胞、および肺のII型肺胞上皮細胞の刷子縁に存在します[18]。 アンジオテンシン変換酵素2によって実行されるアミノ酸輸送の機能は、消化管内の腸内微生物の生態に関連しており、COVID-19が腸内細菌叢にある程度関連している可能性があることを示唆しています[20]。 |
| 小腸がCOVID-19開発のダイナミクスにおいて重要な役割を果たしている可能性があります。 アンジオテンシン変換酵素2が胃、回腸、結腸、腎臓、肝臓で肺と比較してさらに高く発現しているという証拠があります[17]。 さらに、Lamers et al [18]は、彼らの研究で、SARS-CoV-2が腸細胞のアンジオテンシン変換酵素2受容体に付着することを示しました。 ヒトアンジオテンシン変換酵素2への結合は、高レベルのSARS-CoV-2が腸、特に健康な個人の結腸細胞に存在し、ウイルスがアミノ酸の輸送と微生物叢の定量的および定性的組成を調節し、腸において炎症を誘発する可能性があることを示しています [17,21,22]。 さらに、Zuo et al [19]は、患者の糞便サンプル中のSARS-CoV-2と逆相関する腸内のいくつかの細菌株(Bacteroides dorei、Bacteroides thetaiotaomicron、Bacteroides massiliensis、およびBacteroides ovatus)が減少していることを観察しました。マウスの腸でのアンジオテンシン変換酵素2の発現においてだけでなく、Coprobacillus、Clostriudium ramosum、およびClostridium hathewayiの存在量とCOVID-19の重症度との相関関係も観察されています[19]。 |
| アンジオテンシン変換酵素2および膜貫通セリンプロテアーゼ2は、食道、肺、肝臓、腎臓、脳、結腸、または小腸上皮を含むがこれらに限定されない多種多様なヒト組織で発現される。 アンジオテンシン変換酵素2をブロックすると、アンジオテンシノーゲンのレベルが上昇し、その結果、高血圧につながる可能性があります[23]。 SARS-CoV-2は、腸のアンジオテンシン変換酵素2受容体を活性化し、炎症や下痢などの胃腸の症状を誘発します[20]。 腸内免疫系のTリンパ球とBリンパ球の変化と腸管系の活性化によって引き起こされる微生物叢の腸内毒素症は、炎症性メディエーターシグナルを心臓血管系または脳を含む他のヒト器官に送ります[20]。 |
| |
| 3. SARS-CoV-2感染における細菌叢-腸-脳軸 |
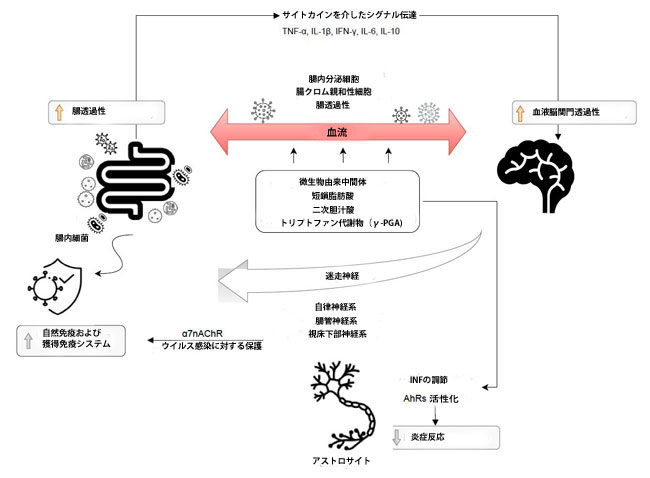
| 消化管にSARS-CoV-2が存在すると、迷走神経または循環経路を介して中枢神経系に侵入するウイルスに影響を与える可能性があります[24]。 腸と中枢神経系の間の双方向通信ネットワークは、脳-腸軸として定義されます。 迷走神経、腸管神経系、自律神経系、および視床下部下垂体副腎軸は、中枢神経系と胃腸管の間の情報の伝達に関与しています。 |
| 腸内細菌叢と中枢神経系との相互作用にはいくつかのメカニズムが関与しています。 Haase et al [25]は、これらのメカニズムには、アセチルコリンまたはカテコールアミンの分泌をもたらす直接迷走神経が含まれることを報告しました。 さらに、腸内分泌細胞との相互作用は、多数の神経ペプチド、腸ホルモン、神経伝達物質、または微生物関連の分子パターンの産生をもたらす可能性があります[25]。 腸内細菌叢と中枢神経系のコミュニケーションは、主に微生物由来の中間体を介して媒介されます。 最もよく説明されている例には、短鎖脂肪酸(SCFA)、二次胆汁酸、およびトリプトファン代謝物、例えば、樹状細胞を刺激してCD4 +細胞をTh1に向けて分極させ、Treg細胞の分化を促進することができる、バチルス由来のポリ-ガンマ-グルタミン酸(ガンマ-PGA)が含まれます [25]。 これらの化合物のいくつかは、腸内分泌細胞、腸クロム親和性細胞、および粘膜免疫系と直接相互作用する可能性があり、腸の障壁を越えて循環に入る能力に大きく貢献します。 この事実は、次に血液脳関門の通過を可能にします[26]。 さらに、腸内微生物叢は、自然免疫および獲得免疫応答を活性化する可能性のある刺激シグナルを免疫系に提供します。 アセチルコリンの放出による副交感神経系の活性化は、マクロファージの炎症反応の低下を含むウイルス感染から保護するアセチルコリンニコチン性受容体(α7nAChR)を活性化します[27]。 |
| 適応免疫システムは、腸内細菌叢の組成と多様性を制御することも示されています。 腸から脳へのサイトカインを介した免疫シグナル伝達は、腸-脳軸のもう1つの証明されたコミュニケーション経路です。 腸内細菌は、TNF-α、IL-1β、IFN-γ、IL-6などの炎症性サイトカイン、およびIL-10などの抗炎症性サイトカインの合成に影響を与えることができます[28]。 中枢神経系に対するサイトカインの直接的な影響は、血液脳関門の特定の領域の透過性と、迷走神経などの求心性神経線維の活性化によるものです。 アストロサイトは、腸内細菌叢と中枢神経系の間の別の注目すべき相互作用に関与しています。 アストロサイトは中枢神経系で最も豊富な細胞集団を構成し、血液脳関門の制御、代謝の調節(グリコーゲン貯蔵)、およびニューロンシグナル伝達のサポートに関与しています[29]。 微生物代謝産物は、アストロサイトにおけるI型インターフェロンシグナル伝達の調節により、アリール炭化水素受容体(AhR)を活性化して炎症反応を低下させることができます[26,29]。 |
| これらのメカニズムを図1に示します。 腸内細菌叢は、セロトニン(Bifidobacterium infantis経由)などの主要な中枢神経伝達物質、またはγ-アミノ酪酸合成細菌(Lactobacillus and Bifidobacterium spp.)からの神経伝達物質の合成と放出も調節します[30]。 |
|
|
図1 脳-腸軸の双方向相互作用
|
| |
| 腸内へのウイルスの侵入は、循環または迷走神経を介してウイルスが中枢神経系に移動する可能性があります。 グリア細胞とニューロンは、細胞へのウイルス侵入を仲介する受容体を提示することが示されています。 現在までのところ、嗅覚の部分的または完全な喪失がSARS-CoV-2感染の初期のマーカーであることが報告されています。 COVID-19の嗅覚機能障害の原因となるメカニズムはよく理解されていません[31、32、33、34]。 ただし、SARS-CoV-2感染に必要なタンパク質受容体を提示する細胞を含む嗅上皮にある嗅覚受容体ニューロンへの損傷のため、その後の脳感染の可能性を考慮する必要があります。 さらに、比較的高レベルのアンジオテンシン変換酵素2および膜貫通プロテアーゼセリン2の発現が、ヒトおよびマウスの嗅粘膜で実証された。 Butowt と Bilinska[35]によると、SARS-CoV-2感染によって引き起こされるサイトカインストームである嗅覚機能障害には、未確認の要因も関係している可能性があります。 |
| 直接迷走神経、腸内分泌細胞との相互作用、微生物由来の中間体などのメカニズムは、腸内細菌叢と中枢神経系の相互作用に関与しています。 これらのいくつかは、腸内細菌叢がサイトカインの合成に影響を与える能力があるため、これらのバリアの透過性を高めることにより、腸のバリアと血液脳関門を通過することを大幅に可能にします。 腸内細菌叢は免疫系を刺激して自然免疫応答と適応免疫応答を活性化し、炎症反応を減少させる可能性もあります[25、26、36]。 |
| |
| 4. SARS-CoV-2感染症における肺微生物叢 |
| Fusobacterium, Haempophilus, Pervotella, Streptococcus、およびVeillonellaは、健康な個人の肺の主な属です[13]。 局所宿主免疫応答に潜在的に最も関連する肺微生物叢の成分を特定するために、Segal et al [37]は、サイトカインプロファイルと微生物の生存可能な群集との間の相関関係を分析しました。 著者らは、Prevotella と Veillonellaの存在が、Th17を含む多種多様なサイトカインの血清濃度と正の相関があることを報告しました。 |
| 肺の微生物叢は宿主の免疫系にとって非常に重要であり、微生物の移動と除去の間の不均衡は、宿主を呼吸器疾患の進行と悪化にかかりやすくします[13,38]。 アンジオテンシン変換酵素2受容体は全身に存在し、ウイルスの細胞侵入とその後の複製および新しい細胞の侵入を可能にする受容体の存在により、SARS-CoV-2の吸入中に宿主組織が感染にアクセスできる可能性があります。 この初期段階で免疫系がSARS-CoV-2に抵抗できない場合、ウイルスは移動して肺に侵入し、増殖します[13]。 |
| 肺は、さまざまな環境刺激に絶えずさらされている場合、体の防御システムに不可欠な器官です[39]。 証拠の増加は、肺免疫細胞の活性化が微生物への曝露を必要とする自然免疫および獲得免疫を開始することを示しています[39,40]。 現在までに、COVID-19患者の肺微生物叢を分析した研究は2つだけです[39]。 Shen et al [41]は、COVID-19患者、非院内肺炎患者、および健常対照者の気管支肺胞洗浄を調査しました。 著者らは、COVID-19と肺炎の患者では、健康な対照と比較して、微生物叢の組成に有意な変化が見られました。 2番目の研究では、20人の死亡したCOVID-19患者の剖検における肺微生物叢の特徴が報告されました。 さまざまな種類の病原菌や真菌が同定されました。 重要なことに、これらの微生物によって引き起こされるクリプトコッカス属菌感染症によって通常支配されていた肺組織の真菌種は、特に免疫抑制と中枢神経系関与に関して、世界的に高い罹患率と死亡率を示します[42]。 |
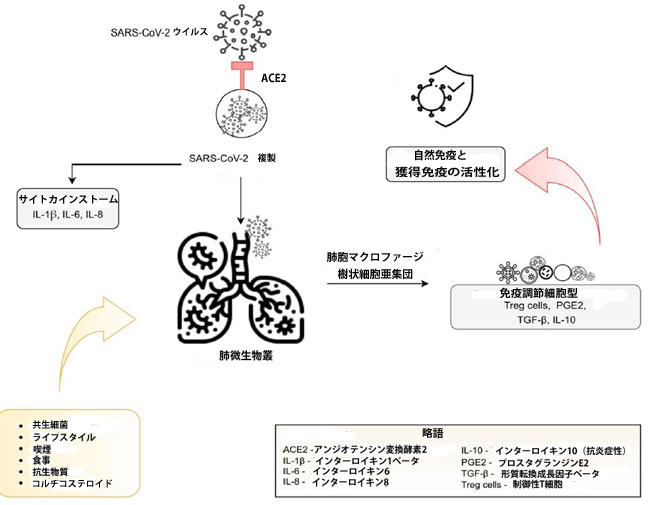
| 肺の微生物叢は、腸内細菌叢と比較してよく理解されていないままです。 しかし、現在報告されている観察結果は、肺胞マクロファージと樹状細胞亜集団によって維持されている免疫寛容における共生肺微生物叢の重要な役割を確認しています[43]。 これらの細胞型はTreg産生を誘導し[44]、プロスタグランジンE2、腫瘍成長因子-β(TGF-β)、およびIL-10 [39]を産生して、免疫調節機能を実行します。 |
| Conte et al [45]によると、共生細菌の組成や宿主の免疫応答など、ライフスタイル、食事、喫煙、抗生物質やコルチコステロイドなどの特定の薬物の使用など、多くの変数が肺微生物叢に影響を与える可能性があります。 最近の前向き研究[46]は、食物繊維が豊富な食事をしている患者はCOVID-19からより良く回復することを示しました。 これは、抗炎症反応にも関与する短鎖脂肪酸を介して、腸内細菌叢を介した体系的な免疫調節に関連している可能性があります。 さらに、[47]は、IFN-Iシグナル伝達応答が、過剰なウイルス複製、炎症、したがってサイトカインストームの回避に関連していることを示しています。 複製、増殖、および共生肺微生物叢の潜在的なメカニズムを図2に示します。 |
|
|
図2 SARS-CoV-2感染後の肺微生物叢
|
| |
| アンジオテンシン変換酵素2受容体は、ウイルスの細胞侵入を可能にし、肺に侵入して炎症を開始するだけでなく、複製と増殖も開始します。 肺免疫細胞は、共生肺微生物叢への曝露を必要とする先天性および獲得免疫応答を開始します。 免疫寛容は、肺胞マクロファージおよび樹状細胞亜集団によって維持され、免疫抑制因子(Treg細胞、PGE2、TGF-β、IL-10)の産生の結果として、免疫調節細胞によって維持されます。 肺微生物叢の組成は、食事、ライフスタイル、抗生物質やコルチコステロイドなどの特定の薬物の使用など、さまざまな要因の影響を受ける可能性があります[13、43、44、45]。 |
| |
| 5. COVID-19における腸-肺軸 |
| LiらによるCOVID-10の分子病因と診断の分析[48]は、コロナウイルスが肺に損傷を与え、不均衡な過免疫反応を伴う肺炎を引き起こすことを示しました[6]。 最近の証拠は、腸と肺の間の双方向クロストークが免疫恒常性の維持[49]と病気の経路に関与していることを示しました。 2012年、Keely et al [50]は、腸内細菌叢と肺の間の双方向交換を通じて、腸内細菌叢が肺の健康に及ぼす影響を実証しました。これは、腸-肺軸として定義されます[6]。 このリンクには、血流を介した腸から気道への免疫細胞の移動も含まれ、これらの細胞は感染との戦いを支援します。 さらに、腸は、血清で検出された宿主獲得炎症性メディエーターを介して肺免疫応答を調節します。 ウイルス性呼吸器感染症の間、病原体に対するマクロファージの反応は腸内微生物の存在に依存します[13,51]。 |
| 肺の炎症を引き起こす内毒素や微生物の代謝物が血流に入ると、腸内細菌叢の組成が変化し[1,52]、バクテロイデス門の相対的な存在量が増加し、ファーミキューテスの相対的な存在量が減少する可能性があります[53]。 |
| COVID-19に苦しむ患者の微生物叢を説明した研究はほんのわずかです。 Khatiwada et al [39]は、肺微生物叢がSARS-CoV-2感染と疾患の転帰に影響を与える可能性があるかどうかを調査し、肺微生物叢をCOVID-19の臨床経過に関連付ける直接的な証拠がないことを指摘しました。 しかし、人間または動物の調査から得られた新たな証拠は、SARS-CoV-2に感染した患者では、肺微生物系と腸内細菌叢が大幅に変化し、COVID-19症状の経過と重症度に影響を与える可能性があることを示しています[39,42,54,55]。 ある研究では、COVID-19患者とインフルエンザA(H1N1)患者の腸内細菌叢の組成と多様性を比較しました。 COVID-19患者のグループでは、微生物の多様性が大幅に減少しStreptococcus、 Rothia, Veillonella, 及び Actinomycesなどの日和見病原体の相対量がかなり多く、共生微生物の相対量が少ないことが検出されました[55]。 著者らは、腸内細菌叢がCOVID-19において潜在的な診断的および治療的価値を持っていると結論付けました。したがって、この分野ではさらなる研究が必要です。 さらに、SARS-CoV-2ウイルスは、一部の感染患者の糞便サンプルでも検出されています[19,56]。 胃腸組織のSARS-CoV-2感染は、入院時から退院までCOVID-19患者の糞便サンプルを収集し、糞便微生物叢の変化とその疾患の重症度および糞便排出との関連を調査した香港の研究者にとって興味深いものでした。 この研究の結果は、SARS-CoV-2(咽頭スワブで測定)を除去し、呼吸器症状を解消した後でも、COVID-19の患者は対照と比較して腸内微生物叢の枯渇を示したことを示唆しました。 Firmicutes cluster、Coprobacillus属、およびClostridium hathewayi種の初期の存在量は、COVID-19の重症度と相関することがよくありました。 (軽度、中程度、重度、または重大)(スピアマン相関係数Rho> 0.9、p <0.01)。 抗炎症性細菌Faecalibacterium prausnitziおよびインドール陽性細菌Alistipesonder donkiiは、COVID-19の重症度と負の相関がありました (スピアマン相関係数Rho <-0.87、F. prausnitziの場合はp <0.01、スピアマン相関係数Rho <-0.09、A. onderdonkiiの場合はp <0.005)。 特に、これらの変化は、感染前に抗生物質で治療されていなかったすべてのCOVID-19患者で観察されました[19]。 特に、口腔および上気道の日和見細菌であるActinomyces viscosusは、COVID-19患者の腸でも同定されました。 その存在は、非経口微生物の腸への通過または移動を示唆しています。 研究は15人の患者の小グループで実施されたため、これらのデータは注意して解釈する必要があります(腸内細菌叢の変化とCOVID-19の重症度との関係の分析は7人の患者のグループで実施されました)。 したがって、結果はより大きなグループで確認する必要があります。 腸内細菌叢がSARS-CoV-2感染患者の重症度に関連しているかどうかを調査している間、同様の結果がYeoh et al [36]によって提示されました。 彼らは、腸内細菌株、Faecalibacterium prausntizii、Eubacterium rectale、および免疫調節性共生菌として知られるビフィズス菌は、COVID-19患者では過少提示され、分解後30日で糞便サンプルで減少したままであると報告しました。 |
| 一方、Groves et al [53]は、一般的な呼吸器病原体、呼吸器合胞体ウイルス(RSV)、およびインフルエンザウイルスの感染のマウスモデルを使用して、腸内細菌叢の肺ウイルス感染と腸環境との関連を調べました。 0日と比較した場合、呼吸器合胞体ウイルス感染後4日目と7日目に腸内細菌叢の組成に有意な変化がありました(p = 0.006)。 感染前後のすべてのマウスで優勢な門はバクテロイデス門とファーミキューテス門でした。ただし、呼吸器合胞体ウイルス感染後、バクテロイデス門の相対的な存在量が大幅に増加し、それに対応してファーミキューテス門が減少しました。 興味深いことに、微生物叢の変化と体重減少は一過性でした。 すでに14日目に、バクテロイデス門またはファーミキューテス門の生物多様性の割合は、感染前に観察されたパラメーターと同様であり、腸内細菌叢の回復力を示しています。呼吸器合胞体ウイルス感染の28日後、マウスはベースライン体重に戻った。 したがって、著者らは、呼吸器合胞体ウイルスによる感染は腸内細菌叢を変化させると結論付けました。 Groves et al [53]はまた、呼吸器合胞体ウイルス感染後の糞便中の有意に高いリポカリン-2濃度(腸の炎症のバイオマーカー)を指摘し、呼吸器合胞体ウイルス感染後の気道および結腸洗浄液中のサイトカインのレベルも測定しました。 しかし、呼吸器合胞体ウイルス感染後にIFN-γが気道で上昇したにもかかわらず、どちらの部位でもIL-13またはIL-17のレベルの検出可能な増加はありませんでした。 したがって、いくつかの研究のデータは、COVID-19に苦しむ患者の糞便レベルのカルプロテクチンの増加を示しました。これは、SARS-CoV-2感染が腸の炎症反応にも寄与することを証明しています[20]。 SARS-CoV-2 RNAは、Xiao et al [57]によって、胃、十二指腸、および直腸上皮の間質性浮腫を伴う形質細胞およびリンパ球の浸潤を伴う糞便粘膜で検出されました。 さらに、ウイルスアンジオテンシン変換酵素2受容体の存在は胃腸上皮細胞の細胞質で実証され、ウイルスヌクレオカプシドタンパク質は直腸、十二指腸、および胃上皮細胞の細胞質で検出された。 |
| Zuo et al [56]の別のパイロット研究では、呼吸器ウイルスRNAが陰性の被験者のサンプルでも、一部のCOVID-19患者の肛門スワブと糞便サンプルでSARS-CoV-2ウイルスRNAが検出されました。 著者によると、ウイルス感染と複製の転写活性は、気道からSARS-CoV-2を除去した後でも腸内で持続します。 したがって、腸内細菌叢の組成と機能を調節することにより、腸内のコロナウイルス活性を排除する戦略の実施を示唆している。 ただし、少数の回答者グループによって制限されていなければ、この調査はより適切であった可能性があります。 糞便サンプルは、中国で入院した15人の患者からのみ収集され、そのうち7人は、メタゲノムウイルスRNAシーケンスに基づく最初のサンプリングでSARS-CoV-2の検査で陽性でした。 |
| 逆に、Pan et al [10]によると、パンデミックの初期(2020年3月まで)に実施された横断研究では、糞便サンプル中のウイルスRNAが最大53.4%の患者で検出されたことが示されました。 |
| 無症候性の人の糞便にSARS-CoV-2ウイルスが存在することは、COVID-19が糞便を介して感染する可能性があることを示しています[20,58]。 一方、Zang et al [59]が報告した研究では、SARS-CoV-2のゲノムRNAはCOVID-19患者の糞便サンプルで検出されたが、再感染に適したウイルスは検出されなかった。 著者らは、主にマウスモデルでウイルスの複製能力を研究し、研究の範囲を拡大してヒトサンプルを含めました。 研究の結果は、SARS-CoV-2粒子は腸細胞に入ることができるが、胃液のpHが低く、ウイルスが胆汁や消化酵素と接触する腸環境が悪いため、胃腸管では生き残れないことを示しました[6、 59]。 現在入手可能な結果は、糞便中のSARS-CoV-2ウイルスが脅威であることを実証できませんでした[6,59]。ただし、COVID-19の重症度に対する腸内細菌叢の影響は、免疫系との双方向の接続のため、今後の研究で調査する必要があります[6]。 |
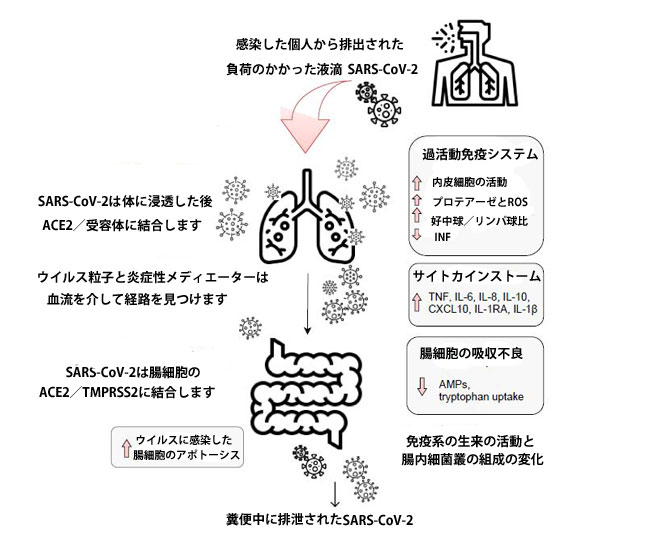
| SARS-CoV-2感染は、感染を理由に炎症性メディエーターの増加を介して肺の透過性亢進を引き起こす可能性があり、したがって、ウイルスは血流を介して腸に移動する可能性があります。 血液中に存在する炎症性メディエーターはまた、腸透過性の増加につながる可能性があり、したがって腸内細菌叢代謝物の漏出および血液を介した肺などの臓器へのその侵入を引き起こす[13]。 確かに、腸内細菌叢と肺は密接に関連しているように見えます。 図3は、SARS-CoV-2感染における肺-腸軸の潜在的なメカニズムを示しています。 |
|
|
図3 SARS-CoV-2感染における腸-肺軸の関与の潜在的なメカニズム
|
| |
| 感染した個人から排出されたウイルスを含んだ液滴の吸入は、SARS-CoV-2分子のアンジオテンシン変換酵素2および他の受容体への結合および潜在的な宿主細胞への侵入につながる可能性があります。 宿主の免疫系の刺激は炎症性メディエーターの放出を引き起こし、その結果、「サイトカインストーム」を引き起こす可能性があります。 炎症性メディエーターの濃度が上昇すると、内皮細胞の活性化と肺の透過性亢進につながります。 したがって、SARS-CoV-2は、炎症性メディエーターとともに、血流を介して腸に移動し、腸細胞に発現するアンジオテンシン変換酵素2受容体に結合して、微生物の構造と免疫系に影響を与えます。 炎症性メディエーターは腸のバリアを破壊し、腸の透過性を高め、微生物とその代謝物の循環への侵入をもたらし、肺を含むさまざまな臓器への移動を可能にします[13,60]。 |
| |
| 6. 腸内細菌叢と免疫システムの機能 |
| 腸内細菌叢は、その代謝的役割に加えて、免疫系の発達、指導、およびプライミングにおいて重要な機能を果たします[51]。 腸内細菌叢のシグナルは、免疫細胞を炎症誘発性および抗炎症性の反応に合わせて調整し、それによって病気に対する感受性を形成します。 腸の免疫恒常性の調整は、免疫調節性サイトカイン(IL-10、TGF-β、IL-35など)を産生する可能性のあるTh17や制御性T細胞などの炎症性応答の発生を誘導することによって達成されます。微生物種の相互共存のバランスを取ります。 さらに、Th17細胞とリンパ組織誘導物質はIL-22産生を誘導し、次にRegIIIy産生を減少させて、腸内細菌叢をさらに形質転換します[61]。 これらのプロセスは、ノトバイオティック(無菌)マウスの研究で説明されており、従来のマウスと比較して、腸の制御性T細胞とIL-10の遺伝子発現が低下しています[62]。 さらに、非粘膜リンパ器官に存在するナチュラルキラー(NK)細胞は、無菌マウスのマクロファージおよび樹状細胞による1型インターフェロン産生の欠如により、抗ウイルス応答を誘発するために効果的にプライミングできませんでした[2]。 |
| 腸内細菌叢はまた、腸内でのIL-22(以前はTh17およびTh22サイトカインとして特徴付けられていた)の産生において重要な役割を果たします。これは、宿主の保護および抗菌ペプチドの誘導の中心であり、上皮バリアの保護機能を促進します[63 ]。 自然リンパ球(ILC)およびCD4 + T細胞はIL-22を産生しますが、CD4 +およびILCT細胞によるIL-22産生を調節する因子は不明です。 最近の報告によると、微生物叢由来の短鎖脂肪酸は、ヒストンデアセチラーゼとGPR41を阻害することにより、CD4 +およびILCT細胞によるIL-22の産生を促進します。 短鎖脂肪酸はまた、アリール炭化水素受容体と低酸素誘導因子1α[63]の発現を促進することにより、IL-22の産生を高めます[62]。 酢酸、プロピオン酸、酪酸などの短鎖脂肪酸は、腸上皮細胞の主なエネルギー源であり、制御性T細胞の発達を促進し、腸粘膜に樹状細胞を誘導し、自己免疫を低下させます。 同時に、微生物代謝産物は、IL-18またはディフェンシン分泌の誘導を含む腸内の病原体に対する免疫応答の促進に不可欠です。 したがって、微生物叢代謝の産物は、粘膜バリアの完全性と免疫恒常性の適切な調節に重要です[51]。 ムチンバリアの侵害は、上皮を介した微生物の侵入を促進し、炎症を引き起こします[2]。 |
| 65歳以上の人は65歳未満の人よりもCOVID-19で死亡する可能性が高くなります。 微生物叢の加齢に伴う変化は非常に重要です[6]。腸内細菌叢は、多様性と安定性を高めるために年齢とともに発達します。しかし、高齢者の腸内細菌叢では逆のパターンが観察されます[2,6]。950の糞便サンプル(DNAが連続して抽出された)のコホート研究[64]は、65歳以上の男性の腸内細菌叢の組成に関するデータを提供しました。合計275のマッピングされた微生物の分類群が記述され、男性被験者の腸内細菌叢を支配する30種類の微生物が示されました。最も一般的な細菌株はバクテロイデス(31.2%、範囲:0.02〜97.86%)で、次にフィーカリバクテリウム(8.5%、0.00〜48,55%)、アリスティペス、アッケルマンシア、プレボテラが続きました。O'TooleとJeffery [65]は、21〜80歳の人々のグループで実施された、宿主の年齢に基づいた微生物叢の定量的および定性的変化を評価する別の複合分析を報告しました。 結果は、腸内微生物の数の減少は年齢に正比例し、微生物の多様性の同時増加に関連していることを示しました。同様に、百歳以上の人と70歳の人口の微生物叢の比較分析は、グループ間の微生物叢の有意差を示しました。百歳以上の微生物叢は、通性嫌気性菌の存在量が多く、ファーミキューテス門とフィーカリバクテリウム プラウスニッチの細菌の存在量が少なかった。さらに、百歳以上のグループでより高い炎症が観察されました[66]。別のレビューの著者[65]は、この観察結果を、恒常性を維持している若い個体群でかなり多い量の抗炎症種の数の減少に関連付けました。加齢によって引き起こされる腸内細菌叢の腸内毒素症[13]と、Bリンパ球によって誘発される獲得免疫の低下を伴う炎症、形質細胞様樹状細胞のインターフェロンI型経路の障害、ACE2の発現低下など、多くの併存疾患により、SARS-CoV-2ウイルスに感染している高齢患者の死亡率が高くなる可能性があります[67]。 |
| SARS-CoV-2感染時の抗生物質治療は、腸内細菌叢の変化のもう1つの理由である可能性があります。中国では、COVID-19治療中に多数の患者(患者の58〜71%)に抗生物質が投与されました[7,68]。抗生物質は腸内毒素症を引き起こし、新たな感染症や炎症に対する感受性を高める可能性があります。さらに、抗生物質は抗生物質関連の下痢を引き起こす可能性があります。 |
| 今日まで、腸内細菌叢の腸内毒素症がCOVID-19疾患の重症度を決定する要因の1つであるかどうか、または逆に、ウイルス感染が腸内細菌叢の好ましくない変化を調節するかどうかについての明確な証拠はありません。 |
| SARS-CoV-2はあらゆる年齢の人々に感染する可能性があります。 しかし、高齢者や併存症のある人は合併症を起こしやすく、感染による死亡のリスクが高くなります[20]。 喫煙、男性の性別、および併存疾患、特に心血管疾患、高血圧、糖尿病[69]、アルツハイマー病、および認知症[20]は、COVID-19疾患の発症リスクを定義する上で重要な役割を果たします。SARS-CoV-2感染は、心筋梗塞、不整脈、脳卒中、または心筋鬱病などの心血管合併症のリスクを高める傾向があります。心血管疾患に伴う微生物叢の多様性の低下[70]は、COVID-19疾患の予後を著しく悪化させます[20]。重要なことに、肥満は腸内細菌叢の変化にも関連しており、COVID-19のもう1つの非常に重要な危険因子です。脂肪組織はSARS-CoV-2ウイルスの貯蔵庫として機能します。肥満患者の脂肪細胞は、より高濃度のアンジオテンシン変換酵素2を示します。 したがって、脂肪組織はSARS-CoV-2の蔓延に寄与する可能性があります。さらに、肥満患者のサイトカインプロファイルの乱れ(炎症性アディポカイン、ロイコトリエン、およびケメリンの濃度の上昇)は、COVID-19感染に反応して死亡するリスクを高める可能性があります[20]。一部の患者では、2型糖尿病はアンジオテンシン変換酵素2の発現低下を伴う場合があります。いくつかのメカニズムが、COVID-19の糖尿病患者の予後不良の原因です。 ただし、SARS-CoV-2感染症の治療に使用される医薬品(コルチコステロイド、ロピナビル、リトナビル)の影響は、2型真性糖尿病患者の血糖コントロールの悪化に寄与する可能性があり、したがって、 自然免疫応答は、炎症性サイトカインの産生を促進し、アンジオテンシン変換酵素2の発現の減少を強めます[71]。 |
| Sharma et al [72]は、COVID-19の治療におけるメトホルミンの潜在的な役割を調査しました。著者らは、メトホルミンはもともと抗インフルエンザ薬として導入されたものであり、メトホルミンの血糖降下作用はその副作用の1つにすぎないと述べています。 SARS-CoV-2感染におけるメトホルミンの可能な治療効果は、肝細胞のAMP(AMPK)によって活性化されるプロテインキナーゼの活性化によるものであり、アンジオテンシン変換酵素2のリン酸化とその構造的および機能的変化をもたらします。最終的に、これはAMPKを介したアンジオテンシン変換酵素2発現のその後の増加を引き起こし、SARS-CoV-2結合の減少につながる可能性があります[72]。メトホルミンによるアンジオテンシン変換酵素2発現のアップレギュレーションは、SARS-CoV-2の液滴が体内に入るのを防ぐだけでなく、AMPKシグナル伝達を介したアンジオテンシン変換酵素2の活性化からも保護します。AMPKの活性化に加えて、メトホルミンはインフルエンザの病因に重要な役割を果たすラパマイシン経路(mTOR)を阻害することも示されています。ラパマイシン経路を含む細胞シグナル伝達ネットワークは、SARS-CoV-2と同様にMERS-CoV-2によって誘発される感染症の病因に重要な役割を果たすことが報告されています[73]。ラパマイシン経路シグナル伝達の阻害によるウイルス複製の防止は、メトホルミンの治療的役割のもう1つの潜在的なメカニズムです。メトホルミンはラパマイシン経路複合体の直接モジュレーターであることが示され[66]、ラパマイシン経路の役割は、Gordonらによって報告されたヒトタンパク質とのSARS-CoV-2相互作用のマッピングに焦点を当てた分子分析によって確認されました [74]。 |
| 限られたinvivoおよびinvitro研究は、メトホルミンがC型肝炎ウイルスを阻害する可能性があることを示しています。Chan et al [75]は、インスリン感受性の障害による抗ウイルス反応の低下を報告しました。著者らは、インスリン感受性を改善することで、C型肝炎ウイルスに感染した患者の抗ウイルス療法を補完できると結論付けました。別の研究では、リポジストロフィーのヒト免疫不全ウイルス(HIV)感染患者の炎症と血糖(空腹時と食後)に対するロシグリタゾンとメトホルミンの効果を調査しました[76]。有意に減少したインスリン抵抗性指数(HOMA指数)と単球化学誘引物質タンパク質1の濃度の減少が観察されました。この研究の結果は、メトホルミンの潜在的な保護効果とアテローム性動脈硬化症の予防を示しました[75]。ウイルスの阻害におけるメトホルミンの役割は有望であるように思われ、さらなる臨床試験が必要です。 |
| プロトンポンプ阻害剤(PPI)は酸抑制剤であり、胃食道逆流症(GERD)治療[78]など、世界で最も広く使用され、過剰に使用されている薬剤の1つです[77]。多くの研究は、プロトンポンプ阻害剤の長期使用は、プロトンポンプ阻害剤による胃の低塩酸症による腸外障害を発症するリスクの上昇に患者をさらし、その結果、胃腸管のすべての領域で微生物叢組成の変化をもたらすことを示しました[77]。最近の注目は、プロトンポンプ阻害剤の使用に関連する腸内細菌叢の変化[77,78,79]およびSARS-CoV-2感染との相関関係[80,81,82]に集中していました。Imhan et al [79]は、腸内細菌叢が腸内感染症において重要な役割を果たすことを実証しました。3つのコホートにまたがる1815人の腸内細菌叢組成の分析は、プロトンポンプ阻害剤の使用が細菌の豊富さの減少と微生物叢の深刻な変化に関連していることを示しました。これは、抗生物質や他の薬物の使用によって誘発される変化よりもさらに顕著です。レビューされた証拠は、細菌の増殖を阻害するか、免疫系を強化し[79]、多形核好中球、細胞傷害性T細胞、およびナチュナルキラー細胞の活性への影響により肺炎のリスクを高める[80] Clostridium difficileおよび他の腸内感染による腸の微生物コロニー形成の耐性および促進における腸内細菌叢のいくつかのメカニズムを介した適切な役割を明らかに示唆している |
| 現在の研究では、SARS-CoV-2の検査を受けた患者におけるプロトンポンプ阻害剤の現在の使用とCOVID-19の感染率との潜在的な関連性も調査されています。韓国の全国コホートには132,316人の患者が含まれ、そのうち14,163人が現在のプロトンポンプ阻害剤ユーザーでした。 プロトンポンプ阻害剤の使用は、COVID-19の重篤な臨床転帰のリスクの79%の増加と関連しており、プロトンポンプ阻害剤の過去の使用との関係は重要ではありませんでした。さらに、この研究は、過去30日以内の現在のプロトンポンプ阻害剤使用が、COVID-19の重篤な臨床転帰のリスクの90%増加と関連していることを示しました。逆に、プロトンポンプ阻害剤の使用がSARS-CoV-2感染に対する感受性を高めるという証拠はありませんでした[80]。これは臨床医にとって重要です[80,82]。この関連性の考えられる説明は、(プロトンポンプ阻害剤投与によって引き起こされる胃のアルカリ度の上昇のために)胃でのウイルスコロニー形成が高い個人は、SARS-CoV-2感染の重症コースに対してより感受性が高い可能性があることを示唆しています。プロトンポンプ阻害剤の使用が微生物叢およびCOVID-19の重症度に及ぼす影響を調査した他の研究では、プロトンポンプ阻害剤またはファモチジン(胃疾患の別の薬剤)の使用が中国のコホートにおける重症のCOVID-19疾患のリスクが高いことに関連していることが示されました[ 81]。KowとHasanによるベータ分析研究[82]には、2020年9月以降に発表された合計37,372人の患者を対象とした5つの研究が含まれていました。結果は、プロトンポンプ阻害剤の使用は、COVID-19の重症コースのオッズを増加させるだけでなく、プロトンポンプ阻害剤を使用しなかった患者と比較して二次感染の発症のオッズも増加させることを示しました。これらの発見は、臨床医が微生物叢に対するプロトンポンプ阻害剤の影響とCOVID-19疾患との関係に注意する必要があることを示唆しています[82]。 |
| |
| 7. 結論 |
| 多くの研究により、ウイルス感染に対する自然免疫系および獲得免疫系の応答の活性化における微生物叢の重要な役割が確認されました。 COVID-19との関連で、微生物叢組成とその代謝産物の量的および質的変化を発見することは、新しい疾患バイオマーカーと新しい治療標的を特定するのに役立ちます。 |
| 微生物叢と肺-腸軸を標的とすることがSARS-CoV-2感染の効果的な治療戦略であるという臨床的証拠はありませんが、プロバイオティクス、プレバイオティクス、および高繊維食の使用は、炎症を軽減し、腸の生物多様性を維持し、免疫システムをサポートします。 |
| |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| |
