
Hui Li, Junjun Ni, and Hong Qing |
| 概要 |
世界の高齢化が急速に進む現在の傾向は、社会に大きな課題をもたらしています。 人間の老化プロセスは、腸内細菌叢の組成、多様性、および機能的特徴の変化と密接に関連していることが実証されています。 生後2年間、腸内細菌叢は、体内でコロニーを形成して発達するにつれて、組成と代謝機能が劇的に変化します。 腸内細菌叢は3歳までにほぼ確立されますが、より安定した多様な微生物種を含む成人期になるまで成熟し続けます。 一方、免疫老化と"炎症"の結果である可能性がある人体の生理学的機能が加齢とともに悪化するにつれて、高齢者の腸は一般に炎症誘発性微生物の増加と有益な種の量の減少を特徴とします。 腸内細菌叢は、脳-腸-腸内細菌叢軸と呼ばれる双方向通信システムを介して脳の発達に影響を及ぼし、このコミュニケーションの調節不全は、加齢に伴う認知障害において極めて重要です。 腸内細菌叢を対象とした食事療法とプロバイオティクス/プレバイオティクスの摂取は、有益な種の量を増やし、宿主の免疫力を高め、腸関連疾患を予防することができます。 このレビューは、最近の研究開発に基づいて、人間の腸内細菌叢の加齢に伴う変化をまとめたものです。 これらの変化を理解することは、健康的な老化を達成するための新しい治療方針の設計を容易にするでしょう。 |
序章 |
健康な腸内細菌叢は、私たちの健康の重要な構成要素です。近年、腸内細菌叢の組成は、ストレス、遺伝学、食事、抗生物質、プロトンポンプ阻害剤、負の幼児環境または腸内感染症などの多くの要因に依存することが示されています[4]。腸内細菌叢の影響には、栄養素の競合、生物変換、ビタミンの生成、抗菌効果、腸のバリアの改善、いわゆる結合部位の競合、炎症の調節、免疫調節が含まれます[5]。 過去10年間で、腸内細菌叢とさまざまな腸外臓器との相互作用が記録されています。これらには、脳-腸軸、肝臓-腸軸、肺-腸軸、または皮膚-腸軸が含まれます。これらの軸の1つまたは複数の破壊は、腸の外の新しい病気をもたらす可能性があります[7]。 腸内細菌叢は、腸内バリアの透過性にも影響を及ぼします。健康な腸内微生物叢では、さまざまな有害物質や危険な細菌やウイルスが腸から血液に侵入することはありません[8]。罹患期間と重症度を減らしながら平均余命を伸ばす方法の問題は、社会にとって深刻な課題となっています。 |
| 100年以上前、Elie Metchnikoffは、腸内細菌叢を人間の健康と老化と初めて結び付け、ヨーグルトに含まれる宿主に優しい細菌の消費を介して腸内細菌叢を調節することにより、健康と寿命を延ばすことができると理論付けました(Mackowiak, 2013)。 人間の腸管に存在する"超生物"である腸内細菌叢は、約500〜1,000の細菌種を含む1×1013〜14の微生物で構成され、人間の宿主と相互に有益な共生を形成します(Qin et al.,2010 ; Biagi et al.,2012)。 この超生物の他の機能には、消化過程と食物吸収を助けることに加えて、必須アミノ酸とビタミンの合成、繊維の短鎖脂肪酸への代謝、腸粘膜バリアの完全性の維持、宿主免疫の調節が含まれます。 病原体の攻撃から宿主を保護し(Gill et al.,2006)、これらはすべて人間の健康と幸福の維持に貢献します。 これとは対照的に、腸内毒素症は、人間の生理学的悪化と老年病の発症の主な原因となる可能性があります(Kim and Jazwinski,2018)。 |
| 第2世代のハイスループット技術に基づく16srRNAシーケンスの適用により、腸内細菌叢の研究が大幅に進歩し、腸内微生物学に関する最新の研究への扉が開かれました(Dave et al.,2012; Bischoff、2016)。 さらに、メタゲノミクスの開発により、ヒトの腸内細菌叢の遺伝子内容とコード化された機能的属性を定義することが可能になりました(Gill et al.,2006)。 腸内細菌叢の研究で生成された大量のシーケンスデータのために、大量のデータから有用な情報を取得する方法が緊急の課題になっています。 機械学習の台頭は、腸内細菌叢の研究に新しいアイデアを提供します。 分類学的または機能的特徴を効果的に特定できるさまざまな機械学習アプローチが最近適用され、腸内細菌叢の加齢に関連する変化を明らかにし、これらの変化に関連する細菌属を特定しています(Hopkins et al.,2001; Odamaki etal.,2016; Bian et al.,2017)。 |
| このレビューでは、老化プロセスにおける腸内細菌叢の役割に関する最近の研究結果、および腸内細菌叢の加齢に伴う変化の分析のための機械学習の応用について要約します。 また、腸内細菌叢と人間の健康との関連、健康的な老化を達成するための有益な腸内細菌叢の維持への食事療法およびプロバイオティクス/プレバイオティクスの貢献と同様に腸内細菌叢が加齢性疾患、特に認知障害の発症にどのように影響するか、およびその根底にあるメカニズムについても解説します。 |
ヒト腸内細菌叢の加齢に伴う変化 |
| 胎盤、羊膜腔、臍帯、および胎便に細菌が存在することは、ヒトと微生物の関係が子宮で始まる可能性があることを示唆しています(Jimenez et al.,2005; Collado et al.,2016)。 出生時の分娩様式は、乳児の微生物叢の多様性に直接影響します(Rutayisire et al.,2016)。経膣的に出産した乳児は、帝王切開で生まれた乳児よりも腸内に多様で健康的な細菌群集を持っています(Jakobsson et al.,2014)。 出生後最初の2〜3年で、乳児の腸内細菌叢は、主に授乳パターン(粉ミルク、母乳、または固形食品)の影響を受けて、著しい変化を起こします(Cong et al.,2016; Kundu et al.,2017 )。 その後、細菌群集の構成は、完全に確立される成人期まで比較的安定したままです(Lynch et al.,2015)。 一般に、健康な成人の腸で最も豊富な門は、Firmicutes、Bacteroidetes、Proteobacteria、Actinobacteria、Verrucomicrobiaであり、FirmicutesとBacteriodetesがこの存在量のほぼ80%を占めています(Eckburg et al,2005)。 成人では、食事が主な影響因子になります。つまり、腸内細菌叢の機能は、乳児に見られる乳糖の利用から、植物の多糖類の分解、生体異物の分解、およびビタミンの生合成に変化します(Riaz Rajoka et al.,2018)。 加齢に伴う生理機能の低下(腸機能の低下、咀嚼の問題、免疫力の低下など)に伴い、高齢者の腸内細菌叢の組成は著しく変化します。 健康な若い成人と比較して、高齢の腸内の微生物叢は、一般に、BifidobacteriumやLactobacillusなどのいくつかの有益な属の存在量が減少と、Enterobacteriaceae やClostridia などの炎症誘発性共生微生物の著しい増加していることを特徴としています(O'Toole and Jeffery,2015; Odamaki et al.,2016; 図1)。 加齢はしばしば腸内細菌叢の多様性の低下を伴い(Bischoff、2016)、これは高齢者の脆弱性指数の増加と関連している可能性があります(van Tongeren et al.,2005; Jackson et al.,2016)。 認知障害は一般的な障害であり、通常、健康な高齢者と比較して、高齢者の腸内細菌叢の変化を伴います。 臨床的証拠は、腸内細菌叢の腸内毒素症を高齢者の認知障害と結びつけています。 なぜなら、認知機能低下と脳アミロイドーシスのある被験者は、対照被験者と比較して、抗炎症性E. rectaleの存在量が少なく、便中の炎症性Escherichia/Shigellaの存在量が多いからです(Cattaneo et al.,2017)。 EnterobacteriaceaeとPorphyromonadaceaeが高齢者の認知と負に関連しているのに対し、乳酸菌メンバーの存在量は正であることが証明されました(Bajaj et al.,2016)。 この証拠は、微生物と高齢者の認知状態との直接的な関連を明らかにしています。 |
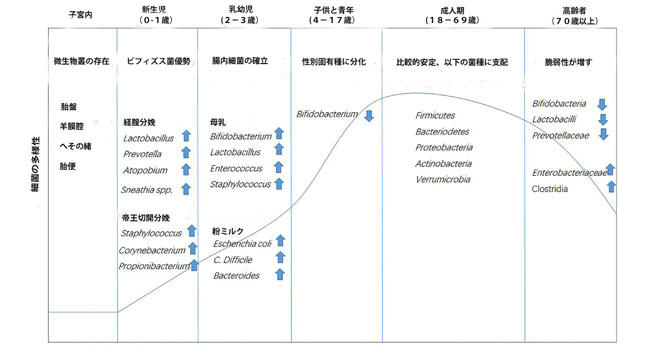 |
| 図1:図1さまざまなライフステージでの腸内細菌叢の組成の変化 |
| 胎盤、羊膜腔、臍帯、および胎便に細菌が存在することから明らかなように、腸内細菌叢のコロニー形成は子宮内で始まる可能性があります。 出生時の送達方法は、腸内細菌叢に直接影響を及ぼします。 腸内細菌叢は、最初は約3歳で確立され、成人期の開始時に食習慣の確立とともに成熟し、より多様で安定した腸内微生物群集につながります。 老年期には、腸内細菌叢が劇的に変化し、多様性が大幅に低下します。 |
| 長寿の高齢者(主に百歳以上の人)の腸内微生物叢の組成も変化しますが、その多様性と有益な種は保持され(Ragonnaud and Biragyn,2021)、恒常性と健康を維持し、その結果、長寿を達成する方法を部分的に説明しています。 イタリアの百歳以上の人を対象とした最近の研究では、加齢に伴って中心的な腸内細菌叢の存在量が累積的に減少することが明らかになりましたが、Ruminococcaceae、Lachnospiraceae、Bacteroidaceaeなどのサブドミナント分類群の腸内細菌の加齢に伴う増加が長寿で促進されました(Biagi et al., 2016)。 中国での同様の研究は、長命の個人(> 90歳)の腸内細菌叢が、より大きなアルファ多様性によって示されるように、より若い個人(65-70歳)よりも優れた頑健性と豊富さを示すことを示唆しています(Kong et al.,2016; Wang N. et al.,2019)。 上位50の機能のうち11は、これら2つの独立した研究間で共有されました。 Blautia, Clostridium cluster XIVa, Faecalibacterium, Escherichia, Shigella,および未分類のLachnospiraceaeのメンバーのコミュニティの豊富さと重要な変化を含み、さまざまな地域の長寿の人々が共有する腸内細菌叢の同様の特徴を示唆しています。 しかし、ほとんどの場合、人種、地理、ライフスタイルも腸内微生物組成の加齢に伴う変化に影響を与えるため、人間の微生物相は個人間の大きな変動を示します(Ragonnaud and Biragyn、2021)。 米国の典型的な食事はタンパク質が豊富ですが、マラウイやアメリカインディアンの人々の間では、食事はトウモロコシとキャッサバによって支配されています。 したがって、米国の大都市圏の住民の腸内の微生物は、ベネズエラのアマゾナスのマラウイ農村部の住民やアメリカ先住民の腸内細菌叢とは大幅に異なっていました(Yatsunenko et al.,2012)。 日本の成人(21〜69歳)は、米国、コロンビア、韓国、中国を含む他の国(Nam et al。、2011; Escobar et al.,2014)の成人と比較して、BlautiaとBifidobacteriumの存在量が多く、Bacteroidetes関連属の存在量が比較的少ない(Odamaki et al.,2016)。 Clostridium cluster XIVaの存在量は、日本人、イタリア人、フィンランド人の高齢者では低かったが(Hayashi et al.,2003; Mueller et al.,2006; Makivuokko et al.,2010)、高齢のドイツ人では多かった(Mueller et al.,2006)。 一方、Bacteroides の存在量はオーストリアの高齢者で増加しましたが(Zwielehner et al.,9)、イタリアの高齢者では逆の傾向が見られました(Mueller et al.,2006)。 |
| 老化の間に腸内細菌叢で発生する連続的な変化を特定するために、最近多くの研究が機械学習法を採用しています。 機械学習には、腸内細菌叢のクラスター分析(Zhang et al.,2017)には、腸内細菌叢の同定と分類(Wang et al.,2007; Zielinski et al.,2017; Oudah and Henschel,2018)、および宿主表現型の予測(Johnson et al。、2016; Thompson et al.,2019)など独自の利点があります。 順列多変量分散分析(PERMANOVA)を使用して、小田巻ら(2016)は、104歳未満の健康な日本人367人から採取した糞便サンプルを調査したところ、20歳未満の腸内細菌叢は年齢とともに成熟し、70歳以上の被験者の腸内細菌叢は高齢者型に変化したことが明らかになりました。 著者らは、老化プロセスには、Bacteroides、Eubacterium、およびClostridiaceaeの存在量の増加が伴うことを発見しました。 小児期および青年期(<20歳)の腸内細菌叢におけるBacteroides、Lachnospiraceae、およびBifidobacteriaの相対的な存在量に連続的な変化が発生しました。 一方、MegamonasとPeptoniphilusは、高齢者(> 70歳)で比較的増加していました。 同じデータサンプルを使用して、Xu et al(2019)は、属の存在量プロファイルにSample Progression Discovery(SPD)と呼ばれる監視されていないアルゴリズムを適用し、加齢に伴うヒト腸内細菌叢の組成の継続的な進行に関連する35属を特定しました。 これらの35属の中で、Lactobacillus、 Oscillospira、 Oxalobacter、 Prevotellaceae、 Parascardovia, および Butyrivibrioなどのいくつかの有益な属分類群の存在量は、年齢とともに増加しましたが、極度の高齢者では減少しました。 対照的にParvimonas、Anaerotruncus、Corynebacterium、Lachnospiraceae、 Desulfovibrio、 Bilophila wadsworthia、 Odoribacter、および Butyricimonas など、炎症や病気に頻繁に関連するいくつかの分類群は、加齢に関して単調に増加するパターンを示しました。 Yatsunenko et al(2012)は、スピアマンの順位相関法とランダムフォレスト法を使用して、3か国の個人の531の糞便サンプルを調査し、Bifidobacterium longum種の存在量は減少しましたが、加齢(0〜70年)に伴う全体的な細菌多様性の増加を報告しました。 しかし、別の研究では、順列多変量分散分析を使用して3歳から100歳以上の1,000人以上の健康な中国人の腸内細菌叢から異なる結果が得られました。 これらの著者は、腸内細菌叢は30歳から100歳以上までの個人間でほとんど差がなく、腸内細菌叢プロファイルのグループ間の主な違いは20歳より前に発見されたと報告しました(Bian et al.,2017)。 高齢者の腸内細菌叢の多様性と数十年若い人々の腸内細菌叢の多様性との類似性は、参加者がほとんど非常に健康であるか、サンプルサイズが小さいためである可能性があります。 |
| まとめると、かなりの個体間変動と、食生活や宿主の地理/文化などの外的要因の影響にもかかわらず(Claesson et al.,2012; Yatsunenko et al.,2012)、ヒト腸内細菌叢の組成に内因性の老化の進行が存在することがますます明らかになっています(Xu et al.,2019; Ragonnaud and Biragyn,2021; 図1)。 対照的に、複雑な生理学的状態と個人間の大きな違いのために、これらの変化の根底にあるメカニズムについてはあまり知られていません。 |
老化中の微生物叢の役割 |
| 老化の速度と質に対する微生物組成の決定的な影響は十分に文書化されています(Candela et al.,2014; Saraswati and Sitaraman,2014)。 腸内細菌叢の組成の変化は徐々に起こります(O'Toole and Jeffery,2015)。 糞便微生物叢は、地域に住む個人と介護施設に住む人々の間で大きく異なり、健康な老化におけるその役割と一致しています(van Tongeren et al.,05; Claesson et al.,12; Kinross and Nicholson,012; Collino et al.,13)。 |
| 免疫老化は、加齢とともに免疫系が徐々に悪化することを意味し、加齢プロセスの重要な特徴を表しています。 "炎症"としても知られる自然免疫系および適応免疫系の慢性的かつ低悪性度の活性化は、NF-κBを介した炎症の持続とナイーブCD4 + T細胞数の減少によって証明されるように、免疫老化に関連しています(Franceschi,2007; Claesson et al.,2012)。 炎症の原因はまだよくわかっていませんが、新たな証拠により、腸内細菌叢の自己免疫耐性の低下と、加齢に伴うその組成の変化が関連付けられています(Guigoz et al.,2008)。 腸内細菌叢は、ヒトの腸の免疫恒常性を維持するために極めて重要です(Honda and Littman,2016)。 これは、腸内微生物の欠如が免疫系の発達と成熟の障害につながる一方で、それらの存在は、インターロイキン10(IL-10)およびトランスフォーミング成長因子ベータ(TGF-β)、Tヘルパー17(Th17)細胞、2型リンパ球自然リンパ球(ILC2)、および免疫グロブリンA(IgA)分泌B細胞を産生する制御性T細胞(Treg)の産生を誘導することを無菌マウスで直接証明することができます。(Hansson et al.,2011; Atarashi et al.,2013、2015; Furusawa et al., 2013;satoh-takayama et al.,2020)。 さらに、いくつかの有益な細菌種とその代謝物、特に短鎖脂肪酸とその前駆体は、ヒトの加齢中に減少することが報告されており、高齢者の虚弱の主な原因である可能性があります(Ragonnaud and Biragyn,2021)。 腸内細菌叢の特定の成分は、例外的な人間の寿命の予測因子であることが実証されました(Vaiserman et al.,2017)。 中国人とイタリア人の百歳以上の人の寿命は、Clostridium cluster XIVa、 Akkermansia muciniphila、 Christensenellaceae、Bifidobacteriaなどの有益な共生生物の豊富さと積極的に関連しています(Biagi et al.,2016; Kong et al.,2016)。 Clostridium cluster XIVaには、短鎖脂肪酸の産生に関与する多くの属が含まれています(van den Abbeele et al.,2013)、 A. muciniphilaは、ムチン産生を誘導することにより腸上皮の完全性を維持するのに役立ちますが、有益な短鎖脂肪酸産生細菌をサポートし、炎症やインスリン抵抗性などの代謝障害の軽減に役立ちます(Schneeberger et al.,2015; Bodogai et al.,2018)。 人間の腸内のChristensenellaceaeの存在量は、ボディマス指数(BMI)と逆相関を示し、人間のいくつかの炎症性疾患の影響を軽減するのに役立ちます(Waters and Ley,2019)。 Bifidobacteriumは、体のpHを調節し、乳酸、ピルビン酸、酪酸を生成することにより、必須栄養素の消化と吸収、およびビタミンの合成を促進します。 さらに、病原菌の増殖を抑制し、宿主の免疫応答を高めることができます(Yusof et al.,2000)。 これらの有益な細菌は腸の恒常性に重要な役割を果たし、老化中に健康な状態を維持するのに役立つ可能性があります。 |
| 全体として、有益な細菌の減少と炎症誘発性種の濃縮は、腸内微生物の多様性の減少とともに、健康な老化とその結果としての寿命に有害な影響を与える可能性があります。 |
脳-腸-腸内細菌叢軸 |
| 腸と脳は、脳-腸-腸内細菌叢軸として知られる複雑な双方向通信システムを介して密接に接続されています。これには、主に神経、免疫、代謝、および内分泌経路が含まれます(Martin et al.,2018) 脳は、固有層細胞(腸のクロム親和性細胞、ニューロン、免疫細胞)を介してシグナル分子を放出するか、胃腸の運動性、分泌物、腸透過性を調節することにより、腸内細菌叢の組成と機能に直接的または間接的に影響を与えることができます(Cryan et al.,2019 )。 逆に、腸内細菌叢は、脳の機能、行動、健康に影響を与える可能性があり、脳の発達、老化、神経変性の主要な調節因子であることが示唆されています(Dinan and Cryan,2017)。 正常な腸内細菌叢と脳の相互作用は、健康な生理学的状態と正常な認知機能を維持するために不可欠です。 |
| 腸内微生物は、中枢神経系、自律神経系、および腸管神経系が関与する神経信号を介して脳と通信でき、多くの場合、迷走神経の刺激が関与します。 迷走神経は、副交感神経の運動線維と感覚線維の束であり、腸管神経系と中枢神経系の間の神経伝達の直接的な手段を提供します(Forsythe et al.,2014; Fung et al.,2017)。 研究によると、γ-アミノ酪酸受容体をコードする遺伝子は、マウスの胃腸管の迷走神経求心性ニューロンと結節神経節で高度に発現しています。 迷走神経は、腸内のγ-アミノ酪酸シグナルを感知し、それらを脳に伝達することができます。これは、迷走神経の末梢端の刺激後の大脳皮質におけるγ-アミノ酪酸A受容体とグルタミン酸デカルボキシラーゼ(GAD)陽性細胞の数の増加によって証明されています。 (Marrosu et al。、2003; Neese et al.,2007; Egerod et al.,2018)。 さらに、プロバイオティクスLactobacillus rhamnosus JB-1 をマウスに補給すると、大脳皮質のγ-アミノ酪酸B受容体B1サブユニットのmRNAレベルと、前頭皮質およびアプリコットカーネルのγ-アミノ酪酸A受容体α2サブユニットのmRNAレベルを増加させることができます。ストレスによるコルチコステロンレベルの上昇を抑制し、マウスの不安や鬱病を緩和します。しかし、これらの有益な効果は、マウスが迷走神経切断されたときに廃止されました(Bravo et al.,2011)。 |
| 中枢神経系機能に対する腸内細菌叢の影響は、神経伝達物質、ホルモン、それらの前駆体、短鎖脂肪酸などのいくつかの微生物由来分子を介して循環系を介して媒介されることもあります。 一部の代謝物は腸関門を通過して体循環に入ることができ、一部は血液脳関門を通過して神経機能を調節することさえできます(O'Mahony et al.,2015; Koh et al.,2016; Sharon et al.,2016)。 |
| 血管脳関門は妊娠中に形成され、循環系と脳実質の間の分子と栄養素の通過と交換を制御し、中枢神経系ホメオスタシスを保証します(Braniste et al.,2014)。 腸内細菌叢は、無菌マウスの異なる脳領域における血管脳関門透過性の増加と密着結合タンパク質オクルディンおよびクローディン-5の発現低下によって証明されるように、血管脳関門の完全性の維持に重要ですが、無菌成体マウスの曝露中、病原体のない腸内細菌叢に対しては、血管脳関門透過性が低下し、密着結合タンパク質の発現がアップレギュレートされました(Braniste et al.,2014)。 短鎖脂肪酸は生物学的に活性な分子であり、主に食物繊維の消化を通じて有益な腸内細菌によって生成されます。 これらの分子は血管脳関門を横断し、細胞に入り、エピジェネティックな調節のためのヒストンデアセチラーゼ阻害剤として作用するか、細胞膜上のGタンパク質共役受容体(GPR)41および/または短鎖脂肪酸受容体GPR43に結合することにより、血管脳関門の発生と維持における重要なシグナル伝達代謝物として機能します(Braniste et al.,2014; Michel and Prat,2016)。 セロトニン(5-ヒドロキシトリプタミン:5-HT)、γ-アミノ酪酸、ドーパミンなどの一部の腸神経伝達物質は血管脳関門を通過できませんが、迷走神経に作用したり、末梢神経系のシグナル伝達に影響を及ぼしたりして、最終的に脳機能に影響を及ぼします( Wu et al.,2020)。 セロトニンは、神経活動と幅広い神経心理学的プロセスの調節における役割で知られているよく特徴付けられた神経伝達物質であり、他の機能の中でもとりわけ、胃腸の運動性と心血管機能の重要な調節因子です(Berger et al.,2009)。ただし、体のセロトニンの90%以上は、消化管の腸クロム親和性細胞によって合成されます。 固有の胞子形成微生物によって生成される短鎖脂肪酸や2Basなどの代謝物は、腸クロム親和性細胞によるセロトニンの生合成と放出を促進することが実証されています(Yano et al.,2015)。 セロトニン前駆体であるトリプトファンは、食事で供給されなければならない必須アミノ酸です。 腸内細菌叢は、トリプトファンの末梢での利用可能性に貢献しています。 腸から吸収されると、循環器系に入り、大きなアミノ酸トランスポーターを介して血管脳関門を通過し、中枢神経系でセロトニンに変換されます。 神経免疫シグナル伝達は、腸内細菌叢と中枢神経系の間のコミュニケーションのための重要な経路でもあります。 一般に、微生物由来の代謝物または他の成分は、免疫系の活動を仲介します。 短鎖脂肪酸はミクログリアの成熟を促進する可能性があり、成熟したミクログリアの維持に必要です(Erny et al.,2015)。 ミクログリアは、中枢神経系の常在性マクロファージおよび主要な免疫防御細胞です。 |
| 無菌マウスはミクログリアが少なく、特定病原体除去(SPF)マウスと比較して形態と機能が異常です。 ただし、これらの効果は無菌マウスに短鎖脂肪酸を投与することで元に戻すことができ、これは主に短鎖脂肪酸による短鎖脂肪酸受容体GPR43の活性化に依存している可能性があります(Erny et al.,2015)。 さらに、リポ多糖(LPS)、細菌性リポタンパク質(BLP)、フラゲリン、サイトカイン-リン酸-グアノシン(CpG)DNAなどの微生物叢に由来する微生物叢由来の微生物関連分子パターン(MAMP)は、末梢の自然免疫系に続いて、インターロイキン-1-β(IL-1β)、インターロイキン-6(IL-6)、腫瘍壊死因子-α(TNF-α)などの多くの炎症誘発性サイトカインの放出を誘導します。 (Sampson and Mazmanian,2015)。 これらの炎症誘発性サイトカインは、求心性神経の受容体に作用するか、血管脳関門を通過して脳実質に入り、最終的に中枢神経系の神経機能に変化をもたらす可能性があります(Dantzer et al.,2000; Fung et al.,2017)。 |
| 最近、多くの研究が、老化と神経変性の調節因子としてのバクテリオファージの潜在的な役割を強調しています。 バクテリオファージは微生物群集の最も豊富なメンバーであり、腸内細菌群集を形成し、微生物叢の安定性を調節する可能性があります(Gogokhia et al.,2019)。 バクテリオファージは、真核細胞やタンパク質との相互作用を介して直接、または特定の細菌の存在量の変化を誘発し、病原体関連分子パターン(PAMP)のレベルを上げることによって、間接的にヒトの疾患の発症に影響を与える可能性があります。 多くのバクテリオファージは、粘液層内に埋め込まれ、侵襲性細菌集団を制御することによって腸のバリアの完全性を維持する能力があり(Barr et al.,2013)、粘膜免疫を変化させ、それによって哺乳類の健康に影響を与えることもできます(Gogokhia et al.,2019) 。 げっ歯類モデルでは、バクテリオファージの投与により腸内細菌叢の変化が誘発され、腸透過性が増加し、慢性炎症が引き起こされました(Tetz and Tetz,2016)。 最近の研究では、バクテリオファージが神経変性病態の被験者の脳脊髄液(CSF)に存在し(Tetz and Tetz、2018)、パーキンソン病患者は溶解性ラクトコッカスファージの量が多く、神経伝達物質産生が10分の1に減少することが示されています。 健康な個体と比較したラクトコッカス菌は、神経変性におけるファージとの関連およびファージの役割の可能性を示唆しています(Tetz et al.,2018)。 バクテリオファージは、腸透過性の増加、健康な中枢神経系の維持に重要な細菌の量の変化、および慢性全身性炎症反応の誘発に関与する経路を通じて中枢神経系に影響を与える可能性があります(Tetz and Tetz、2018)。 ただし、これらの根本的なメカニズムを解明するには、まだかなりの研究が必要です。 |
腸内細菌叢と認知障害 |
| 障害のない認知スキルは、高齢者の日常の機能にとって非常に重要です。 しかし、記憶、学習、問題解決活動を含むこれらの認知スキルのいくつかは、加齢とともに低下します。 認知障害に関連する複数の危険因子が提案されています(Klimova et al.,2017)。 研究は、行動障害と認知機能の低下が顕著である無菌動物モデルを含むものなど、宿主の行動と認知機能に対する微生物の影響をますます強調している(Lee et al.,2020)。 腸内細菌叢は、さまざまな認知過程における加齢に関連する障害において本質的な役割を果たすことができます。 腸内細菌叢の腸内毒素症は、複数の経路で老化関連疾患に関与しています(図2)。 老化は軽度の炎症と関連しており、炎症性サイトカインへの脳の長期曝露は認知を損なう可能性があります。 老齢マウスに関する研究は、急性炎症が記憶障害を誘発する可能性があることを示しています(Chen et al.,2008; Barrientos et al.,2009)。 微生物の腸内毒素症または加齢に伴う腸の透過性の増加は、細菌成分の産生と放出を誘発することにより、同様に炎症と関連しています。 リポ多糖、リポタンパク質、血流への二本鎖RNAなど。 これにより、免疫系が活性化され、TNF-α、IL-1β、IL-6などの炎症性サイトカインが放出されます(Sampson and Mazmanian,2015; Komanduri et al.,2019)。 加齢に伴う認知機能の低下は、脳内のシナプス結合の減少にも起因している可能性があります(Vanguilder et al.,2010)。 一方、腸内微生物は、神経伝達物質(γ-アミノ酪酸、アセチルコリン、ドーパミンなど)と神経栄養因子(脳由来神経栄養因子[BDNF]や神経成長因子[NGF]など)を生成することができます。これらは神経の信号伝達に不可欠です(Diaz Heijtz et al.,2011; Sampson and Mazmanian,2015)。 LactobacilliとBifidobacteriaは、腸内のグルタメートをγ-アミノ酪酸に変換することにより、不安やうつ病のような症状を緩和することができます(Yunes et al.,2016)。 AlcaliganeceaeとPorphyromonadaceaeの数は、認知機能の低下と正の相関があることが示されました(Caracciolo et al.,2014)。 さらに、腸内細菌叢は、アルツハイマー病(AD)患者におけるシアノバクテリアの存在量の急激な増加によって証明されるように、酸化ストレスを促進することによって認知に影響を与える可能性もあります。 シアノバクテリア由来の代謝産物(β-N-メチルアミノ-L-アラニン)は、グルタミン酸受容体を活性化し、ニューロンの酸化ストレスを引き起こし、最終的にはニューロンのアポトーシスを引き起こします(Banack et al.,2010)。 |
| 図2 老化過程における腸内微生物の腸内毒素症 |
| 加齢は、生物学的年齢、栄養の変化など、ライフスタイルの重要な変化を伴います。 運動の低下、抗生物質の使用、慢性ストレス。これにより、微生物の組成が変化し、虚弱な高齢者における腸内細菌叢の腸内毒素症が悪化する可能性があります。 老化における微生物の腸内毒素症は、短鎖脂肪酸産生細菌などの有益な細菌の深刻な減少と病原性の増加を示しています Enterobacteriaceaeなどの細菌は、腸の生理機能に影響を及ぼし、腸の運動性の低下、腸のバリア機能障害、および腸透過性の増加をもたらします。 さらに、微生物叢の腸内毒素症は、以下を含むさまざまな経路を通じて脳機能に影響を与える可能性があります。 (1)炎症性サイトカインの放出を促進するリポ多糖などの循環器系への細菌毒素は、神経免疫経路を介して全身性炎症を引き起こします。 (2)神経信号の伝達を阻害する 腸管神経系から中枢神経系へ、主に迷走神経を介して; (3)微生物の神経伝達物質の生成と放出を抑制する ホルモンは循環器系に、続いて神経内分泌経路を介して脳に送られます。 これらすべての要因は、老化に関連する病状を発症するリスクを高める脳に一連の有害なイベントを引き起こします(この図はBioRender.comで作成されました)。 |
| 多くの前臨床研究は、過敏性腸症候群(IBS)や肥満などの古典的な脳-腸障害の病因や病態生理だけでなく、うつ病、不安神経症、アルツハイマー病、パーキンソン病(PD)など精神障害や神経障害においても、脳-腸内細菌叢のコミュニケーションにおける変化の重要な役割を強調しています。(Collins et al.,2012; Martin et al.,2018; 表1)。 |
アルツハイマー病 |
| アルツハイマー病は進行性神経変性症候群であり、認知症の最も一般的な原因です。 アルツハイマー病の病因には、アミロイドβ(Aβ)ペプチドの過剰な凝集、タウタンパク質の過剰リン酸化によって誘発される神経原線維変化(NFT)の存在、神経炎症、および代謝障害が含まれます。 ただし、アルツハイマー病の病因の根底にあるメカニズムは完全には理解されていません(Jagust,2018)。 |
| 蓄積された証拠は、腸内細菌叢の腸内毒素症とアルツハイマー病の間の密接な関係を裏付けています(Jiang et al.,2017)。 例えば、アルツハイマー病トランスジェニックマウスの小腸粘膜の構造は正常マウスとは異なりますが、アルツハイマー病マウスでは結腸内のグラム陰性菌の数も大幅に減少しています(Karri et al.,2010)。 マッカーシーの調査では、英国の認知症患者の85%で腸内細菌叢が変化していることが示されました(Xiao et al.,2014)。 最近の研究では、アルツハイマー病患者の糞便サンプルは、Escherichia Shigella、Odoribacter splanchnicus、Klebsiella pneumoniaなどの炎症誘発性状態を促進することが知られている分類群の相対的な存在量が高く、非アルツハイマー病個体のメンバーと比較した、ButyrivibrioおよびEubacteriumのメンバーのような主要な酪酸産生抗炎症種の減少が見られることが明らかになりました(Cattaneo et al.,2017; Haran et al.,019)。 さらに、腸内細菌叢コミュニティの多様性は、非アルツハイマー病患者と比較してアルツハイマー病患者で有意に減少していることが報告されました(Vogt et al.,2017)。 Bacteroidesの有病率の増加は、横断研究におけるグラフィカルモデリングと多変量ロジスティック回帰分析に基づいて、認知症のない患者の軽度認知障害(MCI)の存在と独立して関連していることが証明されました(Saji et al.,2019)。 さらに、最新の研究では、アルツハイマー病のマウスモデルにおける腸内細菌叢と認知障害との性依存的な関連性が示され、性別自体がアルツハイマー病病理学における微生物叢の組成に特定の影響を与える可能性があることが示されています(Cuervo-Zanatta et al.,2021)。 |
| 腸内細菌叢は、アルツハイマー病の発症と進行に複数の方法で関与している可能性があります。 神経炎症におけるアルツハイマー病の複雑な病因の重要な役割を果たします。これは、ミクログリアの過剰な活性化を特徴とし、その構造と機能に大きな変化をもたらし、中枢神経系で大量の炎症誘発性因子を産生します。 動物と人間の両方の研究からの新たな証拠は、アルツハイマー病発症中の腸内毒素症とミクログリア活性化との関連を裏付けています(Vogt et al.,2017; Zhuang et al.,2018)。 特定の腸内細菌によって誘導される、脳に沈着したアミロイドβタンパク質は、ミクログリアの表面にあるCD14受容体、メチルペプチド受容体、およびToll様受容体4(TLR4)に結合できます。 これはこれらの細胞を活性化し、IL-6やTNF-αなどの炎症誘発性因子を大量に放出し、それによって星状細胞を活性化し、脳の炎症反応をさらに悪化させます(Lehnardt,2010)。 腸内毒素症はまた、腸粘膜における密着結合タンパク質の産生を変化させる可能性があり、これは腸のバリアを破壊し、血液循環へのリポ多糖の漏出を引き起こし、神経炎症を引き起こす可能性があります(Cani et al.,2008)。 最近の証拠は、アルツハイマー病関連神経炎症におけるCD4 +およびCD8 + T細胞などの末梢免疫細胞の浸潤に関係している(Merlini et al.,2018)。 Wang X. et al(2019)は、特定の細菌(Th1 / M1関連細菌など)、アミノ酸(フェニルアラニン、イソロイシンなど)の組み合わせを示唆しています。 脳浸潤性免疫細胞(例えば、Th1優性)の組成は、アルツハイマー病患者の軽度認知障害の早期診断バイオマーカーとして役立つ可能性があります。 |
|
アミロイドβは、アルツハイマー病患者の大脳皮質と海馬に蓄積して有毒な老人斑を形成します。これは、この疾患の病因と進行に重要な役割を果たします。 ヒトの腸に存在するさまざまな細菌種は、 Pseudomonas、Streptomyces、Bacillus、およびEscherichia coliを含むアミロイドを産生する可能性があり、これは、老化したヒトにおける全身性およびCNS関連アミロイド負荷の両方に寄与する可能性があります(Zhao and Lukiw,2015)。 E.coliによって分泌されるアミロイドは、アミロイドβ42と同様の構造と免疫原性を持っています。 ミクログリアの表面にあるToll様受容体2(TLR2)に結合することで炎症誘発性因子の放出を促進し、その後アルツハイマー病脳の炎症反応を悪化させる可能性があります(Hill and Lukiw,2015)。 タウタンパク質の過剰リン酸化は、アルツハイマー病のもう1つの病理学的特徴です。 腸内細菌叢は、複数のメカニズムを介してタウの過剰リン酸化を直接的または間接的に調節する可能性があります。
(1)沈着したアミロイドβとタウタンパク質の間の相互作用はタウの過剰リン酸化を誘発する可能性があり、微生物はアミロイドβ沈着を調節することによってこのプロセスに影響を与える可能性があります。 (2)抗酸化物質を生成するか、スーパーオキシドジスムターゼ(SOD)およびグルタチオン(GSH)の活性を高めることにより、酸化ストレスによる損傷を軽減することにより、腸内細菌叢はタウの過剰リン酸化をある程度阻害することができます(Wall et al.,2014; Yan etal.,2016)。 (3)腸内細菌叢は、炎症を誘発し、脂肪生成を促進することによってインスリンシグナル伝達経路を妨害し、タウの過剰リン酸化を促進するグリコーゲンシンターゼキナーゼ3β(GSK-3β)の活性化をもたらす可能性があります。 (4)特定の細菌によって分泌されるリポ多糖によって誘発される全身性炎症は、タウタンパク質の過剰リン酸化を加速する可能性があります(Savignac et al.,2016)。 |
| 腸内細菌叢は、脳神経伝達物質(γ-アミノ酪酸や5-ヒドロキシトリプタミンなど)、脳由来神経栄養因子、および短鎖脂肪酸の合成に重要であり、これらはすべてアルツハイマー病に関連しています(Hu et al.,2016)。 γ-アミノ酪酸は、ヒトの中枢神経系における主要な抑制性神経伝達物質です。研究によると、腸内細菌叢が乱されると、特にBifidobacteriaとLactobacilliの数が減少すると、腸内のγ-アミノ酪酸レベルが影響を受け、中枢神経系のγ-アミノ酪酸レベルが低下することが示されています(Bhattacharjee and Lukiw,2013)。 グルタメートは、ヒト中枢神経系の重要な興奮性神経伝達物質であり、ニューロンの活性化、樹状突起と軸索の構造、およびシナプス可塑性の重要な調節因子であるN-メチル-D-アスパラギン酸(NMDA)受容体に結合することが知られています。 Neufeld et al(2011)は、N-メチル-D-アスパラギン酸受容体サブユニット2B(NR2B)のmRNA発現が無菌マウスの海馬で有意にダウンレギュレーションされたことを報告し、腸内細菌叢とN-メチル-D-アスパラギン酸受容体の発現との間に相関関係が存在することを示しています。 短鎖脂肪酸は腸内細菌叢の重要な代謝産物であり、Gタンパク質共役型受容体が関与するさまざまな細胞シグナル伝達カスケードを介して体内の遊離脂肪酸、グルコース、コレステロールの代謝を調節します(Den Besten et al.,2013)。 短鎖脂肪酸は、NF-κBシグナル伝達を介した免疫の重要なモジュレーターとしても機能し、リポ多糖に対するミクログリア細胞の応答性を調節します(Jiang et al.,2017)。 さらに、短鎖脂肪酸はヒストンアセチル化を介して神経調節および後成的効果を発揮し、神経発達および神経変性疾患の動物モデルにおける認知機能を改善することが示されました(Stilling et al.,2014)。 短鎖脂肪酸のこれらの重要な生理学的機能を考えると、アルツハイマー病患者の腸内細菌叢による短鎖脂肪酸産生の低下は、アルツハイマー病の発症の根底にある別のメカニズムを表している可能性があります(Zhuang et al.,2018)。 |
パーキンソン病 |
| パーキンソン病は中枢神経系の長期的な変性疾患であり、α-シヌクレインの異常な凝集とニガードーパミン作動性ニューロンの変性と壊死を特徴としています。 パーキンソン病の臨床症状には、運動症状と、認知障害や睡眠障害などの自律神経の非運動症状の両方が含まれます。 いくつかの証拠は、腸がパーキンソン病の起源に関与している可能性があることを示しています。 たとえば、腸の症状はパーキンソン病の初期段階で現れますが、α-シヌクレインの誤った折り畳みと凝集は、最初は腸管神経系と迷走神経の背側運動核でも起こります(Braak and Del Tredici,2017)。 さらに、腸内細菌によって放出されるリポ多糖は、α-シヌクレインの凝集を調節することもできます。これは、パーキンソン病進行のこの代替経路に関連するよく特徴付けられた相互作用です(Bhattacharyya et al.,2019)。 Holmqvist et al(2014)は、さまざまな形態のα-シヌクレインがマウスの腸に注射された後、注入された材料が、異常に折りたたまれたα-シヌクレインまたは組換え型(モノマー、オリゴマー、またはフィブリル)のα-シヌクレインタンパク質を含むヒトパーキンソン病脳溶解物であったかどうかに関係なく迷走神経に沿って脳に広がる可能性があることを初めて示しました。 |
| 腸内細菌叢はパーキンソン病患者で無秩序です(Scheperjans et al.,2015)。 パーキンソン病患者の腸内のPrevotellaceae の存在量は、健康な対照のそれより77.6%少ないと報告されており、この減少はムチン合成の減少とそれに続く腸透過性の増加をもたらす可能性があります(Caputi and Giron,2018; Gerhardt and Mohajeri, 2018)。 ある研究では、Blautia属、Coprococcus 属、およびRoseburia属の"抗炎症性"酪酸産生細菌の存在量が、パーキンソン病患者の結腸粘膜および糞便サンプルで対照被験者よりも有意に低かったことが明らかになりました(Keshavarzian et al., 2015)。 Mucispirillum, Porphyromonas, LactobacillusおよびParabacteroides は、パーキンソン病患者で最も豊富な分類群であると報告されましたが、Prevotellaは健康な個人の腸でより豊富です。 Bacteroidesの存在量は、身震いを呈する患者よりも身震い症状のないパーキンソン病患者で有意に高く、運動症状の重症度とともに増加します(Lin et al.,2019)。 この研究は、パーキンソン病患者の腸内細菌叢の変化とそれらの臨床表現型の重症度との間に相関関係が存在することを示しました。 デンマークとスウェーデンの患者を対象とした疫学研究でも、体幹迷走神経切断術がパーキンソン病を予防することが示され(Svensson et al.,2015; Liu et al.,2017)、腸内細菌叢とこの疾患との関連の臨床的証拠が提供されています。 さらに、パーキンソン病のマウスモデルを使用した前臨床研究では、運動、認知、腸の症状に対するプレバイオティクス繊維(フラクトオリゴ糖[FOS]およびガラクトオリゴ糖[GOS])を含む栄養補助食品の有益な効果が示されました(Perez-Pardo et al.,2017)。 腸内細菌は、いくつかの経路を介してパーキンソン病に関与している可能性があります。腸内毒素症は腸の炎症を誘発し、腸管神経系にα-シヌクレインが蓄積し、迷走神経を介して中枢神経系に広がる可能性があります(Houser and Tansey,2017)。 さらに、短鎖脂肪酸はパーキンソン病患者の腸内で有意に減少することが示されました。これは、粘膜バリア障害と腸透過性の増加をもたらし、それによって免疫系、腸管神経系、および中枢神経系に影響を及ぼし、パーキンソン病患者の状態に大きな影響を及ぼします。 (Vizcarra et al.,2015)。 |
| さらに、最近の研究では、パーキンソン病患者のファージ/乳酸菌比に有意な変化が確認されました。 細菌はドーパミンを産生し、腸透過性を調節することが知られており、パーキンソン病の病因に関係する主要な要因です(Tetz et al.,2018)。 ただし、腸内細菌叢がパーキンソン病の発症にどのように影響するかを理解するには、さらに研究が必要です。 |
高血圧 |
| 高血圧(HTN)は、高齢者の心血管、脳血管、および腎臓の疾患の主要な危険因子です。 縦断研究は、中年期の高血圧がその後の認知機能低下と認知症の危険因子である可能性があることを示しています(Wysocki et al.,2012; Walker et al.,2019)。 高血圧は、遺伝的要因と環境要因の間の複雑な相互作用によって誘発される可能性があります。 しかし、この罹患率の正確な原因はこれまで解明されていません(Li et al.,2017)。 遺伝的、環境的、および食事的要因は、腸内細菌叢と血圧の両方に深く影響し、腸内毒素症と高血圧との関連を示唆しています(Yang et a.,2015)。 Li et al(2017)は、健康な対照と比較して、劇的に減少した微生物の豊富さと多様性、Prevotellaが優勢な腸エンテロタイプ、有益な細菌の数が減少した明確なメタゲノム組成、および高血圧前症と高血圧症の両方のヒト集団における疾患関連微生物機能を発見しました。 |
| さらに、高血圧のヒトから糞便微生物叢を移植した後、無菌マウスの血圧が上昇し、腸内細菌叢が宿主の血圧に直接影響を与える可能性があることを示しています。 食事療法は高血圧の発症の重要な要因です。 最近の研究では、低繊維の西洋化された食事に起因する有害な影響が高血圧の根底にある可能性があり、これは腸内細菌叢による短鎖脂肪酸産生の不足が原因である可能性があると報告されています(Kaye et al.,2020)。 証拠は、腸内細菌によるリポ多糖の過剰産生が、高血圧の発生に直接関連している可能性があるのに対し、細菌によるアミノ酸生合成、脂肪酸利用、およびプリン代謝が高血圧予防に役割を果たす可能性があることを示唆しています(Li et al.,2017)。 全体として、メカニズムは定義されていませんが、腸内毒素症は高血圧と密接に関連しており、短鎖脂肪酸などの細菌代謝物に関連している可能性があります。 |
アテローム性動脈硬化症 |
| アテローム性動脈硬化症は、高齢者に最もよく見られる血管性脳病変であり、主に蓄積された修飾脂質、過形成平滑筋細胞、およびコラーゲン線維からなるアテローム性動脈硬化症のプラークの形成を特徴とします(Gui et al.,2012)。 研究によると、脳アテローム性動脈硬化症は認知症、特にアルツハイマー病に関連するリスクを高める可能性があることが示されています(Arvanitakis et al.,2016)。 蓄積された証拠は、腸内細菌叢とアテローム性動脈硬化症の発症との間に関連性が存在し、細菌集団の機能と組成の変化が複雑なメカニズムを通じてアテローム性動脈硬化症のリスクを高める可能性があることを示唆しました(Drosos et al.,2015)。 健康な対照と比較して、アテローム性動脈硬化症患者の微生物叢は、EnterobacteriaceaeおよびStreptococcus spp.の存在量の増加を示し、その結果、発酵性が低く、より炎症性の腸環境をもたらします(Jie et al.,2017)。 腸内細菌叢は、主に炎症の調節と、トリメチルアミン-N-オキシド(TMAO)、短鎖脂肪酸、胆汁酸などの微生物代謝産物の産生を介して、アテローム性動脈硬化症の進行に関与している可能性があります(Brown and Hazen,2018)。 |
| 腸内微生物依存性代謝物であるトリメチルアミン-N-オキシドは、宿主の免疫系の調節を通じてアテローム性動脈硬化症の発症に重要であることが示されました(Jandhyala et al.,2015) コレステロール代謝(Geng et al.,2018)、酸化ストレス(Mohammadi et al.,2018)と炎症(Ma et al.,2017)に寄与し、血栓症のリスクを高めます(Zhu et al.,2016)。 研究によると、血漿中のトリメチルアミン-N-オキシドのレベルは、プロバイオティクスとプレバイオティクスの摂取によって腸内細菌叢を改造することによって減らすことができます(Qiu et al.,2018; Tenore et al.,2019)。 |
2型糖尿病 |
| 糖尿病(DM)は、21世紀の最も重要な公衆衛生上の課題の1つであり、高齢者の健康に深刻な脅威をもたらします。 疫学研究は、糖尿病患者は健康な個人よりも認知症にかかりやすいことを示しています(Sun et al.,2020)。 2型糖尿病(T2DM)は、複数のメカニズムによる認知障害のリスクの増加と関連しており、その中で血管疾患が重要な要因である可能性があります(Biessels et al.,2014)。 腸内微生物組成の変化は、糖尿病に関係しています。糖尿病患者は、健康な対照と比較して、酪酸産生細菌の量が少なく、Verrucomicrobiaeの割合が減少していると報告されました(Tai et al.,2015)。 さらに、Lactobacillusの存在量は2型糖尿病患者で有意に増加することが報告されましたが、Bifidobacteriaの存在量は減少しました(Sedighi et al.,2017)、 別の研究では、糖尿病患者の糞便サンプル中のLactobacillus acidophilusの存在量が著しく少ないことがわかり、Lactobacillusと2型糖尿病の相関関係が示唆されました(Halawa et al.,2019)。 |
| さらに、Faecalibacterium prausnitziiとAkkermansia muciniphila の量は、非糖尿病患者よりも2型糖尿病患者の腸で低かった(Fassatoui et al.,2019)。 2型糖尿病に対する微生物叢の影響は、酪酸およびインクレチン分泌の変化を伴うメカニズムによって媒介されることが提案されています(Baothman et al。、2016)。 腸内毒素症と2型糖尿病との関連性についての証拠はありますが、研究対象集団、配列決定技術、分析方法、食事、および使用される薬物の違いにより、さまざまな結果が得られています。 したがって、2型糖尿病と腸内微生物叢との正確な関係を明らかにするには、さらなる研究が必要です。 |
| 脳の老化と認知障害における 腸内細菌叢を標的とする潜在的な介入戦略 |
食物繊維 |
| ライフスタイルは人間の食事構造に大きく影響しますが、腸内細菌叢は食事の変化に迅速に適応できます(David et al.,2014)。 特定の食事(低発酵性、オリゴ糖、二糖、単糖、ポリオール[FODMAP]およびグルテンフリー食[GFD])と食生活は、バランスの取れた腸内細菌叢の組成にプラスの影響を与える可能性があります したがって、あらゆる学習プロセスにとって重要な認知機能の強化に貢献します(Novotny et al.,2019)。 多くの証拠は、特定の種類の食物繊維が微生物とその代謝物の数を調節できることを示しています。 つまり、フルクタンとガラクトオリゴ糖の摂取により、ビフィズス菌とラクトバチルス菌の存在量が増加する可能性があります(So et al.,2018)。 高脂肪食は体重増加につながるだけでなく、腸の透過性と全身性炎症レベルを高め、防御機能を低下させます(Lam et al.,2012)。 対照的に、食物繊維は腸内細菌叢の組成を修正し、短鎖脂肪酸の生成を促進することができます(Bishehsari et al.,2018)。 酪酸、酢酸、プロピオン酸などの短鎖脂肪酸は、代謝に有益です 生理的健康、腸腔の酸性環境の維持を助け、有益な細菌の量を増やし、粘液分泌を促進し、腸粘膜のバリア機能を維持します。 酪酸は血管脳関門を通過し、抗うつ能力として機能し(Han et al.,2014)、ヒストンデアセチラーゼを阻害することで結腸癌の予防にも役立ちます(Hamer et al.,2008)。 プロピオン酸はコレステロール合成に寄与し、肝臓の糖新生に重要な役割を果たし、転移性肝癌の予防効果を発揮します(Comalada et al.,2006)。 肝臓の脂肪生成とコレステロール合成に使用される酢酸は、結腸の血液供給を調節し、肝臓癌から保護することができます(Chambers et al.,2002)。 |
| 短鎖脂肪酸はまた、粘膜免疫系に直接影響を与えることによって視床下部-下垂体-副腎軸を調節し、これらのメカニズムを介して中枢神経系での情報伝達にさらに影響を与える可能性があります(Perry et al.,2016)。 De Filippo et al(2010)は、高繊維食を摂取したアフリカの子供たちと西洋化された食事を摂取したヨーロッパの子供たちの糞便微生物叢を比較しました。 そして、アフリカの子供たちは、ヨーロッパの子供たちと比較して、腸内微生物の多様性と短鎖脂肪酸産生細菌の豊富さ、そして潜在的に病原性の菌株の量の減少を持っていることを発見しました。 これは、食事が腸内細菌叢の形成に支配的な役割を果たしていることを示唆し、健康な腸管の維持に対する食物繊維の有益な効果を浮き彫りにしました。 |
プロバイオティクスとプレバイオティクス |
| プロバイオティクスとプレバイオティクスを使用して腸内細菌叢を調節することは、老化を遅らせるための実行可能な戦略です。 根底にある病状を持つ個人に健康上の利益を提供することに加えて、プロバイオティクスの補給は健康な成人の腸内細菌叢の組成を改善することもできます(Khalesi et al.,2019)。 現在ヒトで使用されているプロバイオティクスには、主にLactobacillus, Bifidobacterium, S. thermophilus, Enterococcus, およびBacillusが含まれます。 プロバイオティクスは、神経伝達物質の放出を調節し、トリプトファン由来の神経栄養因子のレベルを高め、認知機能障害関連疾患の予防と早期治療に貢献することができます(Bhattacharjee and Lukiw,2013)。 特定のLactobacillus およびBifidobacterium 株は、γ-アミノ酪酸、アセチルコリン、ドーパミン、5-ヒドロキシトリプタミンなどの重要な神経伝達物質を分泌します。 これらは、神経の興奮性-抑制性バランス、気分、認知機能、学習および記憶プロセスの制御に重要な役割を果たします(Bravo et al., 2011; Barrett et al.,2012; O'Mahony et al.,2015)。 動物モデルでは、Lactobacillus helveticus NS8は、海馬での5-ヒドロキシトリプタミンおよび脳由来神経栄養因子の発現を増加させ、認知機能の有意な改善を誘発する可能性があります(Liang et al.,2015)。 主にフラクトオリゴ糖、ガラクトオリゴ糖、マンノオリゴ糖(MOS)、およびキシロオリゴ糖(XOS)を含むプレバイオティクスは、いくつかの有益な細菌の増殖を刺激することによって腸内細菌叢を調節できる非消化性食品成分です(Duncan and Flint,2013) 。 強制経口投与によるガラクトオリゴ糖投与は、ラットの脳における脳由来神経栄養因子の発現を有意に増加させました(Savignac et al.,2013)。 最近の研究では、プレバイオティクスサプリメント(フラクトオリゴ等-イヌリン)が、特にTNF-αを減少させることにより、中年マウスのコンカナヴァリンA(Con A)誘発性全身性炎症を抑制できることが示され、プレバイオティクスがT細胞およびナチュラルキラー細胞の免疫プライミングに特定の全身性効果を及ぼす可能性があることが示されました (Boehme et al.,2020)。 |
| プロバイオティクスは、病原性微生物に対する腸の防御機構を改善し、免疫系を強化することができます(Rooks and Garrett,2016年)。 研究によると、プロバイオティクスの摂取は、IL-1β(Ait-Belgnaoui et al.,2012; Luo et al。、2014)、IL-6、TNFα(Ait-Belgnaoui et al.,2012)、ミクログリア活性化マーカー(Ait -Belgnaoui et al.,2014)のような炎症性サイトカインのレベルを低下させることにより、全身性炎症を軽減できることが示されています。 CD1マウスでは、プレバイオティクス治療により、リポ多糖誘発性の炎症反応が大幅に抑制され、皮質でのIL-1βの発現が減少し、5-ヒドロキシトリプタミンおよび神経保護グルタミン酸作動系の構成要素の発現レベルが上昇します(Savignac et al.,2016)。 認知障害のマウスモデルでは、Lactobacillus pentosus var plantarum C29の胃内注入により、D-ガラクトース誘発性の記憶機能障害が大幅に改善され、脳内の脳由来神経栄養因子の発現が増加しました。 老化マーカーp16と炎症マーカーTNF-α、p-p65、p-foxo3a、シクロオキシゲナーゼ-2(COX-2)の発現を減少させました。 誘導型一酸化窒素合成酵素(iNOS)は、C29が加齢に伴う記憶障害と炎症を改善する可能性があることを示しています(Woo et al.,,2014)。 最近の研究では、 bifidobacteriaとlactobacilliの混合物であるSLAB51製剤が、BNDF経路を調節し、PPARγを増加させることにより、パーキンソン病の6-ヒドロキシドーパミン(6-OHDA)によって誘発される有害な影響を打ち消すことができることが明らかになりました。 Nrf2 / HO-1経路を活性化し、NFκBを阻害します。これは、SLAB51がパーキンソン病の予防または治療、あるいは補助療法として有望な候補であることを示唆しています(Castelli et al.,2020)。 さらに、プロバイオティクスは、抗酸化作用とフリーラジカル捕捉能によって老化を遅らせる可能性があります(Li et al.,2012)。 Lactobacillus fermentumは、マロンジアルデヒドレベルを低下させ、スーパーオキシドジスムターゼおよびグルタチオンペルオキシダーゼのレベルを上昇させることにより、ブタの総血清抗酸化能を高めることができ、フリーラジカルを除去する能力があります(Wang et al.,2009)。 |
糞便微生物移植 |
| 糞便微生物移植(FMT)は、健康な人の糞便に存在する機能性細菌を患者の胃腸管に移植して腸内細菌叢を再構築し、腸内および腸外の両方の疾患を治療することと定義されています。 糞便微生物移植は、Clostridium diffcile 感染症(CDI)などのさまざまな腸内細菌叢関連疾患の治療および探索的研究に使用されており、医学的進歩と見なされています。 最近の研究では、老齢マウスの腸内細菌叢を若い無菌マウスに移すと、後者の小腸の炎症が促進され、炎症性細菌成分の体循環への漏出が促進されることが報告されています(Fransen et al.,2017)。 Ridaura et al(2013)は、肥満とそうでない成体の双子のマウスの糞便微生物叢を、低脂肪食餌を与えられた無菌マウスに移植し、肥満マウスの糞便微生物を移植されたマウスが肥満になることを発見しました。 痩せたマウスの糞便微生物を移植されたものは痩せたが、微生物叢の移植が宿主の微生物叢の組成を変える可能性があることを明らかにした。 別の研究は、腸内細菌叢が脊椎動物の寿命を調節する上で重要な役割を果たす可能性があることを示しました。 中年のアフリカのターコイズメダカの腸を若いメダカのバクテリアで再コロニー化すると、寿命が延び、行動の衰退が遅れました。 また、全体的に健康的な生理学的状態、および非常に多様で若いような腸内微生物群集を維持するのに役立ちます(Smith et al.,2017)。 要約すると、腸内細菌叢の移植は寿命を延ばす可能性があることが示されています。ただし、根本的なメカニズムの解明には、さらに広範な調査が必要です。 |
| 結論と将来の展望 |
| 腸内細菌叢と宿主の状態との関連は複雑です。 腸内細菌叢の組成と細胞代謝は加齢とともに変化します。 腸内細菌叢の変化が認知障害の誘発因子であるか結果であるか、そしてそのメカニズムを調査する必要があります。 新たな証拠は、老化中に脳機能を維持するために健康な微生物叢を保存することの重要性を強調しています。 彼らは、認知障害の進行における腸内細菌叢の因果的または寄与的な役割を支持してきました。 パーキンソン病の起源における腸内細菌叢の寄与は、腸管神経系、舌咽神経、迷走神経におけるα-シヌクレイン封入体の早期出現、および迷走神経切断術を受けた個人におけるパーキンソン病のリスクの低下によって証明される、因果関係の明確な確認を提供しました(Braak et al.,2003 ; Shannon et al.,2012; Svensson et al.,2015)。 さらに、プロバイオティクス(Lactobacillus acidophilus、Lactobacillus casei、Bifidobacterium bifidumおよびLactobacillus fermentum)の12週間の摂取は、ランダム化された二重盲検法および管理された臨床試験により、パーキンソン病患者の認知機能といくつかの代謝状態にプラスの影響を与える可能性があることが実証されました(Akbari et al.,2016)。無菌マウスと抗生物質誘発性腸内毒素症は、腸内細菌叢と脳の関係の因果関係を調査するための2つの方法です(Frohlich et al.,2016)。 無菌マウスは、特定病原体除去マウス(SPFマウス)と比較して、不安様、社会的、認知行動の変化を示しました(Diaz Heijtz et al.,2011; Desbonnet et al。、2014; Stilling et al.,2014)。 無菌APPトランスジェニックマウスは、対照マウスと比較して脳のAβアミロイド病理の劇的な減少を示したが、Aβ病理は、従来の方法で飼育されたAPPトランスジェニックマウスからの微生物叢のコロニー形成後に増加した(Harach et al.,2017)。 ある研究では、老化促進マウス耐性1(SAMR1)マウスから糞便細菌移植を受けた偽無菌マウスが示されています。 しかし、老化促進マウス傾向8(SAMP8)マウス(アルツハイマー病のマウスモデル)からではなく微生物叢の行動とα-多様性およびβ-多様性指数の改善が示されました(Zhan et al.,2018)。 さらに、マウスモデルで抗生物質によって誘発された微生物叢の腸内毒素症は、脳由来神経栄養因子の低下、ニューロペプチドYの増加、セロトニントランスポーターなどの脳シグナル伝達分子の調節不全に関連していることが確認され、その後認知障害を引き起こしました(Frohlich et al.,2016)。 |
| しかし、腸内細菌の組成の変化は、単に病状の結果である可能性もあります。 腸の効率的な機能を確保するために、いくつかのシステムが機能しています。 中枢神経系、腸管神経系、自律神経系の交感神経および副交感神経の枝、神経内分泌および神経免疫経路はすべて、腸内微生物とのコミュニケーションに関与しています(Cryan and Dinan,2012)。 脳-腸-腸内細菌叢軸では、脳は固有層細胞を介してシグナル分子を放出するか、消化管の運動性、分泌物、透過性を調節することにより、腸内細菌叢の組成と機能に直接的または間接的に影響を与えることができます(Cryan et al.,2019)。 したがって、神経変性疾患の主要な表現型である神経機能障害が微生物叢の腸内毒素症の一因となる可能性があると考えることも合理的です。 最新の研究では、腸内細菌叢に依存する代謝物トリメチルアミン-N-オキシドまたはその前身であるコリン、カルニチン、ベタインは、双方向メンデルランダム化アプローチによるアルツハイマー病の発症に因果関係を持たないことが支持されました(Zhuang et al.,2021)。 別の観点から、上記のこれらの疾患モデルには両方とも限界があります。 高度に人工的なモデルとして、無菌マウスは血液脳関門と脳の超微細構造の変化も示し(Diaz Heijtz et al.,2011; Braniste et al.,2014)、生涯にわたる微生物叢の欠如によって引き起こされる生理学的欠陥は 代償プロセスによって弱められる可能性が高い(Frohlich et al.,2016)。 抗生物質誘発性腸内毒素症の場合と同様に、抗生物質は全身性の影響を引き起こす可能性があり、腸から脳へではなく脳に直接作用する可能性さえあります。 これらすべての要因が、微生物叢依存性の影響を調査する結果の背後にある本当の原因を保護する可能性があります。 |
| マウスモデルは神経変性疾患の研究において多くの利点を持っており、多くの治療アプローチはかなりの有効性を示していますが、これらの疾患の効果的な治療法はまだありません。これは、少なくとも部分的には、これらのモデルが高度に人工的であり、人間の病気を表す選択された側面のみを模倣しているという事実に関連している可能性があります。 ペット種は、(i)病気の表現型は通常飼い主によって維持されているため自発的に発生し、(ii)遺伝子操作の必要がなく、(iii)寿命が長く、後期であるため、認知障害を研究するための合理的なモデルとなる可能性があります。 状態の発症は、遺伝子組み換えされていない人間の患者と非常によく似ています。 さらに、非ヒト霊長類は、高コストで研究期間が長いにもかかわらず、ヒトの脳や神経系との類似性が高いため、ヒトの老化や認知障害を調査する上で有望なもう1つのモデルです(Teng et al.,2000)。 |
| すべてのアカウントで、腸内細菌叢が老化および老化関連の認知障害にどのように影響するかに関与するメカニズムへの洞察は、老化関連疾患の診断、治療、および予防のための新しい方向性を提供する可能性があります。腸内細菌叢は、老化や認知障害の有望な介入標的となる可能性があります。 微生物叢を対象とした介入に基づく将来の研究では、より適切に設計された大規模なランダム化二重盲検プラセボ対照臨床試験が必要です。 さらに、研究では、存在する微生物の生理学的および病理学的機能を説明し、変化した微生物組成が病気の病態生理学に寄与し、潜在的なプロバイオティクス細菌が宿主の健康に有益な効果を及ぼす正確なメカニズムを調査する必要があります。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Front Aging Neurosci. 2021,13,671142に掲載されたGut Microbiota: Critical Controller and Intervention Target in Brain Aging and Cognitive Impairmentを日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |