
Martin Frappier et al., |
要約 |
| 脂質異常症、特に低密度リポタンパク質コレステロール(LDL-C)の異常値は、心血管疾患の重要な危険因子です。プロバイオティクスが総コレステロールまたはLDL-コレステロールを低下させる有望な作用を示すエビデンスはあるものの、専門家はプロバイオティクスを血中脂質管理の治療薬として推奨するにはまだ至っていません。そのため、新たな効果的なコレステロール低下プロバイオティクスの開発の機会が存在します。胆汁酸塩加水分解酵素(BSH)とフェルロイルエステラーゼ(FAE)は、一部の細菌のコレステロール低下作用を説明すると提唱されている細菌酵素であり、どちらも生体内で脂質減少に関与することが示されている。本研究では、コレステロール低下作用を持つ細菌を選抜するために、乳酸菌に関連する70株を胆汁酸塩加水分解酵素およびフェルロイルエステラーゼ活性についてスクリーニングしました。この双方向スクリーニング手法に基づき、2種類の細菌を選抜し、in vitroにおけるコレステロール同化能(別のメカニズムとして示唆されている)を評価しました。 Lactobacillus acidophilus CL1285は、in vitroにおいて胆汁酸塩加水分解酵素活性およびフェルロイルエステラーゼ活性に加え、コレステロール同化能を示しました。 Lactiplantibacillus plantarum CHOL-200は、胆汁酸塩加水分解酵素活性とコレステロール同化能を示しました。in vitroで観察されたこれらの特性は、両菌株が脂質異常症の管理に適したプロバイオティクス候補であることを示しています。ヒト試験において血中コレステロールを低下させる能力を評価するには、さらなる研究が必要です。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.実験セクション |
| 2.1.本研究で使用した細菌 |
| 2.2.細菌同定 |
| 2.3.胆汁酸塩加水分解酵素(BSH)活性の検出 |
| 2.4.フェルロイルエステラーゼ(FAE)活性の検出 |
| 2.5.乳酸菌によるコレステロールの同化 |
| 2.6.胃生存性 |
| 2.7胆汁酸塩耐性試験 |
| 3.結果 |
| 4.考察 |
| 本文 |
| 1.はじめに |
| 心血管疾患(CVD)は世界中で主要な死亡原因となっています[1]。脂質異常症、すなわち血中脂質、特に低密度リポタンパク質コレステロール(LDL-C)の異常値は、心血管疾患(CVD)の主要な危険因子です[2, 3]。高コレステロール血症患者の血清脂質を正常化するために、数多くの医薬品が処方箋として入手可能であり、世界中で使用されています。しかし、これらの薬剤の大部分は、筋肉痛、糖尿病、腎機能の低下、うつ病様症状の増加などの副作用を引き起こします[4]。スタチンを使用している患者の30%以上が筋肉痛を経験しています[5]。これらの副作用により、多くの患者が脂質代謝を改善するための代替療法、例えば緑茶、水溶性食物繊維、ニンニクなどの様々な食品やサプリメントの摂取を模索しています[6, 7]。さらに、プロバイオティクス菌は、菌株特異的なコレステロール低下作用により大きな注目を集めています[8]。 |
| プロバイオティクスは、適量を投与すると宿主に健康上の利益をもたらす生きた微生物と定義されています [9]。乳酸菌は、十分に特徴付けられたプロバイオティクス細菌であり、in vitro および動物実験と臨床試験において、コレステロールを低下させる有望な能力を示しています [10, 11]。Wu らはメタ分析で、15 件のランダム化ヒト臨床試験の結果を分析し、乳酸菌の摂取が血清脂質プロファイルに及ぼす影響を調べました [12]。これらの研究のうち 14 件を統合して、著者らは、乳酸菌が血中総コレステロール (TC) および LDL-コレステロール(LDL-C )値を著しく低下させる可能性があることを示しました。サブグループ分析により、Lactiplantibacillus (Lactobacillus) plantarum と Limosilactobacillus (Lactobacillus) reuteri が 血中総コレステロール (TC)と LDL-コレステロール(LDL-C )を著しく低下させる可能性があることが強調されました。また、SunとBuys は、10件の臨床研究の統合効果に基づいて、プロバイオティクス、特に複数の株を含む製剤やLactobacillus acidophilusを含む製剤の摂取がLDL-コレステロール(LDL-C )を下げるのに効果的であることを明らかにした[13]。 |
| 一部のプロバイオティクス細菌で観察されるコレステロール低下作用を説明するために提案されている潜在的なメカニズムの中で、最もよく研究されているのは、胆汁酸塩加水分解酵素(BSH)活性、コレステロールの同化、コレステロールのコプロスタノールへの変換、コレステロールと非抱合胆汁酸塩の共沈殿、フェルロイルエステラーゼ(FAE)活性、およびNPC1L1遺伝子発現の調整です[14–16]。 胆汁酸塩加水分解酵素(BSH)は、Lactobacillaceae, Bifidobacterium spp., Enterococcus spp., Clostridium spp., およびBacteroides spp., に関連する一部の細菌によって合成され、一次胆汁酸とグリシンまたはタウリンとの間のペプチド結合を切断し、ステロールコアからアミノ酸を遊離させます[17–21]。酵素によって放出された非抱合胆汁酸は溶解性が低く、腸管腔内に留まります。これらの非抱合型胆汁酸は腸内容物と混ざり合い、便中に自然に排泄されます。このメカニズムにより、体は宿主のコレステロールを利用して新たな胆汁酸分子を新規に合成するようになり、結果として血中コレステロールが減少します[22, 23]。 |
| もう一つの提案されているメカニズムは、フェルロイルエステラーゼ(FAE)活性です。 この酵素は、 Lactobacillus gasseri, Lactobacillus acidophilus, Lactobacillus helveticus, Lactobacillus johnsonii, およびLimosilactobacillus (Lactobacillus) fermentum などの一部の乳酸菌(LAB)に存在し、植物細胞壁からフェルラ酸(FA)などのフェノール化合物の遊離に関与しています[24–26]。フェルラ酸(FA)は、コレステロールのde novo合成を担う主要酵素の一つである3-ヒドロキシ-3-メチルグルタリル-コエンザイムA還元酵素(HMG-CoA還元酵素)の競合阻害剤として作用し、スタチンと同じ標的となります[27]。 フェルラ酸(FA)は、2つのコレステロールトランスポーター、高密度リポタンパク質(HDL)、および低密度リポタンパク質(LDL)の合成に関与する核転写因子であるペルオキシソーム増殖因子活性化受容体α(PPARα)を活性化することもできます。ペルオキシソーム増殖因子活性化受容体α(PPARα)の活性化は高密度リポタンパク質(HDL)の増加と低密度リポタンパク質(LDL)の減少に関連しています[28]。 |
| さらに、特定の乳酸菌の菌株特異的なコレステロール同化能がin vitroで研究されています。細菌の細胞膜に取り込まれたコレステロールは糞便中に排出され、循環血中のコレステロールプール全体を減少させる可能性があります[23, 29–31]。 |
| Bio-K Plus International Inc. (Bio-K +)は、 Lactobacillus acidophilus CL1285, Lacticaseibacillus (Lactobacillus) casei LBC80R, およびLacticaseibacillus (Lactobacillus) rhamnosus CLR2 株を組み合わせた乳酸菌ベースのプロバイオティクス製剤の開発と製造を専門としています。この製剤は、これまでに抗菌薬関連の下痢症および Clostridioides (Clostridium) difficile感染症の発生率を大幅に低下させ、下痢型過敏性腸症候群の患者の生活の質を向上させることが示されています[32–36]。 本研究では、Bio-K +独自の乳酸菌コレクションを、胆汁酸塩加水分解酵素(BSH)およびフェルロイルエステラーゼ(FAE)活性を標的としたマルチメカニズムアプローチを用いてスクリーニングし、ヒトのコレステロール値を管理および低下させる可能性のある候補細菌を選抜しました。 スクリーニングの結果、強力な胆汁酸塩加水分解酵素(BSH)およびフェルロイルエステラーゼ(FAE)活性活性に基づいて L. acidophilus CL1285 および L. plantarum CHOL-200 が選択され、さらに in vitro でのコレステロール同化能力およびプロバイオティクス特性が評価されました。 |
| 2.実験セクション |
| 2.1.本研究で使用した細菌 |
| 全ての細菌は、5%の水素、10%の窒素、85%の二酸化炭素(MEGS、Air Liquideの一部門、Montreal, Canada)からなる混合ガスを含むBactron300嫌気チャンバー(Sheldon Manufacturing Inc.、Cornelius, OR, USA)を用いて、de Man, Rogosa, Sharpe(MRS)寒天培地(EMD Millipore、No. 1.10661)上で嫌気性雰囲気下で培養されました。BK株、ならびにL. acidophilus CL1285株、L. casei LBC80R株、およびL. rhamnosus CLR2株は、Bio-K +の特許取得株であり、食品、母乳、口腔、膣、糞便サンプルから分離されました。その他の菌株は、アメリカタイプカルチャーコレクション(ATCC、Manassas, VA, USA)、ベルギー微生物共同コレクション(BCCM/LMG、Gent, Belgium)、特許・バイオリソースセンター(Formerly Fermentation Research Institute; FERM, Chiba, Japan)から購入しました。ヒト細菌分離株については、参加者は研究目的を説明し、インフォームドコンセントを得た上で、自己採取したサンプルを提供しました。細菌は-80℃で保存し、使用前に室温で解凍しました。各実験の前に、細菌をMRSプレートに画線塗布し、純度を確認しました。 |
| 2.2.細菌同定 |
| 細菌同定は、16SリボソームRNA(rRNA)をコードするrrs遺伝子(Génome Québec、Montreal, Canada)の配列決定によって行った。得られた配列は、BLAST(www.ncbi.nlm.nih.gov/BLAST)を用いて相同細菌配列と比較した。DNA抽出のために、細菌コロニーを100 µLの10 mM Tris-HCL(Fisher Scientific、No. BP153)と100 mgのガラスビーズ(Sigma-Aldrich、N. Z250465)を含む2 mLサンプルチューブに再懸濁した。サンプルはボルテックスアダプターを用いてボルテックス上に水平に置き、最大速度で2分間ビーズを撹拌した。サンプルは氷上で2分間冷却した。ビーズビーティングと冷却のステップを2回繰り返し、サンプルを10,000 × gで2分間遠心分離した。上清をDNA増幅に使用した。16S rRNA遺伝子配列をコードするDNAは、pA (5′-AGAGTTTGATCCTGGCTCAG-3′) プライマーとpH (5′-AAGGAGGTGATCCAGCCGCA-3′) プライマーを用いて、DNAサーマルサイクラー(Tpersonal Thermocycler、Biometra、Goettingen, Germany)で増幅した[37]。 PCR増幅は、1X MyTaq™バッファーに溶解したウシ血清アルブミン(Sigma-Aldrich、No. B8667)20µg、各プライマー(AlphaDNA、Montreal, Canada)10pmol、DNAサンプル4µL、MyTaq™ HS DNAポリメラーゼ(Bioline、No. Bio-21113)2.5Uを添加し、50µL反応液で行った。増幅は、95℃で5分間、55℃で5分間の反応後、72℃で45秒間、94℃で45秒間、55℃で45秒間の反応を30サイクル繰り返した後、72℃で10分間の最終伸長反応を1回行った[38]。表1に、本研究で使用した細菌属の一覧を示す。 L. acidophilus CL1285 および L. plantarum CHOL-200 の 16S rRNA 遺伝子配列は GenBank に登録されており、アクセッション番号 ON544019 および ON544020 でアクセスできます。 |
| 表1. 本研究でスクリーニングに使用した乳酸菌科の各細菌属の数 |
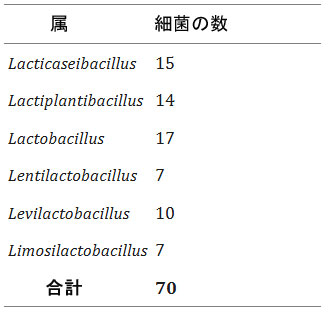 |
| 2.3. 胆汁酸塩加水分解酵素(BSH)活性の検出 |
| 胆汁酸塩加水分解酵素(BSH)活性の評価は、Pereiraら[39]の方法を用いて行った。新鮮な細菌培養液を、0.5%タウロコール酸ナトリウム水和物(TCA)(Sigma-Aldrich; No. 86339)または0.5%グリココール酸ナトリウム水和物(GCA)(Sigma-Aldrich、No. G7132)および0.37 g/L無水塩化カルシウム(Labo MAT、No. CP-0108)を添加したMRS寒天培地(1.5% w/v)(EMD Millipore、No. 1.10661)の表面に塗布した。各プレートを嫌気雰囲気下、37℃で72時間培養した。胆汁酸塩加水分解酵素(BSH)活性は、コロニー周囲の沈殿物、コロニーの粗面、またはその両方によって特徴付けられた。半定量データは、胆汁酸塩添加の有無で寒天培地上で各細菌株の生育域および/または沈殿域を比較した「+」記号で表されます。「+」記号の数は活性の強さに比例します。陰性の結果はマイナス記号で示され、細菌は培地上で生育しますが、胆汁酸塩を添加しない同じ培地と比較して活性が検出されなかったことを意味します。 |
| 2.4. フェルロイルエステラーゼ(FAE)活性の検出 |
| フェルロイルエステラーゼ(FAE)活性の検出は、Donaghyら[40]によって記載された半定量法に若干の改変を加えて行った。簡単に説明すると、MRS培地ブロスと同じ成分(グルコースを含まない)を用いて、1.5%寒天(Fisher Scientific、No. BP1423)を含む改変MRS培地を調製した。培地を121℃で20分間滅菌し、50~55℃で冷却した。N,N-ジメチルホルムアミド(Sigma-Aldrich、No. D4551)に溶解した10%エチル4-ヒドロキシ-3-メトキシケイ皮酸(エチルフェルラ酸)(Sigma-Aldrich、No. 320617)溶液6mLを500mLの培地に加え、穏やかに混合した。その後、培地を滅菌ペトリ皿に注ぎ、室温で固めた。各ペトリ皿の表面に新鮮な細菌培養液を一白金耳ずつ塗布し、嫌気雰囲気下、37℃で3~6日間培養しました。すべての結果は、寒天培地上で、エチルフェルラ酸添加の有無で、各菌株の増殖と各細菌コロニー周囲の曇りの消失を比較することで表しています。フェルロイルエステラーゼ(FAE)活性はプラス記号「+」で示され、記号の数はフェルロイルエステラーゼ(FAE)活性に比例します。陰性の結果はマイナス記号で示され、細菌は培地上で増殖しますが、エチルフェルラ酸を添加していない同じ培地と比較して活性が検出されなかったことを意味します。 |
| 2.5.乳酸菌によるコレステロールの同化 |
| コレステロールミセルは、Razinら[41]が開発した方法に若干の改変を加えて調製した。簡単に説明すると、100 mgのコレステロール(Sigma-Aldrich、No. C8667)と220 mgの大豆レシチン(ホスファチジルコリンとリゾレシチンの混合物、American Lecithin Company、No. LPC50)を10 mLのクロロホルム(Fisher Scientific、No. BP1145)に溶解した。クロロホルムは窒素ガス(Praxair Canada Inc.、Laval, Quebec)を用いて蒸発させた。次に、30 mLの0.4 Mスクロース溶液(Fisher Scientific、No. S5)を加え、コレステロール/レシチン混合物を超音波処理してコレステロールミセルを調製した。超音波処理は、氷上でSonic Dismembrator 500(Fisher Scientific、 Pittsburg, PA, USA)を用いて最大振幅で、出力を100~120ワットに設定し、15分間×3回実施し、各回ごとに氷を交換した。その後、溶液を高速遠心管に入れ、30,000×gで30分間遠心分離(Avanti J-26S XPI、Beckman Coulter、Brea, CA, USA)し、超音波プローブから金属粒子を除去した。 |
| MRSブロス中で2回連続して一晩嫌気培養した後、各培養物を生理食塩水(NaCl 0.85% w/v)で洗浄し、ペレットを滅菌水に再懸濁した。次に、ペレット懸濁液100 µLを、0.2%チオグリコール酸ナトリウム(Sigma-Aldrich、No. T0632)および0.6%オックスゴール(Sigma-Aldrich、No. B3883)を添加した還元型MRS培地中のコレステロールミセル1 mLと混合した。その後、全てのチューブを嫌気雰囲気下、37℃で48時間培養した。陽性対照としてL. acidophilus ATCC 43121株を選択した。 |
| 細菌によるコレステロール同化の定量は、RudelとMorrisおよびGillilandらの方法[29, 42]に若干の改変を加えて用いて測定した。簡単に説明すると、培養物9mLを含む各チューブの内容物を3,700 × gで15分間遠心分離し、同化されたコレステロールを含むペレットを同量の滅菌水に再懸濁した。各サンプル1mLを、95%エタノール(Les Alcools de Commerce、No. USP + 432,526)3mLと50%水酸化カリウム溶液(Acros Organics、No. 232550010)2mLを含むホウケイ酸チューブに移した。各チューブを20秒間ボルテックスし、その後、60℃のウォーターバスで10分間加熱した。次に、チューブを室温で 10 分間冷却しました。次に、5 mL の n-ヘキサン (Acros Organics、No. AC160780010) と 3 mL の滅菌蒸留水をチューブに加え、30 秒間ボルテックスしました。チューブを室温で 15 分間インキュベートして相分離させました。その後、2.5 mL の上相を別のホウケイ酸チューブに移しました。チューブを 70 °C に加熱したお湯で温め、窒素ガスを使用して n-ヘキサンを完全に蒸発させました。ペレットを、あらかじめ氷酢酸 (Fisher Scientific、No. 351271) に溶解しておいた 0.5 mg/mL の濃度の o-フタルアルデヒド (Sigma-Aldrich、No. 79760) の新しく調製した溶液 4 mL に再懸濁しました。チューブは室温で 10 分間インキュベートしました。次に、濃硫酸(Fisher Scientific、No. 351298–212)2 mLを各チューブに加え、ボルテックスで20秒間混合し、再び室温で10分間インキュベートした。各サンプルのOD550nmをBioPhotometer plus(Eppendorf、Hamburg, Germany)を使用して測定した。ブランクは、o-フタルアルデヒド溶液4 mLと濃硫酸2 mLで構成されていた。標準曲線は、0、25、50、75、100、200、および400 μg/mLのコレステロール溶液を使用して作成した。総コレステロール (TC)は、コレステロールミセルを含むチオグリコール酸および胆汁酸添加MRS培地のOD550nmから、コレステロールを含まないチオグリコール酸および胆汁酸添加MRS培地のOD550nmを差し引くことで決定した。すべての標準およびサンプルは、同一の手順で試験された。同化率は次の式を使用して計算されました。 |
 |
| 各細菌について、コレステロール同化率は3つの独立したサンプルを2連で測定し、評価した。値は平均値±標準偏差として表される。データは、SPSS Statistics for Windows バージョン19.0(IBM Corporation、Armonk, NY, USA)を用いて一元配置分散分析(ANOVA)によって解析された。群間の差は、事後ダンカンの多重範囲検定によって解析された。平均値間の差は、p≤0.05で有意と判定された[43]。 |
| 2.6.胃生存性 |
| 実験当日、pH 1.5、2、2.5の模擬胃液(SGF)を調製した。簡単に説明すると、塩化ナトリウム(Fisher Scientific、No. BP358-212)2gとペプシン(Sigma-Aldrich、No. P7000)3.2gを900 mLの浸透圧濾過水に溶解した。5 M塩酸(Fisher Scientific、No. A144-212)でpHを調整し、Ross Ultra pH/ATC Triodeを装備したOrion 3 Star pH BenchTop(Thermo Scientific、米国マサチューセッツ州ビバリー)を用いてpHを測定した。pH調整後、滅菌浸透圧水を用いて模擬胃液(SGF)の容量を1 Lに定容し、19 mLの模擬胃液(SGF)を50 mLコニカルチューブに移した。実験前に、各チューブを 37 °C のインキュベーターに 1 時間置いて溶液を温めました。 |
| L. acidophilus CL1285またはL. plantarum CHOL-200の一晩培養液1mlを、模擬胃液(SGF)を含む各チューブに加え、37℃に予熱したMaxQ 4450インキュベーターシェーカー(Thermo Scientific、Marietta, OH, USA)に直ちに置き、250 rpmで30分および60分間撹拌した。インキュベーション後、各SGF-細菌混合物1mLを0.1Mリン酸ナトリウム緩衝液の滅菌溶液9mLで中和した。細菌はペプトン水(ペプトン1g/Lおよび塩化ナトリウム0.5g/L)で10倍段階希釈することにより計数した。適切な希釈液をMRS寒天培地(1.5% w/v)に塗布し、好気雰囲気下、37℃で48時間インキュベートした。 |
| 2.7胆汁酸塩耐性試験 |
| L. acidophilus CL1285株とL. plantarum CHOL-200株の両株に対し、3種類の異なる胆汁を用いて胆汁酸塩耐性試験を実施しました。牛胆汁粉末(Sigma-Aldrich、No. B3883)、胆汁酸塩(Sigma-Aldrich、No. 48305)および細菌学的胆汁(OrganoTechnie、No. 10236)に対する耐性は、各タイプの胆汁を0.15%または0.3%(w/v)含むプレートに細菌を接種することによって評価しました。各株を胆汁酸塩を添加したMRS寒天プレートの表面に画線し、嫌気性雰囲気下で37°Cで48時間インキュベートしました。胆汁酸塩を含まないMRS寒天上での増殖を陽性対照として使用し、各タイプの添加MRS寒天上での各株の増殖能力を判定しました。 |
| 3.結果 |
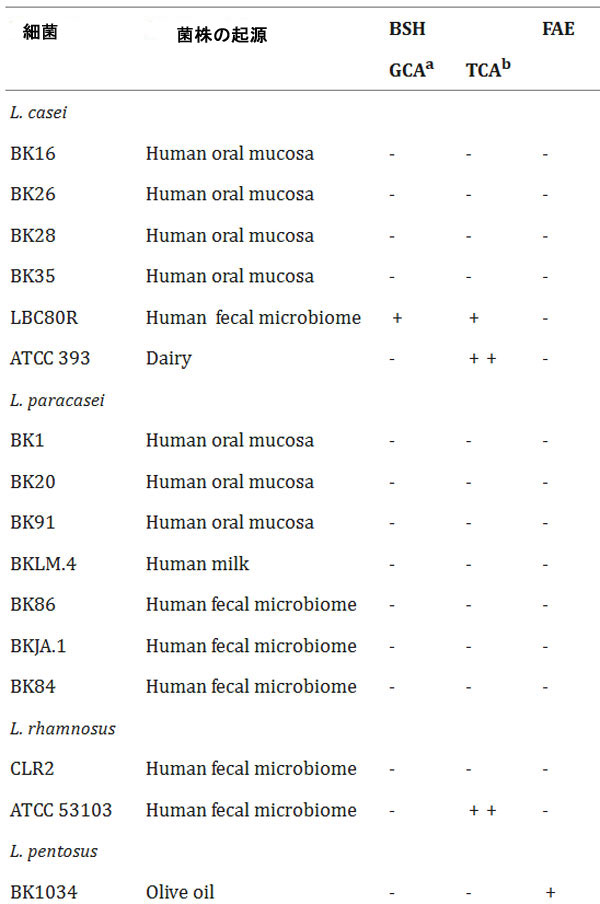
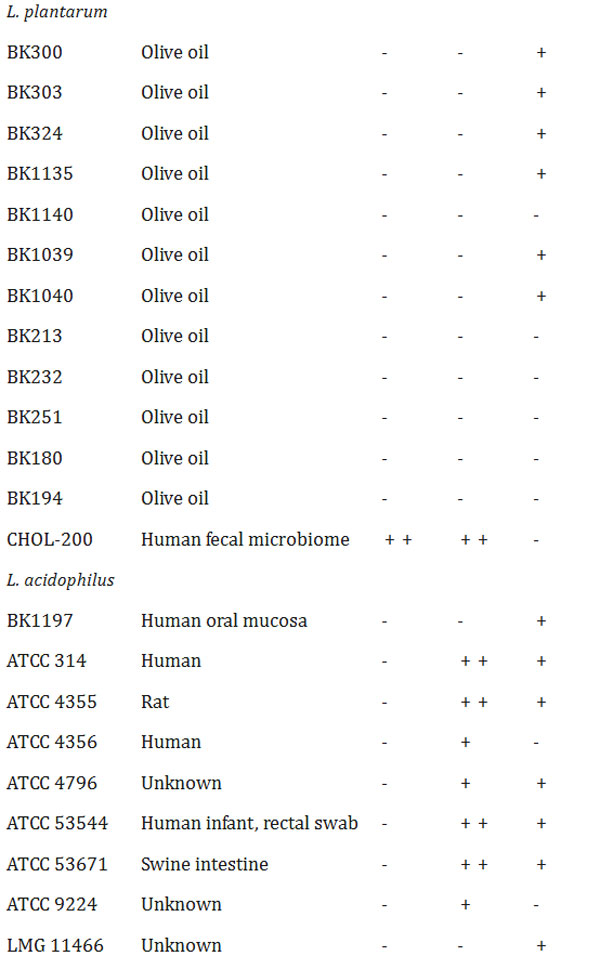
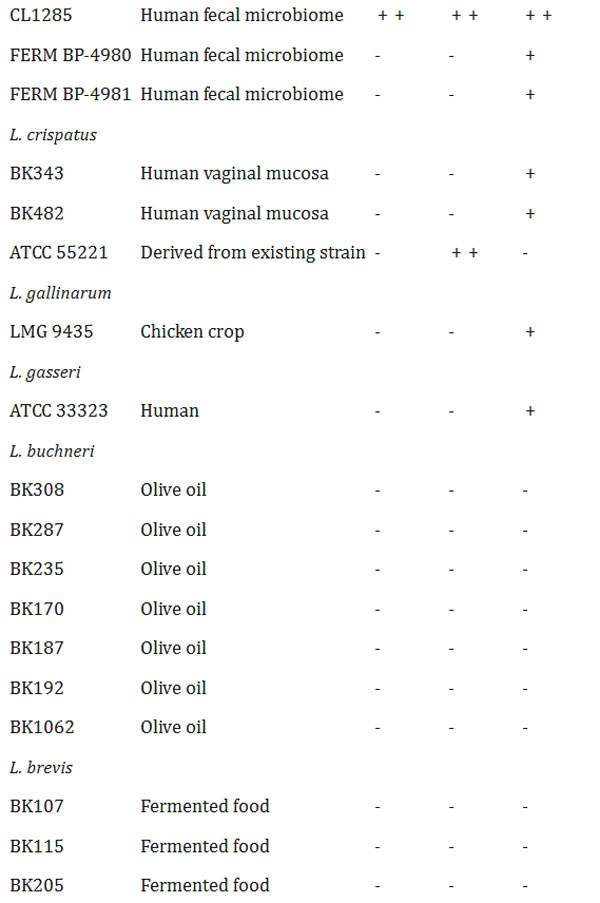
| ヒトの糞便、口腔、膣、乳汁、食品から分離、または市販のLactobacillaceaeに属する細菌70種について、胆汁酸塩加水分解酵素(BSH)活性またはフェルロイルエステラーゼ(FAE)活性の有無を調べた。これらのうち18種が胆汁酸塩加水分解酵素(BSH)活性を有し、そのうち10株はタウリン抱合型胆汁酸(TCA)に選択的に活性を示し、5株はグリシン抱合型胆汁酸(GCA)に特異的な活性を示した。さらに、Lactobacillus acidophilus, Lacticaseibacillus casei, および Lactiplantibacillus plantarum に関連する3株は、タウリンまたはグリシンのいずれかを用いて胆汁酸を脱抱合する能力を示した。これらの3株のうち2株は、より強い胆汁酸塩加水分解酵素(BSH)活性を示すようであった。 L. acidophilus CL1285 および L. plantarum CHOL-200 は、グリシン抱合型胆汁酸(GCA) またはタウリン抱合型胆汁酸(TCA)の存在下で、テストした他のすべての乳酸菌と比較して強力な胆汁酸塩加水分解酵素(BSH)活性を示しました (表 2)。 |
表2 胆汁酸塩加水分解酵素(BSH)およびフェルロイルエステラーゼ(FAE)活性 -:陰性、+:陽性、++:強陽性 |
 |
 |
 |
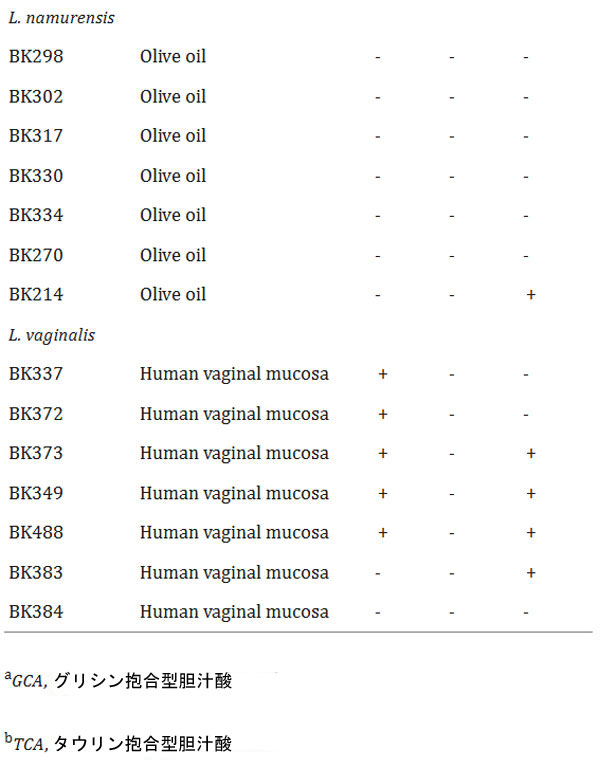 |
| 並行して、同じ細菌株のフェルロイルエステラーゼ(FAE)活性も評価しました。フェルロイルエステラーゼ(FAE)活性陽性株は26株(表2)で、Lactiplantibacillus属が7株、Lactobacillus属が14株、Levilactobacillus属が1株、Limosilactobacillus属が4株でした。しかし、これらの株のうち、強いフェルロイルエステラーゼ(FAE)活性を示したのはL. acidophilus CL1285のみでした。胆汁酸塩加水分解酵素(BSH)およびフェルロイルエステラーゼ(FAE)陽性活性の代表的なデータを図1に示します。参考として、L. acidophilus CL1285およびL. plantarum CHOL-200の結果を用いました。 |
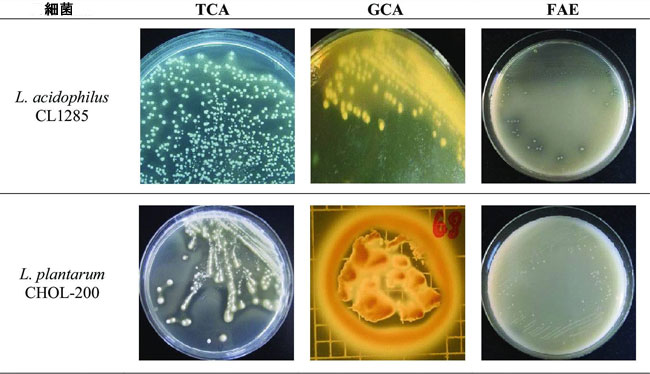 |
図1 L. acidophilus CL1285およびL. plantarum CHOL-200の胆汁酸塩加水分解酵素(BSH)およびフェルロイルエステラーゼ(FAE)陽性活性の視覚的表示。 株は、タウリン抱合型胆汁酸(TCA)およびグリシン抱合型胆汁酸(GCA)存在下で37℃の嫌気雰囲気下で72時間培養、またはエチルフェルラ酸(FAE)存在下で37℃の嫌気雰囲気下で最大6日間培養された。L. plantarum CHOL-200ではフェルロイルエステラーゼ(FAE)活性は検出されなかった。 |
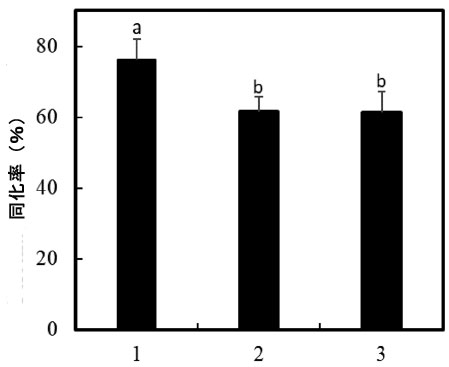 |
図2 コレステロール同化率。 1: L. plantarum CHOL-200、2: L. acidophilus CL1285、3: L. acidophilus ATCC 43121。異なる文字の数字は有意差がある(p ≤ 0.05)。 |
| プロバイオティクス菌がその有益な効果を発揮するには、胃と小腸のそれぞれ厳しい酸性と胆汁環境に耐えなければなりません。L. acidophilus CL1285 と L. plantarum CHOL-200 のプロバイオティクス特性をさらに調べるため、両菌株を酸性および酵素的な胃の状態をシミュレートした pH 1.5~2.5 の模擬胃液(SGF)に 30 分と 60 分間曝露させました (図 3)。L. acidophilus CL1285 は、模擬胃液(SGF)pH 2 および 2.5 に 60 分まで曝露しても影響を受けません (初期細菌数との差が 1 Log10 CFU/mL 未満)。L. acidophilus CL1285 は pH 1.5 で 30 分間の模擬胃液(SGF)にも耐性があります。L. plantarum CHOL-200 は、模擬胃液(SGF) pH 2.5 では最大 60 分間、模擬胃液(SGF) pH 2 では 30 分間生存しました。しかし、模擬胃液(SGF)pH 2 では 60 分後には生存率が約 1.9 Log10 CFU/mL 減少したことが観察されました。L. plantarum CHOL-200 は、それぞれ 2.84 Log10 CFU/mL と 5.43 Log10 CFU/mL の減少で示されるように、30 分間または 60 分間の 模擬胃液(SGF)pH 1.5 に対して最小限の耐性を示しました。 |
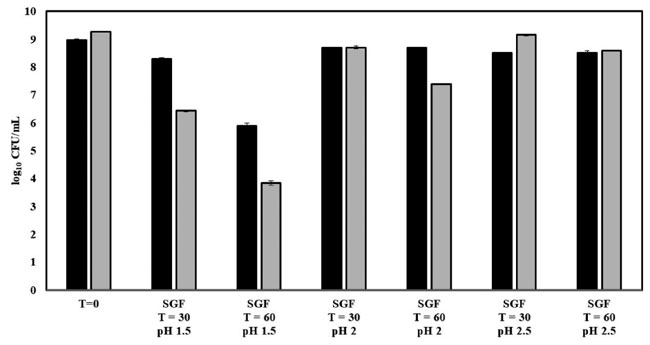 |
| 図3:L. acidophilus CL1285およびL. plantarum CHOL-200をpH1.5~2.5の模擬胃液(SGF)に30分および60分間曝露した際の胃内生存率。黒色バー:L. acidophilus CL1285、灰色バー:L. plantarum CHOL-200 |
| Goldin と Gorbach は、プロバイオティクス細菌は 0.15~0.3% の胆汁酸塩の存在下で増殖できるはずだと述べています [44]。そこで、L. acidophilus CL1285 と L. plantarum CHOL-200 について、市販されている 3 種類の胆汁酸混合物に対する耐性を評価しました (表 3)。L. acidophilus CL1285 は、牛胆汁粉末、細菌学的胆汁、0.15% の胆汁酸塩の存在下で増殖できました。しかし、0.3% の胆汁酸塩の存在下では増殖阻害効果が見られました。L. plantarum CHOL-200は、試験した濃度に関係なく、3 種類すべての胆汁酸塩を添加した MRS 上で増殖しました。試験した 3 つの製品のうち、両株とも牛胆汁粉末の存在に対してより高い耐性を示しました。Hu ら市販の様々な牛胆汁粉末の組成を評価し、胆汁酸の比率に基づいてシグマアルドリッチの牛胆汁粉末がヒト胆汁に類似していることを示しました。この観察結果は、シグマアルドリッチの牛胆汁粉末がプロバイオティクス細菌の胆汁耐性を評価するのに最も適していることを裏付けています[45]。 |
表3. 嫌気性雰囲気下、0.15%および0.3%の胆汁酸塩(w/v)を添加したMRS上で48時間培養後のL. acidophilus CL1285およびL. plantarum CHOL-200の増殖。 -:増殖なし、+:増殖、++:著しい増殖 |
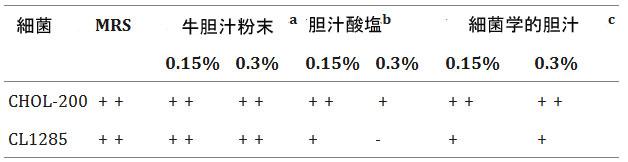 |
a 牛胆汁(胆汁酸塩70%、リン脂質22%、コレステロール4%、タンパク質3%、ビリルビン0.3%含有)(出典:シグマアルドリッチ) b コール酸とデオキシコール酸を約50%ずつ混合したもの(出典:シグマアルドリッチ) c 乾燥物中の45%以上に相当する胆汁酸(コール酸として)(出典:オルガノテクニー) |
| 4.考察 |
| 特に低密度リポタンパク質(LDL)粒子由来の総コレステロール (TC)レベルの上昇は、心血管疾患(CVD)発症の主要な危険因子である。高コレステロール血症の管理には様々な治療戦略が用いられているが、心血管リスクの低減につながるLDL-コレステロール(LDL-C)目標値を達成できる患者はわずか32.1~55.7%に過ぎない[46]。さらに、スタチンなどの使用により、一部の患者に認められる副作用は、治療遵守の低下や治療中止につながる可能性がある[47]。こうした状況を踏まえ、脂質を低下させる新たな天然物質を単独または既存の医薬品との併用で利用する機会が生まれている。これまで、ベルベリン、緑茶エキス、プロバイオティクスなどの栄養補助食品が血中脂質レベルに与える影響については、多くの研究で評価されてきた[6]。臨床的エビデンスは、一部のプロバイオティクス菌、特にLactobacillaceaeに関連する菌株が脂質プロファイルを改善する有効性を示している[11]。 2017年に専門家グループは、当時入手可能なデータでは、脂質異常症の管理のための代替治療としてプロバイオティクスを推奨できないと述べました[6]。しかし、プロバイオティクスは安全であり、現在までに摂取後に副作用は報告されていません。プロバイオティクスが脂質プロファイルの調節不全を予防する潜在的な効果を排除することはできず、腸内細菌叢と消化機能の複雑な相互作用に関する研究に基づいてさらに調査する必要があります。新しい効率的な脂質低下プロバイオティクス製剤のニーズを満たすために、一部の細菌のコレステロール低下効果をもたらすと提案されているメカニズムに関連するin vitro特性を持つ候補プロバイオティクス株が選ばれました。提案されたすべてのメカニズムの中で、胆汁酸塩加水分解酵素(BSH)およびフェルロイルエステラーゼ(FAE)活性がスクリーニングターゲットとして選ばれました。 |
| タウロ結合コール酸およびグリコ結合コール酸に対する乳酸菌70株のうち、18株が胆汁酸塩のいずれか、または両方に対して胆汁酸塩加水分解酵素(BSH)活性を示した。これは、胆汁酸塩加水分解酵素(BSH)が乳酸菌に普遍的に存在するわけではないこと[48, 49]、また、その基質特異性は大きく異なること[50, 51]を示した他の研究結果とも一致する。本研究では、ほとんどの胆汁酸塩加水分解酵素(BSH)陽性株がタウロコール酸に特異性を示した。L. acidophilus CL1285とL. plantarum CHOL-200は、最も強い胆汁酸塩加水分解酵素(BSH)活性を示しただけでなく、L. casei LBC80R株以外では、グリココール酸とタウロコール酸の両方に対してin vitro活性を示した唯一の株であった。基質の好みを決定するにはさらなる分析が必要ですが、タウリンおよびグリシン抱合胆汁酸を加水分解する能力は、L. acidophilus CL1285およびL. plantarum CHOL-200にとって、ヒトの腸内に存在する多様な胆汁酸塩プールへの適応上の利点を提供することで有益である可能性があります[50]。13のL. plantarum株を胆汁酸塩加水分解酵素(BSH)寒天培地アッセイでテストしました。興味深いことに、L. plantarum CHOL-200のみが胆汁酸塩を加水分解しました。しかし、文献によると、他の多くのL. plantarum株が胆汁酸塩加水分解酵素(BSH)活性を保持しています[49]。ここで紹介する胆汁酸塩加水分解酵素(BSH)陽性株のほとんどは、糞便サンプルから分離されました。これは、たとえば、細菌が消化管内の一部の胆汁酸の毒性作用に抵抗できるようにするなど、腸内細菌叢の形成における胆汁酸塩加水分解酵素(BSH)の重要性と一致しています[50]。O'Flaherty et al. [49]は、Lactobacillusがコードする胆汁酸塩加水分解酵素(BSH)タンパク質が典型的には脊椎動物の消化管に関連していることを示しており、この環境に適応するための選択圧を示唆している。 |
| 26株がフェルロイルエステラーゼ(FAE)活性陽性で、L. acidophilus CL1285が最も強い活性を示した。これらの株は植物、動物、またはヒトから分離されたが、これは植物細胞壁からフェルラ酸(FA)などのフェノール化合物を放出し、食物繊維の消化をサポートするという微生物フェルロイルエステラーゼ(FAE)の機能と一致している。私たちの結果は、すべての乳酸菌がフェルロイルエステラーゼ(FAE)活性を介してフェルラ酸(FA)を生産する能力を持っているわけではないことを示した。これは、テストした33株のうち12株のみがフェルロイルエステラーゼ(FAE)活性を生産できたというLiuらによる以前の研究[52]によって裏付けられている。放出されたフェルラ酸(FA)は、活性酸素種(ROS)を除去する抗酸化物質、天然の抗菌化合物、抗炎症剤としてなど、さまざまな方法で作用することができるため、抗糖尿病分子として重要な役割を果たし、他の多くの望ましい治療効果をもたらす[53]。 |
| フェルロイルエステラーゼ(FAE)および/または胆汁酸塩加水分解酵素(BSH)活性に加え、L. plantarum CHOL-200およびL. acidophilus CL1285は、in vitroにおいてコレステロールを同化する能力を有することが示されました。これは乳酸菌に広く見られる特性です[54]。この能力については複数のメカニズムが提唱されています。コレステロールは細菌の細胞膜に取り込まれるか、乳酸菌の表面に吸着して結合するか、あるいは同化されて細菌の細胞質に直接移行する可能性があります[30, 31, 55]。両株はin vitroの模擬胃環境下でも生存し、胆汁酸存在下で増殖することができます。これらは、プロバイオティクスが消化管を通過し、宿主に有益な効果を発揮するために必須の2つの特性です[44]。 |
| 胆汁酸塩加水分解酵素(BSH)およびフェルロイルエステラーゼ(FAE)の最初の選択は、この in vitro 活性が動物モデルおよびヒトに応用できるという証拠に基づいていました。in vivo 研究では、胆汁酸塩加水分解酵素(BSH)陽性の L. casei F0822 を含む発酵乳を使用して LDL-コレステロール(LDL-C) および総コレステロール (TC)血清値の有意な低下が観察されましたが、胆汁酸塩加水分解酵素(BSH)遺伝子を除去すると効果は見られませんでした [56]。胆汁酸塩を脱抱合し、コレステロールを除去し、NPC1L1 タンパク質レベルを調節する能力について乳酸菌を in vitro スクリーニングした後、動物モデルでの L. plantarum CAAS 18008 によるコレステロール低下効果と相関する胆汁酸塩加水分解酵素(BSH)活性のみが特定されました [57]。胆汁酸塩加水分解酵素(BSH)活性のために選択されたプロバイオティクス株である L. plantarum ECGC 13110402 は、正常、軽度高コレステロール血症、高コレステロール血症の人の 総コレステロール(TC) および LDL-コレステロール(LDL-C)を低下させることが示されました [58, 59]。同様に、フェルラ酸(FA)抽出物の投与はラットのLDL-コレステロール(LDL-C)を低下させることが示されており[27]、さらに最近では、高コレステロール血症患者の総コレステロール(TC)、LDL-コレステロール(LDL-C)、トリグリセリド、およびHDL-コレステロール(HDL-C)に好ましい有意な影響を与えることが示されています[60]。フェルロイルエステラーゼ(FAE)陽性細菌であるL. fermentum CRL1446の補給は、動物モデルにおいてトリグリセリドおよび総コレステロール(TC)レベルを低下させました[61]。さらに、別のフェルロイルエステラーゼ(FAE)陽性株であるL. fermentum NCIMB 5221は、高血糖および高脂血症を呈するラットモデルにおいて、トリグリセリドおよびLDL-コレステロール(LDL-C)、ならびに動脈硬化指数およびアテローム性動脈硬化指数を有意に低下させました[16]。また、L. rhamnosus NCIMB 6375、L. plantarum NCIMB 8826、およびL. fermentum NCIMB 5221のブレンド(L. plantarum NCIMB 8826の胆汁酸塩加水分解酵素(BSH)活性とL. fermentum NCIMB 5221のフェルロイルエステラーゼ(FAE)活性を組み合わせたもの)を投与すると、高脂肪(HF)食ハムスターモデルの総コレステロール(TC)、LDL-コレステロール(LDL-C)、およびトリグリセリドレベルが低下することが示されました[62]。 |
| 提案された作用機序とは無関係に、多くの研究でプロバイオティクス介入が血中脂質プロファイルに有益な影響を与えることが示されています [12, 13, 63, 64]。より具体的には、サブグループ解析では、プロバイオティクス株のL. plantarumまたはL. reuteriの摂取が、高コレステロール血症患者の総コレステロール(TC)およびLDL-コレステロール(LDL-C)の低下に特に効果的であることが示唆されました [12]。他のメタアナリシスでは、L. acidophilusを含むプロバイオティクス製剤が総コレステロール(TC)および/またはLDL-コレステロール(LDL-Cの有意な低下を示しました [13, 63]。しかし、これらのメタアナリシスは、限られた数の特定の株のみを対象とし、時には複数の株を配合した製剤の一部として実施されたものであり、コレステロール値への影響は様々であることから、コレステロール低下効果を種レベルで一般化することはできないことが示唆されています。 |
| L. acidophilus CL1285とL. plantarum CHOL-200の単独または併用投与が、高コレステロール血症ハムスターモデルにおいて血中脂質に及ぼす影響が評価されました(未発表データ)。その結果、L. acidophilus CL1285は非HDL-C濃度を低下させる傾向があり(p = 0.08)、この効果はL. acidophilus CL1285をL. plantarum CHOL-200と併用した場合に顕著になりました(p ≤ 0.05)。さらに、L. acidophilus CL1285株単独投与およびL. plantarum CHOL-200との併用投与は、HDL:コレステロール比を有意に上昇させました(p ≤ 0.05)。L. plantarum CHOL-200の投与では逆の効果を示したことから、非HDL-C濃度とHDL:コレステロール比への影響はL. acidophilus CL1285によって引き起こされていると考えられます。しかし、L. acidophilus CL1285 およびL. acidophilus CL1258 と L. plantarum CHOL-200 の組み合わせで観察される脂質プロファイルの改善が体内で 胆汁酸塩加水分解酵素(BSH)、フェルロイルエステラーゼ(FAE)、両方の活動の組み合わせ、あるいはコレステロールを同化する能力のいずれによるものなのか、正確なメカニズムを解明するにはさらなる分析が必要です。 |
| 要約すると、細菌の複数の脂質低下メカニズム、すなわち胆汁酸塩加水分解酵素(BSH)およびフェルロイルエステラーゼ(FAE)活性を標的としたアプローチにより、L. acidophilus CL1285およびL. plantarum CHOL-200が選択された。両株は、プロバイオティクス特性と複数のコレステロール低下メカニズムに比して高い能力を示し、脂質異常症の管理に適したプロバイオティクス候補と考えられる。さらに、その作用機序は、生体内で様々な治療標的に作用する能力を有する可能性を示唆している。高コレステロール血症ハムスターモデルを用いた生体内アッセイでは、L. acidophilus CL1285単独、およびL. plantarum CHOL-200との併用で、血中非HDL-コレステロール(non-HDL-C)濃度を低下させ、HDL/コレステロール比を改善する能力が実証されたが、L. plantarum CHOL-200単独ではその効果は示されなかった。しかし、この研究で観察されたコレステロール低下効果を裏付ける正確な作用機序を検証し、これらの結果が人間にも当てはまるかどうかを判断するには、さらなる研究が必要となるでしょう。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この文献は、Probiotics and Antimicrobial Proteins (2022) 14:873–883に掲載されたScreening and Characterization of Some Lactobacillaceae for Detection of Cholesterol‑Lowering Activities.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |