ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(アロニア:研究の最前線) |
アロニアは筋原性分化を上方制御し、筋肉代謝を通じて筋肉量と機能を増強します |
Chae-Eun Yun, Hyun-Kyung So et al., |
|
|
| 要約 |
ブラックチョークベリーまたはアロニア (Aronia melanocarpaの果実) は、高血圧、肥満、糖尿病、炎症誘発性状態などのメタボリック シンドロームに対して薬理作用があることが報告されています。 しかし、筋原性分化と筋肉の恒常性に対するアロニアの影響は不明です。 この研究では、若いマウスの筋形成分化と筋代謝機能に対するアロニア (ブラックチョークベリー) の影響を調査しました。 アロニア抽出物 (AR) は筋原性分化を促進し、Akt (訳者注:アポトーシス促進タンパク質の直接阻害、または転写因子によって産生されるアポトーシス促進シグナルの阻害を介して、細胞の生存へ作用する主要なメディエーター)活性化を通じて多核筋管の形成を促進します。 アロニア抽出物は、Akt 活性化によって媒介される筋肉特異的ユビキチンリガーゼの阻害を通じて、デキサメタゾン (DEX) 誘発性筋管萎縮を保護します。 アロニア抽出物による治療により、心肥大のないマウスの筋肉量と筋力が増加します。 アロニア抽出物治療は、ミトコンドリア遺伝子とグルコース代謝関連遺伝子の上昇により、酸化性および解糖性の筋線維と筋肉代謝の両方を強化します。 さらに、アロニア抽出物を与えられた筋線維は、総 OxPHOS (訳者注:酸化的リン酸化. ミトコンドリアにおいて,酸化反応を伴う電子伝達系と共役してリン酸化反応によりATP合成を行う経路のことをいう)およびミオグロビンタンパク質のレベルの増加を示します。 まとめると、アロニア抽出物は筋原性分化を促進し、筋肉量と機能を改善します。これは、アロニア抽出物が筋力低下と萎縮に介入する栄養補助食品として有望な可能性を秘めていることを示唆しています。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.材料と方法 |
| 2.1.試薬 |
| 2.2.アロニアの原料と抽出手順 |
| 2.3.動物研究 |
| 2.4.細胞培養 |
| 2.5ウェスタンブロッティングと免疫染色 |
| 2.6.凍結切片、染色分析、繊維サイズ測定 |
| 2.7.RNAの分離と定量的リアルタイム-PCR |
| 2.8.握力テスト |
| 2.9.統計分析 |
| 3.結果 |
| 3.1.アロニア抽出物は Akt 活性化を通じて筋芽細胞の分化を強化します |
| 3.2.アロニア抽出物は Akt シグナル伝達の活性化を通じて デキサメタゾン誘発性筋管萎縮を保護します |
| 3.3.アロニア抽出物は若いマウスの筋肉量と機能を強化する |
| 3.4.アロニア抽出物は若いマウスの解糖性筋線維と酸化性筋線維の両方を増加させる |
| 3.5.アロニア抽出物は若いマウスの筋肉の酸化代謝と解糖代謝の両方を改善します |
| 4.議論 |
| 5.結論 |
本文 |
| 1.はじめに |
| 加齢に伴い、骨格筋は加齢に伴うサルコペニアと呼ばれる状態に関連して、質量、強度、機能が徐々に低下します(1)。 サルコペニアは、高齢者の虚弱、自立の喪失、身体障害の危険因子です(2)。 骨格筋は健康な若者の体重の約 40% を構成し、体の代謝の健康に寄与しているため、筋肉量と機能の低下は、メタボリックシンドローム、心血管疾患、慢性炎症など二次的な老化関連疾患の発生率に影響を及ぼします。 これらの二次的な病気は筋肉の喪失をさらに悪化させ、罹患率と死亡率の増加に寄与します(5)。 したがって、筋肉量と機能を強化することによるサルコペニアの予防は、高齢者の健康寿命を延ばすために重要であると考えられます。 ミトコンドリア機能や筋再生能力の低下、神経筋機能不全などの複数のメカニズムが、サルコペニアなどのさまざまな筋消耗状態に関与していると考えられています(6-9)。 したがって、ミトコンドリア機能、筋肉再生、運動ニューロン機能を改善することは、さまざまな症状に関連する筋肉の消耗を防ぐために重要です。 筋肉の消耗を防ぐための治療ツールの開発には多くの注意が払われてきましたが、これまでのところ最も効果的な介入は運動であるようです(10)。 運動の主なメカニズムの 1 つは、ペルオキシソーム増殖因子活性化受容体ガンマコアクチベーター 1-アルファ (PGC-1α) と呼ばれる転写コアクチベーターを介してミトコンドリアの生合成と機能を改善することです。 運動や模倣によるミトコンドリア機能の増加は、加齢や除神経などのその他の状態によって引き起こされる筋萎縮や筋力低下を防ぐことができます(11)。 筋幹細胞機能の改善は、運動を介したメカニズムの保護効果とも関連しています (12)。 |
| 筋肉量の制御により直接的に関連する他の経路は、それぞれタンパク質の合成と分解を制御するIGF1/Akt/mTORおよびmyostatin-Smad2/3経路である(13、14)。 さまざまな症状に関連するサルコペニアでは、このタンパク質代謝の不均衡が主要な原因メカニズムの 1 つです (15、16)。 タンパク質合成と比較して過剰なタンパク質分解は、飢餓、脱神経、がん性悪液質、老化などのさまざまな状態に関連した筋萎縮を引き起こします(11、14、17、18)。 2 つの主要なタンパク質分解経路であるプロテアソーム経路とオートファジー - リソソーム経路は、筋萎縮中に活性化され、筋肉量の減少にさまざまに寄与します (19)。 2 つの筋肉特異的 E3 リガーゼ、筋肉 RING フィンガー含有タンパク質 1 (MuRF1) と筋萎縮 F-box タンパク質 (Atrogin-1) は、筋タンパク質分解経路に関連しています (20-22)。 これらの E3 リガーゼは、Forkhead box O3 (FoxO3) などの転写因子によって調節され、さらに Akt シグナル伝達によって負に調節されます (19、22、23)。 一方、Akt/哺乳類ラパマイシン標的 (mTOR) シグナル伝達は、筋肥大につながるタンパク質合成を促進します (24)。 Akt はリン酸化によって FoxO 転写因子の活性を抑制し、その結果として MuRF1 と Atrogin-1 の発現を抑制することができます (25)。 したがって、Akt/mTORシグナル伝達は、FoxOの作用をブロックすることによってタンパク質の分解を弱め、S6Kの活性化を通じてタンパク質の合成を増加させ、筋肥大をもたらします。 |
| ブラックチョークベリーまたはアロニア (Aronia melanocarpaの果実) はバラ科の低木で、北アメリカ原産の植物で、約 1 世紀前にヨーロッパに移されました (4, 26)。 アロニアは伝統的にポタワトミのアメリカ先住民によって風邪の治療に使用されており、強壮剤およびアダプトゲン(訳者注:トラウマ、不安、肉体的疲労などのストレスへの抵抗能力を高める働きのある天然のハーブ)活性としても使用されています(27)。 アロニアは、アントシアニン、フラボノール、フラバノール、プロアントシアニジン、フェノール酸などのフェノール化合物に基づくさまざまな生物活性を持っています (28、29)。 アロニアとその製品には、脂質異常症、高血圧、肥満、糖代謝障害、炎症誘発性状態、血栓症などのメタボリックシンドロームの危険因子の軽減に関連した、健康増進につながる大きな可能性があります(4、30-34)。 さらに、白血病、乳がん、腸がん、がん幹細胞など、さまざまな種類のがんの発生を阻害する効果があることが示されています (33、35)。 この研究では、デキサメタゾン (DEX) によって引き起こされる筋芽細胞の分化と筋管萎縮に対するアロニア抽出物の効果を調査しました。 さらに、マウスの筋肉機能と代謝に対するアロニア抽出物の影響が測定されました。 |
| 2.材料と方法 |
| 2.1.試薬 |
| 野生型 C57BL/6 雄マウスは (Orient-Bio、Seongnam, Korea) から購入しました。 ウシ胎児血清 (FBS)、ウマ血清 (HS)、およびダルベッコ改変イーグル培地 (DMEM) は、Thermo Scientific (Waltham, MA, USA) から購入しました。 3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロミド (MTT)、デキサメタゾン (DEX)、および他のすべての化学物質は Sigma-Aldrich (St. Louis, MO, USA) から入手しました。 抗体は次のように購入しました: ミオシン重鎖 (MHC、Developmental Studies Hybridoma Bank (DSHB)、Iowa, IA, USA) ミオゲニン、ミオグロビン、total-OxPHOS (Abcam、Cambridge, MA, USA)、total-Akt、phospho-Akt 、phospho-mTOR、mTOR、phospho-S6K、S6K (Cell Signaling Technology、Beverly, MA, USA)、MuRF1、Atrogin-1、HSP90 (Santa Cruz Biotechnology、Santa Cruz, CA, USA)、および β-チューブリン (Zymed, South San Francisco, CA, USA)。 |
| 2.2.アロニアの原料と抽出手順 |
| アロニア の新鮮な果実は、2016 年 8 月に韓国忠清北道丹陽郡で収集され、著者の 1 人 (K. H. Kim) によって同定されました。 バウチャー標本 (SKKU AR-2016-08) は、韓国の水原にある成均館大学薬学部の植物標本館に寄託されました。アロニアの乾燥果実 (350 g) を 80% MeOH で 3 日間、室温で 2 回抽出しました。 次いで、抽出物を濾過し、濾液を真空圧下で濃縮して、アロニア抽出物(21.8g)を生成した。アロニア抽出物は使用するまで -20°C で保管されました。 |
| 2.3.動物研究 |
| すべての動物実験は成均館大学医学部 (SUSM) の施設内動物管理および研究諮問委員会によって承認され、施設内倫理委員会の規定に準拠しました。 すべてのマウスを 23℃、12:12 の明暗サイクルで維持し、餌と水を自由に摂取させました。 アロニア抽出物の効果を調べるために、これらのマウスに 1 日量 3.3 mg/kg アロニア抽出物を 8 週間経口投与しました (8 か月齢のマウス)。 対照マウスには、生理食塩水に溶解した同量のビヒクル(ジメチルスルホキシド、DMSO)を投与した。 水を自由に摂取しながら6時間絶食させた後、すべての動物を屠殺した。 |
| 2.4.細胞培養 |
| C2C12 筋芽細胞は以前に記載されているように培養されました (36)。 それらを、15% FBS (増殖培地、GM)、10 単位/ml ペニシリン、および 10 μg/ml ストレプトマイシン (Welgene、Daegu, Korea)、37°C、5% CO2。 C2C12 筋芽細胞の分化を誘導するために、コンフルエント近くの細胞を 2% HS を含む ダルベッコ改変イーグル培地 (分化培地、DM) に増殖培地を交換し、分化後 2 または 3 日で筋管形成を観察しました。 デキサメタゾン誘導性萎縮研究では、C2C12 細胞を ダルベッコ改変イーグル培地中で 3 日間 (D3) 分化誘導し、続いて 100 μM デキサメタゾンとビヒクルジメチルスルホキシドまたはアロニア抽出物でさらに 1 日間 (D4) 処理しました (37)。 |
| 2.5ウェスタンブロッティングと免疫染色 |
| ウェスタンブロット分析は以前に記載されているように実行されました(38)。 簡単に説明すると、完全なプロテアーゼ阻害剤カクテル (Roche Diagnostics、Basel, Switzerland) を含む細胞抽出バッファー (10 mM Tris-HCl、pH 8.0、150 mM NaCl、1 mM エチレンジアミン四酢酸 (EDTA)、および 1% Triton X-100) で細胞を溶解しました。続いてドデシル硫酸ナトリウム - ポリアクリルアミドゲル電気泳動(SDS-PAGE)および一次抗体および二次抗体とインキュベーションしました。 |
| ミオシン重鎖(MHC)発現の免疫染色は以前に記載されているように実行されました (39)。 簡単に説明すると、分化した培養物を、ミオシン重鎖抗体および Alexa 568 結合二次抗体 (Molecular Probes、Eugene, OR, USA) について免疫染色しました。 画像は、Nikon ECLIPSE TE-2000U 顕微鏡および NIS-Elements F ソフトウェア (Nikon, Tokyo, Japan) で取得および処理されました。 筋管形成の効率を分析するために、2 ~ 5 個、または 6 個以上の核を含む ミオシン重鎖陽性筋管を少なくとも 3 回定量化し、ImageJ ソフトウェアを使用して測定しました。 |
| 2.6.凍結切片、染色分析、繊維サイズ測定 |
| 筋肉組織を Tissue-Tek OCT Compound (Sakura Finetek、Nagano, Japan) に包埋し、クライオミクロトームを使用して染色用の厚さ 7 mm の連続切片を切り出しました。 ニコチンアミドアデニンジヌクレオチド(NADH)デヒドロゲナーゼ活性を分析するために、切片にした組織を室温で10分間乾燥させ、3.5 mMリン酸緩衝液(pH)中の0.9 mM NADHおよび1.5 mM ニトロブルーテトラゾリウム(NBT; Sigma-Aldrich)中でインキュベートしました。 7.4)30分間。 コハク酸デヒドロゲナーゼ (SDH) 活性を分析するために、K-EGTA (Sigma-Aldrich) を含む 114 mM リン酸緩衝液中の 50 mM コハク酸ナトリウムおよび 0.3 mM ニトロブルー テトラゾリウム中で切片を 30 分間インキュベートしました。 グリセロール-3-リン酸デヒドロゲナーゼ(GPDH)活性を分析するために、乾燥組織サンプルを使用し、それらをリン酸ナトリウム緩衝液(pH 7.4)中の1.2 mM NBT、2 mM フェナジンメト硫酸、および1.86 mM グリセロールリン酸中で40分間インキュベートしました。 |
| 筋肉組織切片の Myh 免疫染色は、固定、透過、および MyhIIa および MyhIIb (DSHB) およびラミニン (Abcam) に対する一次抗体とのインキュベーションの順序で実行されました。 画像は、NIS-Elements F ソフトウェアを使用して Nikon ECLIPSE TE-2000U でキャプチャされました。 筋線維面積はImageJソフトウェアで測定した。 筋肉の組織学のために、凍結切片をメイヤーのヘマトキシリンおよびエオシン(BBC Biomedical、McKinney、TX、USA)で染色した。 画像はNikon ECLIPS TE-2000Uを使用して撮影されました。 |
| 2.7.RNA の分離と定量的リアルタイム-PCR |
| 総 RNA 抽出と定量的リアルタイム (RT)-PCR分析は、以前に記載されているように実行されました (40)。 組織を FastPrepR-24 (MP Biomedicals、Santa Ana, CA, USA) でホモジナイズし、イージースピン Total RNA 抽出キット (iNtRON、Seongnam, Korea) を使用して抽出しました。 遺伝子発現倍率変化は、18S リボソーム RNA の発現に対して正規化されました。 この研究で使用したプライマーの配列を表 1 に示します。 |
| 表 1 この研究で使用したプライマー |
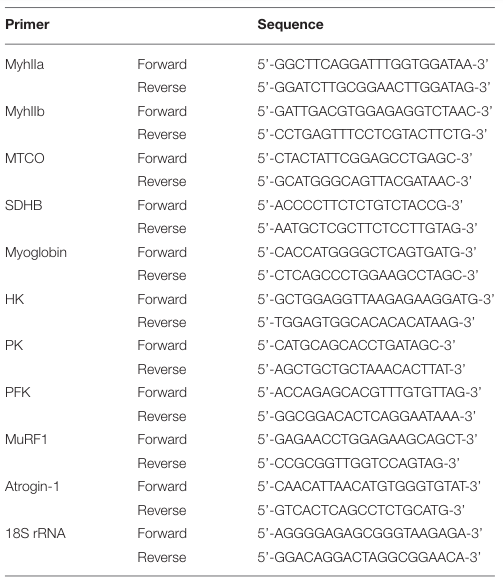 |
| 2.8.握力テスト |
| 握力は握力計(Bioseb、Pinellar Park, FL, USA)を使用して測定しました。 ブラインドテストにより、動物に前肢と後肢でグリッドを掴ませました。 前肢がグリッドから外れるまで、四肢を一定の力でゆっくりと引っ張ります。 最大強度はグリッドを取り外したときに記録されました。 各動物は 3 回の試験でテストされました。 |
| 2.9.統計分析 |
| 図の凡例に示すように、値は、in vitroの場合は平均±SD、またはin vivoの場合は±SEMとして表されます。 統計的有意性は、スチューデントの t 検定 (対応のない両側)、または多重比較のための事後テューキー検定による ANOVA のいずれかを使用して計算されました。 差異は、P < 0.05 の値以下で統計的に有意であるとみなされました。 |
| 3.結果 |
| 3.1.アロニア抽出物は Akt 活性化を通じて筋芽細胞の分化を強化します |
| 筋原性分化に対するアロニア抽出物の効果を調べるために、ジメチルスルホキシド中0.1〜1μg/mlの範囲の示された濃度のビヒクルジメチルスルホキシドまたはアロニア抽出物の存在下で、C2C12筋芽細胞の分化を3日間(D3)誘導した。 そして、イムノブロッティング分析による筋芽細胞の分化の評価を受けました。 アロニア抽出物による処理により、ミオシン重鎖およびミオゲニンの発現レベルが用量依存的に増加し、0.2 ~ 0.4 μg/ml の濃度でピークに達しました (図 1A)。 より高い アロニア抽出物濃度でのこのわずかな減少は、3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾリウムブロミド (MTT)アッセイで評価したところ、細胞毒性によるものではありませんでした (図 1B)。 アロニア抽出物媒介筋原性促進の分子調節経路を調査するために、C2C12 筋芽細胞を 0.1、0.3、および 1.0 μg/ml の濃度のアロニア抽出物で 48 時間処理しました。 細胞溶解物は、前筋原性キナーゼ Akt の活性化状態を評価するために、活性リン酸化 Akt (pAkt) のイムノブロッティング分析に供されました。 アロニア抽出物、特に 0.3 μg/ml 濃度での処理により、総 Akt タンパク質レベルは変化せずに pAkt レベルが増加しました (図 1C、D)。 さらに、アロニア抽出物処理は、Akt の下流標的である mTOR のリン酸化を用量依存的に誘導しました (図 1C、D)。 これらの結果は、アロニア抽出物が Akt 活性化を強化して筋原性分化を促進することを示しています。 |
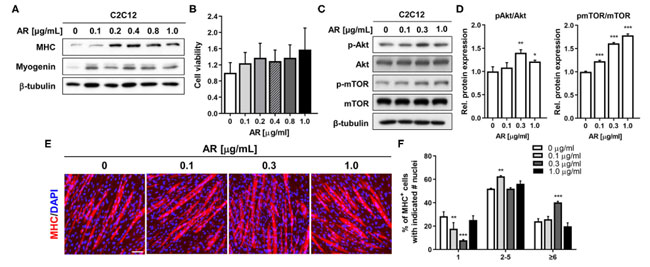 |
図1 アロニア抽出物は、細胞毒性を持たずに C2C12 細胞の筋芽細胞の分化を促進します (A) C2C12 筋芽細胞は、ジメチルスルホキシドまたは DM 中の指定濃度の アロニア抽出物の存在下で 3 日間分化誘導されました。 溶解物は、筋肉特異的タンパク質、ミオシン重鎖、ミオゲニン、β-チューブリンをローディングコントロールとして使用したイムノブロッティング分析に供されました。 実験を 3 回繰り返しましたが、同様の結果が得られました。 (B) 細胞生存率は MTT アッセイで測定されました。 (C) D3 のビヒクルまたは アロニア抽出物で処理した、リン酸化型 Akt および総 Akt および負荷対照としての β-チューブリンの発現に関する C2C12 細胞の免疫ブロット分析。 (D) パネル C に示すように同様に実行された 3 つの実験からのブロットの定量化。 pAkt および pmTOR のシグナル強度を定量化し、その値をそれぞれ総 Akt および mTOR に対して正規化しました。 (E) ミオシン重鎖 発現の免疫染色 (赤) および核を視覚化するための DAPI (青) 染色。 C2C12筋芽細胞を、ジメチルスルホキシドまたはDM中の指定濃度のアロニア抽出物の存在下で3日間分化誘導した。 スケールバー: 50 μm。 (F) パネル E に示されている ミオシン重鎖陽性筋細胞は、筋管あたりの核の数として定量化されました。 Tukey 検定による一元配置 ANOVA 分析。 データは平均値 ± SD を表します。 *P < 0.05 および **P < 0.01。 AR、アロニア抽出物; DMSO、DM、分化培地; MHC、ミオシン重鎖; DAPI.。 |
| アロニア抽出物の筋形成促進効果を確認するために、ミオシン重鎖免疫染色によって筋管形成を評価しました。 その結果、C2C12 筋芽細胞における アロニア抽出物処理は、対照細胞と比較して、より大きな ミオシン重鎖陽性多核筋管の形成を誘発しました (図 1E)。 筋管形成を定量化するために、ミオシン重鎖陽性筋細胞を単核、2 ~ 5 個の核を含む筋管、または 6 個以上の核を含む筋管として計数し、パーセンタイルとしてプロットしました (図 1F)。 アロニア抽出物による治療は、単核筋細胞の割合を減少させましたが、6 個以上の核を含む大きな筋管の割合を用量依存的に実質的に増加させました。 我々の現在のデータは、形態学的および生化学的レベルで筋芽細胞の分化に対する アロニア抽出物 のプラスの効果をさらに裏付けています。 アロニア抽出物は、明白な細胞毒性を伴わずに、Akt 活性化を通じて筋形成促進効果を発揮できます。 |
| 3.2.アロニア抽出物は Akt シグナル伝達の活性化を通じて デキサメタゾン誘発性筋管萎縮を保護します |
| 合成グルココルチコイドデキサメタゾンは、筋特異的なユビキチンリガーゼの発現を誘導し、筋管径の減少を伴う筋萎縮表現型に寄与します (37)。 Akt の活性化は、デキサメタゾンによって引き起こされる筋特異的ユビキチンリガーゼの誘導と筋萎縮を抑制する重要なイベントの 1 つです (25)。 アロニア抽出物はAktを活性化できるため、デキサメタゾン誘発性C2C12筋管萎縮に対する0.1または1.0μg/mlの濃度でのアロニア抽出物の効果を調べた。 C2C12細胞をDM中で3日間(D3)分化誘導し、その後さらに1日間(D4)溶媒ジメチルスルホキシドまたはアロニア抽出物とともにデキサメタゾンで処理した(図2A)。 次いで、筋管の厚さを調べるために、筋管を ミオシン重鎖 免疫染色に供しました。 デキサメタゾン誘発筋管萎縮による治療は アロニア抽出物治療により抑制されましたが、アロニア抽出物治療培養物中に大きな多核筋管が存在することから明らかでした (図 2B)。 筋管径の定量化により、デキサメタゾン治療により筋管径の減少が引き起こされ、アロニア抽出物治療により大幅に回復したことが明らかになりました (図 2C)。 さらに、qRT-PCR 分析では、デキサメタゾン治療により筋肉特異的な E3 ユビキチンリガーゼ、筋肉 RING フィンガー含有タンパク質 1 (MuRF1)、およびアトロジン-1 が大幅に上昇し、アロニア抽出物治療によりこの誘導が減弱されたことが示されました (図 2D)。 さらに定義するには、筋肉特異的タンパク質とユビキチンリガーゼのタンパク質レベルをイムノブロッティング分析によって測定しました。 qRT-PCR の結果と一致して、デキサメタゾン処理筋管におけるアロニア抽出物による処理は、対照と比較して 筋肉 RING フィンガー含有タンパク質 1 (MuRF1) および Atrogin-1 タンパク質のレベルを減少させました (図 2E、F)。 デキサメタゾンの治療により ミオシン重鎖タンパク質レベルの低下が誘発され、デキサメタゾンと アロニア抽出物の同時治療により筋管における ミオシン重鎖タンパク質の減少が軽減されました。 さらに、デキサメタゾン処理筋管は pAkt レベルの低下を示しましたが、デキサメタゾン処理筋管における アロニア抽出物治療はこの減少を無効にしました。 総合すると、これらの結果は、アロニア抽出物が、Akt 活性化によって媒介される筋肉特異的ユビキチンリガーゼの阻害を通じて デキサメタゾン誘発性筋管萎縮を保護することを示唆しています。 |
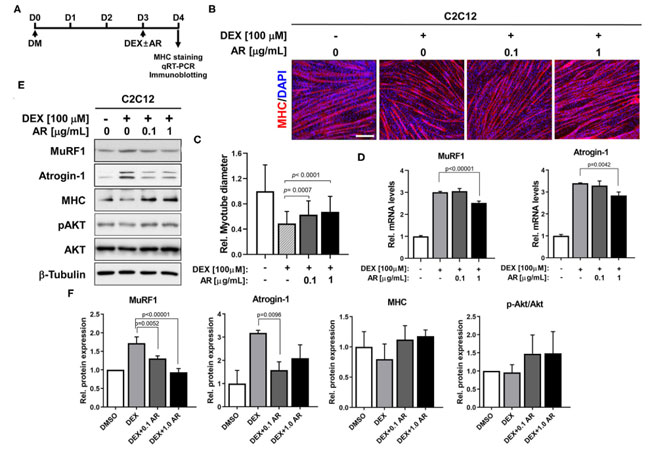 |
図2 アロニア抽出物は デキサメタゾンによる筋萎縮を防ぎます。 (A) 萎縮研究の手順図。 (B) ミオシン重鎖発現の免疫染色 (赤) および核を視覚化するための DAPI (青) 染色。 C2C12筋芽細胞をDM中で3日間分化誘導し、ビヒクルジメチルスルホキシドまたはデキサメタゾンを含む指定濃度のアロニア抽出物で処理した。 スケールバー、60μm。 (C) パネル B の相対直径を定量化し、デキサメタゾン誘発筋萎縮による アロニア抽出物の効果を示しました。 N = 123 筋管/各サンプル。 (D)ビヒクルまたはデキサメタゾン処理アロニア抽出物のC2C12細胞における筋肉 RING フィンガー含有タンパク質 1 (MuRF1)およびアトロジン-1の発現に関するqRT-PCR分析。 (E) ミオシン重鎖、筋肉 RING フィンガー含有タンパク質 1 (MuRF1)、アトロジン-1、pAktおよびAkt、ならびにD3についてビヒクルまたはデキサメタゾン処理アロニア抽出物で処理した負荷対照としてのβ-チューブリンの発現についてのC2C12細胞の免疫ブロット分析。 (F) パネル E に示すように同様に実行された 3 つの実験からのブロットの定量化。 筋肉 RING フィンガー含有タンパク質 1 (MuRF1)、Atrogin-1、および ミオシン重鎖のシグナル強度を定量化し、値を β-チューブリンに対して正規化しました。 pAkt のシグナル強度を定量化し、総 Akt に対して正規化しました。 Tukey 検定による一元配置 ANOVA 分析。 AR、アロニア抽出物; DEX、デキサメタゾン。 MHC、ミオシン重鎖; DAPI. |
| 3.3.アロニア抽出物は若いマウスの筋肉量と機能を強化する |
| 筋肉に対する アロニア抽出物の in vivo 効果を評価するために、生後 8 か月のマウスに対照またはアロニア抽出物を 8 週間与えた後、筋肉の機能分析と生検を行いました。 アロニア抽出物を摂取したマウスの後肢の筋肉は、対照を与えたマウスの後肢の筋肉よりも暗く見えました。これは、5 つの後肢の筋肉グループのうち、腓腹筋 (GAS) 、ヒラメ筋 (SOL)、前脛骨筋 (TA)、長趾伸筋 (EDL)、大腿四頭筋 (QU) など筋肉で容易に検出できます。 アロニア抽出物治療は、ビヒクル治療グループと比較して、体重を軽度ではあるが有意に増加させました (図 3B)。 4 つの後肢筋肉のうち、ヒラメ筋 (SOL)および 長趾伸筋 (EDL)筋肉の重量は、ビヒクル給餌マウスと比較して、アロニア抽出物給餌マウスではそれぞれ約 20.0 および 15.3% 増加しました (図 3C)。 心臓の質量はわずかに減少しましたが、肝臓の質量は変化しませんでした (図 3D)。 筋肉を採取する1週間前に、握力を測定することによって筋力を検査した。 アロニア抽出物を与えられたマウスは、対照マウスと比較して握力が約 14.5% 増加しました (図 3E)。 これらのデータを総合すると、アロニア抽出物治療は心筋に対する明らかな肥大効果なしに筋肉量と機能を改善することを示唆しています。 |
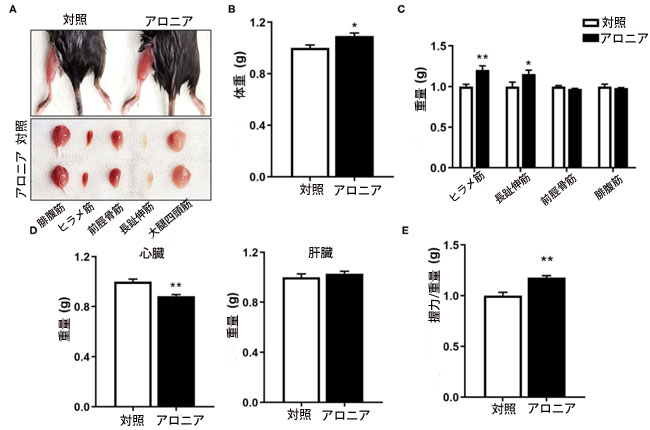 |
図3 アロニア抽出物は筋肉量と筋力を強化します。 (A) 対照または 3.3 mg/kg アロニア抽出物を 8 週間摂取した生後 8 か月のマウスの後肢から分離した筋肉タイプの写真。 (B) 8 週間の対照給餌および アロニア抽出物給餌の 8 か月齢マウスの体重。 (C、D) 対照マウスまたは 3.3 mg/kg アロニア抽出物を 8 週間摂取したマウスの (C) 4 つの筋肉タイプと (D) 心臓および肝臓の重量、n = 3。 (E) 各グループの動物が引っ張った力 (グラム) として示される握力、n = 5。 スチューデントの t 検定 (対応のない両側)。 データは平均 ± SEM、*P < 0.05 および **P < 0.01 を表します。 |
| 3.4.アロニア抽出物は若いマウスの解糖性筋線維と酸化性筋線維の両方を増加させる |
| 筋肉の詳細な組織学を調べるために、対照および アロニア抽出物処理した前脛骨筋 (TA)筋肉を凍結切片にし、ヘマトキシリンおよびエオシン染色を行った後、筋線維の断面積を測定しました (図 4A、B)。 アロニア抽出物治療を受けた筋肉は、対照治療を受けた筋肉と比較して、より大きな筋線維を持っていました。 筋線維タイプに対する アロニア抽出物の効果を調べるために、解糖性筋線維タイプ IIb (MyhIIb )および 筋線維タイプ IIa (MyhIIa) に対する抗体を用いた免疫染色によって筋肉切片を分析しました (図 4C)。 アロニア抽出物治療は、ビヒクル治療と比較して、より大きな筋線維タイプ IIa (MyhIIa) および 解糖性筋線維タイプ IIb (MyhIIb )陽性筋線維へのシフトを誘発しました (図 4D、E)。 一貫して、アロニア抽出物処理した筋肉の qRT-PCR 分析では、対照筋肉と比較して、筋線維タイプ IIa (MyhIIa)および解糖性筋線維タイプ IIb (MyhIIb )の発現が上昇していました (図 4F)。 これらのデータは、アロニア抽出物治療が筋線維タイプ IIa (MyhIIa)筋と 解糖性筋線維タイプ IIb (MyhIIb )筋を強化することを示唆しています。 |
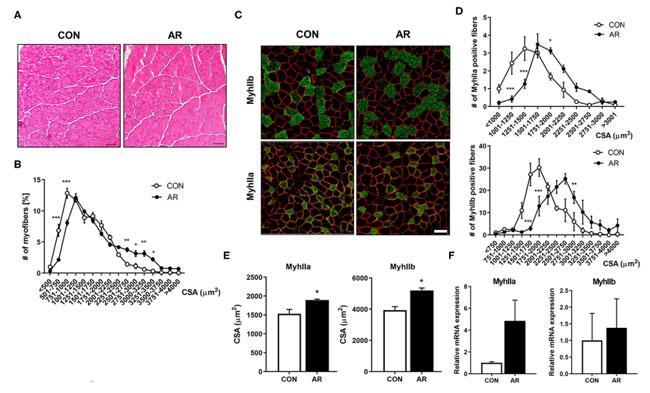 |
図4 アロニア抽出物は、筋線維タイプ IIa (MyhIIa)および 解糖性筋線維タイプ IIb (MyhIIb )陽性のより大きな筋線維の形成を誘導します。 (A) 対照または 3.3 mg/kg アロニア抽出物を 8 週間摂取した生後 8 か月のマウスの前脛骨筋 (TA)の組織学的染色。 H&E 染色は構造の回復を示します。 スケールバー、50μm。 (B) 前脛骨筋 (TA)における総筋線維の断面積の定量化。 (C) 対照マウスまたは 3.3 mg/kg アロニア抽出物を 8 週間摂取したマウスの 前脛骨筋 (TA)における 解糖性筋線維タイプ IIb (MyhIIb )(緑色)、筋線維タイプ IIa (MyhIIa)(緑色)、およびラミニン (赤色) の免疫染色。 スケールバー、50μm。 (D、E) パネル (C) の解糖性筋線維タイプ IIb (MyhIIb )および筋線維タイプ IIa (MyhIIa) 陽性筋線維の定量化 (n = 3)。 (F) 対照マウスまたは 3.3 mg/kgアロニア抽出物を 8 週間摂取したマウスの 前脛骨筋 (TA)における 筋線維タイプ IIa (MyhIIa)および 解糖性筋線維タイプ IIb (MyhIIb )の発現に関する qRT-PCR 分析 (n = 3)。 スチューデントの t 検定 (対応のない両側)。 データは平均±SEM、*P < 0.05、**P < 0.01、***P < 0.001を表します。 AR、アロニア抽出物; TA、前脛骨筋。 |
| 3.5.アロニア抽出物は若いマウスの筋肉の酸化代謝と解糖代謝の両方を改善します |
| 筋線維は異なる代謝特性を持っています。 筋線維タイプ IIa は、解糖性筋線維タイプ IIb と比較して、ミトコンドリア含有量が高くなります (41、42)。 アロニア抽出物は 筋線維タイプ IIa (MyhIIa)と 解糖性筋線維タイプ IIb (MyhIIb )の両方の発現を実質的に上昇させたので、次に、筋肉の酸化代謝についてはコハク酸デヒドロゲナーゼ (SDH)およびニコチンアミドアデニン ジヌクレオチド テトラゾリウム レダクターゼ (NADH-TR) の活性を測定し、解糖代謝についてはグリセロール-3-リン酸デヒドロゲナーゼ(GPDH)の活性を測定することにより、筋肉の代謝を調べました。 筋線維タイプの染色と一致して、アロニア抽出物治療は、対照筋肉と比較して、コハク酸デヒドロゲナーゼ (SDH)、ニコチンアミドアデニン ジヌクレオチド テトラゾリウム レダクターゼ (NADH-TR)、および グリセロール-3-リン酸デヒドロゲナーゼ(GPDH)に対して強い (暗い) 活性を持つ筋線維の割合を上昇させました (図 5A、B)。これは、アロニア抽出物が酸化的筋代謝と解糖系筋代謝の両方を強化することを示しています。一貫して、アロニア抽出物 処理した筋肉は、コントロールの筋肉と比較して、ミトコンドリア遺伝子 (MTCO1、Sdhb)、ミオグロビン、および糖代謝関連遺伝子 [ヘキソキナーゼ (HK)、ピルビン酸キナーゼ (PK)、ホスホフルクトキナーゼ (PFK)] の発現レベルが高かった ( 図5C、D)。 さらに確認するために、大腿四頭筋 (QU)組織における総 OXPHOS [ATP5A (CV)、MTCO1 (CIII)、SDHB (CII) および NDUF88 (CI)] タンパク質、ミオグロビン、および S6K のタンパク質レベルを調べました。 RNA 発現データと一致して、アロニア抽出物処理した筋肉では、総 OXPHOS(訳者注:酸化的リン酸化.ミトコンドリアにおいて,酸化反応を伴う電子伝達系と共役してリン酸化反応によりATP合成を行う経路のことをいう)、ミオグロビン、およびリン酸化 S6K タンパク質のレベルが上昇しました (図 5E、F)。 これらのデータは、アロニア抽出物が筋肉特異的遺伝子およびミトコンドリア成分などの筋肉代謝遺伝子の発現を増強することを示唆しています。 |
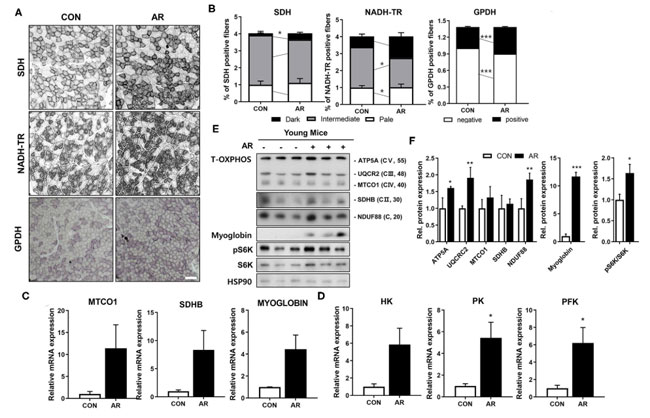 |
図5 アロニア抽出物は若いマウスの筋肉代謝を増加させます。 (A) 前脛骨筋(TA )における コハク酸デヒドロゲナーゼ (SDH)、コチンアミドアデニンジヌクレオチドテトラゾリウムレダクターゼ(NADH-TR )、および グリセロール-3-リン酸デヒドロゲナーゼ(GPDH)酵素活性の組織化学的染色。 スケールバー、50μm。 (B) コハク酸デヒドロゲナーゼ (SDH)および ニコチンアミドアデニンジヌクレオチドテトラゾリウムレダクターゼ(NADH-TR )の染色強度は 3 つの異なるグレード (濃い、中間、薄い) として定量化され、パーセンタイル (n = 3) としてプロットされます。対応のない両側スチューデントの t 検定。 (C) 前脛骨筋(TA )筋におけるミトコンドリア遺伝子 (MTCO1、SDHB) およびミオグロビンの発現に関する 定量リアルタイム-PCR 分析。 (D) 前脛骨筋(TA )における糖代謝関連遺伝子の発現に関する定量リアルタイム-PCR分析。 対応のない両側学生の t 検定。 (E) 大腿四頭筋 (QU)における Total-OXPHOS、ミオグロビン、および S6K の発現に関するイムノブロッティング分析。 (F) パネル E からの総 OXHOS タンパク質のレベルの定量化、n = 3。 スチューデントの t 検定 (対応のない両側)。 データは平均値 ± SEM (n = 3) を表します。 *P < 0.05、**P < 0.01、***P < 0.001。 AR、アロニア抽出物; TA、前脛骨筋。 SDH、コハク酸デヒドロゲナーゼ。 GPDH、グリセロール-3-リン酸デヒドロゲナーゼ。 NADH-TR、ニコチンアミドアデニンジヌクレオチドテトラゾリウムレダクターゼ。 |
| 4.議論 |
| 病的状態や老化過程における筋肉量と機能を改善するための効果的な薬理学的サプリメントの発見には多くの注意が払われてきました。 筋肉生物学の最近の進歩により、筋萎縮や筋力低下を防ぐための薬理学的または栄養補助食品の治療に新たな関心が集まりました。 この研究では、マウスの筋原性分化と筋肉機能に対する アロニア抽出物の影響を調査します。 我々の結果は、アロニア抽出物が明白な細胞毒性を伴わずにAkt活性化を介して筋芽細胞の分化と多核筋管の形成を誘発することを実証しています。 デキサメタゾン誘発性の萎縮性筋管における アロニア抽出物の治療は、おそらく Akt 活性化によって媒介される、筋肉特異的なユビキチンリガーゼの抑制を通じて筋管形成を回復します。 さらに、アロニア抽出物治療は、心筋に対する明白な肥大効果を引き起こすことなく、筋肉特異的遺伝子および筋肉代謝遺伝子の発現を高めることにより、筋肉量と機能を改善します。 |
| 筋芽細胞の分化は、筋芽細胞の増殖とその後の細胞周期停止によって開始され、その後、筋肉特異的遺伝子の発現や筋芽細胞融合による多核筋線維の形成などの分化プログラムが続きます(43)。 筋芽細胞の分化に関与するとされる多様なシグナル伝達経路の中で、Akt は筋芽細胞の分化の誘導と筋管肥大に関連する筋タンパク質合成において重要な役割を果たします (24)。 Akt はセリン/スレオニン - プロテイン キナーゼであり、筋芽細胞の分化中に活性化されます。 Akt の過剰発現は筋原性分化を促進しますが、Akt のドミナントネガティブ型は Akt 活性化を阻害し、筋管形成を防ぎます。 さらに、構成的活性型の Akt の異所性発現は、PI3K の阻害を通じて筋芽細胞分化の阻害を回復することができます (44)。 さらに、Akt は PI3K/Akt/mTOR シグナル伝達において重要な役割を果たし、エネルギー代謝とタンパク質合成の調節に寄与します。 骨格筋肥大を制御する Akt/mTOR シグナル伝達の 2 つの主要な下流標的タンパク質は、p70S6K と eIF4E 結合タンパク質 1 (4EB-BP1) であり、タンパク質合成の上方制御につながります。 FoxO 転写因子は、筋肉特異的な E3 ユビキチン リガーゼ、MuRF1、および Atrogin-1 の活性化を制御します (22、37)。 特に、Akt/mTORシグナル伝達は、タンパク質異化に関与するFoxO転写因子および筋肉特異的ユビキチンリガーゼの抑制により、正味のタンパク質蓄積を増強します(15、16、22)。 Akt は FoxO 転写因子のリン酸化を誘導し、リン酸化された FoxO タンパク質を核から排除することで FoxO の転写機能を阻害します。 FoxO 転写機能の Akt 媒介制御は、筋芽細胞の分化プロセスに関与しています (45)。 タンパク質代謝の不均衡に加えて、筋肉幹細胞の再生能力の低下は、加齢やさまざまな筋肉疾患による筋肉量と機能の低下にも密接に関連しています(10)。 我々の現在の結果は、アロニア抽出物が筋幹細胞の再生能力とAktに依存したタンパク質合成を促進し、筋肉量と筋力の向上に寄与する可能性があることを裏付けています(図6)。 |
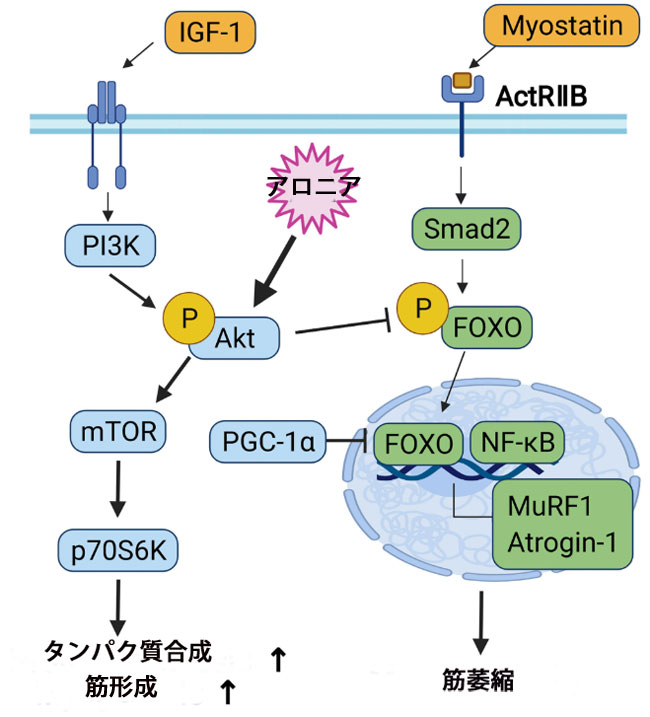 |
| 図6 筋芽細胞の分化とタンパク質代謝に関係するシグナル伝達経路の図 |
| ペルオキシソーム増殖因子活性化受容体ガンマコアクチベーター 1 アルファは、ミトコンドリア生合成の転写制御を支配する制御ネットワークにおいて中心的な役割を果たしています。 PGC-1α は、ミトコンドリア生合成、脂肪酸酸化の刺激、血管新生、筋萎縮に対する抵抗性に関与する遺伝子など、運動に関連する遺伝子の発現を誘発します (46)。 ニコチンアミドアデニンジヌクレオチド(NADH)と コハク酸デヒドロゲナーゼ (SDH)はミトコンドリアのクエン酸回路に関与します。 ニコチンアミドアデニンジヌクレオチドテトラゾリウムレダクターゼ(NADH-TR )反応は、筋原線維間マトリックスと呼ばれる筋原線維間の空間を評価するために使用される組織化学反応です。 この反応は、ミトコンドリア内の酵素 (NADH デヒドロゲナーゼ) または小胞体内の酵素 (NADH シトクロム b5 レダクターゼ) によって触媒されます。 コハク酸デヒドロゲナーゼ (SDH)はミトコンドリアに特異的な反応で、通常はミトコンドリア筋症のスクリーニングに使用されます。 ニコチンアミドアデニンジヌクレオチドテトラゾリウムレダクターゼ(NADH-TR )反応性はミトコンドリアまたは小胞体の酵素の活性化を意味しますが、コハク酸デヒドロゲナーゼ (SDH) 反応性はミトコンドリアに特有の酵素の活性化を意味します。 グルコース 6-リン酸デヒドロゲナーゼ (GPDH) は還元的生合成のマーカーです。 ミトコンドリア GPDH はミトコンドリア呼吸鎖の不可欠な構成要素であり、グリセロリン酸 (GP) シャトルの律速段階として機能します。 ミトコンドリア GPDH 発現は、C2C12 筋芽細胞分化の過程で大幅に増加し、その発現プロファイルはミオゲニンおよび ミオシン重鎖と同様でした (47-49)。 具体的には、CaMKKβ/AMPKを介してミトコンドリア生合成を制御することにより、筋原性マーカーと筋芽細胞の分化を調節します。 ミトコンドリア GPDH-/- は、in vitro および in vivo で骨格筋再生を減弱させますが、ミトコンドリア GPDH の過剰発現は、mdx マウスのジストロフィー性病状を改善します。 筋原性分化の調節におけるミトコンドリア生合成は、筋肉再生障害および筋肉病理を改善するための潜在的な治療標的として注目されています。 我々の結果では、Aアロニア抽出物は酸化筋線維(MyhIIa)と解糖筋線維(MyhIIb)の両方の増加を誘導し、ミトコンドリア成分を含む筋肉代謝遺伝子の発現を増強します。 |
| アロニアの果実は、アントシアニン、フラボノイド、ウルソール酸、アセチルウルソール酸、オレアノール酸などのさまざまな成分で構成されています (28、50、51)。 これらの成分は、筋肉量、速筋、遅筋の線維サイズ、筋力の増加に関与していると考えられています (52-54)。 アロニアの主成分の 1 つであるウルソール酸による治療は、筋肉のインスリン/IGF-I シグナル伝達を強化し、萎縮に関連する筋肉の mRNA 発現を阻害することにより、マウスの筋肉量を増加させます (52)。 Akt は IGF-1 の主要な下流シグナル伝達成分であるため、これは我々の現在のデータと一致しています。 機能的側面については言及されていないが、別の研究では、アロニアの効果は筋タンパク質合成を増加させることなく、レジスタンス運動に応じたmTORC1活性化を通じて発揮される可能性があると提案されている(50)。 アロニアが筋肉量と筋力に有益な効果を及ぼす制御機構を明らかにするには、さらなる研究が必要です。 私たちの現在の研究は、アロニア治療がミトコンドリア遺伝子とグルコース代謝関連遺伝子の発現増加により、酸化代謝酵素と解糖代謝酵素の両方の活性を上方制御することも示しています(図5)。 |
| 5.結論 |
| 私たちの研究は、アロニア抽出物がAkt活性化を通じて筋原性分化を促進し、Akt活性化を通じてデキサメタゾン誘発性筋管萎縮を保護し、それにより筋肉特異的ユビキチンリガーゼの発現を抑制することを実証しています。 さらに、アロニア抽出物治療は、筋肉特異的遺伝子と筋肉代謝遺伝子が上方制御された解糖性筋線維と酸化性筋線維の両方の発現を増加させ、筋肉量と筋力を改善します。 したがって、骨格筋萎縮に対する治療法が現在不足していることを考慮すると、アロニア抽出物は筋力低下と萎縮に介入する栄養補助食品として有望な可能性があると考えられます。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Front Nutr. 2021; 8: 753643.に掲載されたAronia Upregulates Myogenic Differentiation and Augments Muscle Mass and Function Through Muscle Metabolism.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


