ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(アロニア:研究の最前線) |
選択された 8 つのベリー抽出物からのブラックチョークベリー (アロニア メラノカルパ) の高度な糖化最終産物形成に対する新規阻害効果とそれに対応するメカニズムの研究 |
Hui Tan,Baoyue Cui et al., |
|
|
| 要約 |
多くの健康被害が終末糖化生成物 (AGE) に関連しています。 この研究では、ウシ血清アルブミン-フルクトース、ウシ血清アルブミン-メチルグリオキサール (MGO)、および ウシ血清アルブミン-グリオキサール (GO) を含む反応モデルを使用して、終末糖化生成物形成に対する 8 つの異なるベリー種の抗糖化能を調べました。 我々の結果は、ブラックチョークベリー (Aronia melanocarpa) が最も高い阻害効果を示し、IC50 値がそれぞれ 0.35 ± 0.02、0.45 ± 0.03、および 0.48 ± 0.11 mg/mL であることを示しています。 さらに、我々の発見は、ブラックチョークベリーがウシ血清アルブミンと結合することで終末糖化生成物形成を阻害し、立体構造の変化を緩和し、タンパク質の架橋を防ぎ、反応性のα-ジカルボニルを捕捉して付加物を形成することを示唆している。 特に、ブラックチョークベリー由来のシアニジン-3-O-ガラクトシド、シアニジン-3-O-アラビノシド、プロシアニジン B2 を含む 3 つの主要なポリフェノールは、ウシ血清アルブミン-メチルグリオキサール (MGO)、/ウシ血清アルブミン-グリオキサール (GO) 捕捉に対して顕著な阻害効果を示し、新しい付加物の形成が LC-MS/MS分析 によって確認されました。 要約すると、私たちの研究は、潜在的な抗糖化効果を持つ天然の機能性食品成分としてベリー、特にブラックチョークベリーを使用するための理論的根拠を提供します。 |
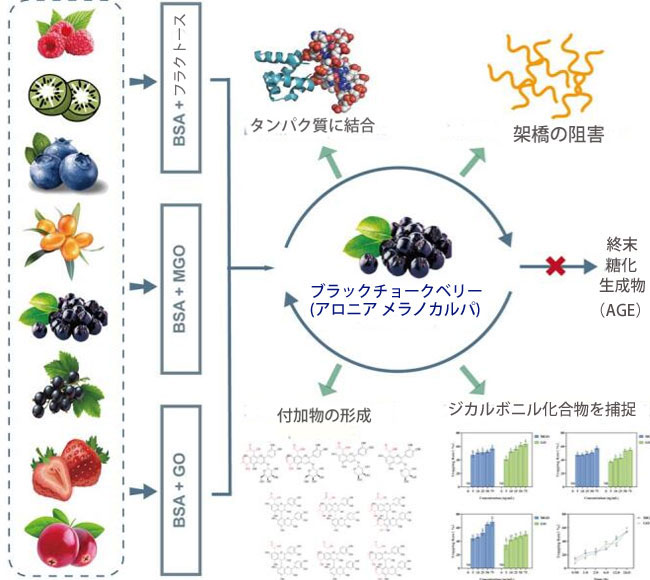 |
| 要約の図解 |
| BSA:牛血清アルブミン、GO:グリオキサール、MGO:メチルグリオキサール |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.材料と方法 |
| 2.1.化学薬品 |
| 2.2.ベリー抽出物の調製 |
| 2.3.ベリー抽出物の化学分析 |
| 2.4. 牛血清アルブミン-フルクトースおよび牛血清アルブミン-メチルグリオキサール/グリオキサールモデルにおける抗糖化分析 |
| 2.5.ベリー抽出物の抗酸化活性の測定 |
| 2.6.蛍光分光法と同期蛍光分光法 |
| 2.7.円二色性 (CD) 分光法 |
| 2.8.ドデシル硫酸ナトリウム - ポリアクリルアミドゲル電気泳動分析 |
| 2.9.α-ジカルボニル含量の定量 |
| 2.10.メチルグリオキサールおよび グリオキサール捕捉能力の決定 |
| 2.11.UPLC-Q-TOF-MS を使用した メチルグリオキサールまたは グリオキサール 付加物の同定 |
| 2.12.統計分析 |
| 3.結果と考察 |
| 3.1.さまざまな反応モデルにおける終末糖化生成物の形成に対するベリー抽出物の影響 |
| 3.2.さまざまなベリー抽出物の化学組成と抗酸化活性 |
| 3.3.牛血清アルブミンの蛍光スペクトルに対するブラックチョークベリー抽出物の影響 |
| 3.4.タンパク質の架橋と二次構造に対するブラックチョークベリー抽出物の影響 |
| 3.5.メチルグリオキサール/グリオキサールにおけるブラックチョークベリーエキスの捕捉能力 |
| 3.6.ブラックチョークベリー抽出物の主要化合物のメチルグリオキサール/グリオキサールへの捕捉能力と付加物の同定分析 |
| 4.結論 |
本文 |
| 1.はじめに |
| 非酵素的糖化反応とも呼ばれる糖化反応は、タンパク質、脂質、核酸などの高分子上の遊離アミノ基と還元糖上のカルボニル基が関与する非酵素的縮合反応です。 終末糖化生成物は、これらのプロセスから生じる持続的な共有結合付加物です。 終末糖化生成物の生成には 3 つの段階が特定されることがよくあります。 アミノ基は最初にカルボニル基と求核付加して可逆的なシッフ塩基を生成し、次にそれが転位を受けて安定なアマドリ生成物 (ARP) を生成します。 中間段階では、アマドリ生成物 (ARP)の酸化的分裂またはレトロアルドール断片化により、メチルグリオキサールやグリオキサールなどの α-ジカルボニルが生成されます。 これらの物質は最終的に暗褐色の架橋ポリマーメラノイジンに変換される(Dariya and Nagaraju、2020、Jia et al.、2022、Chen et al.、2021)。 終末糖化生成物は外因性 (食物由来) の場合もあれば、体内で内因的に合成される場合もあります。 研究により、内因性または外因性の終末糖化生成物の蓄積が、アルツハイマー病、糖尿病、心血管疾患、神経系障害などの慢性加齢関連疾患の発症の重要な要因であることが明らかになりました (Basta et al., 2004, Kuhla et al. 2007)。 以前の研究によると、アミノグアニジン (AG) は効果的な抗糖化剤です (Okamoto and Okube, 2000、Reddy and Beyaz, 2006)。しかし、アミノグアニジン (AG)の長期摂取は、細胞増殖の遅延などの特定の副作用を引き起こす可能性があります。 したがって、終末糖化生成物 の生成を安全かつ効果的に防止する新規の植物化学物質を、食用野菜、果物、薬草植物から発見することに大きな関心が寄せられています。 |
| ベリーには、フェノール酸、フラボノイド(アントシアニン、フラボノール、カテキンを含む)、タンニン(黒いベリーに含まれるプロシアニジン)などのフェノール化合物が高濃度で含まれていることはよく知られています。 フェノール化合物は、その特殊な分子構造により、アマドリ生成物 (ARP)の生成の減少、フリーラジカルの除去、反応性カルボニル種を捕捉するフェノール - メチルグリオキサール/グリオキサール付加体の生成、およびタンパク質の糖化部位の修飾 (Velichkova、Foubert、および Pieters、2021)など、いくつかのメカニズムを通じて終末糖化生成物の生成を阻害する効果があることが実証されています。 以前の研究では、ブルーベリー果実からの抽出物が終末糖化生成物の形成を大幅に阻害することが実証されており、メチルグリオキサールと付加物を形成することでメチルグリオキサールを除去するカテキンなどのフェノール成分が抗糖化特性に関与していると考えられていました (Wang, Yagiz, Buran, Nunes, & Gu, 2011)。 さらに、ヤマモモ由来のフェノール組成物は、フリーラジカルを捕捉し、金属イオンをキレート化し、カルボニル化合物を捕捉することにより糖化反応を抑制し、終末糖化生成物の生成を低減できることが実証されている(Zhang et al., 2021)。 しかし、さまざまなベリー果実のフェノール含有量と生理活性組成は異なる可能性があるため、特に糖化の初期段階と後期段階の両方で、化学組成に関連して終末糖化生成物を減少させるさまざまなベリー種の有効性を体系的に比較することが重要です (Zhao ら、2022)。 |
| この研究の目的は、ベリー由来の新規候補物質の抗糖化能力を評価し、その阻害メカニズムを明らかにすることでした (Sarmah, & Roy, 2022)。 私たちは、ブルーベリー (Vaccinium corymbosum)、ストロベリー (Fragaria × ananassa Duch.)、ラズベリー (Rubus corchorifolius)、クランベリー (Vaccinium Oxycoccos)、ブラックチョークベリー (Aronia melanocarpa)、キウイベリー(Actinidia arguta)、シーバックソーン(Hippophae rhamnoides)、ブラックカラント(Ribes nigrum L.)を含む 8 種類のベリーの終末糖化生成物形成に関する包括的な研究と比較を行いました。。 抗糖化効果についての予備スクリーニング後、フリーラジカルを除去し、タンパク質の糖化と架橋を防止し、反応性α-ジカルボニルを捕捉して付加物を形成する能力を研究することにより、活性抽出物とその成分のメカニズムをさらに調査しました。 今後の研究の参考とすることで、抗糖化作用を有する食品素材の可能性として新たなベリー資源の開発に貢献することを目指します。 |
| 2.材料と方法 |
| 2.1.化学薬品 |
| ウシ血清アルブミン(純度 > 96 %) は YuanYe Biotechnology Co., Ltd. (Shanghai, China) から入手しました。 d-フルクトース、アミノグアニジン (AG)、メチルグリオキサール (40 % v/v) およびグリオキサール (40 % v/v) は、Solarbio Technology Co., Ltd. (Beijing, China) から入手しました。 シアニジン-3-O-アラビノシド、シアニジン-3-O-ガラクトシドおよびプロシアニジン B2 は ChemFaces Biochemical Co., Ltd. (Wuhan, China) から購入しました。 o-フェニレンジアミン (ΟPD)、2,2-アジノビス (3-エチルベンゾチアゾリン-6-スルホン酸) ジアンモニウム塩 (ABTS)、およびその他の化学試薬は、分析グレードの Sinopharm Chemical Reagent Co. Ltd. (Shanghai, China) から購入しました。 |
| 2.2.ベリー抽出物の調製 |
| ブルーベリー (Vaccinium corymbosum) は、Shenyang Qipanshan Gem Crown Blueberry Industry Co., Ltd. (Shenyang, China) から提供されました。 ストロベリー (Fragaria × ananassa Duch.) は、Dandong YiNong Food Co., Ltd. (Dandong, China) から提供されました。 ラズベリー (Rubus corchorifolius)、クランベリー (Vaccinium Oxycoccos)、ブラックチョークベリー (Aronia melanocarpa)、シーバックソーン (Hippophae rhamnoides)、キウイベリー (Actinidia arguta)、およびブラックカラント (Ribes nigrum L.) は、Dandong JunAo Food Co., Ltd. (Dandong, China)より提供されました。 |
| 果実を70%エタノール(v/v)水溶液を用いて45℃で90分間抽出した。 抽出物を5000rpmで20分間遠心分離した後、上清を移した。 沈殿物を前述のようにさらに 3 回再抽出し、次に上清を合わせて濾過し、減圧下 45℃で蒸発させました。 さらなる検査の前に、濃縮溶液を凍結乾燥し、-80℃で保存しました。 |
| 2.3.ベリー抽出物の化学分析 |
| 私たちの以前の出版物によると、Folin-Ciocalteau 法を使用してベリーの各サンプルの総フェノール含有量 (TPC) が決定されました (Wang et al., 2016)。 没食子酸は標準曲線の作成のための標準物質として使用され、結果は乾燥抽出物 1 グラムあたりの没食子酸当量の mg(mg 没食子酸当量/g DW)で表されました(Li et al., 2017)。 総フラボノイド含有量(TFC)は、亜硝酸ナトリウム-硝酸アルミニウム比色分析を使用してわずかに調整して決定されました(Liu et al., 2022; Wang, Gao, Li, Tan, & Zheng, 2019)。 ルチン濃度を総フラボノイド含有量測定の標準として使用しました。 総アントシアニン含有量(TAC)は、pH 区別手順を利用して決定され、1 リットルあたりのシアニジン-3-グルコシド(C3G)当量の mg として表されました(Wang et al.、2016)。 ブタノール-HCl 試験は、総プロシアニジン含有量 (TPAC) を評価するためにわずかに修正され、プロシアニジン B2 が標準として機能しました (Gao et al., 2023)。 |
| 2.4. 牛血清アルブミン-フルクトースおよび牛血清アルブミン-メチルグリオキサール/グリオキサールモデルにおける抗糖化分析 |
| 牛血清アルブミン-フルクトース (またはメチルグリオキサール)/ グリオキサール) は、牛血清アルブミン (20 mg/mL) およびフルクトース (0.5 mol/L、または メチルグリオキサール / グリオキサール (10 mM) を含むリン酸緩衝液 (PBS) (50 mM pH 7.4) 中で調製しました。 タンパク質溶液を、さまざまな濃度のベリーエタノール抽出物とともに(処理)、またはそれらなしで(対照)、37℃でインキュベートしました。 アミノグアニジン (AG)を陽性対照として使用した。 励起および発光波長として 370 および 440 nm を使用し、7 日後に蛍光マイクロプレートリーダーで蛍光終末糖化生成物を測定しました (Zhao et al., 2021)。 終末糖化生成物阻害率は以下の式(1)により算出した。
蛍光終末糖化生成物の阻害 (%) = [1-(Fサンプル / Fコントロール)] × 100 (1) |
| 2.5.ベリー抽出物の抗酸化活性の測定 |
| 以前に報告されたように、ベリーサンプルのインビトロフリーラジカル消去能力は、2,2-アジノビス (3-エチルベンゾチアゾリン-6-スルホン酸) ジアンモニウム塩 (ABTS)およびペルオキシルラジカル消去能力(PSC)分析によって決定されました(Lang et al., 2021; Zang et al., 2021a)。 標準対照として使用されるアスコルビン酸 (Vit C)、および細胞抗酸化活性 (CAA) は、HepG2 細胞を使用して記載されているように測定されました (Wang et al., 2017)。 |
| 2.6.蛍光分光法と同期蛍光分光法 |
| ブラックチョークベリー抽出物と牛血清アルブミンの相互作用は、蛍光分光計 FLx800™ Fluorometer により λex = 280 nm および λem = 300 ~ 400 nm で蛍光消光法を使用して測定されました。 タンパク質溶液 (0.1 mg/mL) を、規定量のブラックチョークベリー抽出物とともに (処理)、または抽出なしで (対照) と 37 °C でインキュベートしました。 さらに、同期蛍光分光計の発光波長と励起波長は、Δλ15 nmに対してそれぞれ265〜325 nmと280〜340 nmに設定されました。 発光波長と励起波長は、Δλ60 nm に対してそれぞれ 280 ~ 420 nm と 220 ~ 360 nm に設定されました。 スリット幅は 5 nm に設定されました (Lang et al., 2019)。 |
| 2.7.円二色性 (CD) 分光法 |
| 糖化タンパク質の構造変化に対するブラックチョークベリー抽出物の影響は、25℃で光路長1 mm石英キュベット内で 190 ~ 250 nm の遠紫外領域でスキャンした JASCO J-810CD 分光偏光計 (Rhode Island, USA )で記録された円二色性 (CD)スペクトルによって測定されました (Zang et al., 2021b)。 |
| 2.8.ドデシル硫酸ナトリウム - ポリアクリルアミドゲル電気泳動分析 |
| タンパク質架橋構造に対するブラックチョークベリー抽出物の効果は、公開された方法に従ってポリアクリルアミドゲル電気泳動 (SDS-PAGE)によってさらに分析されました(Sheng et al., 2018、Ni et al., 2021)。 簡単に説明すると、サンプルを 4 × ローディングバッファー中で 10 分間煮沸し、10,000 g で 1 分間遠心分離しました。 サンプルをゲルレーンにロードして分離した後、ゲルを 0.05 % クマシーブルー R-250 で 1 時間染色し、次に 10 % (v/v) 酢酸を含む 40 % (v/v) メタノールで 24 時間脱色しました。 |
| 2.9.α-ジカルボニル含量の定量 |
| メチルグリオキサールおよびグリオキサール含有量は、若干の変更を加えた公開プロトコルに従って定量されました (Zhang et al., 2021)。 簡単に説明すると、リン酸緩衝液 (PBS) (0.2 mol/L pH 7.4) に溶解した 1 mg/mL の誘導体化試薬 OPD を各モードのサンプル 1 mL に 25 ± 2℃、暗所で 12 時間添加し、続いて 37℃ で 0.5 時間インキュベートしました。 得られた混合物を HSS T3 カラム (4.6 × 150 mm、5 μm、Waters、USA) に注入量 5 μL、流速 0.3 mL/min、カラム温度 27℃でアプライしました。 ギ酸 (0.1 %、v/v) を含む水溶液を溶媒 A として使用し、メタノールを溶媒 B として使用しました。グラジエント法は次のとおりです。0 ~ 2 分、45 ~ 45 % B。 2 ~ 3.5 分、45 ~ 80 % B; 3.5 ~ 6 分、80 ~ 80 % B; 6 ~ 8.01 分、80 ~ 45 % B; 8.01 ~ 10 分、45 % ~ 45 %。 次に、メチルグリオキサールとグリオキサールを λ = 290 nm で測定しました。 一方、メチルグリオキサール/グリオキサールの残留含有量は、メチルグリオキサールとグリオキサールの標準曲線に従って定量されました。 |
| 2.10. メチルグリオキサールおよび グリオキサール捕捉能力の決定 |
| メチルグリオキサール/グリオキサール (10 mM) を、リン酸緩衝液 (PBS) (0.2 mol/L pH 7.4) 中でさまざまな濃度のブラックチョークベリー抽出物およびその主要化合物 (シアニジン-3-O-ガラクトシド、シアニジン-3-O-アラビノシド、プロシアニジン B2) と反応させました。 。 誘導反応とHPLC検出法は2.7.1で述べた。 メチルグリオキサール/グリオキサール (10 mM)を、リン酸緩衝液 (0.2 mol/L pH 7.4) 中の 0.8 mg/mL のブラックチョークベリー抽出物およびその主要化合物とともに、それぞれ 0、0.5、1、2、6、12 および 24 時間インキュベートしました。 メチルグリオキサール/グリオキサール捕捉率(%)は、下記式(2)により評価した。 |
| メチルグリオキサール/グリオキサール捕捉率(%) = [ (メチルグリオキサール/グリオキサールコントロール– メチルグリオキサール/グリオキサールサンプル) / メチルグリオキサール/グリオキサールコントロール] × 100 (2) |
| 2.11.UPLC-Q-TOF-MS を使用した メチルグリオキサールまたはグリオキサール付加物の同定 |
| 混合物を濾過し、Agilent UPLC 1260-QTOF 6530 システムでLC-MS/MS分析に供した。 クロマトグラフィー分離は、Waters Cortecs C18 カラム (2.1 × 50 mm、1.7 μm) を使用し、移動相 A (10 mM 酢酸を含む水) および移動相 B (メタノール) を使用し、流速 0.3 mL/min で実行しました。 注入量は5μLであった。 シアニジン-3-O-ガラクトシド、シアニジン-3-O-アラビノシドおよびそれらの付加物のグラジエント プログラムは次のとおりです。0 ~ 1 分、10 % B。 1 ~ 8 分、10 ~ 90 % B; 8 ~ 12 分、90 % B; 12 ~ 12.1 分、90 ~ 10 % B; 12.1 ~ 13 分、10 % B。質量データは陽イオンモードで取得されました。 プロシアニジン B2 とその付加物のグラジエント プログラムは次のとおりです。0 ~ 5 分、5 % B。 5 ~ 20 分、25 % B; 20 ~ 22 分、40 ~ 80 % B; 22 ~ 24 分、80 ~ 100 % B。質量データはマイナスイオンモードで取得されました。 パラメータは次のとおりです。ガス温度 360 °C、流量 7 L/min。 シースガス温度、400℃。 シースガス流量、11 mL/分。 質量シグナルは 100 ~ 1000 m/z で収集され、MS/MS スペクトルは、Agilent MassHunter 定性分析 (B06.00) を使用した「式による検索」分析によって取得されまし |
| 2.12.統計分析 |
| すべてのアッセイは 3 回の反復で表され、すべての日付は平均 ± 標準偏差 (S.D.) として表示されました。 一元配置分散分析 (ANOVA) が実行され、平均比較のダンカン検定が 5 % の確率レベルで評価されました (p < 0.05)。 |
| 3.結果と考察 |
| 3.1.さまざまな反応モデルにおける終末糖化生成物の形成に対するベリー抽出物の影響 |
| 終末糖化生成物は糖化反応の最終生成物であり、再配列、酸化、脱水、環化などの一連の複雑な反応を通じて生成されます。 この研究では、牛血清アルブミン-フルクトース 、牛血清アルブミン-メチルグリオキサール、牛血清アルブミン-グリオキサールの3つの反応モデルで8つのベリー抽出物の抗糖化効果を評価しました。結果は図1A〜Cに順番に示されています。 |
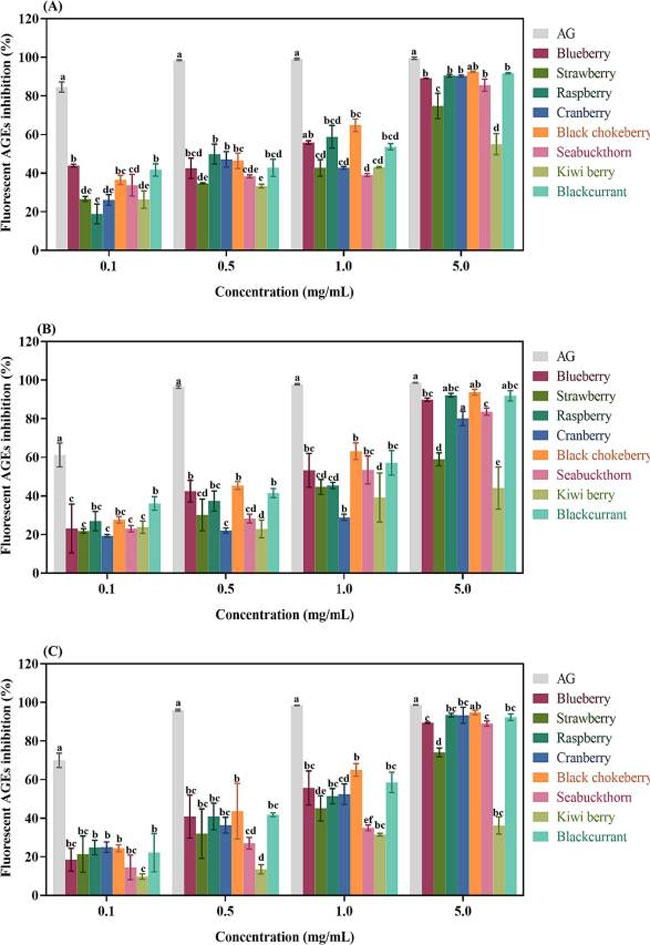 |
図 1 さまざまなモデルにおけるアミノグアニジン(AG)およびベリー抽出物の蛍光終末糖化生成物に対する阻害率。 (A) 牛血清アルブミン-フルクトース モデル、(B) 牛血清アルブミン-メチルグリオキサールモデル、(C) 牛血清アルブミン-グリオキサールモデル。 |
| 牛血清アルブミン-フルクトース モデルは、タンパク質の糖化のすべての段階を評価します。 牛血清アルブミン-フルクトースモデルでは、試験したすべてのベリーの終末糖化生成物形成に対する阻害効果が図1Aに示されています。 7 日間のインキュベーション後、すべてのベリー抽出物は用量依存的に顕著な阻害効果を示しました。 ブラックチョークベリーが最も高い抑制効果を示し、次にブルーベリー、ブラックカラントが続きました。 表 1 に示すように、ブラックチョークベリー、ブルーベリー、およびブラックカラントの IC50 値は、それぞれ 0.35 ± 0.02、0.36 ± 0.06、および 0.39 ± 0.08 mg/mL と計算されました。 |
| 表1 さまざまなベリー抽出物の抗糖化、フェノール組成、および抗酸化能力 |
 |
| *IC50値を単位(mg/mL)で表します。 GAE、RE、C3G、PCB2、Vc、QE はそれぞれ没食子酸当量、ルチン当量、シアニジン-3-O-グルコシド、プロシアニジン B2、ビタミン C、ケルセチン当量を表します。 異なる文字は、同じ列内で有意な差があることを示唆しています s(p < 0.05、ダンカンの検定。 |
| タンパク質の糖化の中期段階では、メチルグリオキサールや グリオキサールなどの反応性カルボニル化化合物が形成され (Zhang et al., 2021)、これらはタンパク質のアミノ基と反応して、終末糖化生成物の生成中に重要な中間体であるタンパク質の架橋を形成することができます ( Xu、You、Zhao、2023)。 牛血清アルブミン-メチルグリオキサールモデルおよび牛血清アルブミン-グリオキサール(B牛血清アルブミン(BSA)-グリオキサール)反応モデルにおける終末糖化生成物形成に対する各ベリー抽出物の阻害効果を図1B〜Cに示しました。 同様に、さまざまなベリー抽出物 (0.1、0.5、1、および 5 mg/mL) を反応モデルに添加すると、用量依存的に終末糖化生成物の含有量が大幅に減少しました。 牛血清アルブミン-メチルグリオキサールモデルでは、ブラックカラント、ブラックチョークベリー、ブルーベリーで最も高い阻害効果が観察され、IC50 値はそれぞれ 0.44 ± 0.06、0.45 ± 0.03、0.63 ± 0.25 mg/mL でした。 同様の結果が牛血清アルブミン-グリオキサールモデルでも見られました。 IC50 値はそれぞれ 0.48 ± 0.11、0.57 ± 0.12、および 0.61 ± 0.12 mg/mL で、ブラックチョークベリー、ブラックカラント、ラズベリーの順にランク付けされました。 |
| 要約すると、この研究でテストした 8 つのベリー抽出物はすべて、さまざまな反応系にわたって終末糖化生成物生成の濃度依存性の有意な減少を示しました。 注目すべきことに、ブラックチョークベリーは 3 つの反応モデルすべてにおいて新規な阻害効果を示し、次にブラックカラント、ブルーベリー、ラズベリーが続きました。 |
| 3.2.さまざまなベリー抽出物の化学組成と抗酸化活性 |
| 選択したベリーの成分含有量と抗酸化活性を測定しました。結果を表 1 にまとめます。まず、8 つのベリー抽出物の総フェノール含有量 (TPC)、総フラボノイド含有量(TFC)、総抗酸化能力 (TAC)、および総プロシアニジン含有量 (TPAC)を分析しました。 ベリー抽出物の総フェノール含有量および総フラボノイド含有量は、それぞれ 80.07 ± 0.45 ~ 230.44 ± 1.27 mg 没食子酸等量/g DW および 62.21 ± 4.63 ~ 132.12 ± 2.40 mgルチン等量/g DW の範囲でした。 8 つのベリー抽出物の中で、ブラック チョークベリーが最も高い総フェノール含有量値を持ち、ブルーベリーが最も高い総フラボノイド含有量値 (132.12 ± 2.40 mg RE 相当量/g DW) を持ち、ラズベリー、シーバックソーン、ブラック チョークベリーがそれに続きました。 これらの発見は、以前に発表された研究と一致しています(Jurendić and Ščetar、2021、Hwang et al.、2014)。 |
| プロアントシアニジンとアントシアニンは、ベリーに含まれる 2 つの重要な化合物グループです。 ベリー抽出物の総抗酸化能力 (TAC) レベルは、9.85 ± 0.33 ~ 168.83 ± 1.07 mg C3G 等量/g DW の範囲でした。 ブルーベリーが最も高い総抗酸化能力値 (168.83 ± 1.07 mg C3G 等価物/g DW)、次にブラックチョークベリー (111.58 ± 3.33 mg C3G 等価物/g DW) を示しました。これは、以前の研究で報告された値と一致しています (Kim、Han、Kim、Kim&Kim、2021)。 さらに、私たちの研究では、ブラックチョークベリーがテストしたすべてのベリーの中で最も高い総プロシアニジン含有量を有し、その含有量は 42.54 ± 6.94 mg PCB2/g DW で、ブルーベリーのほぼ 4 倍であることがわかりました。 クランベリーの総プロシアニジン含有量含有量は 33.13 ± 2.86 mg PCB2/g DW で 2 番目に高い総プロシアニジン含有量含有量でしたが、他のベリーの含有量は 7.87 ± 2.93 ~ 14.17 ± 3.76 mg PCB2/g DW の範囲でした (Taheri, 2013、Wangensteen et al., 2014) 。 |
| また、2,2-アジノビス (3-エチルベンゾチアゾリン-6-スルホン酸) ジアンモニウム塩 (ABTS)、ペルオキシルラジカル消去能力(PSC)、細胞抗酸化活性 (CAA)法を使用して、8 種類のベリー抽出物の細胞内およびインビトロのラジカル消去活性を分析しました。 結果は、ベリーの2,2-アジノビス (3-エチルベンゾチアゾリン-6-スルホン酸) ジアンモニウム塩 (ABTS)フリーラジカル消去能力の IC50 値が 0.13 ± 0.01 ~ 1.13 ± 0.02 mg/mL の範囲であることを示しました。 ブラックチョークベリーが最も顕著な2,2-アジノビス (3-エチルベンゾチアゾリン-6-スルホン酸) ジアンモニウム塩 (ABTS)抗酸化能力を示し、予想通りブルーベリーがそれに続きました。 ベリーの ペルオキシルラジカル消去能力(PSC)値は、0.12 ± 0.05 ~ 0.64 ± 0.08 μmol Vc equiv./mg の範囲でした。 ブラックカラントのペルオキシルラジカル消去能力(PSC)値が最も高く (0.64 ± 0.08 μmol Vc equiv./mg)、続いてブルーベリー (0.40 ± 0.09 μmol Vc equiv./mg)、ブラックチョークベリー (0.33 ± 0.08 μmol Vc equiv./mg) でした。 細胞抗酸化物質の分析では、ブルーベリーとブラックチョークベリーも高い 細胞抗酸化活性 (CAA)値を示しました。 したがって、ベリーの化学組成含有量と抗酸化活性が、ベリーの抗糖化活性の理由の 1 つである可能性があると推測しました。 ただし、調査したベリー抽出物の抗酸化特性と抗糖化特性との関連性は、さまざまな模擬糖化反応系における終末糖化生成物に対するベリーの阻害効果を考慮すると異なります。 |
| 3.3.牛血清アルブミンの蛍光スペクトルに対するブラックチョークベリー抽出物の影響 |
| 上記の分析に基づくと、ブラックチョークベリーは糖化プロセスのすべての段階を通じて最も高い抗糖化活性を示しましたが、正確な抗糖化メカニズムはまだ完全には解明されていません。 このメカニズムをさらに調査するために、固有蛍光スペクトルを利用して、ブラックチョークベリー抽出物からのポリフェノールと 牛血清アルブミンの間の結合挙動を研究しました。 得られたデータを図2に示します。ここでは、ブラックチョークベリーの濃度が増加するにつれて、340 nmでの牛血清アルブミンの蛍光強度が徐々に減少することが観察でき、用量依存的に蛍光が消光することを示しています(図2A) |
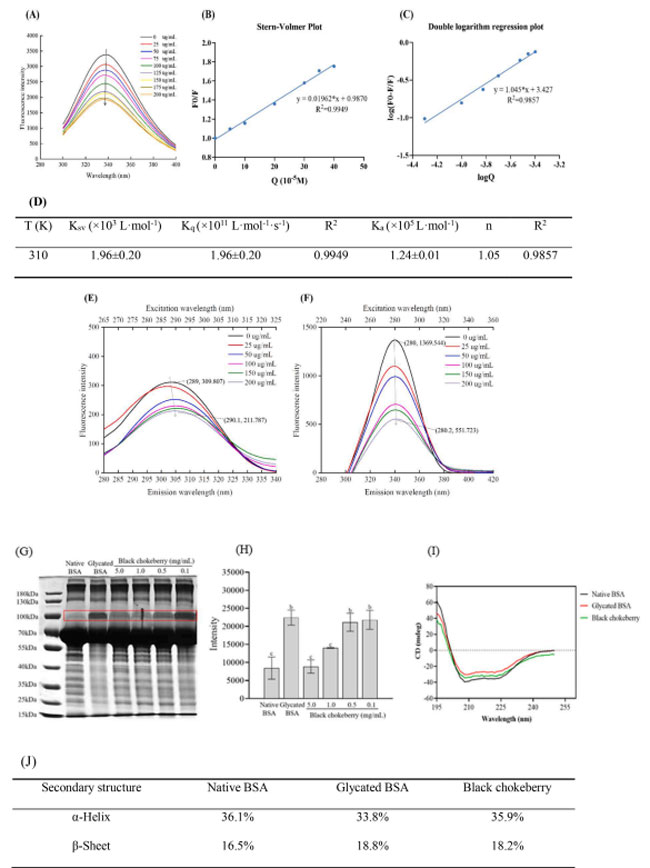 |
| 図2 (A) pH 7.4、310 K、0 ~ 200 μg/mL ブラック チョークベリーの存在下での 牛血清アルブミンの蛍光スペクトル。(B) ブラック チョークベリーによる 牛血清アルブミンの消光に関する Stern-Volmer プロット。 (C) 異なる濃度のブラックチョークベリーを使用した 牛血清アルブミンの二重対数回帰。 (D) さまざまな濃度での 牛血清アルブミンとブラックチョークベリー間の相互作用の消光定数と結合定数。 (E-F) (E) Δλ = 15 nm および (F) Δλ = 60 nm の場合、298 K でブラックチョークベリー抽出物を添加した牛血清アルブミンの同期蛍光スペクトル。 (G) ブラックチョークベリー抽出物を含む 牛血清アルブミンの ポリアクリルアミドゲル電気泳動 (SDS-PAGE)プロファイル。 (H) ブラックチョークベリーによる糖化牛血清アルブミンの濃度分析。 (I) ブラックチョークベリー抽出物を含む場合と含まない場合の 牛血清アルブミンおよび糖化牛血清アルブミンの円二色性 (CD)スペクトル。 (J) 糖化牛血清アルブミンの二次構造内容に対するブラックチョークベリーの影響。 |
| 蛍光消光は、動的消光と静的消光の 2 つのタイプに分類できます。 潜在的な消光メカニズムを理解するために、図 2B ~ D に示すように Stern Volmer プロットを使用してデータを計算しました。 Kq 値は 1.96 ± 0.20 × 1011 L・mol−1・s−1 と決定され、これは最大拡散律速消光定数 (2 × 1010 L・mol−1・s−1) よりも大幅に高く、次のことを示しています。 ブラックチョークベリーポリフェノールによる牛血清アルブミンの消光プロセスは、静的消光メカニズムを通じて起こったということです。 さらに、両対数回帰プロットを使用して、結合定数 Ka および結合化学量論 n を計算しました。 結合親和性定数 Ka は 1.24 ± 0.01 (×105 L・mol-1) であることが判明し、ブラックチョークベリー抽出物と 糖化牛血清アルブミンの間の強力な結合効果が示唆されました。 さらに、糖化牛血清アルブミンの二重対数回帰プロットは、結合部位値が約 1 の明確な直線関係を示しました。これは、牛血清アルブミンがブラックチョークベリー ポリフェノール化合物に対して 1 つのクラスの結合部位を持っていることを示唆しています。 |
| 同期蛍光スペクトルは蛍光スペクトルから派生した技術であり、タンパク質の立体構造変化を研究するために一般的に使用され、アミノ酸残基を取り巻く微小環境の極性についての洞察を提供します。 Δλが15 nmと60 nmに等しい場合、それはそれぞれチロシン残基とトリプトファン残基の周囲の微小環境を反映します(Lang et al., 2019)。 図2E〜Fに示すように、チロシンとトリプトファンの蛍光強度は、ブラックチョークベリー抽出物の濃度が増加するにつれて徐々に減少します。 特に、トリプトファン残基の蛍光強度はチロシン残基の蛍光強度よりも高く、トリプトファンが牛血清アルブミンの主な蛍光源として機能することを示した。 両方のアミノ酸は最大発光波長にわずかなレッドシフトを示し、疎水性の低下とチロシンおよびトリプトファン残基の極性の増加を示しました。 これらの発見は、ブラックチョークベリーが牛血清アルブミンと相互作用し、最終糖化生成物の形成を間接的に減少させる可能性があることを示唆しています。 |
| 3.4.タンパク質の架橋と二次構造に対するブラックチョークベリー抽出物の影響 |
| ポリアクリルアミドゲル電気泳動 (SDS-PAGE)を使用して、牛血清アルブミンの分子量 (MW) に対する糖化とブラックチョークベリー抽出物の影響を分析しました。 図 2G では、天然 牛血清アルブミンは 66.7 kDa で明確なバンドを示しました。 しかし、グリコシル化牛血清アルブミンの分子量は変化し、97.4 kDaに高分子量のバンドが現れ、フルクトースによるタンパク質の非酵素的グリコシル化によりタンパク質の高分子架橋構造が形成されたことが示されました。 興味深いことに、ブラックチョークベリー抽出物を添加すると、抽出物濃度が増加するにつれてバンドが徐々に鮮明になり、これはバンドの濃度分析によっても確認されました (図 2H)。 これらの結果は、ブラックチョークベリー抽出物がタンパク質の架橋と凝集体の形成を防止し、それによってグリコシル化反応を阻害し、最終糖化生成物の生成を減らす役割を果たしている可能性があることを示唆しています。 |
| 円二色性 (CD)スペクトルを使用して、牛血清アルブミンの二次構造に対する糖化の影響を決定しました。 図 2I に示すように、天然牛血清糖化アルブミンスペクトルは 208 nm と 222 nm で 2 つの異なる負のピークを示しました。 ただし、糖化牛血清アルブミンの負の吸収バンドは減少し、位置のシフトと信号強度の低下を伴いました。 図2Jは、ブラックチョークベリー抽出物の処理により糖化牛血清アルブミンのシグナル強度が軽減されたことを示しています。 天然牛血清アルブミン中のα-ヘリックスおよびβ-シートの含有量は、それぞれ36.1%および16.5%であった。 糖化後、α-ヘリックス含有量は 33.8 % に減少しましたが、β シート含有量は 18.8 % に増加しました。これは、糖化プロセスによって引き起こされた α-ヘリックスから β-シートへの構造変換を示しています。 ブラックチョークベリーで処理した後、糖化牛血清アルブミンのαヘリックス含有量は35.9%、βシート含有量は18.2%まで回復しました。 |
| 3.5. メチルグリオキサール/グリオキサールにおけるブラックチョークベリーエキスの捕捉能力 |
| メチルグリオキサールおよびグリオキサールは、糖化反応の中間生成物として機能するカルボニル化合物であり、最終糖化生成物の形成を促進する重要な前駆体です。 したがって、模擬条件下で 24 時間インキュベートした後、メチルグリオキサールおよびグリオキサールの除去効率に対するさまざまな濃度のブラックチョークベリー抽出物の影響を調査しました。 図3Aに示すように、異なる濃度のブラックチョークベリー抽出物で処理した後、モデルにおけるメチルグリオキサールまたはグリオキサールの残留レベルは、用量依存的に対照よりも有意に低かった。 濃度 0.1 mg/mL のブラックチョークベリー抽出物では、グリオキサールの残留含有量 (0.46 ± 0.02 mg/mL) は メチルグリオキサールの残留含有量 (0.12 ± 0.01 mg/mL) より約 4 倍高く、メチルグリオキサールの阻害が抑制されていることを示しています。 グリオキサールに比べて感度が高かったです。 これらの結果は、ブラックチョークベリー抽出物がα-ジカルボニル化合物、特にメチルグリオキサールを捕捉することにより最終糖化生成物の形成を効果的に軽減する可能性があることを示唆しています。 |
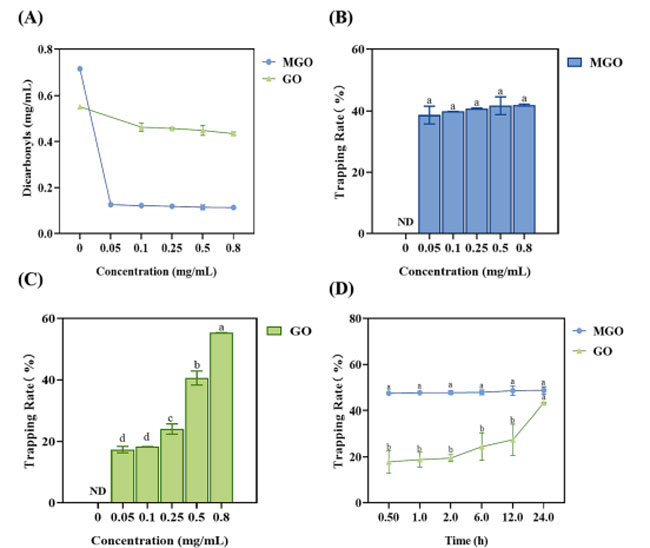 |
図3 (A) 牛血清アルブミン-メチルグリオキサール/グリオキサールモデルにおける メチルグリオキサールおよび グリオキサールの内容に対するブラックチョークベリーの影響。 (B-C) さまざまな濃度のブラックチョークベリー抽出物によるメチルグリオキサールとグリオキサールの捕捉。 (D) 異なる時点でのブラックチョークベリー抽出物による メチルグリオキサールとグリオキサールの捕捉。 MGO:メチルグリオキサール、GO:グリオキサール
|
| メチルグリオキサールとグリオキサールに対するブラックチョークベリー抽出物の捕捉能力を図3B〜Cに示し、減少がメチルグリオキサールおよびグリオキサールに対するブラックチョークベリー抽出物の直接捕捉効果に起因するかどうかをさらに実証しました。 予想どおり、ブラックチョークベリー抽出物は、用量と時間に依存して メチルグリオキサールとグリオキサールを捕捉しました。 ブラックチョークベリー抽出物の濃度 0.8 mg/mL では、メチルグリオキサールとグリオキサールの捕捉率はそれぞれ 41.95 % と 55.32 % でした。 図3Dに示すように。 ブラックチョークベリー抽出物濃度 0.8 mg/mL では、24 時間で、メチルグリオキサールの捕捉効率は 48.80 % に達しましたが、グリオキサールの捕捉効率は 43.34 % でした。 この結果は、ブラックチョークベリー抽出物が効率的にメチルグリオキサールを捕捉することを示唆しています。 この潜在的な理由の 1 つは、グリオキサールは主に二量体または三量体の形で水溶液中に存在し、そのため遊離 グリオキサールへの変換が遅くなり、その結果、ブラックチョークベリー抽出物とグリオキサールの間の捕捉反応が減速することです。 同様の結果が以前の研究でも報告されています (Li、Zheng、Sang、および Lv、2014)。 これらの発見は、反応性カルボニル化合物がブラックチョークベリー抽出物によって効果的に捕捉できることを示唆しています。 |
| 3.6.ブラックチョークベリー抽出物の主要化合物のメチルグリオキサール/グリオキサールへの捕捉能力と付加物の同定分析 |
| 私たちの以前の研究(Zang et al.、2021b)では、ブラックチョークベリーに含まれる主なポリフェノール化合物は、シアニジン-3-O-アラビノシド、シアニジン-3-O-ガラクトシド、プロシアニジンB2の順であることがわかりました。 これら 3 つの主要化合物の メチルグリオキサール/グリオキサール 捕捉能力を測定しました (図 4A ~ C を参照)。これらは用量依存的に メチルグリオキサール と グリオキサールを捕捉しました。 75 μg/mL の濃度では、シアニジン-3-O-ガラクトシド、シアニジン-3-O-アラビノシド、およびプロシアニジン B2 による メチルグリオキサールの捕捉率は、それぞれ 56.85 %、56.95 %、および 68.27 % でした。 グリオキサールの捕捉率はそれぞれ63.60%、54.55%、50.16%であった。 カルボニル化合物の動的捕捉プロセスでは、インキュベーション時間の経過とともに捕捉能力が増加することが示されました。 24 時間のインキュベーション時間で、シアニジン-3-O-ガラクトシド、シアニジン-3-O-アラビノシド、およびプロシアニジン B2 による メチルグリオキサールの捕捉率は、それぞれ 56.54 %、42.73 %、および 54.09 % でした。 一方、グリオキサールの捕捉率はそれぞれ23.70%、21.87%、55.13%であった。 これらの結果は、3 つの化合物すべてが グリオキサールよりも メチルグリオキサールを捕捉するのに効果的であることを示しています。 |
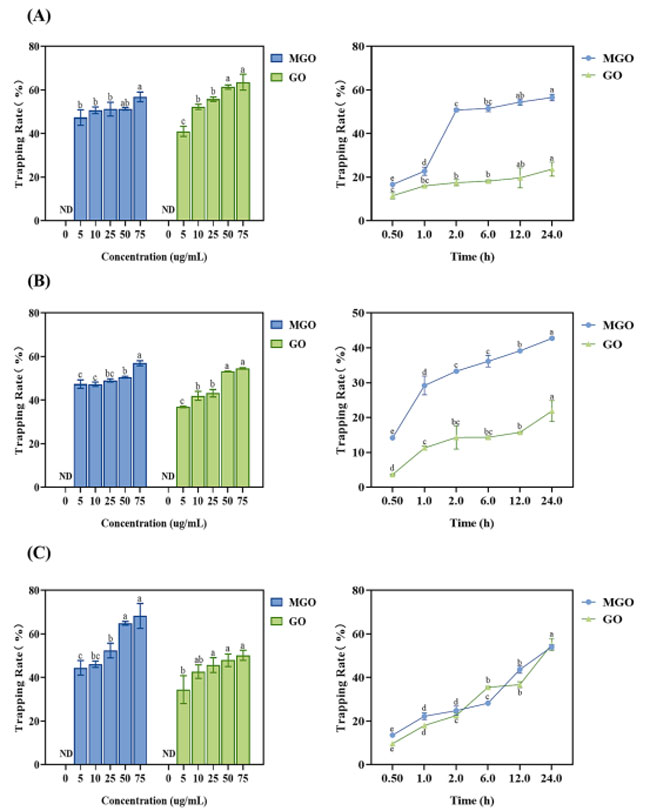 |
図4 (A) 37℃、異なる濃度および異なる時間におけるシアニジン-3-O-ガラクトシド、シアニジン-3-O-アラビノシドおよびプロシアニジン B2 (A-C) による メチルグリオキサールおよびグリオキサールの捕捉能力。 MGO:メチルグリオキサール、GO:グリオキサール |
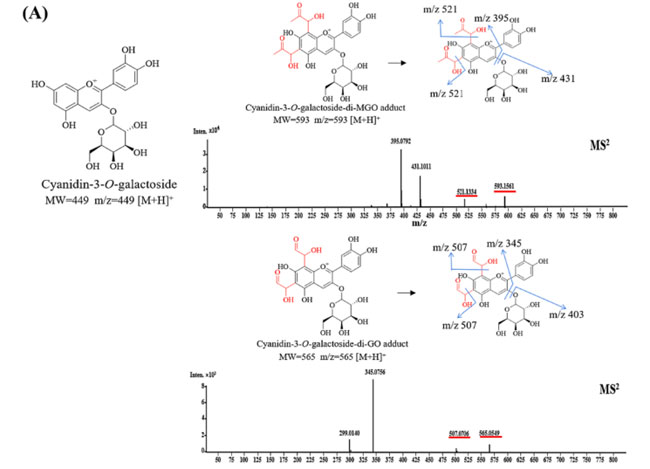
| 高い メチルグリオキサール/グリオキサール捕捉効率は、ブラックチョークベリーに含まれる主要化合物と α-ジカルボニル間の付加物の形成に起因すると考えられます。 3 つの化合物 (シアニジン-3-O-ガラクトシド、シアニジン-3-O-アラビノシド、プロシアニジン B2) とメチルグリオキサール/グリオキサールとの反応が完了した後、二次フラグメント イオンと反応付加物の考えられる構造がさらに特徴付けられ、 UPLC-Q-TOF-MS を使用して同定され、結果が図5に示されています。 シアニジン-3-O-ガラクトシド(m/z 449 [M + H]+)の主要フラグメントイオンは、糖部分の喪失により m/z 287 [M + H-Gal]+ であることが知られています。 シアニジン-3-O-ガラクトシドを メチルグリオキサールとインキュベートすると、得られた分子イオンの質量は m/z 593 [M + H]+ で、シアニジン-3-O-ガラクトシド-ジメチルグリオキサール に相当します (質量シフト + 144 m/ z)。 MS2 スペクトルは、メチルグリオキサール分子の損失により、m/z 521 (質量シフト -72 m/z) でプロダクト イオンを示しました。 m/z 431 [M + H-Gal] + および 395 [M + H-Gal-18-18]+ のイオンは、それぞれジメチルグリオキサール-シアニジン アグリコンと 2 つの水分子の損失に起因すると考えられます。 同様に、グリオキサールとのインキュベーション後、シアニジン-3-O-ガラクトシド-ジグリオキサールは同様の断片化パターン (565 [M + H]+→m/z 507(質量シフト -58 m/z) → 345 [M + H-Gal]+) で同定されました。(図5A)。 |
 |
 |
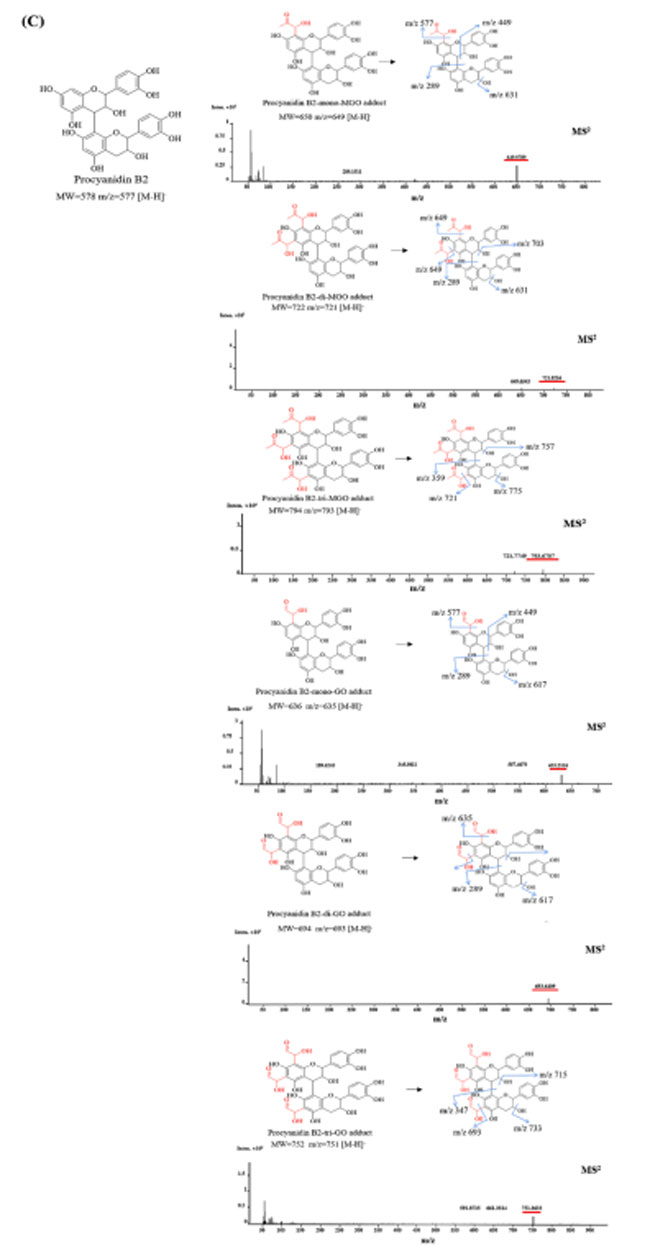 |
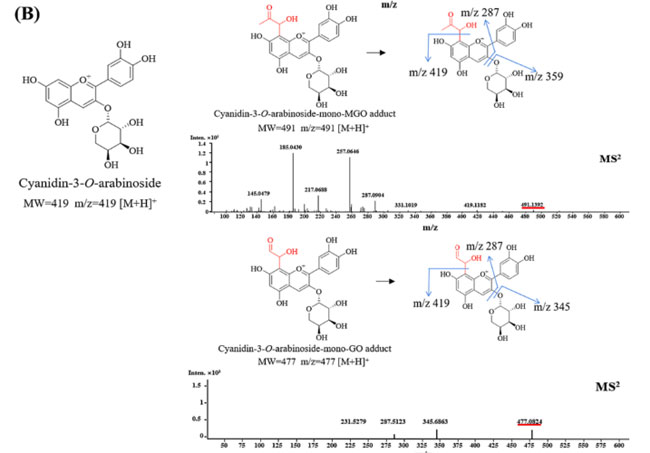
| 図5 暫定的に同定された付加物の MS/MS スペクトルと提案された構造 (A) シアニジン-3-O-ガラクトシド-ジ-メチルグリオキサール/グリオキサール付加物 (B) シアニジン-3-O-アラビノシド-モノ-メチルグリオキサール/グリオキサール付加物 (C) プロシアニジン B2 モノ、ジ、トリメチルグリオキサール/グリオキサール付加物。 |
| 比較すると、シアニジン-3-O-アラビノシド (419 [M + H]+) は メチルグリオキサールまたはグリオキサールと反応してモノ付加物を生成しました。 モノ付加物の MS2 スペクトルは、シアニジン-3-O-アラビノシド-モノメチルグリオキサール(491 [M + H]+) およびシアニジン-3-O-アラビノシド-モノグリオキサール(477 [M + H]+) を示しました。 糖部分の喪失(-m/z 132)により、m/z 345 [M + H-Ara]+ でシアニジン-3-O-アラビノシド-モノグリオキサールフラグメントイオンが生じました(図 5B)。 これまでの研究では、α-ジカルボニル化合物の主な捕捉部位はA環のC6およびC8位置であることが示唆されている(Li, Zheng, Sang, & Lv, 2014; Zhang et al., 2022)。 さらに、先行研究では、ケルセチンが迅速にメチルグリオキサールを捕捉し、モノおよびジ メチルグリオキサール付加物を形成することで 最終糖化生成物の形成を阻害できることが実証されています。 ジ-メチルグリオキサール付加物は、長期のインキュベーション中に主要な生成物になります (Li、Zheng、Sang、および Lv、2014)。 反応中のメチルグリオキサール 量が増加すると、ジメチルグリオキサールミリセチン付加物のピークの強度は増加しますが、モノ メチルグリオキサールミリセチン付加物のピークの強度は減少します (Zhang、Xiao、Lv & Sang、2020)。 全体として、モノ-およびジ-メチルグリオキサール/グリオキサール付加物の量は反応時間と反応率に関係していると推測されます。 メチルグリオキサールおよび グリオキサールとの捕捉反応における各化合物の反応速度論のさらなる研究が必要です。 |
| プロシアニジン B2 の分子量は 578 であることが知られています。 m/z 分子イオンのピークデータに基づいて、プロシアニジン B2 と メチルグリオキサール が反応すると、プロシアニジン B2-モノメチルグリオキサール (m/z 649 [M−H]-)、プロシアニジン B2-ジメチルグリオキサール (m/z 721 [M-H]-)、およびプロシアニジン B2-トリメチルグリオキサール (m/z 793 [M-H]-)の 3 種類の付加生成物が生じると推測されます。。 同様に、グリオキサールとのインキュベーション後、プロシアニジン B2-モノグリオキサール (m/z 635 [M-H]-)、プロシアニジン B2-ジグリオキサール(m/z 693 [M-H]-)、およびプロシアニジンB2-トリグリオキサール (m/z 751 [M−H]-)の 3 つの付加生成物も観察されました。。 ただし、プロシアニジン B2 の組成は複雑であるため、各付加物の分子イオン ピークのみを提供しました。 今後の研究では、形成された付加物を正確に特定するために、より明確な構造を持つ特定のプロシアニジンの使用を検討することをお勧めします。 |
| 4.結論 |
| 本研究では、8種類のベリーの全段階における抗糖化効果を調査しました。 その中でも、ブラックチョークベリーは、最終糖化生成物生成に対する新たな阻害活性を示しました。 ブラックチョークベリーの阻害効果の背後にある根本的なメカニズムは、タンパク質との結合相互作用に起因すると考えられ、それによって構造変化が防止され、タンパク質の架橋が阻害されます。 さらに、ブラックチョークベリーは、その 3 つの主要なポリフェノール、すなわちシアニジン-3-O-ガラクトシド、シアニジン-3-O-アラビノシド、およびプロシアニジン B2 とともに、メチルグリオキサールおよび グリオキサール含有量の顕著な捕捉能力を示しました。 これらは最終糖化生成物形成の重要な阻害メカニズムです。 UPLC-Q-TOF-MS 分析を通じて、シアニジン-3-O-ガラクトシドおよびシアニジン-3-O-アラビノシドのモノまたはジメチルグリオキサール/グリオキサール付加物、およびプロシアニジン B2-モノ、ジ、およびトリメチルグリオキサール/グリオキサール付加物を検出することができました。 。 要約すると、私たちの発見は、ベリーが最終糖化生成物の形成を阻害する新規化合物を同定するための有望な資源として機能する可能性があることを明確に示しています。 特にブラックチョークベリーは、強力な抗糖化ベリーとして際立っており、飲料、グミ、フルーツパウダーなど、糖化や老化に対する固有の特性を備えた製品を開発するための食品加工に利用できます。 さらに、医療分野においても加齢に伴う慢性疾患の予防や治療に利用することができ、幅広い応用が期待されています。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Food Chem X. 2024 Mar 30; 21: 101032.に掲載されたNovel inhibitory effect of black chokeberry (Aronia melanocarpa) from selected eight berries extracts on advanced glycation end-products formation and corresponding mechanism study.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


