ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(アロニア:研究の最前線) |
アロニアメラノカルパフラボノール抽出物 - 抗ラジカルおよび免疫調節活性の分析 |
Kseniya Bushmeleva et al., |
|
|
| 概要 |
アロニア・メラノカルパ(A. melanocarpa)の生物学的活性に関する研究は、粗抽出物の取得とフラボノール化合物の分離に焦点を当てています。アロニア・メラノカルパ果実の抽出・分画、そして高速液体クロマトグラフィーとDarco G-60フィルターを用いた定量分析を実施しました。この手法により、各分画中のフラボノイドの定量が可能になりました。抗酸化活性、免疫調節活性、そしてリンパ芽球細胞株RPMI-1788に対する細胞毒性について検討しました。アロニア・メラノカルパのフラボノール抽出物は、in vitroにおいて遊離DPPHおよびAAPHラジカルを中和する高い能力を有することが示されています。また、シクロホスファミドに曝露されたラットにおいて、好中球の「呼吸バースト」形成を促進し、細胞の代謝予備能を増加させました。対照溶液(ケルセチンとルチンの等価混合物)は脂質過酸化を減少させ、貪食作用を増強しました。研究対象化合物は、動物における白血球血液プロファイルへの影響が低いことが示されました。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2. 結果 |
| 2.1. 抽出物の化学組成と抗酸化活性 |
| 2.2. 抽出物のDPPH消去活性への影響 |
| 2.3. 調査化合物の化学発光活性 |
| 2.4. 抽出物のリンパ芽球正常細胞への影響 |
| 2.5. ラット末梢血の血液学的検査 |
| 2.6. 白血球貪食活性 |
| 2.7. 自発性および活性化好中球化学発光活性の研究 |
| 2.8. 脂質過酸化試験 |
| 3. 考察 |
| 4. 材料と方法 |
| 4.1. サンプリング |
| 4.2. 改質炭素吸着剤の調製 |
| 4.3. 抽出物の調製 |
| 4.4. フラボノール画分の調製 |
| 4.5. 化学組成分析 |
| 4.6. フラボノール画分抽出物のクロマトグラフィー分析 |
| 4.7. 化学薬品および試薬 |
| 4.8. アロニア抽出物中の抗酸化活性と生理活性物質含有量 |
| 4.9. リンパ球細胞株RPMI-1788を用いたin vitro試験 |
| 4.9.1. in vitroにおける細胞保護特性の測定 |
| 4.9.2. 細胞の染色と計数 |
| 4.10. 生体内実験 |
| 4.10.1. 血液学的検査 |
| 4.10.2. ラット血中好中球顆粒球の機能状態 |
| 4.10.3. ラット血中脂質過酸化 |
| 4.11. 統計解析 |
| 5. 結論 |
本文 |
| 1.はじめに |
| ブラックチョークベリーすなわちアロニア・メラノカルパ (Michx.) エリオットは、北米原産のバラ科の低木で、約1世紀前にヨーロッパに持ち込まれました。ブラックチョークベリーの可食部は主に果実で、ジュース、シロップ、ジャム、フルーツティー、栄養補助食品など、食品業界で広く利用されています[1,2]。 |
| アロニアはシベリアやアメリカインディアンによって、精神を研ぎ澄まし、骨の損傷を治癒する若返りの秘薬として用いられていました。アロニアは筋力の発達を促進するため、特に妊娠中の若い女性に多く投与されていました[3]。かつて、アロニアの葉は伝統医学において抗炎症剤、抗ウイルス剤、抗菌剤、抗増殖剤として使用されていました[4]。アロニアの葉抽出物は、バイオ医薬品工学の有効成分源として利用されてきました[5]。経口投与実験では、抽出物が脳ホモゲネート中のアスコルビン酸と過酸化水素によって誘発される脂質とタンパク質の過酸化の強度を低下させることが明らかになりました[6]。 |
| アロニア・メラノカルパの生物学的活性は、アントシアニン、フラボノール、フラバノール、プロアントシアニジン、フェノール酸などのポリフェノールファミリーの化合物と相関することが知られています。アロニア・メラノカルパのフェノール成分含有量は、これまで調査された他のほとんどのベリー類や果物よりも高く、これは実験室試験におけるその抗酸化力と一致しています[7,8]。ブラックチョークベリー抽出物の抗酸化作用は、メチルリノール酸酸化阻害[9]、酸素ラジカル吸収能[10]、トロロックス相当抗酸化能[11]、DPPHラジカル消去活性[12]など、様々なin vitro試験を用いて評価されています。 |
| フラボノールは、2-フェニルベンゾ-γ-ピランの天然誘導体群であり、フラボノイドの最も代表的なクラスの一つです。植物界に広く分布し、紫外線や微生物の攻撃から植物と微生物の相互作用に至るまで、植物の代謝において数多くの重要な役割を果たしています[13]。フラボノールは、抗酸化作用[14]、降圧作用[15,16]、免疫調節作用[17]、抗菌作用[18,19]、抗発がん作用[20]、抗ウイルス作用[21]など、様々な生物学的活性を持つことが知られています。ケルセチンとルチンは、植物に広く分布し、主に果物や野菜などの日常の食事に多く含まれるフラボノールです[22]。 |
| 文献によると、ケルセチン、ゲニステイン、フラボンは活性酸素種(ROS)の産生を抑制するだけでなく、ヒト好中球のアポトーシスを促進することが示されています[23]。さらに、フラボノイド、特にフラボン、フラボノール、ケルセチン、ルチンは、多形核好中球の遊走を著しく阻害しました[24]。これらの結果は、フラボノイドが、持続的または制御不能な炎症プロセスに関連する好中球によって引き起こされる傷害から保護する免疫調節作用を有することを明らかにしました。 |
| フラボノールの高い免疫調節作用は、高い抗酸化作用と関連している[25]。合成薬の副作用と、治療における天然代替物質の探求により、免疫力を高めるためのフラボノールの複合作用に対する需要が高まっている[26,27]。 |
| 高等植物における免疫調節物質の存在は広く研究されている[28]が、植物由来の免疫調節物質は限られた量しか知られていない。これらの物質は、自己免疫疾患、アレルギー、糸球体腎炎、慢性肝炎など、過剰な免疫反応や望ましくない免疫反応によって引き起こされる疾患の治療における代替補助剤として開発される可能性がある[29]。 |
| アロニア・メラノカルパ抽出物は、動物の免疫プロファイルにプラスの影響を与えるフラボノイドの豊富な供給源として知られていますが、その治癒効果のメカニズムを理解するためには、アロニア・メラノカルパ由来のフラボノール抽出物について、さらなる研究が必要です。これまで、特殊な吸着剤を用いてアロニア・メラノカルパのフラボノールを豊富に含む画分を単離する研究が行われてきましたが、高い吸着容量、脱着係数、フラボノールへの選択性において、両者に差はありませんでした。 |
| したがって、本研究の主な目的は、予備的改変後の Darco G-60 吸着剤を使用した アロニア・メラノカルパの濃縮フラボノール分画抽出物が動物の抗酸化システムおよびシクロホスファミド (CP) によってラットに誘発される免疫抑制に対する生体内マクロファージの貪食に及ぼす影響を調査することです。 |
| 2. 結果 |
| 2.1. 抽出物の化学組成と抗酸化活性 |
| 試験した抽出物中の糖類と天然抗酸化物質の総含有量を表1に示す。アロニア・メラノカルパの元の70%エタノール抽出物中のフラボノイド含有量は、総アントシアニン含有量の2.3倍低く、これは他の研究結果と一致している[30]。 |
| 表1.アロニア・メラノカルパ果実のエタノールおよびフラボノール抽出物中の糖類および天然抗酸化物質の総含有量(乾燥物ベース)。 |
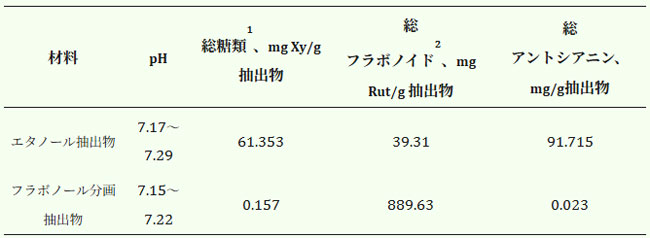 |
| 1 キシロース当量 (Xy) あたりの総糖含有量。2 ルチン (Rut) 当量あたりの総フラボノイド。 |
| 他の研究によると、本研究で使用した70%エタノールは、毒性が低く、選択性が低いポリフェノールの抽出率が高いことから、最適な抽出剤であることが示されています[31,32,33]。Darco G-60(改良炭素クロマトグラフィー吸着剤)処理では、70%エタノールチョークベリー抽出物と比較して糖含有量が低下し(99.74%減少)、フラボノイド総量は39.3 mg/gから889.63 mg/g(乾燥重量ベース)に増加しました。アントシアニン量はさらに減少し、平均含有量は99.75%減少しました。 |
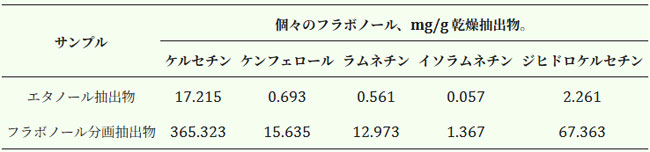
| フラボノール抽出物の抗酸化作用は、フラボノールに起因していると考えられています。抽出物中のアントシアニンの残留量は、抗酸化活性に大きく寄与しません。アロニア・メラノカルパの2種類の抽出物に含まれる主要なフラボノールは、カラムにおける保持時間、分光学的特性、およびフラグメンテーションパターンに基づき、HPLCによって同定されました。5種類のフラバノールが同定されました(表2)。そのうちケルセチンが主成分であり、フラボノール画分中のフラボノイド総数の41%、エタノール抽出物中のフラボノイド総数の43.8%を占めています。ケンフェロール、ラムネチン、イソラムネチン、ジヒドロケルセチンは、その他の同定されたフラボノールです。 |
| 表2. アロニア・メラノカルパ果実のエタノール抽出物およびフラボノール画分中に同定された個々のフラボノール量 |
 |
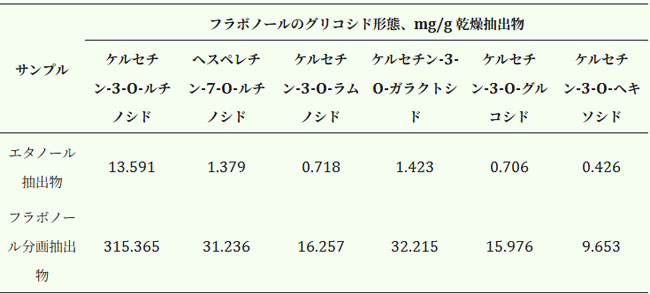
| 本研究では、得られたフラボノール総量の約半分を占める6種類のグリコシル化フラボノールも同定されました。主要成分はルチン(ケルセチン-3-O-ルチノシド)で、エタノール抽出物では総フラボノイド含量の34.6%、フラボノール抽出物では35.4%を占めました。残りの化合物は、ヘスペリジン(ヘスペレチン-7-O-ルチノシド)、ケルセチン-3-O-ラムノシド、ケルセチン-3-O-ガラクトシド、ケルセチン-3-O-グルコシド、ケルセチン-3-O-ヘキソシドでした(表3)。 |
| 表 3. アロニア メラノカルパ果実のエタノール抽出物およびフラボノール画分中に同定されたグリコシル化フラボノールの量 |
 |
| さらに、フェノール酸、特にクロロゲン酸およびネオクロロゲン酸が、乾燥重量基準でそれぞれ0.517mg/gおよび0.439mg/g検出された。これらの酸はエタノール抽出物では検出されず、検出限界以下であった。これらの酸はフラボノール抽出物中に濃縮されていた。 |
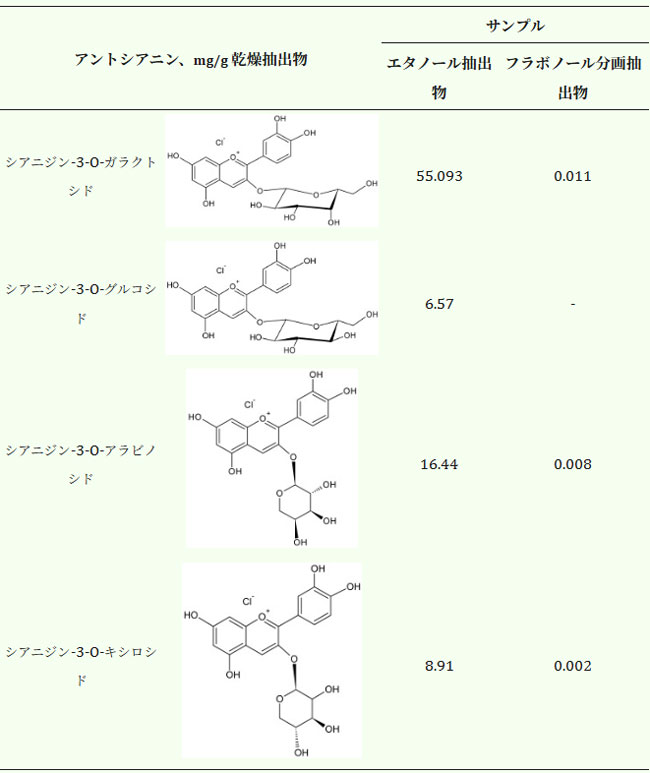
| 親水性HPLCの逆相カラムを用いることで、フラボノール画分中に低濃度で存在していた残りのアントシアニンを同定することができました。同定された化合物には、シアニジン-3-ガラクトシド、シアニジン-3-アラビノシド、シアニジン-3-キシロシドが含まれていました(表4)。 |
| 表4. アロニア・メラノカルパ果実のエタノール抽出物とフラボノール画分中に同定されたアントシアニン量。 |
 |
| HPLC分析後、各フラクション中の主要化合物を同定しました。薄層クロマトグラフィー(TLC)の結果、フラクション4、6~8、12、14、20~22、および24には1つの主要成分が含まれていました。フラクション10には2種類の化合物が含まれていましたが、フラクション16~17には3種類の化合物が含まれていました。これらを分離できなかった理由は、使用した物質の吸収特性が類似していることによるものです。同定されたフラボノールの定量値は表5に示します。分画クロマトグラムは図S1に示します。 |
表5. 個々のフラボノール画分のカラムクロマトグラフィー出力。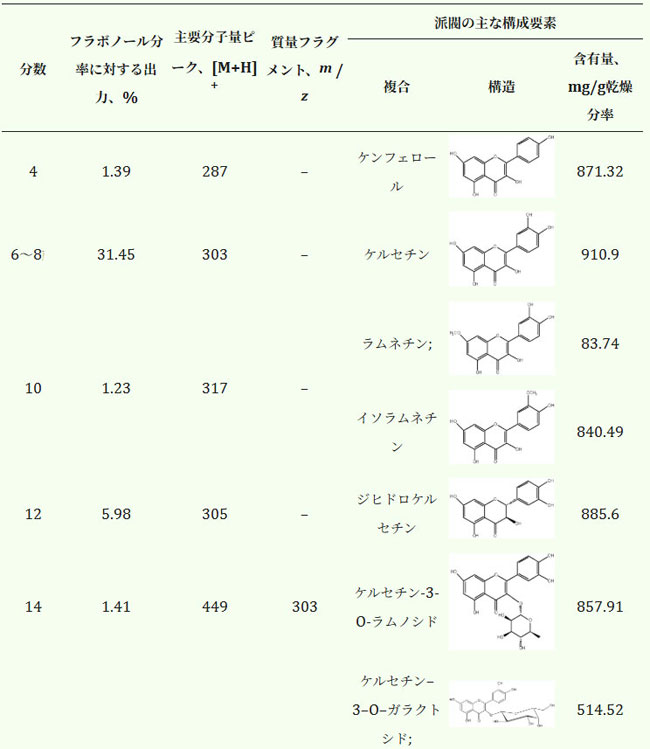 |
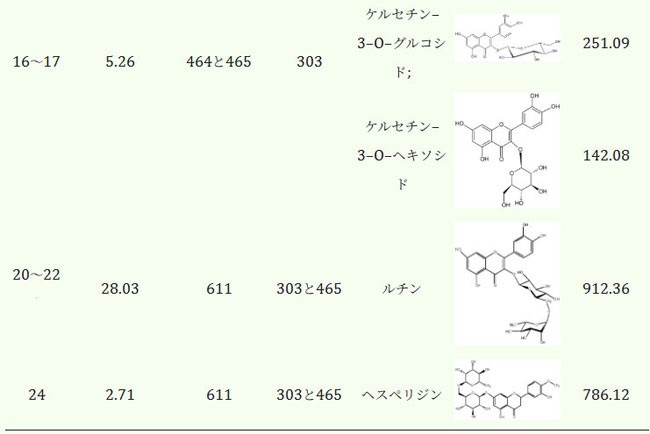 |
| フラボノール分画中の主要化合物はケルセチンとルチンであり、合わせて全抽出物量の68.07%を占めていることから、フラボノール抽出物の抗酸化メカニズムはこれら2つの化合物に基づいていると考えられます。そこで、フラボノール抽出物を、ケルセチン(表5、分画6~8)とルチン(表5、分画20~22)を主成分とする高純度の成分に分離し、その抗酸化特性を評価する並行研究を実施しました。 |
| エレクトロスプレーイオン化(ESI)質量スペクトルは、陽イオンモード(図S2)で得られ、プロトン化イオン[M+H]+(ここで、H = 1(プロトンの質量)[34])が形成されました。 フラクション4、6〜8、10、および12のESI質量スペクトルにはそれぞれ1つの一次イオンピークが含まれていました。 ケルセチン-3-O-ラムノシドに関連する一次信号に加えて、ケルセチンフラグメントに関連する質量フラグメンテーションピークがあるように見えます。 フラクション20〜22および24は、ケルセチン-単糖類の組み合わせに関連するm / z 465の追加のイオンピークを示しています。 フラクション16〜17に関しては、これらはm / z 464.5の高調波としてピーク強度をもたらします。ルチンとヘスペリジン(m/z = 610)、ラムネチンとイソラムネチン(m/z = 316)、ケルセチン-3-O-ガラクトシドとケルセチン-3-O-グルコシド(m/z = 464)、そしてケルセチン-3-O-グルコシド(M = m/z)はいずれも分子量が類似しているため、検証を確実にするためにHPLCを用いて組成分析を行いました。試験した全サンプルのクロマトグラムとピークの同定結果は、補足資料(図S2)に添付しました。処理と抽出を別々に行うことで、抗酸化作用のメカニズムを解明し、フラボノール抽出物の化学組成および個々の成分との相関関係を明らかにすることができます。 |
| 2.2. 抽出物のDPPH消去活性への影響 |
| アロニア・メラノカルパ果実フラボノール抽出物の抗酸化特性は、よく知られた簡便なDPPH消去法を用いて評価した。この方法は、特定のフラボノールのDPPHラジカル消去能試験にも用いられた[35]。ラジカル消去活性はEC50値(mg/mL)、すなわちDPPH濃度を50%低下させるのに必要な濃度で表された。表6に示すように、フラボノール画分は、天然のアロニア・メラノカルパ果実抽出物、および同等濃度(それぞれ9.3倍および10.4倍)のケルセチン溶液およびルチン溶液と比較して、優れたAOAを示した。DPPH消去能に関しては、フラボノール画分は天然由来の抗酸化物質であるケルセチンに最も近い値を示した。半最大阻害濃度は4.95倍高かった |
| 表 6. 個々のフラボノール AOA 分析、および DPPH 法による アロニア・メラノカルパからの抽出物。 |
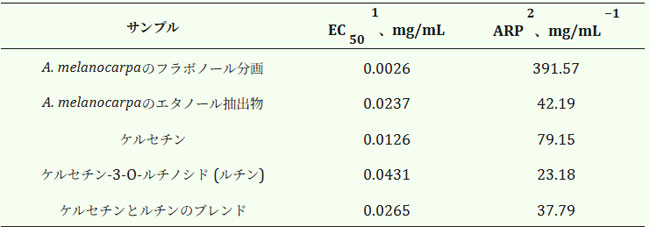 |
| 1 EC50 - DPPH の初期濃度を 50% 低減する有効濃度。2 ARP - 1/EC50 として定義される抗酸化剤の有効性。 |
| 2.3. 調査化合物の化学発光活性 |
| 調査化合物の抗酸化活性は、ルミノール増強化学発光活性の研究によって検証された。化学発光は、その高感度により、抗酸化活性の試験方法としてより魅力的な方法である[36]。化合物を化学発光溶液に添加することで、発光を強めたり弱めたりすることができる。発光の弱まりが抗酸化活性の指標となると考えられる。 |
| 検査された抽出物のうち、活性化合物がケルセチンとルチンであるフラボノール画分は、ケルセチンとルチンを含む画分相当溶液を上回る、化学発光の顕著な阻害を示しました (図 1)。 |
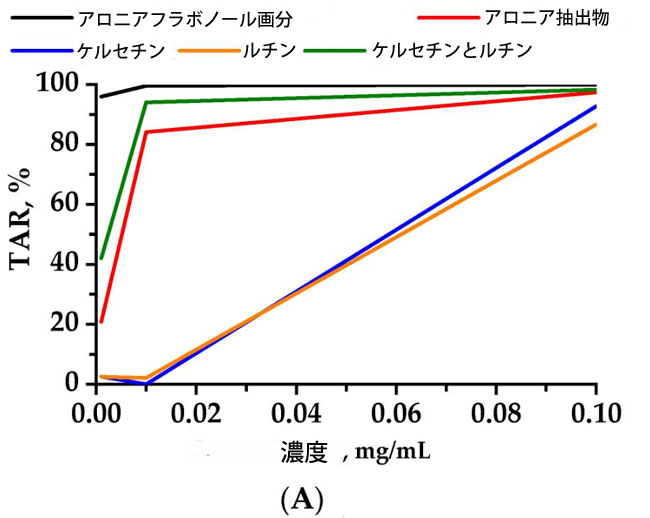 |
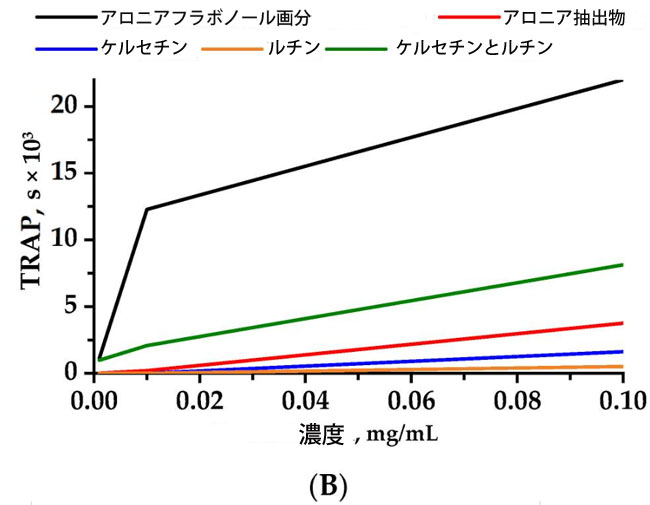 |
| 図1 化学発光強度の減衰(A)(TAR—総抗酸化反応性)および時間(B)(TRAP—総反応性抗酸化ポテンシャル)と被験化合物の濃度の関係。ルミノール増強化学発光の消光から得られた値。 |
| 調製したケルセチンおよびルチン製剤は、アロニアフラボノール画分の化学発光阻害時間プロファイルに従わなかった。0.1 mg/mLの濃度におけるケルセチンおよびルチンフラボノールの阻害時間プロファイルは、フラボノール画分よりもそれぞれ20,375秒および21,490秒短く、アロニアエタノール抽出物のプロファイルよりもそれぞれ2,131秒および3,246秒短かった。発光抑制法によって測定したケルセチンおよびルチンアロニアフラボノール抽出物、ならびにアロニアエタノール抽出物の化学発光活性プロファイルは、0.01 mg/mLのアロニアフラボノール抽出物よりもわずかに低く、それぞれ5.5%および15.5%であった。 |
| 2.4. 抽出物のリンパ芽球正常細胞への影響 |
| 抽出物およびブラックチョークベリーフラボノール抽出物の毒性を評価するため、ヒトリンパ芽球RPMI-1788細胞株を用いて細胞毒性を調べた(図2)。 |
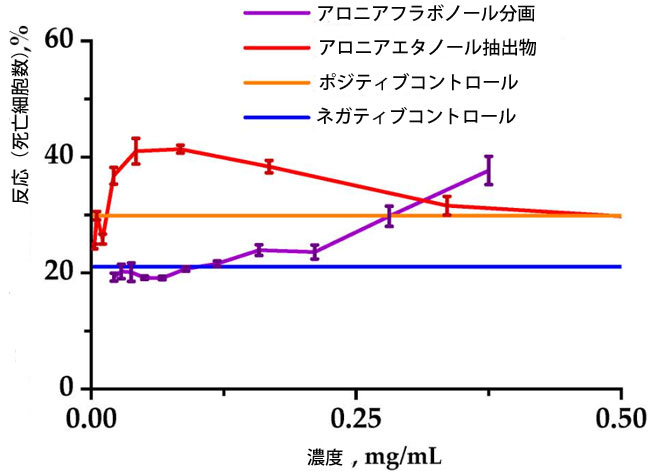 |
| 図2. 分析対象物質がRPMI-1788細胞の生存率に及ぼす影響。細胞(1.0 × 105個)を、シクロホスファミド(CP)を含まない培地(ネガティブコントロール)と1.25 mg/mLのシクロホスファミドを含む培地(ポジティブコントロール)の200 µLで最大48時間培養した。生細胞はHoechst/貪食指数蛍光色素を用いて検出し、フローサイトメーターで計数した。データは3回の独立した実験の平均値を示す。エラーバーは標準偏差を示す。 |
| 各サンプルの生細胞数を分析した結果、比較的低濃度のアロニアエタノール抽出物とシクロホスファミド(1.25 mg/mL)を併用した培養液中で細胞を24時間培養すると、正常ヒト細胞に対して顕著な細胞毒性効果が認められました。0.25 mg/mL以下の濃度では、アロニアフラボノール分画は、シクロホスファミド誘発ストレス下におけるリンパ芽球細胞の生存率に対して保護効果を示しました。 |
| 2.5. ラット末梢血の血液学的検査 |
| 血液学的検査の結果は、全体的な健康状態、骨髄の活性、そして溶血などの血管内への影響の可能性に関する重要な情報を提供します。 |
| 図3および図4によると、研究対象の製剤は、7日間積極的に投与されたラットの白血球に対して有意な影響を示さなかった。しかし、シクロホスファミドに24時間曝露してから8日目には、研究対象の全群で白血球数の有意な減少が認められ、1日目の値と比較して、C群(コントロール)では2倍、Q群(ケルセチン50 mg/kg)では2.4倍、P群(乾燥基準でアロニアフラボノール抽出物50 mg/kg)では1.85倍減少した(p < 0.05)。その後7日間は有意な変化は認められなかったが、21日目にはQ群とP群で白血球数が減少した。 |
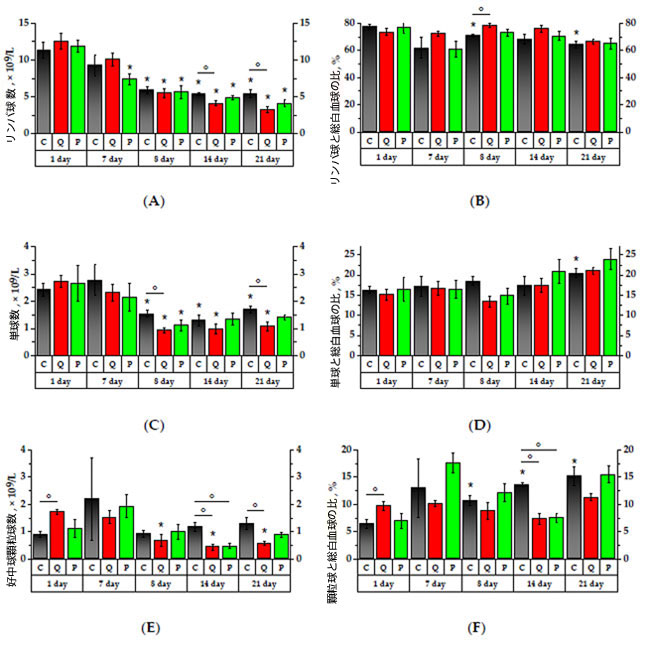 |
| 図3.白血球プロファイル |
(A) リンパ球 (LYM) 数、(B) リンパ球と総白血球の比 (LYM%)、(C) 単球 (MON) 数、(D) 単球と総白血球の比 (MON%)、(E) 好中球顆粒球 (GRA) 数、(F) 顆粒球と総白血球の比 (GRA%)。* p < 0.05、実験初日と比較した有意差、° p < 0.05、動物群間の有意差。 C群(コントロール)、Q群(抽出物のフラボノール画分と同等の濃度のケルセチンとルチンの溶液)、P群(果実抽出物から得られたフラボノール画分) |
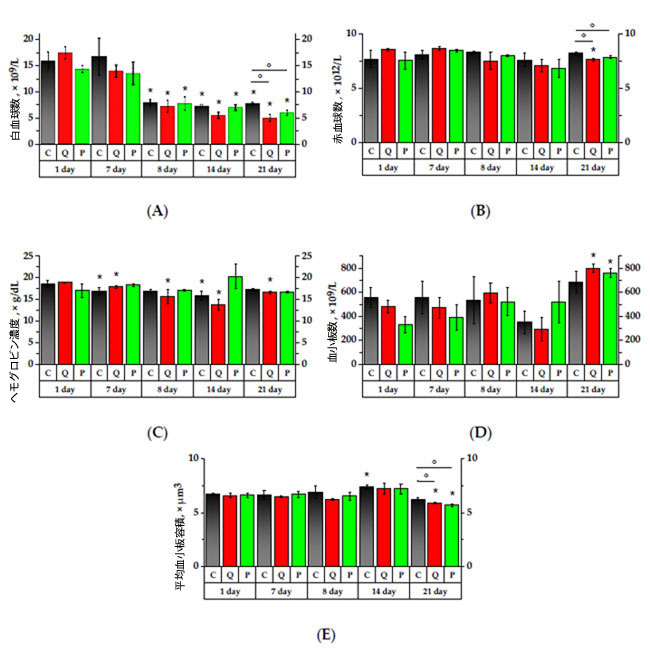 |
| 図4. 実験動物の全血の主な血液学的検査結果 |
A) 白血球(WBC)数、(B) 赤血球(RBC)数、(C) ヘモグロビン(HGB)濃度、(D) 血小板(PLT)数、(E) 平均血小板容積(MPV)。* p < 0.05、実験初日と比較した有意差、° p < 0.05、動物群間の有意差。 C群(コントロール)、Q群(抽出物のフラボノール画分と同等の濃度のケルセチンとルチンの溶液)、P群(果実抽出物から得られたフラボノール画分) |
| アロニアフラボノール画分を7日間摂取した後、P群でリンパ球が1.6減少しました(p < 0.05)。24時間のシクロホスファミド曝露後、リンパ球の絶対数は調査したすべての群で有意に減少し、1日目の初期値と比較して、C群で1.9倍、Q群で2.3倍、P群で2.1倍になりました。リンパ球比率(LYM%)は、実験1日目と比較してC群で1.1倍減少しましたが、Q群はC群と比較して1.1高いリンパ球比率%を示しました(p < 0.05)。その後の7日間で、実験8日目と比較してQ群とP群のリンパ球の絶対数はそれぞれ1.3倍と1.1倍減少し、C群と比較してQ群では1.3倍減少しました(p < 0.05)。 |
| シクロホスファミド投与後の単球数(MON)は、1日目の値と比較して、対照群では1.6倍、Q群では2.9倍、P群では2.4倍減少しました(p < 0.05)。8日目、14日目、21日目には、Q群の単球値はC群の1.7倍低くなりました(p < 0.05)。21日目には、単球比(単球数%)は有意に増加し、1日目の値と比較して、対照群では1.3倍、Q群では1.4倍、P群では1.5倍になりましたが、Q群では単球の減少がC群の1.6倍低くなりました(p < 0.05)。 |
| 研究初日、Q群の顆粒球(GRA)数は対照群の1.5倍であった。ケルセチンとルチンの混合物を7日間摂取した結果、ラットの顆粒球絶対数は1.7倍に増加し、顆粒球比率(%)の増加はQ群とP群でそれぞれ基準値の1.1倍と2.5倍にまで上昇した。シクロホスファミドに24時間曝露後、7日目にP群の顆粒球絶対数は1.9減少したが、顆粒球%は対照群とP群の両群で1.7倍に増加した(p < 0.05)。14日目には、Q群とP群で対照群に対して顆粒球と顆粒球比率(%)の両方の減少が観察された(p < 0.05)。 21日目には、C群の顆粒球比率(%)は試験開始1日目と比較して2.4倍増加しました。Q群およびP群ではそれぞれ1.2倍および2.2倍(p < 0.05)増加し、Q群の値はC群よりも低かった(p < 0.05)。 |
| シクロホスファミドへの24時間曝露後、P群では赤血球(RBC)が1.1分の1に減少しました(p < 0.05)。試験開始14日目には、Q群とP群の赤血球数は7日目と比較していずれも1.2分の1に減少しました。P群では、赤血球数は7日目と8日目よりも低くなりました(p < 0.05)。21日目には、Q群とP群の赤血球数は、C群と比較してそれぞれ1.09分の1と1.05分の1に減少しました(p < 0.05)。 |
| 研究開始7日目に、対照群およびQ群のヘモグロビン(HGB)濃度は、それぞれ1日目と比較して1.09倍および1.06倍減少した(p < 0.05)。シクロホスファミドに24時間曝露後、Q群では1日目と比較してヘモグロビン濃度が1.2倍減少し、P群では7日目と比較して1.1倍減少した(p < 0.05)。14日目には、対照群およびQ群のヘモグロビン濃度は、それぞれ研究開始1日目と比較して1.2倍および1.4倍低下したのに対し、P群のヘモグロビンは増加する傾向にあった。 |
| シクロホスファミドに1日間曝露後、ケルセチンおよびルチンを投与されたラットの平均血小板容積(MPV)は、7日目と比較して減少し、C群と比較して1.1倍低かった(p < 0.05)。14日目には、Q群の平均血小板容積は8日目と比較して1.1倍増加したのに対し、平均血小板容積対照群では試験開始1日目と比較して1.1倍高かった(p < 0.05)。 |
| 研究中、血小板には大きな変化は見られませんでしたが、シクロホスファミドに曝露されたQ群 と P群 では 血小板が増加する傾向があり、曝露後 7 日目にC群とQ群では血小板が減少する傾向がありました。 |
| 2.6. 白血球貪食活性 |
| 好中球および単球貪食活性試験の結果を図5および図6に示す。便宜上、初日のデータを100%として、残りのパーセンテージは初日に対する割合として計算した。 |
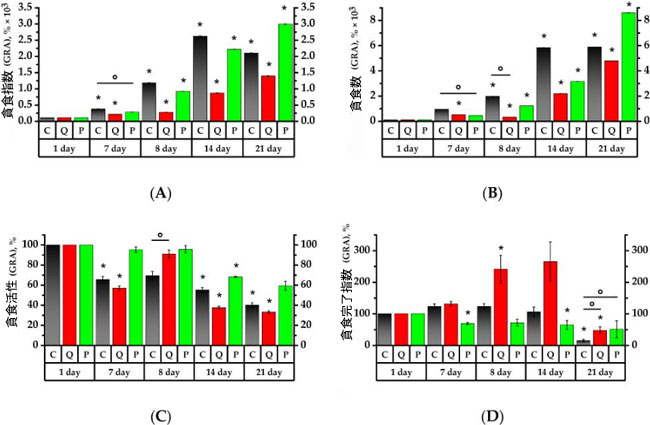 |
| 図5. ラット末梢血好中球顆粒球の貪食活性値 |
実験初日の各群のベースラインを100%とする。値(貪食指数(A)、貪食数(B)、貪食活性(C)、貪食完了指数(D))は%で表す。* p < 0.05:実験初日と比較した有意差、° p < 0.05:動物群間の有意差。 C群(コントロール)、Q群(抽出物のフラボノール画分と同等の濃度のケルセチンとルチンの溶液)、P群(果実抽出物から得られたフラボノール画分) |
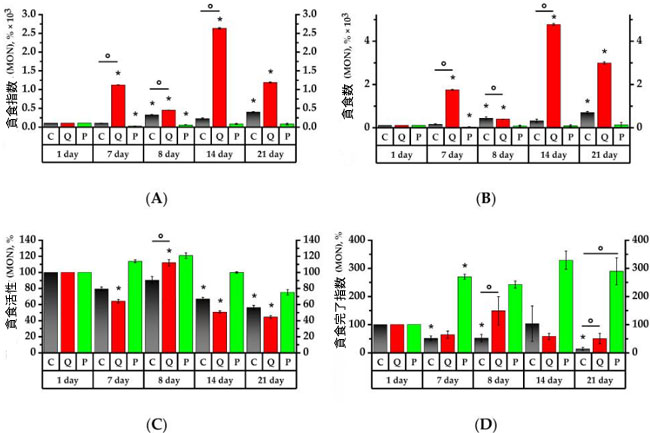 |
| 図6. ラット末梢血単球の貪食活性値 |
実験初日の各群のベースラインを100%とする。値(貪食指数(A)、貪食数(B)、貪食活性(C)、貪食完了指数(D))は%で表す。* p < 0.05:実験初日と比較した有意差、° p < 0.05:動物群間の有意差。 C群(コントロール)、Q群(抽出物のフラボノール画分と同等の濃度のケルセチンとルチンの溶液)、P群(果実抽出物から得られたフラボノール画分) |
| 7日目に、C群とQ群の顆粒球は、それぞれ研究初日と比較して貪食指数(PI)が3.6倍と2.1倍、貪食数(PN)が9倍と5倍増加しました(p < 0.05)。同時に、P群の顆粒球の貪食指数と貪食数は、7日目に、C群の同日の値と比較して、それぞれ1.9倍と2.25倍低くなりました(図5)。Q群の単球に関しては、貪食指数と貪食数の値は、C群と1日目の値と比較して、それぞれ15倍と22倍増加しました。一方、P群では、値は研究初日と比較して減少しました(p < 0.05)(図6)。 |
| 7日目には、C群の顆粒球貪食活性(PA)が1.5倍減少したのに対し、Q群では顆粒球と単球の顆粒球貪食活性がそれぞれ試験1日目と比較して1.75倍と1.6倍低下した。P群では、試験1日目のC群と比較して、顆粒球と単球の顆粒球貪食活性がそれぞれ1.4倍と1.3倍低下した(p < 0.05)。 |
| 貪食完了指数(PCI)は、P群では試験開始1日目と比較して、顆粒球が1.45倍減少し、単球が2.7倍増加したことを示した(p < 0.05)。C群の単球貪食完了指数は、試験開始7日目には15倍減少した(p < 0.05)。 |
| シクロホスファミドに24時間曝露後、曝露前の結果とは対照的に、C群では顆粒球の貪食指数が3.2倍、P群では3.3倍に増加した。シクロホスファミド曝露1日後、C群とP群の両群において、シクロホスファミド投与前と比較して顆粒球の貪食指数値がそれぞれ3.2倍と3.3倍に上昇した。MONO 貪食指数はC群で3.2倍、P群で2.4倍増加した(p < 0.05)。顆粒球貪食指数は7日目と比較してQ群で1.3倍増加した。一方、MONO 貪食指数は2.5倍減少し、同日のC群と比較して3.4倍低かった(p < 0.05)。 7日目の結果では、貪食指数と同様に、顆粒球および単球の貪食数は、C群ではそれぞれ2.2倍および2.8倍増加したのに対し、P群ではそれぞれ2.75倍および2.6倍増加しました(p < 0.05)。Q群では、顆粒球および単球の貪食数はそれぞれ7日目と比較して1.6倍および4.4倍減少しました(p < 0.05)。 |
| C群およびP群の活性化顆粒球および単球数については、1日目の顆粒球貪食活性はC群を下回ったままであった。7日目と比較すると、Q群の顆粒球貪食活性はそれぞれ1.6倍および1.7倍増加し、同日のC群の顆粒球および単球の顆粒球貪食活性の1.5倍を確実に上回った(p < 0.05)。 |
| 試験開始8日目において、C群では貪食完了指数に有意な変化は認められなかったが、Q群では顆粒球およびMONOの貪食完了指数が試験開始7日目と比較してそれぞれ1.8倍および2.3倍に上昇した。これらの値は、同日の貪食完了指数基準値と比較してそれぞれ1.8倍および2.5倍と有意に高かった。 |
| シクロホスファミド導入後 7 日で、8 日目と比較して、Q群 の貪食指数は 3.1 倍、P群 では 2.4 倍増加しました (p < 0.05)。同様に、研究の 8 日目と比較して、Q群で顆粒球の 貪食数は 7.2 倍、P群で 2.6 倍高くなりました (p < 0.05)。Q群 の単球の 貪食指数と貪食数 はそれぞれ 5.9 倍と 12.1 倍の増加を示しましたが、C群の単球の 貪食指数 は 8 日目と比較して 1.4 倍低下しました (p < 0.05)。特に、Q群 の単球の 貪食指数と 貪食数 が、コントロール値よりもそれぞれ 2.5 倍と 2.2 倍有意に高かったことは注目に値します。P群の単球の貪食指数と 貪食数 は 7 日目と比較して 8 日目に高くなりましたが、その後これらの値に有意な増加は見られませんでした。 |
| シクロホスファミド導入後7日目の顆粒球貪食活性は、Q群では試験開始8日目と比較して単球で31.1%、顆粒球で28.8%有意に減少した。14日目には、P群の顆粒球の顆粒球貪食活性が試験開始1日目と比較して10.3%有意に低下し、C群の顆粒球および単球の顆粒球貪食活性はそれぞれ試験開始1日目と比較して7.1%、9%低下した(p < 0.05)。 |
| 貪食完了指数に関しては、C群では14日目に有意な変化は見られませんでしたが、Q群の貪食完了指数は試験8日目と比較して2.6倍減少し(p < 0.05)、顆粒球の貪食完了指数は8日目と同程度に高値を維持しました。8日目と比較して、P群では単球の貪食完了指数が増加しましたが、顆粒球の貪食完了指数は8日目の値で一定であり、1日目と比較して1.6倍減少しました。 |
| Q群およびP群の顆粒球貪食数は、シクロホスファミド投与後14日目(21日目)に、投与14日目と比較してそれぞれ2.2倍および2.7倍増加した(p < 0.05)。Q群およびP群の顆粒球貪食指数値は、投与8日目と比較してそれぞれ5.1倍および3.2倍有意に増加した(p < 0.05)。Q群の単球貪食数は投与8日目と比較して7.6倍の増加を示した。P群では、投与7日目と比較して4.3倍の増加を示した(p < 0.05)。 |
| 貪食活性値は 21 日目も同じままでしたが、Q 群では顆粒球の 貪食活性がC群と比較して 8.2% 低いことがわかりました (p < 0.05)。 |
| Q群の顆粒球および単球の貪食完了指数は、C群と比較してそれぞれ2.9倍および5.6倍高かった。P群でも同様で、それぞれ3.3倍および4.2倍高かった(p < 0.05)。C群の顆粒球および単球の貪食完了指数は、14日目と比較してそれぞれ7.2倍および7.8倍減少した。Q群の顆粒球の貪食完了指数は、14日目と比較して5.7倍減少した(p < 0.05)。 |
| 2.7. 自発性および活性化好中球化学発光活性の研究 |
| 化学発光、特にルミノール増強化学発光は、貪食細胞の評価に広く用いられている[37]。化学発光(CL)は、活性化貪食細胞によって生成される活性酸素種(ROS)の定量的指標である[38]。しかし、化学発光は細胞の貪食機能だけでなく、活性酸素種生成に関与する細胞内酸化代謝反応も測定する。化学発光は貪食細胞の殺菌活性と密接に関連していると考えられている[39]。これが、顆粒球の機能を調査する臨床研究において化学発光が用いられる主な理由である。 |
| 7日間にわたって、C群とP群は、安静時の化学発光の自発的な強度(Imax)と濃度時間曲線下面積(AUC)の有意な自発的な強度が、それぞれC群で5と4.5倍、P群で5.6と5倍であることが示されました(図7)。研究したすべての群で、1日目のデータに関連する化学発光曲線の傾きが増加し、C群で4.3倍、Q群で3.9倍、P群で10.8倍でした。これは、C群の値よりも2.2倍高かったです。安静時の化学発光ピークを示す時間(Tmax)はQ群で低下し、コントロール値よりも2.8倍低かったです(図S3)。 |
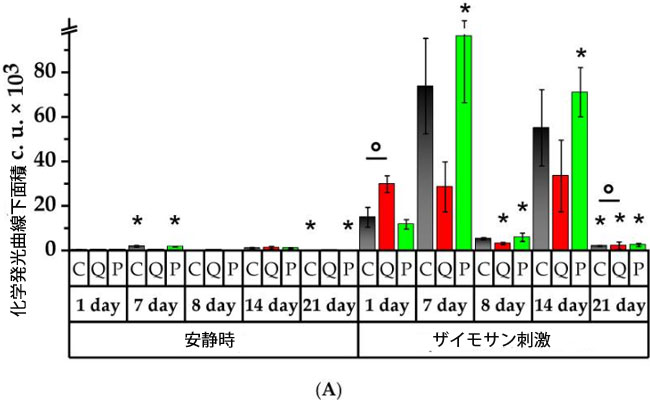 |
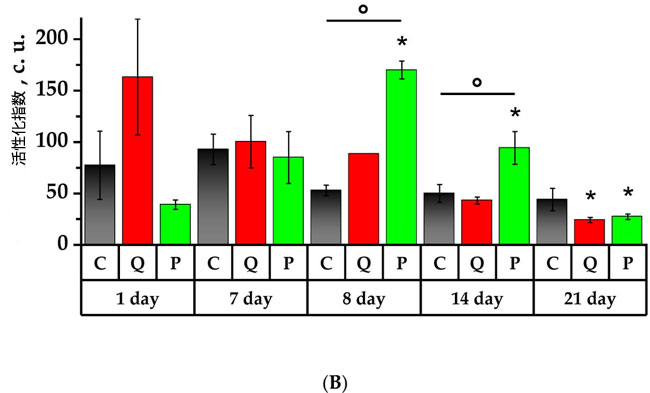 |
| 図7.ラット好中球の自発的およびザイモサン活性化化学発光の値 |
| (A)化学発光曲線下面積(AUC、c.u.)、(B)活性化指数(Iact、c.u.)。* p < 0.05、実験初日と比較した有意差、° p < 0.05、動物群間の有意差。 C群(コントロール)、Q群(抽出物のフラボノール画分と同等の濃度のケルセチンとルチンの溶液)、P群(果実抽出物から得られたフラボノール画分) |
| ザイモサン誘発化学発光反応に対する好中球の反応は、P群において自発的な強度および化学発光曲線下面積パラメータの有意な増加を伴うことが観察され、それぞれ10.3倍および8.2倍の増加を示し、C群と比較して有意に高かった。1日目と比較して、C群およびP群ではザイモサン誘発反応の運動速度が自発的に増加した。Q群の誘発化学発光ピークを示す時間は、C群の1日目に記録された値と比較して1.2倍減少し、Q群およびP群ではC群の1日目の値と比較して有意に低かった。 |
| 研究8日目、シクロホスファミド投与の翌日、自発的化学発光、化学発光曲線下面積および傾きは、7日目と比較して、C群では14.7倍、18.6倍、6.4倍低下し、P群では15.2倍、22.3倍、46.4倍低下しました(p < 0.05)。C群の化学発光ピークを示す時間値は、1日目の値と比較して2.7倍有意に低下しました。ザイモサン誘導化学発光は、研究のすべての群において、7日目と比較して8日目に自発的な強度、化学発光曲線下面積および傾きの有意な低下を示しました。注目すべきは、Q群の化学発光曲線下面積がC群の化学発光曲線下面積よりも1.7倍有意に低く、化学発光ピークを示す時間が短縮し、対照値よりも1.2倍有意に低かったことです。活性化指数(Iact)は、P群では初日と比較して4.4倍と有意に増加し、C群の3.2倍を上回りました(p < 0.05)。 |
| 試験開始14日目には、自発的化学発光のパラメータにおいて、C群およびP群の好中球の殺菌活性が試験開始8日目と比較して上昇していることが示され、自発的な強度はそれぞれ7.5倍および9倍、化学発光曲線下面積は9.7倍および13.1倍、傾きは90倍および13.3倍増加した(p < 0.05)。自発的化学発光のピークを示す時間(Tmax)は、P群では試験開始1日目と比較して1.6倍減少したのに対し、Q群では試験開始7日目と比較して3.6倍増加した(p < 0.05)。 |
| 14日目に、ザイモサン誘導性化学発光の結果では、8日目の値と比較して、自発的な強度、化学発光曲線下面積、傾きが有意に増加し、それぞれ、C群で12、10.5、13.8倍、Q群で8.8、10.8、6.8倍、P群で13.1、6.4、13.9倍増加しました(p < 0.05)。誘導性化学発光のピーク時間は、研究したすべての群で1日目と比較して減少し、C群とP群では7日目と比較して減少しました。Q群では逆のケースが観察され、8日目と比較して化学発光ピークを示す時間が1.1倍増加しました。14日目に、C群とQ群の活性化指数(値は、7日目に記録された値と比較して、それぞれ1.9倍と2.3倍減少しました。 1日目と比較して、P群では活性化指数(が2.4倍高くなっており、C群の8日目と14日目に得られた値と比べてそれぞれ1.8倍と1.9倍有意に高かった(p < 0.05)。 |
| 試験開始21日目の背景化学発光では、自発的な強度や化学発光曲線下面積などのパラメータにおいて、C群およびP群の好中球の殺菌活性が試験開始1日目、7日目、14日目と比較して有意に低下していることが明らかになった。同様に、反応速度はC群およびP群では7日目および14日目と比較して低下したのに対し、P群では8日目と比較して上昇した。P群では、好中球の化学発光ピークを示す時間(Tmax)は試験開始日の2.4分の1(p < 0.05)に低下した。誘発化学発光では、研究対象の全群において、1日目、7日目、14日目と比較して自発的な強度、化学発光曲線下面積、傾きの値が減少していることも明らかになった。しかし、Q群の値は次のように基準を超えた。自発的な強度は1.6倍、化学発光曲線下面積は1.1倍、傾きは2倍超過した(p < 0.05)。21日目には、化学発光ピークを示す時間値は研究対象の各群の初期値よりも低かった。C 群の化学発光ピークを示す時間値は8日目と比較して1.11倍低かったのに対し、Q群とP群では、この値は8日目と比較して1.15倍と1.05倍高かった(p < 0.05)。P群の化学発光ピークを示す時間はC群の1.13倍長かった(p < 0.05)。 21日目には、C群およびQ群の活性化指数(は7日目と比較してそれぞれ2.1倍および4.2倍減少しました。P群では、活性化指数(値は1日目、8日目、14日目と比較してそれぞれ1.4倍、6.2倍、3.5倍低下しました(p < 0.05)。 |
| 2.8. 脂質過酸化試験 |
| ラットの脂質過酸化(LP)を調査し、各物質が動物の抗酸化システムに与える影響を明らかにした(図8)。 |
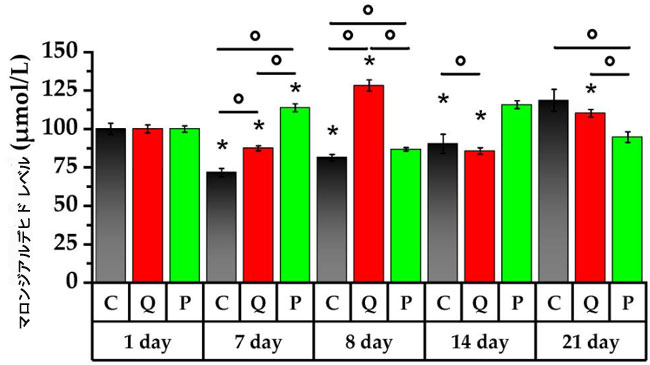 |
| 図8. ラットの末梢血中の マロンジアルデヒド(MDA)レベル |
* p < 0.05、実験初日と比較した差異の有意性、° p < 0.05、動物群間の差異の有意性。 C群(コントロール)、Q群(抽出物のフラボノール画分と同等の濃度のケルセチンとルチンの溶液)、P群(果実抽出物から得られたフラボノール画分) |
| 研究開始7日目、C群とQ群のラットの血液サンプルでは、マロンジアルデヒド(MDA)値がそれぞれ28%と13%減少しました。一方、アロニアフラボノールを摂取したラットのマロンジアルデヒド値は14%増加しました。 |
| 試験開始8日目にシクロホスファミドを単回投与したところ、C群では試験開始7日目と比較して脂質過酸化生成物の蓄積が14%増加し、Q群では47%増加しました。これは、毒性物質への曝露に対する身体の適応反応を示すものです。対照的に、アロニアフラボノールを投与されたラット群では、マロンジアルデヒドが23%減少しました(p < 0.05)。 |
| その後7日間にわたり、C群とアロニアフラボノール分画を摂取したラット群のマロンジアルデヒド値はそれぞれ11%と33%上昇しました。一方、Q群ではマロンジアルデヒド値は33%減少しました(p < 0.05)。 |
| 21日目、アロニア画分を投与されたラットの血中脂質過酸化産物は、試験開始14日目と比較して18%減少しましたが、Q群では14日目と比較して29%増加しました(p < 0.05)。さらに、C群における脂質過酸化の増加は試験開始21日目にのみ認められ、8日目と比較して46%の有意な増加を示しました。対照的に、Q群ではシクロホスファミド投与後1日目に脂質過酸化産物の最高値が観察され、P群ではシクロホスファミド投与後7日目に最高値が観察されました。 |
| 3. 考察 |
| 本研究では、アロニア・メラノカルパ果実抽出物中のフラボノール分画が好中球活性化、貪食作用、殺菌反応、および抗酸化能に及ぼす影響を調査し、フラボノール分画と同濃度のケルセチンやルチンなどの主要成分の混合物と比較した。 |
| 本研究では、アロニア・メラノカルパの果実からフラボノールを豊富に含む画分を得るために、改良Darco G-60活性炭を用いた。フラボノールの単離、分離、精製には、主に7種類のマクロポーラス樹脂(X-5、D4020、LS-305、LS-46D、D101、NKA-9)が用いられ、これらはそれぞれ異なる物理的特性を有する(表7)。一方、炭素吸着剤はフェノール化合物に対して高い吸着能を持つことが広く知られているが、天然化合物の単離においては、脱着係数が低く、特定のポリフェノール群に対する選択性が低いという欠点がある。石炭においては、この要因は化学活性化と官能基化によって解消されている。 |
| 表7. マクロ多孔性樹脂と炭素吸着剤の物理的特性の比較分析 |
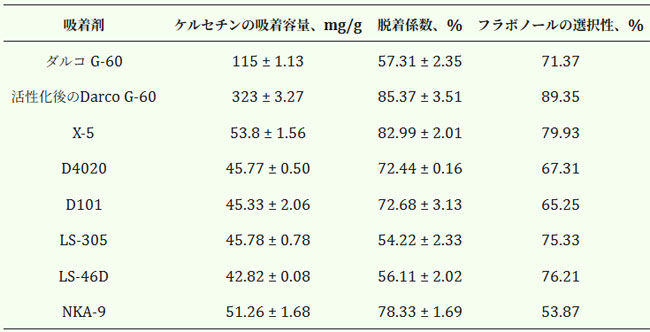 |
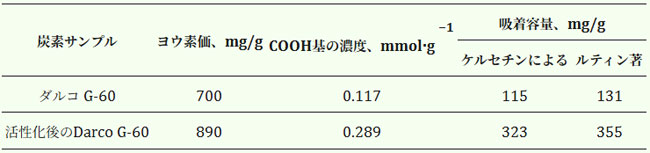
| 合成マクロ多孔性樹脂の中で、非極性X-5樹脂の吸着容量と脱着係数は、他の人工的に製造された吸着剤よりも高かった。使用時の初期のカーボンであるDarco G-60は、X-5吸着剤と比較して吸着容量が高く(2.1倍)、脱着係数が低い(44.8%低下)ことと、フラボノールへの選択性が高い(12%低下)ことが特徴であった。改質処理後、得られたカーボン吸着剤はケルセチンの吸着容量が3倍に増加し、相対的なマクロ多孔性樹脂X-5の脱着係数は2.4%、選択性は10%向上した。 |
| ルミノール強化化学発光の結果は、アロニアフラボノール分画が、AAPH抑制、アルキルラジカルまたはペルオキシラジカルの吸収、または酸化AAPHの還元によってルミノールの酸化を阻害できることを証明しています。 |
| シクロホスファミド効果に対する細胞保護作用の解析結果から、アロニアフラボノール分画は低濃度では正常なヒトリンパ球細胞に有益な影響を与える一方、高濃度では毒性作用を示すことが示唆されました。フラボノイドが酸化促進剤として作用するには、最適な濃度が存在するようです[40]。 |
| これまで、フラボノイド配糖体は細胞に取り込まれないことが報告されていた[41]。つまり、ルチンは親水性が高いため細胞内にほとんど浸透せず、生物学的効果を持たない可能性がある。一方、高濃度のフラボノイドは、内皮細胞傷害の危険因子となる可能性がある。RPMI-1788細胞株を用いた我々の研究結果は、高濃度フラボノイドの細胞毒性は、細胞内で活性酸素(ROS)を産生する能力によるものであることを示唆している[40]。 |
| 混合物中の異なるフラボノイドの間には、拮抗的な相互作用と相乗的な相互作用の両方があることが認められている [42]。前者の場合、フラボノイド混合物の抗ラジカル活性は、個々の成分の抗ラジカル活性の合計よりも小さく、後者の場合、それよりも大きい。相乗効果と拮抗作用は、調査中の物質の抗ラジカル活性を決定するために使用される方法によっても異なります。フラバノールのフリーラジカルを遮断する能力を研究する場合、この方法ではケルセチンとルチンの相互作用が拮抗的であることが示されています [43]。しかし、DPPH法とルミノール増強化学発光を使用したこの研究では、アロニアフラボノール画分中のケルセチンとルチンの相互作用で高い相乗効果が明らかになりました。抽出物中にケルセチン、ルチン、レスベラトロールが共存すると、各物質の抗酸化効果が強化されるという証拠もあります [44]。アロニアフラボノイド分画の総フラボノイド、および DPPH ラジカル消去活性と化学発光活性は相関しており、つまり、アロニアフラボノイドの大部分は抗酸化活性に関与しています。 |
| 以前、著者らはルチンがシクロホスファミド中毒を促進する役割を果たすことを明らかにしている[45]。ルチンの摂取は、炭素粒子のクリアランスが用量依存的に増加することから、貪食プロセスを強化するとみられる[46]。 |
| 動物血液の血液学的パラメータ分析の結果、アロニアフラボノール分画を7日間摂取してもラットの総白血球数に確実な変化は見られなかったことが明らかになりました。同時に、白血球相対数の減少と顆粒球数の増加が全群で観察されましたが、特にP群で顕著でした。同時に、C群および動物群にケルセチンとルチンの混合物を投与した後、ヘモグロビン濃度は正常範囲内に低下しました。 |
| 著者の Neboh と Ufelle [47] は、シクロホスファミド 治療が正球性正色素性貧血を誘発したことを明らかにしました。これは、DNA 合成と癌細胞の分裂、および骨髄前駆幹細胞を含む正常組織の増殖を阻害するアルキル化抗癌剤の特性と関連している可能性があり、その結果、汎血球減少症が発生します。白血球像については、シクロホスファミド は総白血球、リンパ球、および単球数の大幅な減少を引き起こしました [48]。このような結論は、シクロホスファミドの毒性代謝物であるホスホラミド マスタードに起因すると考えられます。ホスホラミド マスタードは骨髄細胞 DNA と反応してその機能不全を引き起こし、幹細胞の喪失と骨髄の新しい血液細胞の再生不能を引き起こす骨髄抑制剤であると考えられています [49]。さらに、シクロホスファミドは脾臓ナチュラルキラー細胞の活性を阻害し、脾臓細胞中のT-bet/GATA-3(Th1/Th2転写因子)のmRNA発現を抑制し、末梢血および組織中のリンパ球減少をもたらす[50]。 |
| シクロホスファミド曝露後24時間で、全ての動物群において免疫不全状態が等しく観察され、白血球総数は減少しましたが、白血球像は顆粒球増加とリンパ球減少の方向に推移しました。ただし、全ての群において顆粒球割合は減少しました。ケルセチンとルチンの混合物を摂取したラットの白血球像では、リンパ球増加、ヘモグロビン減少、平均血小板容積減少の方向に変化が見られました。アロニアフラボノール分画を摂取したラットでは、白血球像は顆粒球増加と赤血球減少の方向に推移し、正常範囲内にとどまりました。C群およびP群における好中球増多は、炎症誘発性メディエーター(IL-1β、IL-6、TNF-α)の活性化により、好中球の分化および成熟に重要な役割を果たす顆粒球マクロファージコロニー刺激因子(G-CSF)の産生が誘導された結果であると考えられる[51]。さらに、シクロホスファミド投与はリンパ節および脾臓のTh2型細胞におけるIL-5の発現上昇を誘導し、好酸球増多をもたらした[52]。 |
| 実験14日目、つまりシクロホスファミド暴露7日後、Q群とP群ではC群と比較して顆粒球割合と赤血球数の減少がみられた。Q群ではヘモグロビン濃度と血小板容積が減少したが、平均血小板数は増加した。著者Murphy K.J.らは、フラボノール化合物、特にカテキンがその抗酸化作用により血小板機能を阻害できることを示した[53]。これは、アラキドン酸代謝カスケード中に生成されるH2O2をポリフェノールが除去し、血小板凝集を引き起こす能力によるものと推定されている[54]。P群では血小板数が増加したが、これはおそらく血小板新生過程によるものと考えられる。 |
| 実験21日目には、C群とP群でも顆粒球含量の増加が観察され、全群で単球数が増加した。マクロファージと単球は炎症期の重要な細胞と考えられている[55]。これらの細胞は、微生物の貪食、細胞残骸、マトリックスメタロプロテアーゼの分泌による損傷したマトリックスの除去に関与している。サイトカインと成長因子の主な供給源としての役割に加えて、単球は線維芽細胞の増殖を刺激する[56]。実験群QとP群では、21日目に血小板数は増加したが、赤血球数と血糖値は減少した。平均血小板容積(MPV)は調査対象の全群で減少した。 |
| 貪食活性の分析により、予防的治療7日目および免疫抑制療法後にケルセチン・ルチン混合物を投与された動物群において、貪食された血液単球中の微生物数が増加していることが明らかになった。貪食顆粒球中の微生物数は、C群では実験14日目および21日目に増加し、フラボノール分画を投与された動物群では免疫抑制療法14日目に確実に増加し、C群の貪食顆粒球中の微生物数を上回った。 |
| 注目すべきは、シクロホスファミド導入に反応してケルセチン・ルチン混合物を投与されたラット群では、貪食された活性単球および顆粒球の数が確実に増加したが、その後の治療期間中は減少した点である。P群では、貪食された顆粒球数は実験開始14日目と21日目に初期値と比較して減少した。 |
| 貪食完了指数の研究では、アロニアフラボノール分画投与7日目に単球の消化能力が増加した一方で、顆粒球の消化能力は代償的に減少したことが示されました。同時に、C群の貪食完了指数は初期値と比較して減少しました。シクロホスファミド投与に伴い、ケルセチンとルチンの混合物を投与された動物群では、顆粒球と単球の貪食完了指数が増加し、7日後には単球の貪食完了指数は減少しました。21日目には、実験群Qと実験群Pの顆粒球と単球の貪食完了指数はC群よりも高くなりました。 |
| 上記のように、本研究で得られたアロニアフラボノール分画が単球の消化能力を活性化する作用は、主に健康な動物において顕著に現れました。同時に、ケルセチンとルチンの混合物を摂取させた動物では、健康な動物と免疫抑制状態の動物の両方において、好中球と単球の消化能力が活性化されました。さらに、ケルセチンとルチンの摂取は、シクロホスファミド投与後7日目には単球の貪食完了指数を、14日目には顆粒球の貪食完了指数を減少させました。 |
| ルチン(ケルセチン配糖体)は、アグリコン型(ケルセチン)よりも抗酸化活性が低いことが示されています。フラボノイド(フラボノイド配糖体)に含まれる糖鎖の量とその位置は、抗酸化活性において重要な役割を果たします。アグリコン型は、配糖体よりも抗酸化活性が高いことがしばしば見られます。配糖体は一般的にアグリコン型よりも抗酸化力が弱いと考えられていますが、グルコース残基がバイオアベイラビリティを向上させる場合があります[43]。ケルセチンは好中球の酸化代謝を強力に阻害します。しかし、フリーラジカルの消去に加えて、これらの化合物が好中球のエフェクター機能に作用するメカニズムが他にも存在する可能性があります。フラボノイドの抗炎症作用機序には、呼吸バーストおよび好中球の脱顆粒の阻害、アラキドン酸代謝の調節、炎症性サイトカインおよびケモカイン遺伝子発現の調節、細胞膜および細胞内シグナル伝達タンパク質との相互作用、ならびにフリーラジカルの消去などがある[57]。 |
| ラットを用いた免疫抑制実験では、ミリセチン、アピゲニン、ヘスペリジンなどのフラボノイドが、マクロファージの貪食能、リンパ球増殖能、ナチュラルキラー細胞の細胞傷害活性を高めることが確認された。また、化学療法薬の毒性を低下させ、腫瘍治療において相乗効果を示した[58]。フラボノイドの多標的薬理特性は、様々な免疫細胞や免疫メディエーターとの相互作用を促進し、腫瘍の免疫抑制性微小環境を様々なレベルで制御し、免疫監視を再開させ、腫瘍細胞に対する免疫応答を増強し、さらには腫瘍細胞を直接殺傷する効果も報告されている。このアプローチは、腫瘍関連マクロファージを標的とする他の薬剤に比べて優れている[59,60,61,62]。 |
| 好中球顆粒球におけるルミノール依存性化学発光の研究は、健常動物および免疫抑制動物における好中球顆粒球中のNADPHオキシダーゼ活性状態を特徴づける可能性を示した。自発発光およびザイモサン誘発性化学発光の分析パラメータ(自発的な強度および化学発光曲線下面積)に従い、C群と比較して、アロニア・メラノカルパのフラボノール画分の摂取に伴い、貪食細胞の殺菌活性が確実に増加することが観察された。ケルセチンとルチンの混合物を健常動物に投与すると、「呼吸バースト」の発生速度が増加し、健常動物の好中球顆粒球におけるNADPHオキシダーゼ活性の上昇が示された。 |
| 免疫抑制因子は、研究対象となったすべての群において、8日目に好中球のROS活性化能力を低下させることがわかった。シクロホスファミド導入翌日、Q群におけるザイモサン刺激による「呼吸バースト」により、化学発光ピーク時間が短縮し、化学発光曲線下面積が減少し、指標は確実にコントロール値を下回った。この活性は、混合物のROS受容作用、または混合物の存在下で細胞が受ける機能的変化のいずれかによって説明できる。ザイモサン刺激を受けた細胞は刺激を受けていない細胞よりも阻害されるので、後者の仮説の方がはるかに可能性が高い。さらに、混合物による化学発光放出の阻害はザイモサン存在下でより明白であるため、貪食細胞による酸素放出の阻害は、混合物がザイモサン依存性プロテインキナーゼC活性化に関与していることに依存している可能性がある[63]。研究の14日目(シクロホスファミド導入後7日目)、相対的休眠状態の好中球顆粒球と、ザイモサンでさらに刺激された呼吸バーストの両方が、Q群の化学発光時間を増加させました。実験の8日目と14日目に、アロニアフラボノール画分を摂取した動物の群で活性化指数が増加しました。活性化指数の値の増加は、好中球が機能活性化のための代謝リソースを持っていることを示しています。Q群の抗原ザイモサン刺激細胞に同様の変化がないことは、細胞の代謝リソースによって影響を受けるNADPHオキシダーゼの活性化速度に制限があることを示唆しています。14日目にP群で自発的な化学発光ピーク時間が短縮したことは、細胞代謝システムが高レベルのスーパーオキシドラジカルを生成する能力を示しています。 |
| 脂質過酸化プロセスは、活性酸素種の作用の結果として、細胞膜の完全性を破壊することで細胞死を引き起こします[64]。この研究では、フラボノールの抗酸化活性を推定するために脂質過酸化指数を使用し、in vivoで抗酸化活性を担う化合物を見出しました。分析の結果、シクロホスファミド導入後のC群とP群は、Q群と比較して脂質過酸化とフリーラジカル形成のレベルが低いことが明らかになりました。さらに、アロニアフラボノール画分を7日間摂取した後、マロンジアルデヒドが減少する傾向があり、これはフラボノール抗酸化剤がin vivoで免疫抑制動物の酸化ダメージを防ぐ有益な効果を示しています。シクロホスファミド導入後7日目にQ群で、シクロホスファミド導入後のフラボノール画分療法14日目にP群で、マロンジアルデヒドが初期値まで減少したことが観察されました。 |
| この研究では、フラボノールを豊富に含むアロニアベリーエキスが、健康な動物と免疫抑制ラットの両方において、血中マロンジアルデヒド濃度を低下させる効果はごくわずかであることが分かりました。生体内では、アロニアのフラバノール分画は、そのバイオアベイラビリティが限られているため、抗酸化活性をほとんど示さないことが示唆されています[65]。 |
| 著者ら[66]は、ケルセチンとルチンが酸化ストレス下における脂質過酸化および活性酸素種プロセスに関連する損傷を軽減する上でより優れた結果を示したと指摘している。本研究では、ケルセチンとルチンの溶液を摂取させたところ、免疫抑制ラットの脂質過酸化産物含有量が短期的に増加し、適切な投与7日後には減少した。 |
| 化学構造と抗酸化能の相関関係から、フラボノイドが強力な抗酸化活性を示すためには、C環のC-3位のヒドロキシル基、C2-C3炭素間の二重結合、およびC環のC-4位のカルボニル基が重要であることがわかっています。A環のC-5およびC-7位、およびB環のC-3'およびC-4'位のヒドロキシル基も、抗酸化活性を高めます。ケルセチンとルチンは、これらすべての構造的特徴を備えています。ルチンの糖部分は、立体障害により隣接するヒドロキシル基の抗酸化活性を低下させますが、腸内細菌叢によって対応するアグリコンケルセチンに加水分解され、生体内での効果も維持されます[67]。 |
| したがって、ルチンとケルセチンがスーパーオキシドイオンおよび脂質過酸化ラジカルと反応し、抗酸化機能を維持する能力は、これらのフラボノイドを使用してフリーラジカル病理と戦う可能性を示しています。 |
| 4. 材料と方法 |
| 4.1. サンプリング |
| 原料として、前研究 [33] で収集・特性評価したブラックパールチョークベリーの果実を使用した。成熟した散形花序状のアロニアの果実は、2022年9月の収穫期にシュイスキエ・ヤゴディ農場(イヴァノヴォ州)で収穫された(図9)。果実の最大直径は0.9 cm、質量の平均は1.1~1.3 gであった。果実は10本の茂みから無作為に採取し、1株あたり0.5 kgであった。果実収穫時、チョークベリーの茂みは樹齢6年であった。果実は蒸留水で洗浄して埃や汚染物質を除去し、綿布で乾燥させた後、更なる研究のために-35 °Cの冷凍庫で保存した。 |
 |
| 図9. イヴァノヴォ地方のブラックチョークベリー品種「ブラックパール」の果実 |
| 4.2. 改質炭素吸着剤の調製 |
| Darco G-60炭素(Thermo Fisher Scientific Inc、米国マサチューセッツ州ウォルサム)を120℃で恒量まで乾燥させ、LM 202ミル(LLC Plaun、ロシア・モスクワ)で約0.5~1 mmの粒径に粉砕した。必要な粒径は炭素ふるい分けによって得られた。炭素の改質は、密閉式加熱装置を備えた5Lセラミックチャンバーを備えた実験室用マッフル炉で行った。このマッフル炉は、反応領域を開始および活性化に必要な温度(700℃)まで加熱する。 |
| 反応ゾーンの温度は自動制御装置によって制御された。210℃の過熱蒸気と二酸化炭素の両方が活性化エリアに供給された。炭素活性化は1.5時間行われ、その後乾燥アルゴン気流で冷却された。改質後、吸収容量が増加した(表8)。ヨウ素指数は、滴定法[68]を用いて吸収されたヨウ素量から測定した。活性化前後の末端カルボキシル基の数は、電位差法および電流測定法[69]によって測定した。 |
| 表8.活性化前後の炭素の吸着パラメータ |
 |
| 得られた炭素は、その性質と親和性により、主にポリフェノール化合物を吸収することができます。 |
| 4.3. 抽出物の調製 |
| 本研究では、抗酸化特性を物質の化学組成との関係で検討した。第一段階は、冷凍果実からエタノール抽出物を得ることであった。冷凍アロニア果実は、粉砕管を強制冷却する実験室用ミル(KN 195 Knifetec、Labtec Foss、Hellirod、Denmark)でペースト状に粉砕し、アルゴン置換した平底三角フラスコで3段階浸軟抽出を行った。抽出は、バイオマスと溶媒の比率が1:5の70%エタノール溶液を用い、自動マグネティックミキサー(Ohaus、Guardian 7000、Parsippany、NJ、USA)を用いて、活性化合物の酸化を防ぐため、乾燥アルゴンを一定流量で流しながら、45℃で1.5時間、500rpmで混合して行った[33]。得られたホモゲネートは、酸化反応を避けるため、+5℃、11,000 rpmで15分間遠心分離し、大きな粒子と懸濁液を沈殿させた(H3-18KR遠心分離機、Hunan Kecheng Instrument EquipmentCo, Ltd.、長沙、中国)。抽出物は、ロータリーエバポレーター(LabTex Re 100-Pro、Labtech Company、Moscow, Russia)を用いて、30~32℃、13.3 mbarのウォーターバス上で溶媒が完全に除去されるまで濃縮した。乾燥抽出物は、さらなる分析のために-35℃の医療用冷凍庫で保管した。その後、抽出物は参照サンプルとして使用した。抽出物は1.3-プロピレングリコールに溶解し、研究用の1%溶液を調製した。 |
| 4.4. フラボノール画分の調製 |
| アロニア・メラノカルパ(Aronia melanocarpa)の凍結粉砕果実100gを、90%エタノール溶液と1.3%二水素リン酸カリウム(1:8.5)を用いて浸軟法で抽出した。pH = 5.5の緩衝液系を作製し、45℃、3時間、水浴中で1:8.5の比率で処理した。得られた抽出物は、70%エタノール抽出物の調製と同様の方法で精製し、真空(13.3 mbar)で12回濃縮した[70]。フラボノール画分の精製と回収には、カラムクロマトグラフィー法を用いた[34]。固定相には、粒子径分布0.7~1.0 mmの改良カーボンクロマトグラフィー吸着剤であるDarco G-60を用いた。 |
| 吸着材をガラスカラム(3×55cm)に入れた。ガラスカラムの底を焼成ガラスウールの層で覆い、その上に高さ30cmの改質吸着剤の層、さらにその上に吸収層の完全性を保つためのガラスウールの層を置いた。カラムを、TLC法で選択した溶出液(エタノール:酢酸エチル(1:9)の溶媒系)で洗浄した。次に、調査した抽出物を加え、50mLずつ7つの溶出画分を収集した。TLCで同じ移動相を使用して、画分3から6までの分配係数Rf(0.57)が類似していることを決定した。したがって、これらの画分を結合した。スポットを可視化するために、波長254nmの紫外線を使用した[71]。得られた画分の総量は200mLであり、溶出液が蒸発するまで乾燥させた。アロニア・メラノカルパの乾燥フラボノール画分は、灰黄色の結晶性粉末で、pHは7.15~7.25でした。本研究では、乾燥フラボノール画分を1.3-プロピレングリコールに溶解し、1%の溶液を調製しました。 |
| 4.5. 化学組成分析 |
| 総フラボノイド含量はスタンコビッチ法[72]を用いて測定した。抽出物とフラボノール画分(各0.5 mL)を別々の試験管に入れ、10%塩化アルミニウム(0.1 mL)、1モル酢酸カリウム(0.1 mL)、80%メタノール(1.5 mL)、蒸留水を各試験管に加えた。得られた溶液を混合した。標準溶液は、抽出物の代わりに既知濃度のルチン溶液を用いた以外は同様の方法で調製した。すべての試験管を室温で30分間インキュベートした。光学密度は、固定波長走査型分光光度計(UV/VIS分光計T7DS)を用いて、λmax = 415 nmで測定した。フラボノイド濃度は、乾燥抽出物1グラムあたりのルチン当量(Rut mg/g)で表した。 |
| 残留アントシアニンは、乾燥抽出物1グラムあたりのシアニジン-3-O-グルコシド当量(mg)として分光光度計による示差分光法で測定した[73]。総糖含量は、フェノールと濃硫酸の5%水溶液を用いて、520 nmの分光光度計で測定した。標準物質としてキシロース溶液を用いた[74]。分析結果を表1に示す。 |
| 4.6. フラボノール画分抽出物のクロマトグラフィー分析 |
| フラボノール画分をカラムクロマトグラフィーにかけ、アロニア・メラノカルパに含まれる個々のフラボノールとグリコシル化フラボノールを分離した。ガラスクロマトグラフカラム(2×45cm)の底に、グラスウール薄層と、粒子径100~1000nm、細孔径3.4nmの高密度充填吸着剤MSM-41(ACS Material LLC.、Pasadena, CA, USA)を充填した。 |
| カラムクロマトグラフィーを用いて、酢酸エチル-酢酸-水(90:3:7)-Iおよびメタノール-ギ酸-水(75:1.5:23.5)-IIの2種類の溶媒系を用いて25の溶出画分を収集した。溶媒系はTLC法により選択した。スポットの可視化には、波長254 nmのTLC 254/365(Petrolaser NPO、Saint Petersbeurg, Russia)のUV照射装置を使用した。これらの移動相を用いて、12mLの画分を収集し、各画分について、TLCシリカゲル60 F254(Merck KGaA、Darmstadt, Germany)のアルミニウムプレート上で薄層クロマトグラフィーを実施した。画分12が得られた後、溶媒系Iを溶媒系IIに置き換えた。システムIおよびIIを用いたプレートクロマトグラフィーの結果、画分4、6~8、10、12、14、16~17、20~22、24には基本的に1つの成分しか含まれていないことが示された。画分1~3、5、9、11、13、15、18~19、23、25は混合物であった。画分の保持係数(Rf)は、それぞれ0.45/0.41/0.53/0.67/0.21/0.26/0.29、0.35であった。収集した画分は、ロータリーエバポレーターを用いて、温度32~35℃、圧力0.10~0.13 mbarで濃縮し、無色、薄灰色、および明黄色の微細結晶粉末を得た。得られた抽出物は、アルゴン雰囲気下、暗色バイアル中で+5℃に保たれた。抽出されたフラボノール分画は、ESI法およびHPLC法による質量分析によって同定された。イオントラップと大気圧化学イオン化(APCI)を備えた質量分析計は、Amazon XBruker Daltonix GmbH(Bremen, Germany)[75]を使用した。 |
| 分析結果によると、アロニア・メラノカルパフラボノール抽出物の主成分はルチンとケルセチンである(表2および表3)。さらなる研究のため、ルチンおよびケルセチン画分を推定量の1.3-プロピレングリコールに溶解し、1%溶液を調製した。抽出物および画分中の個々の化合物の同定は、Agilent 1260 Infinity II LC多波長検出器(Agilent Technologies, Inc.本社、Santa Clara, CA, USA)などのクロマトグラフと多波長分光光度計を用いたHPLC法によって行った(表2、図S1)。 |
| HPLC分析は、Zorbax Eclipse C18(4.6 × 150 mm)およびAgilent Hiflex H(250 × 4.6 mm)カラム(Agilent Technologies, Inc.本社、Santa Clara, CA, USA)を使用して実施した。フラボノイドを検出するために、溶出はグラジエント法を用いて実施した。移動相は、フラボノイドに対して、0.1%ギ酸とアセトニトリル溶液の1:0、1:9、9:1の比率の混合物、および0.1%ギ酸とアセトニトリル溶液の1:0、1:9、9:1の比率の混合物であった。溶出速度は1.0 mL/分、注入量は10 µL、溶出時間は30分、加熱ユニット温度は45 °Cであった[76]。 |
| アントシアニンは、逆相カラムを用いた親水性HPLC法で測定した。溶出は、蒸留水中にアセトニトリル30%およびギ酸5%を溶解した溶液で行った。カラム加熱部の温度は40℃、移動相の流速は1mL/分であった。注入量は15µLであった。 |
| 4.7. 化学薬品および試薬 |
| ケルセチン(純度95.0%以上)、ケンフェロール(純度90.0%以上)、ラムネチン(純度95.0%以上)、イソラムネチン(純度95.0%以上)、ジヒドロケルセチン(タキシフォリン)、純度95.0%以上、ケルセチン-3-O-ルチノシド(ルチン)、純度94.0%以上、ヘスペリジン(純度80.0%以上)、ケルセチン-3-O-ラムノシド(純度90.0%以上)、ケルセチン-3-O-ガラクトシド(純度90.0%以上)、ケルセチン-3-O-グルコシド(純度90.0%以上)の標準品。ケルセチン-3-O-ヘキソシド(純度93.0%以上)は、ドイツのPhytoLab GmbH & Co. KG(Merck、Merck KGaA、Darmstadt, Germany)から購入しました(図S4)。 |
| 上記のフラボノール製造方法に従い、アロニア・メラノカルパの果実からフラボノール含有量が88.3%以上の濃縮抽出物が得られました。さらに、ケルセチンとルチンという2つの主要化合物が、それぞれ純度91.1%以上、91.2%以上で抽出されました。 |
| 4.8. アロニア抽出物中の抗酸化活性と生理活性物質含有量 |
| アロニア果実抽出物の抗酸化活性を、化学発光法および比色法を用いて、遊離過酸化ラジカルとの相互作用能を測定した。具体的には、それぞれ2.2'-アゾビス(2-アミジノプロパン)塩酸塩(AAPH)および2.2-ジフェニル-1-ピクリルヒドラジル(DPPH)を用いた。AAPH法にはシグマアルドリッチ社(米国ミズーリ州セントルイス)から入手した試薬を使用し、DPPH法にはアルファエイサー社(Saint Louis, MO, USA)から入手した試薬を使用した。 |
| 化学発光AAPHアッセイは[77]に記載されており、Lum-1200ルミノメーター(LLC DISoft、Moscow, Russia)[78]に適合されています。結果は、PowerGraph 3.3 ProfessionalおよびOriginLab Pro 9.5ソフトウェアを使用してパーソナルコンピュータで処理されました。Lissiらの研究[79]では、曲線のこの特徴を考慮した総抗酸化能を測定する2つのアプローチ、TRAP(総反応性抗酸化電位)法とTAR(総抗酸化反応性)法が説明されています。TRAPはシステム内の抗酸化物質の量を反映し、TARはその活性、すなわち抗酸化物質とラジカルの相互作用速度を反映していると考えられています。TRAP法は、化学発光(CL)潜伏期間の測定に基づいています。TAR法は、化学発光強度消光の値を決定するために使用されました。 |
| DPPHアッセイは、Brand-Williamsらの方法[35]に若干の改変を加えて行った。ストック溶液は、24 mgのDPPHを100 mLのエタノールに溶解して調製し、必要になるまで-20 °Cで保存した。ワーキング溶液は、10 mLのストック溶液と45 mLのエタノールを混合し、分光光度計を用いて515 nmで1.1 ± 0.02単位の吸光度が得られるように調製した。ベリー抽出物(200 µL)を800 µLのDPPH溶液と暗所で30分間反応させた。その後、517 nmで吸光度を測定した。抗ラジカル活性は、DPPHの初期濃度を50%減少させるために必要な抗酸化物質の量と定義されました(有効濃度 = EC50((mol/L) AO/(mol/L) DPPH))。抗酸化物質の有効性は、1/EC50で定義される抗ラジカル力(ARP)と定義されました。ARPが大きいほど、抗酸化物質の有効性は高くなります。 |
| 4.9. リンパ球細胞株RPMI-1788を用いたin vitro試験 |
| 本試験は、条件付き正常ヒトBリンパ球細胞株であるRPMI-1788を用いて実施した。リンパ芽球は、D.I.イワノフスキーウイルス学研究所(モスクワ)のロシア細胞培養コレクションから入手した。細胞は、10%ウシ胎児血清、1%必須アミノ酸、およびゲンタマイシン抗生物質[80]を添加したRPMI-1640培地中で37℃で培養した。細胞は37℃、5% CO2下で培養した。 |
| 4.9.1. in vitroにおける細胞保護特性の測定 |
| RPMI-1788細胞懸濁液を105細胞/mLの濃度で調製した。200 µLの懸濁液を96ウェルプレートに分注し、24時間インキュベートした。[81]に従って細胞保護効果を測定するため、免疫抑制剤シクロホスファミドを1.25 mg/mLの濃度で被験細胞に添加した。陰性対照(参照対照)細胞の培養培地には、細胞培養中、抽出物もシクロホスファミドも添加しなかった。陽性対照細胞の培養培地には、被験物質を添加せず、シクロホスファミドのみを1.25 mg/mLの濃度で添加した。実験サンプルの培養培地には、アロニアエタノール抽出物(2.6~671 µg/mL)とフラボノール画分(6.1~292.5 µg/mL)を添加した。細胞は再び24時間培養され、各細胞群について3回培養が行われた。 |
| 4.9.2. 細胞の染色と計数 |
| 細胞培養の生存率を評価するため、蛍光色素を含む完全増殖培地を調製した。培地総量198 µL、ヘキスト33342(濃度1 mg/mL)2 µL、ヨウ化プロピジウム0.5 µLをウェルあたり添加した。さらに、培養培地を調製した色素含有増殖培地に交換し、45分間インキュベートした。インキュベーション後、ミリポア(Darmstadt, Germany)製のGuava easyCyteフローサイトメーターを用いて生細胞と死細胞を計数した。 |
| 4.10. 生体内実験 |
| すべての手順は、カザン(ヴォルガ地方)連邦大学の倫理ガイドライン(2017年5月18日付プロトコルNo.4)に従って実施されました。本研究は、細胞増殖抑制剤シクロホスファミド(CP)の投与により誘導された免疫機能低下(免疫抑制)を呈したWistar実験用雄ラットを用いて実施されました。ラットにおける誘導免疫不全を背景として、アロニア抽出物が動物の免疫状態、具体的には末梢血中の白血球数とそのサブポピュレーション比、および免疫細胞の機能状態(化学発光および貪食活性)に及ぼす影響を検討しました |
| 7日間にわたり、ラットには水(コントロールまたはC群)、乾燥基準で50 mg/kgの用量のアロニアメラノカルパの果実抽出物から得られたフラボノール画分(P群)、および抽出物のフラボノール画分と同等の濃度のケルセチンとルチンの溶液(Q群)が与えられた。精製フラボノール標準物質(ケルセチンとルチン)の混合物は1.3:1であった。混合物の投与量は4.33 mg/kgで、アロニアメラノカルパ抽出物のフラボノール画分(P群)中の対応するフラボノールと同等であった。ラットに投与した溶液および抽出物の量は、質量100 gあたり0.1 mLであった。C群には飲料水が与えられ、実験群と同様の曝露条件が作成された。 |
| 免疫不全を誘発するため、実験の 8 日目にラットに 25 mg/kg の単回投与を腹部に注射し、その後 7 日間経口給餌を続けました。 |
| 最初の採血は試験開始前の初日に実施し、得られた結果を基準値として採用した。その後、シクロホスファミド投与1日後(8日目)、そして免疫抑制誘導下で抽出物投与7日後(14日目)、14日目(21日目)に再度採血を行った。 |
| 4.10.1. 血液学的検査 |
| ラット末梢血中の免疫細胞の数とサブポピュレーションを決定するために、Mythic 18 Vet(Orphee SA、Plan-les-Ouates, Switzerland)自動血液分析装置と専用試薬キットを使用した。ラットの血液を検査し、白血球(WBC)総数、リンパ球数の絶対値、および白血球総数に対する割合(それぞれLYMおよびLYM%)、単球(同様にMONおよびMON%)、および顆粒球(GRAおよびGRA%)を測定した。赤血球(RBC)数、ヘモグロビン(HGB)濃度、血小板(PLT)数、および平均血小板容積(MPV)を測定した。 |
| 4.10.2. ラット血中好中球顆粒球の機能状態 |
| 好中球による活性酸素種産生を評価するため、実験ラットの末梢血から単離した細胞について、文献[82]で報告された方法を用いて、化学発光活性化剤を使用せずに自身の発光(自発活性)と、ザイモサンによる活性化に対する好中球の化学発光の応答シグナル(誘導活性)を記録した。 |
| 好中球のルミノール依存性化学発光の運動曲線では、次のパラメータを測定しました:ピーク化学発光を示す時間(Tmax、秒)、最大光度(Imax、c.u.)、化学発光曲線のスルーレート(傾き、c.u.)、および自発的化学発光(AUC1)とザイモサン誘導性化学発光(AUC2)の化学発光曲線下面積(AUC、c.u.)。 |
| 誘発化学発光と自発化学発光の増幅は、化学発光曲線下の面積比 (AUC2/AUC1) によって決定され、それによって 活性化指数(Iact)、すなわち活性化指数 (c.u.) が決定されました。 |
| 貪食作用、すなわち殺菌活性の評価は、ミリポア(Darmstadt, Germany)のGuava easyCyteフローサイトメーターを用いた細胞蛍光測定法で行った。[83,84,85]に記載の方法で、フルオレセイン-5-イソチオシアネート(FITC)(Sigma Aldrich、Burghausen, Germany)で標識した不活化細菌、大腸菌を貪食作用の因子として使用した。貪食反応は、[82]に記載の方法で得られた、1 mLあたり1 x 106個の細胞を含む白血球濃縮液(100 µL)をFITC標識細菌大腸菌の懸濁液(10 µL、1 mLあたり細菌数5 x 107個)と37 °Cで30分および120分間インキュベートすることによって行った。 |
| FITC標識大腸菌に対する好中球の貪食細胞数(PN)は貪食された好中球または単球1個あたりの細菌粒子数として計算された。貪食活性(PA)は活性貪食細胞が吸収したFITC標識細菌の数を単球または好中球の総数で割った値である。貪食細胞指数(PI)は好中球または単球1個あたりの細菌の平均値である。貪食完了指数(PCI)は30分間のPNと120分間のPNの比としてc.u.で定義される[84,86]。 |
| 4.10.3. ラット血中脂質過酸化 |
| 脂質過酸化(LP)の程度は、ラット赤血球中のマロンジアルデヒド(MDA)含量によって測定した。血中マロンジアルデヒドは、BuegeとAust [87] の報告法に若干の改変を加えた方法に従い、反応性物質とチオバルビツール酸との反応を行うことで測定した。生理食塩水で洗浄した赤血球0.1 gを、ガラス製ホモジナイザーを用いて0.15 mol L-1 KClに1:9の割合で溶解した。赤血球1容量を、15% wt./vol.トリクロロ酢酸、0.375% wt./vol.チオバルビツール酸、および0.25 mol × L-1塩酸からなるマトリックス溶液2容量と十分に混合した。溶液を沸騰湯浴中で15分間加熱した。冷却後、沈殿物を1000×gで10分間遠心分離した。透明な上澄み液の535 nmにおける吸光度を測定し、モル吸光係数1.56×105 mol−1 cm−1を用いてマロンジアルデヒド濃度を算出した。マロンジアルデヒド値は、初期水分を含む血液1gあたりのnmolで表した。 |
| 4.11. 統計解析 |
| データはMicrosoft Excel 2016およびOriginPro 9.5(OriginLab社、Northampton, MA, USA)を用いて処理した。データの比較はノンパラメトリックKruskal-Wallis検定を用いて行った。群間の一対比較については、Mann-Whitney検定を用いて正確なp値を算出した。データ解析にはIBM SPSS 23.0統計ソフトウェア(Chicago, IL, USA)を用いた。得られた値は平均値±平均値の標準偏差として表した。p値0.05未満を統計的に有意と判定した。 |
| 5. 結論 |
| 本研究の過程で、改良型Darco G-60吸着剤を用いてアロニア・メラノカルパ(Aronia melanocarpa)の果実からフラボノール含有量88.3%以上の濃縮抽出物が得られました。これにより、フラボノール化合物の回収率と精製度が大幅に向上し、抽出原料1単位あたりの吸着剤使用量を削減することができました。アロニア・メラノカルパ抽出物由来のフラボノール画分は、試験した無細胞系において高い酸化剤中和能を示しました。画分中の抽出フラボノールの相互作用は、in vitroにおけるDPPH法およびルミノール増強化学発光法において高い相乗効果を示しました。血液学的検査データは、アロニア・フラボノール画分および個々のフラボノールがシクロホスファミド(CP)誘発性白血病学的変化に及ぼす影響は最小限であることを示唆しています。 |
| アロニアフラボノール分画の単球活性化能は、主に健康な動物で観察されました。ケルセチンとルチンの混合物の投与は、健康な動物と免疫抑制状態の動物の両方において、顆粒球と単球の貪食プロセスを促進し、貪食完了指数の上昇によってその証拠を示しました。ケルセチンとルチンの混合物は、健康な動物の好中球顆粒球の「呼吸バースト」形成にプラスの影響を与えることが示されました。一方、誘導免疫抑制状態において、この混合物の投与は活性酸素種(ROS)産物の活性を低下させます。アロニアフラボノール分画の投与は、休眠時およびザイモサンによる誘導時の両方で、好中球顆粒球の「呼吸バースト」形成を刺激します。生体内では、ケルセチンとその配糖体であるルチンの混合物は、動物の血中マロンジアルデヒド(MDA)濃度を初期値まで低下させるため、脂質過酸化(LP)プロセスの低下をもたらします。同じ曝露条件下では、アロニアのフラボノール分画は、この値に対してそれほど顕著な影響を示しません。 |
| 研究により、アロニア メラノカルパから抽出されるフラボノール成分、主にケルセチンとルチンに良い見通しがあることが明らかになりました。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Plants (Basel). 2023 Aug 17;12(16):2976.に掲載されたAronia melanocarpa Flavonol Extract—Antiradical and Immunomodulating Activities Analysis.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


