ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(アロニア:研究の最前線) |
2型糖尿病および糖尿病性腎症合併症患者における アロニア・メラノカルパ果汁強化プロバイオティクスブルガリアヤギヨーグルトの 併用療法の効果:パイロットスタディ |
Petya Goycheva et al., |
|
|
| 要約 |
背景:ヤギミルクとその発酵製品は、2型糖尿病(T2DM)や糖尿病性腎症(DN)などの関連合併症といった代謝疾患の管理において、独自の栄養学的・治療学的特性を示す。ヤギミルクは、豊富な生理活性化合物を含み、牛乳に比べて消化性に優れているため、栄養素の吸収を促進し、顕著な抗炎症作用および抗酸化作用を示す。本研究の主目的は、糖尿病と併存する腎機能障害患者における酸化ストレス(OS)の軽減、代謝恒常性の回復、そして長期合併症の進行抑制を目的とした多面的な治療アプローチの不可欠な要素として、ヤギミルクをベースとした栄養介入の有効性を体系的に評価することであった。 |
| 方法:2型糖尿病と診断された参加者を、腎機能障害の重症度に基づいて3つのサブグループに層別化した。結果は健常対照群と比較して分析された。 |
| 結果:アロニア(アロニア・メラノカルパ)果汁を豊富に含むヤギミルクを含む食事療法を受けた患者、特に糖尿病性腎症群では、フリーラジカル濃度の顕著な低下、サイトカイン産生の減少、脂質およびタンパク質酸化副産物の減少が認められた。さらに、介入前の測定値と比較して、一酸化窒素(NO)レベルの有意な改善、一酸化窒素合成酵素(NOS)系の部分的な回復、および内因性抗酸化酵素活性の上方制御(p < 0.05)が観察された。 |
| 結論:これらの結果は、食事介入が酸化ストレスを軽減するだけでなく、罹患患者の腎機能の改善にも寄与したことを示唆している。この結果は、機能性乳製品ベースの食事、特にアロニア メラノカルパ果汁やヤギミルクなどの生理活性成分を組み込んだ食事が、2 型糖尿病および糖尿病性腎症患者の酸化ダメージを軽減し、代謝と腎臓の健康を増進する治療効果があることを裏付けています。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2. 結果 |
| 2.1. アロニア果汁入りヤギヨーグルト |
| 2.2. 一酸化窒素、内皮型一酸化窒素合成酵素および誘導型一酸化窒素合成酵素アッセイ |
| 2.3. マロンジアルデヒド、活性酸素種、および8-イソプロスタグランジンの濃度測定 |
| 2.4. タンパク質修飾レベル |
| 2.5. 抗酸化酵素 |
| 2.6. 炎症誘発性サイトカイン濃度 |
| 3. 考察 |
| 4. 材料と方法 |
| 4.1. 原材料の供給源 |
| 4.2. ヨーグルト製造プロトコル |
| 4.3. 試薬 |
| 4.4. 被験者および研究デザイン |
| 4.5. 電子常磁性共鳴(EPR)分光法 |
| 4.5.1. 活性酸素種(ROS)生成物レベルの評価 |
| 4.5.2. 一酸化窒素(NO)濃度の評価 |
| 4.5.3. 3-マレイミドプロキシル(5-MSL)によるタンパク質酸化 |
| 4.6. 酵素免疫測定法 |
| 4.7. 研究の限界 |
| 4.8. 統計解析 |
| 5. 結論 |
本文 |
| 1.はじめに |
| ヤギミルクは古代から人類の食生活において重要な役割を担っており、考古動物学的証拠から、ヤギは反芻動物の中でも最初に家畜化された動物の一つであることが示唆されています。ヤギミルクが長年にわたり栄養学的に重要な役割を担ってきたのは、生物学的に価値の高いタンパク質、脂質、ミネラルなど、必須のマクロ栄養素とミクロ栄養素を豊富に含んでいるためです。さらに、ビタミン、オリゴ糖、ポリアミン、複合脂質、酵素、生理活性ペプチド、ヌクレオチドなど、多様な生理活性成分を含んでいます[1,2]。これらの成分は、ヤギミルクの基本的な栄養価だけでなく、治療効果にも寄与しています。牛乳と比較して、ヤギミルクには独自の利点があります[3]。脂肪球が小さく、αs1-カゼイン含有量が低いため、消化性が高く、アレルギー誘発性が低いのです。さらに、ヤギミルクは、カルシウム、鉄、銅などの主要な微量栄養素の吸収を促進します。特に消化機能が低下している人や吸収不良症候群の患者にとって、その効果は顕著です。これらの特性から、ヤギミルクは機能性食品や臨床栄養への利用が特に魅力的であり、特に乳児、高齢者、代謝疾患や炎症性疾患のある人など、脆弱な集団にとって有用です[4]。 |
| 糖尿病性腎症は、長期にわたる2型糖尿病の重篤な微小血管合併症です。さらに、腎機能が徐々に低下することを特徴とし、多くの場合、明らかな症状を示さずに静かに進行し、進行期を迎えます[5]。糖尿病性腎症の病因は慢性高血糖と密接に関連しており、慢性高血糖は糖毒性に寄与し、膵β細胞機能を障害します。慢性高血糖は、ミトコンドリアにおける活性酸素種の過剰産生を誘発し、活性窒素種の形成を促進し、抗酸化防御を圧倒して酸化ストレスを引き起こします。酸化ストレスは脂質、タンパク質、DNAを損傷し、シグナル伝達を阻害し、神経障害、腎症、網膜症、心血管疾患などの糖尿病合併症を引き起こします[6,7,8,9]。また、酸化還元バランスを崩し、インスリン感受性を悪化させ、血管および腎臓の損傷を加速させる[10]。酸化ストレス、炎症、および内皮機能障害の相互作用は糖尿病性腎症の中心的要因であり、活性酸素種と活性窒素種が糸球体細胞および尿細管細胞に損傷を与える[11,12]。さらに、半減期の長い酸化副産物は、糖尿病における酸化負荷の信頼できるバイオマーカーとして機能する。 |
| したがって、糖尿病性腎症を含む糖尿病合併症を軽減するための効果的な治療・予防戦略を開発するには、酸化ダメージを理解し、標的とすることが不可欠です。ヤギミルクは、基本的な栄養上の利点に加えて、ヨーグルト、チーズ、プロバイオティクス飲料などの発酵乳製品の製造に貴重な基盤を提供します。発酵は特定の乳酸菌、特にStreptococcus thermophilusとLactobacillus delbrueckii subsp. bulgaricusを用いて行われます。これらの細菌は、ラクトースを乳酸に変換すると同時に、様々な生理活性ペプチドと遊離アミノ酸を生成します。これらのペプチドと遊離アミノ酸の多くは、抗酸化作用、降圧作用、抗菌作用を有しています[2]。 |
| 特にヤギヨーグルトは栄養価の高い食品です。カルシウムとカリウムが豊富で、筋肉の維持と骨の健康に不可欠な完全タンパク質の優れた供給源となります[1]。牛乳由来のヨーグルトと比較して、発酵ヤギ乳製品は通常、必須アミノ酸、ビタミン(特にビタミンB群とビタミンA)、マグネシウムや亜鉛などの微量元素、そして抗炎症作用と脂質低下作用で知られる特定の中鎖脂肪酸を多く含んでいます[13,14]。発酵ヤギ乳の重要な利点は、プロバイオティクスとしての可能性です。発酵に関与する細菌株は、腸内細菌叢を調整することで腸の健康をサポートするだけでなく、全身的な効果ももたらします[15]。これには、免疫調節、抗酸化防御の強化、低レベルの炎症の抑制、脂質代謝の改善、血圧調節などが含まれます。発酵ヤギ製品に含まれるイオン形態のミネラルは、バイオアベイラビリティと吸収性を向上させるため、栄養需要の増加や栄養素の吸収障害のある人にとって特に有益です[16]。ヤギミルクにはカルシウム、亜鉛、マグネシウムが豊富に含まれており、発酵プロセス中に乳酸菌の増殖を促進し、最終製品の機能的および官能的品質を向上させます。最近の研究では、発酵ヤギミルクを定期的に摂取することで、体内の抗酸化能力が大幅に向上し、生体分子(脂質やDNAなど)への酸化ダメージのマーカーが減少し、鉄の恒常性が改善されることが実証されています[17,18]。これらの効果は、貧血や慢性炎症に苦しむ人にとって特に重要です。ヤギヨーグルトの独特の官能特性(滑らかでクリーミーな食感、ほのかな酸味、独特の香りなど)は、その多様な健康効果と相まって、健康志向の高い市場や臨床栄養市場における消費者の関心と需要の高まりにつながっています。 |
| 本研究では、アロニア・メラノカルパ果汁を配合したプロバイオティクスヤギヨーグルトが、酸化ストレス(OS)を軽減し、代謝恒常性を回復し、糖尿病合併症および腎機能障害の進行を抑制する機能性栄養介入として、その治療効果の可能性を検討した。この目的のため、(1) 酸化ストレスの指標としてのフリーラジカル生成、(2)脂質およびタンパク質の酸化修飾、(3)主要な抗酸化酵素の活性、(4)インターロイキン発現に重点を置いたサイトカインプロファイルを評価した。 |
| 2. 結果 |
| 2.1. アロニア果汁入りヤギヨーグルト |
| アロニア果汁で強化されたヤギヨーグルトは、特に重要なマクロおよびミクロ元素の天然供給源として、顕著な栄養効果をもたらします。この組み合わせはヨーグルト全体のミネラルプロファイルを向上させ、バランスの取れた食事に貴重な追加成分となります。アロニア果汁を加えることで、抗酸化物質などの生理活性化合物が補給されるだけでなく、カルシウム、カリウム、マグネシウムなどの必須ミネラル(マクロ元素)や、亜鉛、鉄、マンガンなどの微量元素(ミクロ元素)の含有量も増加します[2]。この強化ヨーグルトを定期的に摂取することで、骨代謝、酵素活性、免疫機能、抗酸化防御など、健康維持に必要な様々な生理学的プロセスをサポートすることができます。天然の成分と強化されたミネラル含有量により、この製品は栄養摂取にプラスの影響を与え、食事中のミネラル欠乏症の予防に役立つ機能性食品とみなすことができます。 |
| 2.2. 一酸化窒素、内皮型一酸化窒素合成酵素および誘導型一酸化窒素合成酵素アッセイ |
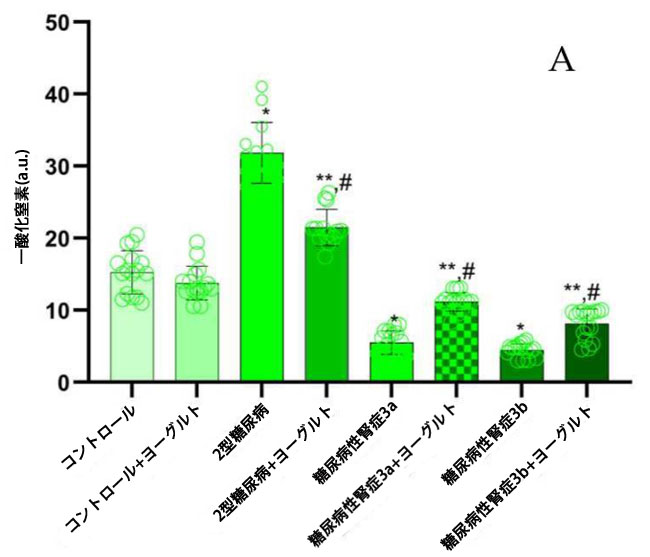
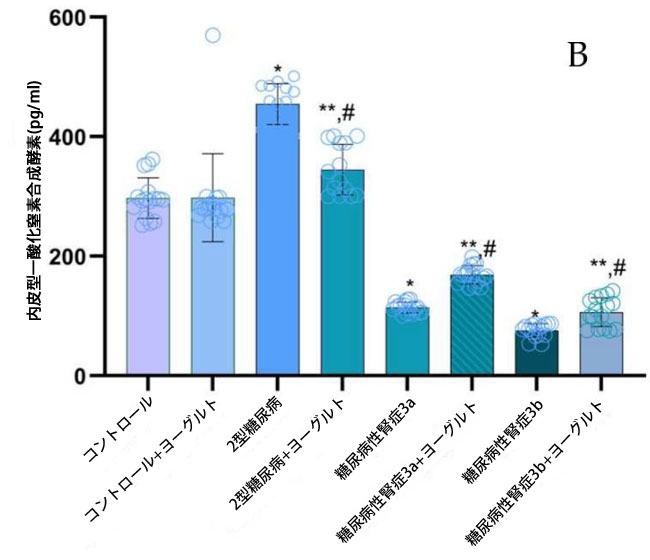
| 腎機能が保たれたコホート(2型糖尿病ステージ1)では、一酸化窒素ラジカル(NO)濃度が健常対照群(p = 0.05)(図1、NO)およびステージ3a(p = 0.05)および3b(p = 0.0003)の糖尿病性腎症患者と比較して有意に上昇していた。一方、腎機能障害群では、ステージ1患者と比較して、内皮型一酸化窒素合成酵素(eNOS)および誘導型一酸化窒素合成酵素(iNOS)濃度(図1、eNOS;図1、iNOS)が著しく低下していた。アロニア強化ヤギヨーグルト200gを毎日摂取し、標準化された食事を遵守する3ヶ月間の介入後、腎機能障害患者において有意な変化が観察された。腎機能が正常な2型糖尿病N0群では、介入後の解析でベースライン値と比較して一酸化窒素ラジカルが有意に減少したことが明らかになりました(p < 0.05)。重要な点として、腎機能障害群では、ベースラインで一酸化窒素、内皮型一酸化窒素合成酵素、誘導型一酸化窒素合成酵素が減少した後、食事療法介入後にこれらのパラメータが部分的に回復しました。 |
 |
 |
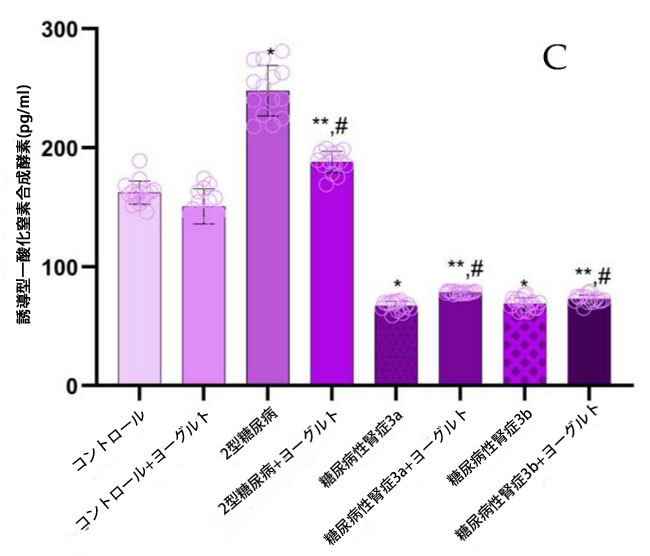 |
図1 血漿サンプル中の一酸化窒素(NO)ラジカル、内皮型一酸化窒素合成酵素(eNOS)、および誘導型一酸化窒素合成酵素(iNOS)を表します。 (A) 一酸化窒素(NO): (1) 健康なコントロール、(2) 腎機能が保持された 2型糖尿病ステージ1、(3) 軽度から中等度の腎機能低下を伴う糖尿病性腎症ステージ3a、(4) 中等度から重度の腎機能低下を伴う 糖尿病性腎症ステージ3b、(5) アロニア入りヤギ酸ミルク食のコントロール、(6) 腎機能が正常でアロニア入りヤギ酸ミルク食を摂取している2型糖尿病ステージ1、(7) 軽度から中等度の腎機能低下を伴う糖尿病性腎症ステージ3a、(8) アロニア入りヤギ酸ミルク食を摂取している中等度から重度の腎機能低下を伴う糖尿病性腎症ステージ3b。 (B) 内皮型一酸化窒素合成酵素(eNOS)、 (C) 誘導型一酸化窒素合成酵素(iNOS)、 Fisherの最小有意差(LSD)事後検定、(*) コントロールに対して p < 0.05、(**) ヤギミルクとアロニア入りのコントロールに対して p < 0.05。 (#) 腎機能が保持された 2型糖尿病ステージ1、軽度から中等度の腎機能低下を伴う糖尿病性腎症ステージ3a、中等度から重度の腎機能低下を伴う 糖尿病性腎症ステージ3b群と比較してp < 0.05。 |
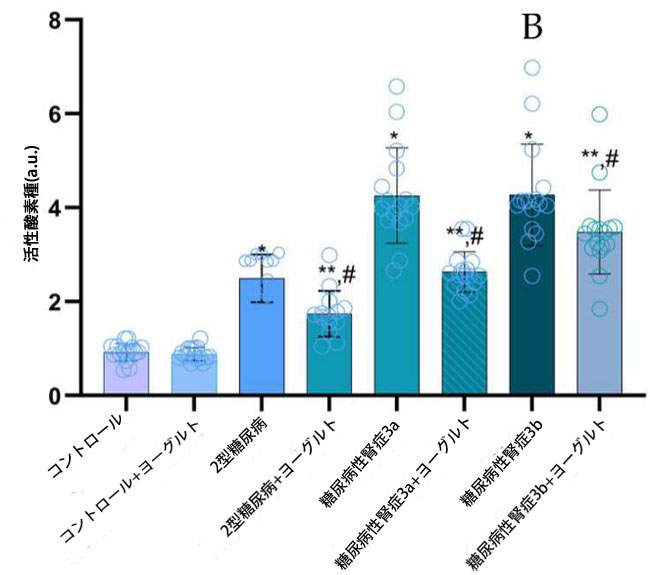
| 2.3. マロンジアルデヒド、活性酸素種、および8-イソプロスタグランジンの濃度測定 |
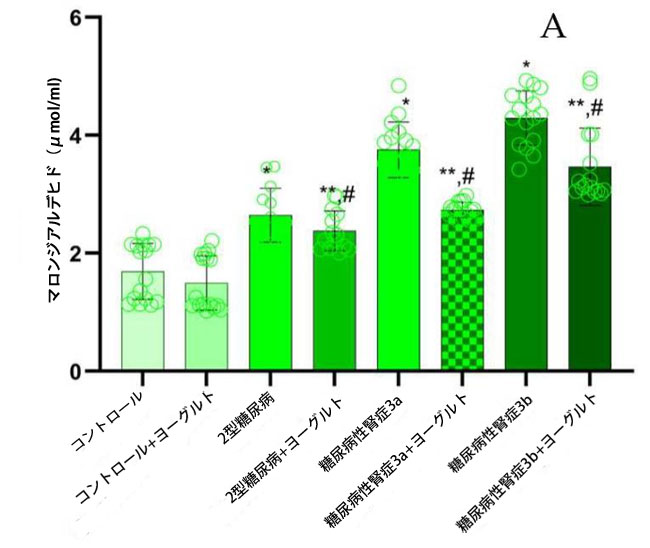
| 軽度から中等度の腎機能障害を有する糖尿病性腎症群(p = 0.05)および中等度から重度の腎機能障害を有する糖尿病性腎症群(p = 0.02)の両群において、腎機能が保たれた2型糖尿病ステージ1群と比較してマロンジアルデヒド(MDA)濃度が有意に上昇していた。さらに、3つの患者群全てにおいて、健常対照群と比較してマロンジアルデヒド濃度が有意に高かった(p = 0.002、図2、マロンジアルデヒド)。これらの知見は、糖尿病と腎機能低下の両方に関連する酸化ストレスの顕著な増加を示している。特に、ヤギミルクとアロニアジュースを配合した特別な食事はマロンジアルデヒド濃度の有意な調節をもたらし、食事介入が酸化ストレスバイオマーカーに対する潜在的な治療効果を示唆している。 |
 |
 |
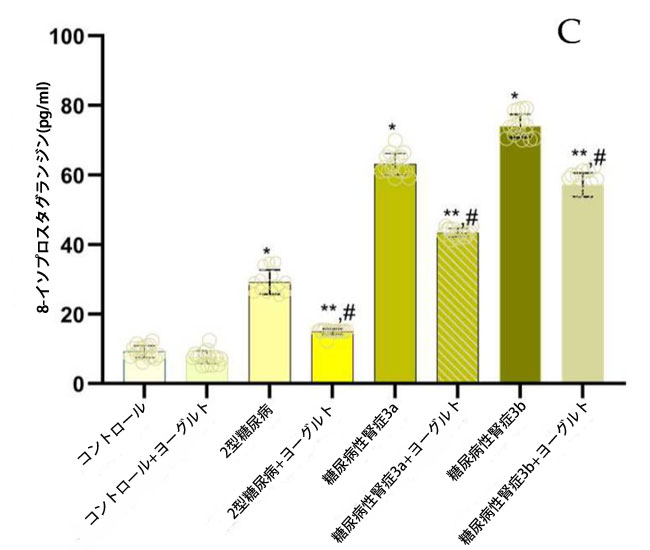 |
図2. マロンジアルデヒド(MDA)、活性酸素種(ROS)、および8-イソプロスタグランジン(8-イソPr)のレベル (A) マロンジアルデヒド(MDA) (1) 健康対照群、(2) 腎機能正常の2型糖尿病ステージ1、(3) 軽度から中等度の腎機能低下を伴う糖尿病性腎症ステージ3a、(4) 中等度から重度の腎機能低下を伴う糖尿病性腎症ステージ3b、(5) アロニア添加ヤギ酸乳食を摂取した対照群、(6) 腎機能正常の2型糖尿病患者とアロニア添加ヤギ酸乳食を摂取した対照群、(7) 軽度から中等度の腎機能低下を伴う糖尿病性腎症ステージ3a、(8) アロニア添加ヤギ酸乳食を摂取した中等度から重度の腎機能低下を伴う糖尿病性腎症ステージ3b。 (B) 活性酸素種(ROS)、 (C) 8-イソプロスタグランジン(8-イソPr)、 Fisherの最小有意差(LSD)事後検定、(*) 対照群と比較してp < 0.05、 (**) ヤギミルクおよびアロニアを対照群としてp < 0.05; (#) 2型糖尿病ステージ1、糖尿病性腎症ステージ3a、および糖尿病性腎症ステージ3bと比較してp < 0.05。 |
| 相関分析の結果、血漿マロンジアルデヒド値と推定糸球体濾過量(eGFR)の間には強い逆相関(r = -0.98、p ≤ 0.01)が認められ、尿中アルブミン排泄量(UAE)とは正の相関(r = 0.80、p ≤ 0.03)を示した。同様に、ヨーグルト摂取後、血漿8-イソ-PGF値はeGFRと有意な負の相関(r = -0.97、p ≤ 0.04)、UAEと正の相関(r = 0.92、p ≤ 0.04)を示した。 |
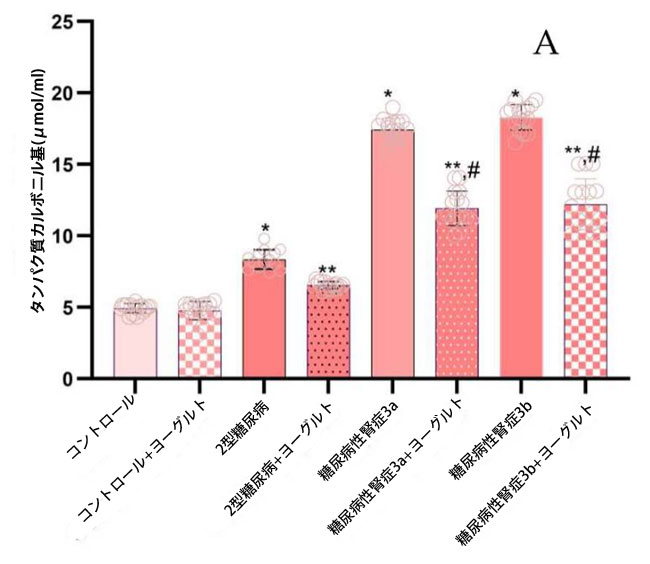
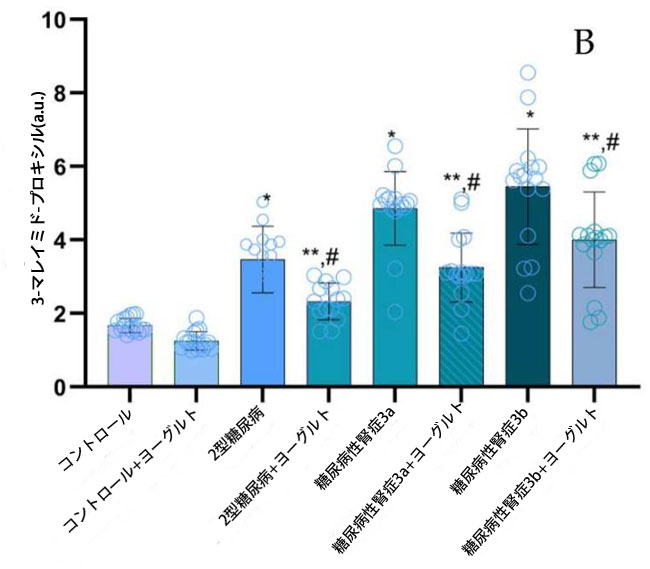
| 2.4. タンパク質修飾レベル |
| タンパク質修飾は、タンパク質カルボニル基(PC)、3-マレイミド-プロキシル(5-MSL)、および終末糖化産物(AGE)の定量により評価した。健常対照群と比較して、タンパク質カルボニル基濃度(図3、PC)は、合併症の有無にかかわらず、すべての糖尿病サブグループで有意に上昇していた。2型糖尿病ステージ1(p = 0.001)、糖尿病性腎症ステージ3a(p = 0.002)、および糖尿病性腎症ステージ3b(p = 0.003)。腎機能障害患者では、タンパク質カルボニル基(値はグループ間で同程度であり、2型糖尿病ステージ1コホートと比較して有意ではない上昇を示した(p = 0.002)。 |
 |
 |
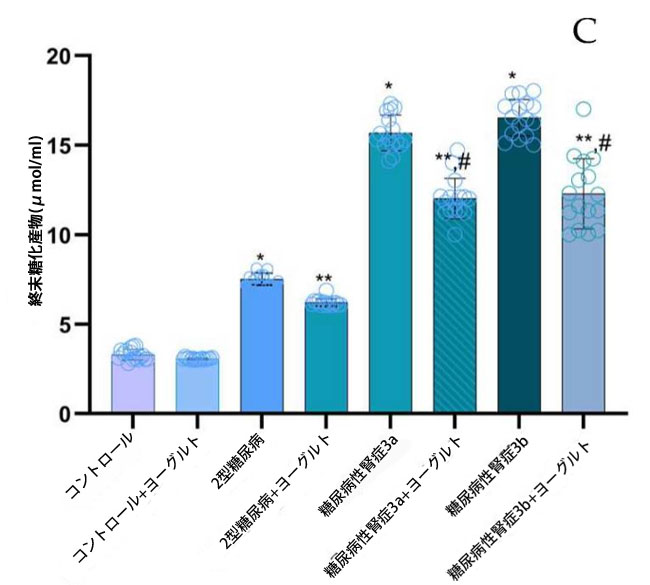 |
図3. タンパク質修飾レベルは、タンパク質カルボニル基(PC)、3-マレイミド-プロキシル(5-MSL)、終末糖化産物(AGE)として示されている。 (A) タンパク質カルボニル基(PC) (1) 健康対照群、(2) 腎機能正常の2型糖尿病ステージ1、(3) 軽度から中等度の腎機能低下を伴う糖尿病性腎症ステージ3a、(4) 中等度から重度の腎機能低下を伴う糖尿病性腎症ステージ3b、(5) アロニア添加ヤギ酸乳食を摂取した対照群、(6) 腎機能正常でアロニア添加ヤギ酸乳食を摂取した2型糖尿病ステージ1、(7) 軽度から中等度の腎機能低下を伴う糖尿病性腎症ステージ3a、(8) アロニア添加ヤギ酸乳食を摂取した中等度から重度の腎機能低下を伴う糖尿病性腎症ステージ3b。 (B) 3-マレイミド-プロキシル(5-MSL)、 (C) 終末糖化産物(AGE)、 Fisherの最小有意差(LSD)事後検定、(*) 対照群と比較してp < 0.05、 (**) ヤギミルクおよびアロニアを対照群としてp < 0.05; (#) 2型糖尿病ステージ1、糖尿病性腎症ステージ3a、および糖尿病性腎症ステージ3bと比較してp < 0.05。 |
| 3-マレイミド-プロキシル濃度は、健常対照群と比較して、全ての糖尿病サブグループで有意に上昇しました(2型糖尿病ステージ1(p = 0.05)、糖尿病性腎症ステージ3a(p = 0.03)、糖尿病性腎症ステージ3b(p = 0.02)。アロニア・メラノカルパ果汁を添加したヤギ乳ヨーグルトを用いた3ヶ月間の食事介入後、介入群の3-マレイミド-プロキシル濃度は、対応する非介入群と比較して有意に低下しました(p < 0.05)。これは、この食事療法がタンパク質チオール酸化に対して潜在的な抗酸化作用を持つことを示唆しています(図3、3-マレイミド-プロキシル)。腎機能正常の2型糖尿病患者群では、終末糖化産物が対照群と比較して有意に上昇しました(p = 0.01、図3、終末糖化産物)。腎機能障害患者では、終末糖化産物レベルは対照群と比較してさらに増加しており (糖尿病性腎症ステージ 3a、p = 0.01、糖尿病性腎症ステージ 3b、p = 0.03)、2型糖尿病ステージ 1 グループと比較した場合も有意差が認められました (糖尿病性腎症ステージ 3a、p = 0.01、糖尿病性腎症ステージ 3b、p = 0.02)。 |
| 相関解析の結果、血清タンパク質カルボニル基とIL-10(r = −0.92、p ≤ 0.02)および終末糖化産物とIL-10(r = −0.94、p ≤ 0.001)の間に強い逆相関が認められた。さらに、血清一酸化窒素と内皮型一酸化窒素合成酵素(r = 0.90、p ≤ 0.01)、および一酸化窒素と誘導型一酸化窒素合成酵素(r = 0.93、p ≤ 0.01)の間にも正の相関が認められた。 |
| 2.5. 抗酸化酵素 |
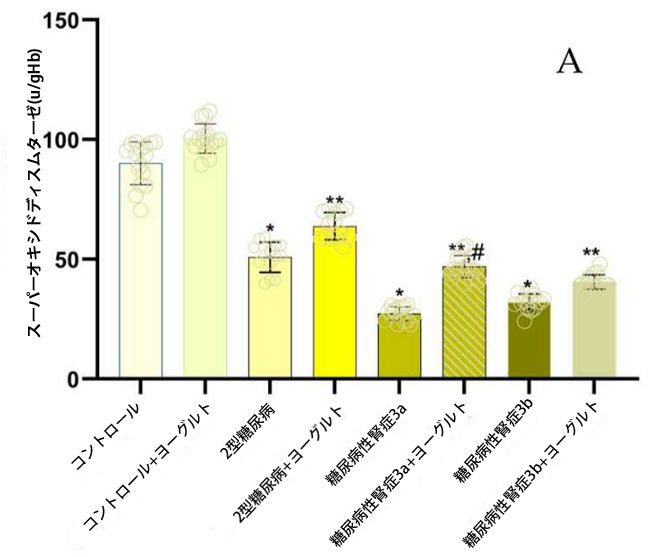
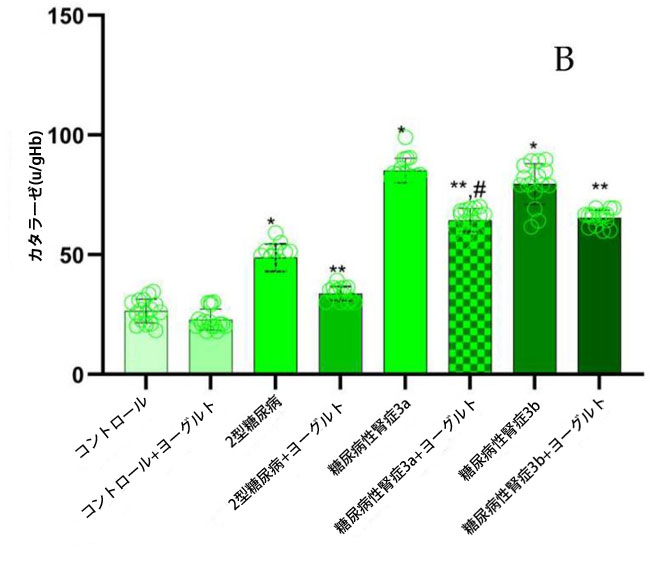
| データ解析の結果、糖尿病性腎症患者において、食事療法介入前に腎機能が低下していたコホートでは、主要な抗酸化酵素であるスーパーオキシドディスムターゼ(SOD;図4)、カタラーゼ(CAT;図4)、グルタチオンペルオキシダーゼ(GSH-Px;図4)の活性が、健常対照群および腎機能が保たれていた糖尿病患者と比較して有意に低下していたことが明らかになりました(p < 0.05)。アロニア・メラノカルパ果汁を補充したヤギヨーグルトを3ヶ月間摂取させた後、糖尿病性腎症ステージ3a群ではベースラインと比較してスーパーオキシドディスムターゼ活性が有意に上昇しました(p = 0.01;図4、スーパーオキシドディスムターゼ)。糖尿病性腎症ステージ3bコホートでも同様の増加が観察されました(p = 0.05)。これは、食事療法介入が酵素による抗酸化防御に回復効果をもたらすことを示唆しています。 |
 |
 |
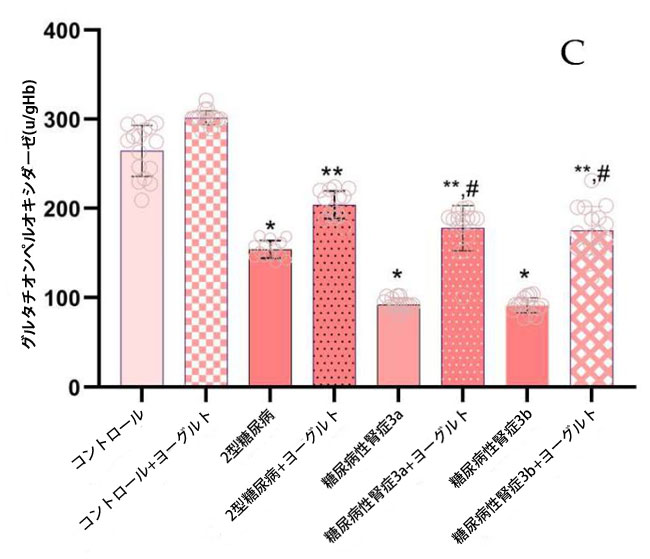 |
図4 抗酸化酵素スーパーオキシドディスムターゼ、カタラーゼ、および グルタチオンペルオキシダーゼの活性。 (A) スーパーオキシドディスムターゼ (1) 健康対照群、(2) 腎機能が正常な2型糖尿病ステージ1、(3) 軽度から中等度の腎機能低下を伴う糖尿病性腎症ステージ3a、(4) 中等度から重度の腎機能低下を伴う糖尿病性腎症ステージ3b、(5) アロニア入りヤギ酸ミルク食の対照群、(6) 腎機能が正常な2型糖尿病患者とアロニア入りヤギ酸ミルク食を摂取している2型糖尿病ステージ1、(7) 軽度から中等度の腎機能低下を伴う糖尿病性腎症ステージ3a、(8) アロニア入りヤギ酸ミルク食を摂取している中等度から重度の腎機能低下を伴う糖尿病性腎症ステージ3b。 (B) カタラーゼ、 (C) グルタチオンペルオキシダーゼ、 Fisherの最小有意差(LSD)事後検定、(*) 対照群と比較して p < 0.05、(**) ヤギミルクとアロニア入りの対照群と比較して p < 0.05。 (#) 2型糖尿病ステージ 1、糖尿病性腎症ステージ 3a、糖尿病性腎症ステージ 3b群と比較してp < 0.05。 |
| 糖尿病性腎症ステージ 3a群(p = 0.004)と糖尿病性腎症ステージ 3b群(p = 0.002)および糖尿病合併症のない2型糖尿病ステージ 1群(図4、カタラーゼ)では、対照群と比較してカタラーゼ活性に統計的に有意な差が認められました。また、ヨーグルト摂取後の糖尿病性腎症ステージ 3a群(p = 0.01)と糖尿病性腎症ステージ 3b群(p = 0.01)のカタラーゼ活性は、食事前の群と比較して統計的に有意に高くなりました。結果を分析すると、糖尿病性腎症ステージ 3a群(0.01)と糖尿病性腎症テージ 3b群(0.01)の両群とも、治療前のグルタチオンペルオキシダーゼ活性が2型糖尿病ステージ1群および対照群(p = 0.01、図4、グルタチオンペルオキシダーゼ)と比較して有意に低いことが示されました。ヨーグルト摂取後、グルタチオンペルオキシダーゼ活性は統計的に有意に増加しました。ヤギヨーグルト摂取後の結果を分析したところ、摂取前の同じグループと比較して、糖尿病性腎症グループでは統計的に有意な改善が見られました (p < 0.05、図 4)。 |
| 2.6. 炎症誘発性サイトカイン濃度 |
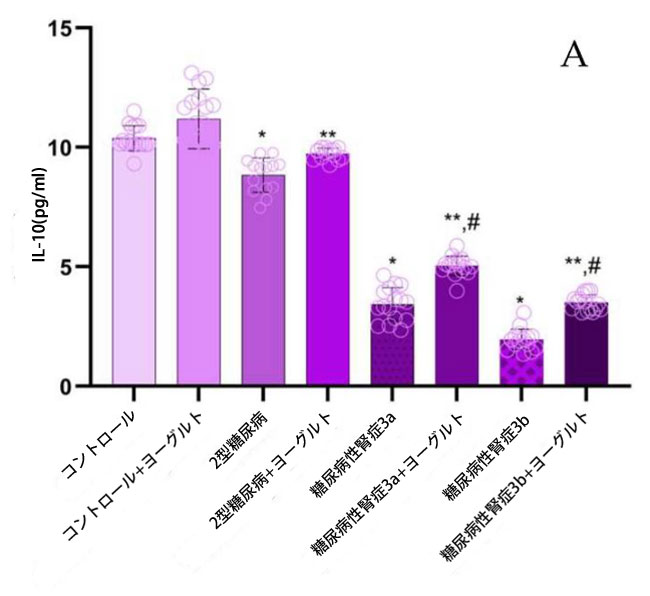
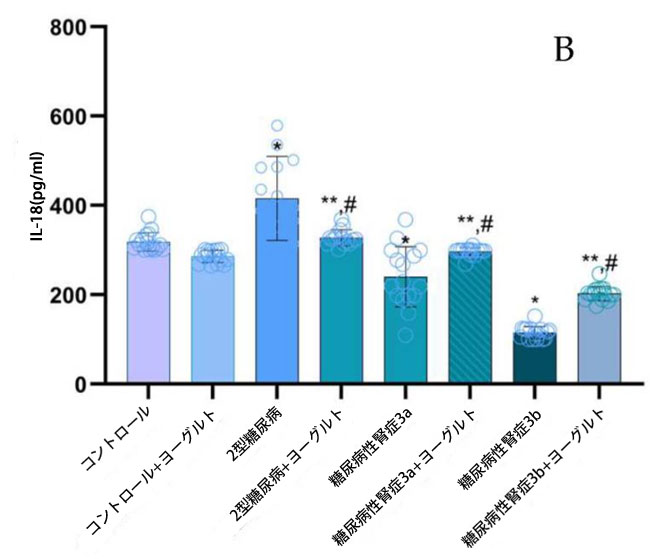
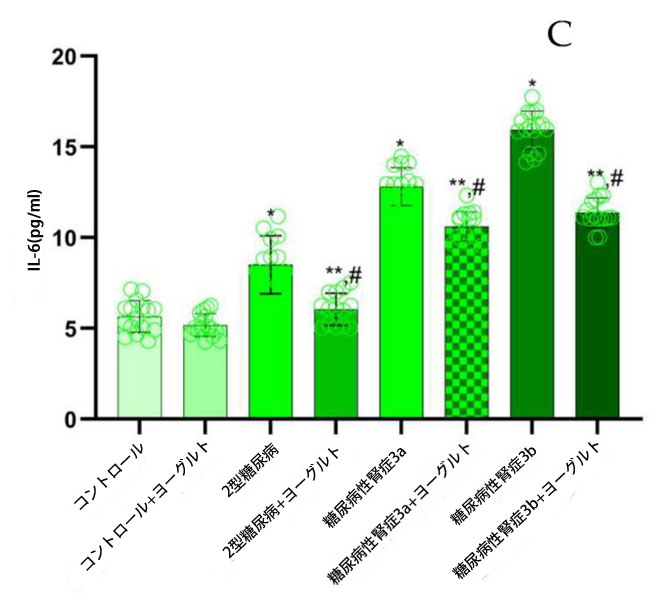
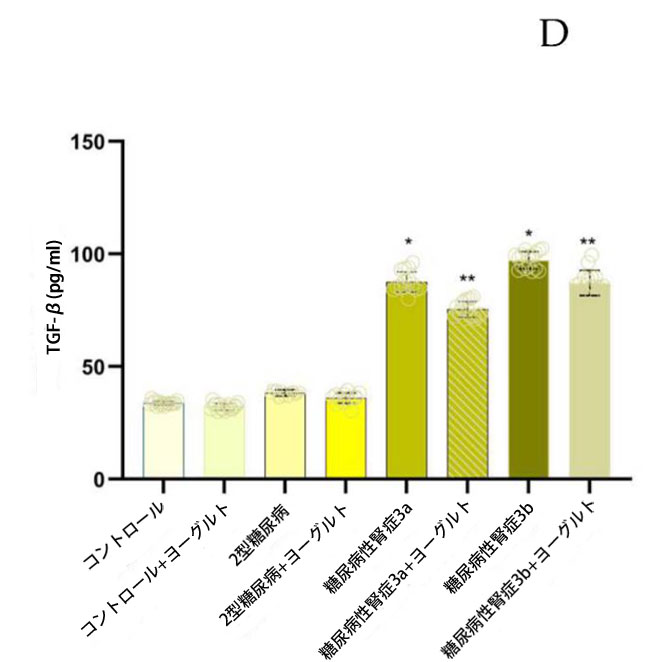
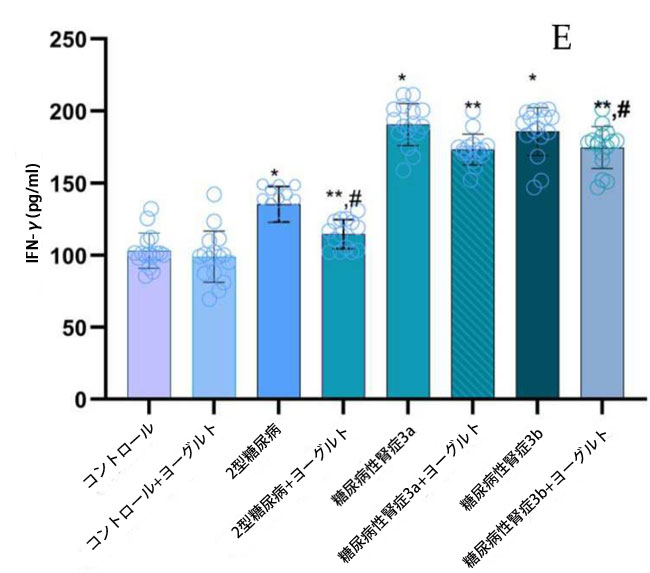
| ヤギヨーグルトおよびアロニア食摂取前の結果:腎機能低下率の異なる糖尿病性腎症ステージ 3aおよび糖尿病性腎症ステージ 3bの両患者群において、インターロイキン10(IL-10)濃度(図5)は、腎機能が正常な2型糖尿病ステージ1群(p < 0.05)および対照群(p < 0.05)と比較して有意に低かった。2型糖尿病ステージ1群のインターロイキン18(IL-18)濃度は、糖尿病性腎症ステージ3a群(p < 0.05)および糖尿病性腎症ステージ3b群(p < 0.05)と比較して有意に高かった。インターロイキン6(IL-6)についても同様の有意な関係が認められた。 糖尿病性腎症群の平均腫瘍壊死因子(TNF-α;図5)値は、対照群(p < 0.05)および2型糖尿病ステージ1(p < 0.05)と比較して有意に高かった。インターフェロンガンマ(IFN-γ;図5)の結果は、腎機能低下群において対照群(糖尿病性腎症ステージ3a、p < 0.05、糖尿病性腎症ステージ3b、p < 0.05)および2型糖尿病ステージ1(p < 0.05)と比較して有意に増加したことを示した。トランスフォーミング成長因子β(TGF-β;図5)値は、腎機能障害群において健常者(糖尿病性腎症ステージ3a、p < 0.05、糖尿病性腎症ステージ3b、p < 0.05)および2型糖尿病ステージ1(p < 0.05)と比較して有意に高かった。ヤギヨーグルトとアロニアの食事摂取後の結果の分析では、治療前の結果と対照群の両方と比較して、特に腎機能低下群(糖尿病性腎症ステージ 3a、p < 0.05、糖尿病性腎症ステージ 3b、p < 0.05)で有意な増加が示されました。 |
 |
 |
 |
 |
 |
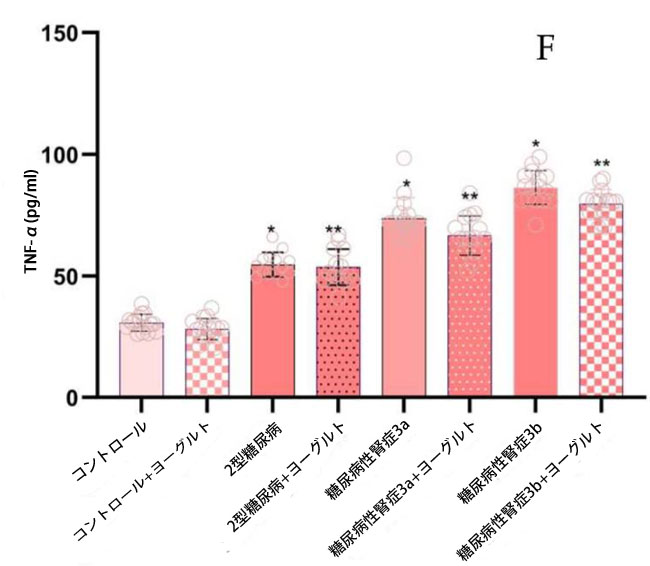 |
図5 炎症誘発性サイトカイン濃度: (A) IL-10、(B)IL-18、(C)IL-6、(D)TGF-β、(E)IFN-γ、(F)TNF-α。 Fisherの最小有意差(LSD)事後検定、(*)対照群と比較してp < 0.05、(**)ヤギミルクとアロニアを対照群と比較してp < 0.05、(#)2型糖尿病ステージ1、糖尿病性腎症ステージ3a、および糖尿病性腎症ステージ3b群と比較してp < 0.05。 |
| 3. 考察 |
| 酸化ストレスは複雑な現象であり、その主な原因は活性酸素種が生理学的プロセスと病理学的プロセスの両方を制御するという二重の役割を担っていることである。酸化ストレスは酸化還元状態の不均衡から生じ、過剰な活性酸素種産生が体内の抗酸化防御システムを圧倒し、細胞および分子の損傷につながる[19]。酸化還元恒常性システムは、細胞や組織が環境ストレスや代謝ストレスに反応する上で重要な役割を果たしている。これは、転写因子などの重要な分子標的の可逆的酸化と不可逆的酸化の間の平衡を維持する、厳密に制御された一連の酸化還元反応を介して媒介される[20]。活性酸素種の中でも、過酸化水素(H2O2)や一重項酸素のような非ラジカル種は、空間的および時間的に制御された方法で生成され、酸化還元シグナル伝達経路における重要な二次メッセンジャーとして作用する。特に、H2O2はインスリンシグナル伝達、細胞増殖、分化、免疫応答、組織修復など、数多くの生物学的プロセスに関与している[21]。生理的濃度では、H2O2と一重項酸素はシグナル分子として働き、核因子赤血球2関連因子2(Nrf2)などの酸化還元感受性転写因子と協調して、細胞内酸化還元恒常性を微調整し、軽度の酸化ストレスへの細胞適応をサポートする。この適応応答は酸化的ユーストレスと呼ばれる[22]。しかし、H2O2レベルが生理的閾値を超えて上昇し、超生理学的になると、タンパク質、脂質、核酸などの細胞高分子に酸化ダメージを引き起こす。この状態が酸化ストレスと定義され、さまざまな慢性疾患や変性疾患の発症に関与している[23]。 |
| 糖尿病は、病期に応じて一酸化窒素産生およびその代謝物を増加または減少させる様々な病態生理学的プロセスを引き起こします。血漿中の一酸化窒素代謝物のレベルの上昇は、腎機能が正常または軽度低下している患者、ならびに糖尿病性腎症患者で観察されています。特に、腎機能が保持されている糖尿病患者では、一酸化窒素レベルが有意に上昇する一方で、亜硝酸塩/硝酸塩(NO2−/NO3−)濃度が著しく低下しています[24]。糖尿病性腎症の発症は、内皮型一酸化窒素合成酵素(eNOS)の発現および活性の変化と関連しています[25]。いくつかの研究は、腎臓の内皮型一酸化窒素合成酵素の発現および活性が糖尿病性腎症の初期段階ではアップレギュレーションされるが、疾患の慢性期にはダウンレギュレーションされることを示唆しています。初期段階における一酸化窒素レベルの顕著な上昇は、主に内皮型一酸化窒素合成酵素と神経型一酸化窒素合成酵素(nNOS)の両方によって媒介される状態である微量アルブミン尿の一因であると考えられています[26,27]。腎血管系では内皮型一酸化窒素合成酵素が優勢な酵素であり、高血糖による腎障害の初期段階でその発現が高まります[24,28]。 |
| 本研究では、糖尿病を患いながらも腎機能が正常な患者において、一酸化窒素ラジカルおよび内皮型一酸化窒素合成酵素レベルの上昇が認められたことが確認された。一方、中等度から重度の腎機能障害患者においては、一酸化窒素および内皮型一酸化窒素合成酵素レベルが有意に低下していた。特に、ヤギヨーグルトとアロニアを併用した食事は、腎機能が正常な2型糖尿病患者の一酸化窒素および内皮型一酸化窒素合成酵素レベルを有意に低下させたのに対し、糖尿病性腎症患者においては一酸化窒素および内皮型一酸化窒素合成酵素レベルが上昇したことが示された(図1)。通常、糖尿病性腎症においては、内皮型一酸化窒素合成酵素の保護作用と誘導型一酸化窒素合成酵素(iNOS)の有害作用の間に病的な不均衡が存在する。正常な生理学的条件下では、内皮型一酸化窒素合成酵素由来の一酸化窒素は、血管拡張を促進し、血小板凝集を阻害し、炎症を抑制することで血管の恒常性を維持している。しかし、糖尿病環境では、慢性高血糖と酸化ストレスが内皮型一酸化窒素合成酵素の発現および活性をダウンレギュレーションし、生理的な一酸化窒素産生の低下と内皮機能障害を招いている。逆に、高血糖やTNF-α、IL-1、IL-6などの炎症性サイトカインは誘導型一酸化窒素合成酵素の発現を亢進させ、過剰かつ持続的な一酸化窒素産生をもたらします。内皮型一酸化窒素合成酵素由来の一酸化窒素産生は厳密に制御されていますが、誘導型一酸化窒素合成酵素由来の高産生一酸化窒素はスーパーオキシドと反応して、強力な反応性窒素種であるペルオキシナイトライト(NOO-)を形成します。これは酸化ストレスおよびニトロソ化ストレスに寄与し、炎症、アポトーシス、細胞外マトリックスの蓄積を促進します。これらは糖尿病性腎症における糸球体および尿細管間質障害の主要な因子です[29]。 |
| ヤギヨーグルトベースの食事とアロニアジュースを組み合わせると、空腹時血糖値と耐糖能が改善し、腎機能障害(糖尿病性腎症ステージ3aおよび糖尿病性腎症ステージ3b)の人の一酸化窒素レベルが上昇し、正常な腎機能を持つ2型糖尿病ステージ1ではこれらのレベルが対照群近くまで低下することが示されました。さまざまな代謝物で観察された有意な変化に基づいて、主要な代謝経路、抗酸化酵素の活性、および生化学反応が、関連する重要な統合プロセスとして特定できます。これらの知見は、チョークベリー果汁添加と組み合わせた場合の発酵中の乳酸菌の代謝を解明するものです。高血糖誘発性酸化ストレスは炎症性サイトカインの産生を誘発します(図5)。血糖値の上昇は、IL-6、TNF-α、IL-18などのサイトカインの循環レベルの増加につながり、これが酸化メカニズムを介して健康な人でも耐糖能障害に寄与する可能性があります。特に、2 型糖尿病の成人では、IL-6 レベルは C 反応性タンパク質 (CRP) と独立して相関しており、炎症と代謝機能障害の関連を示しています。 |
| 糖尿病では、慢性高血糖が活性酸素種(ROS)および活性窒素種(RNS)の過剰産生につながる。例えば、高血糖は解糖系およびトリカルボン酸回路を介した代謝フラックスを増加させ、NADHおよびFADH2レベルの上昇を引き起こす。これはミトコンドリアにおける電子伝達活性の亢進につながり、ミトコンドリア電子伝達系への過負荷と電子漏出を引き起こす。分子状酸素との未熟反応から、活性酸素種の主要形態であるスーパーオキシドアニオンラジカル(O2•−)が形成される。高血糖はプロテインキナーゼCを活性化し、これがNADPHから酸素への電子伝達を担う酵素NADPHオキシダーゼを刺激し、さらにスーパーオキシドラジカルを生成する。ポリオール経路では、グルコースはNADPHを利用するアルドース還元酵素によってソルビトールに還元される。NADPHは抗酸化物質グルタチオン(GSH)の再生に関与しており、その枯渇は細胞の抗酸化能を低下させ、酸化ストレスの上昇につながる[30]。高血糖は終末糖化産物濃度の上昇を引き起こします。これらの分子は細胞表面の受容体RAGEと相互作用し、NF-κBの活性化などのシグナル伝達カスケードを引き起こし、炎症性サイトカインおよび活性酸素種の産生を促進します。最後に、内皮型一酸化窒素合成酵素の影響があります。糖尿病状態では、酸化ダメージと補因子テトラヒドロビオプテリンの減少により、内皮型一酸化窒素合成酵素は脱共役状態になります。この脱共役過程において、内皮型一酸化窒素合成酵素は一酸化窒素の代わりにスーパーオキシドアニオンラジカルを生成します。これは、O2•-と一酸化窒素の反応の結果、反応性の高い窒素種であるONOO-が生成され、ニトロソ化ストレスが増加するためです。したがって、高血糖は、ミトコンドリア機能不全、NADPHオキシダーゼの活性化、抗酸化物質の枯渇、終末糖化産物-RAGEシグナル伝達、および内皮型一酸化窒素合成酵素の脱共役を介して、活性酸素種および活性窒素種産生の増加を引き起こします。 |
| これらのプロセスは、糖尿病とその合併症の発症に根本的に関わる酸化ストレスとニトロソ化ストレスに大きく寄与します (図 1)。 |
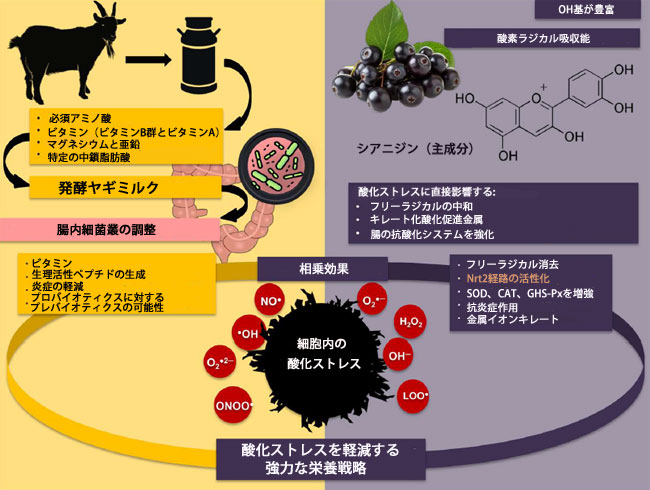 |
| スキーム1. ヤギミルクは、生理活性ペプチド、ビタミン(A、D、Eなど)、セレンや亜鉛などの微量元素の豊富な供給源です。これらはすべて、抗酸化酵素(スーパーオキシドディスムターゼ(SOD)、カタラーゼ(CAT)、グルタチオンペルオキシダーゼ(GHS-Px)など)の活性を高めることで、内因性の抗酸化防御システムに寄与します。これらの元素は、活性酸素(ROS)の除去、または酸化還元感受性タンパク質の安定化によって、酸化ストレスの低減に役立つ可能性があります。アロニアベリー(アロニア・メラノカルパ)は、特にアントシアニン、シアニジン、プロアントシアニジン、フラボノイドなどのポリフェノールが非常に豊富で、強力なフリーラジカル消去能がよく知られています。これらの化合物は活性酸素種を直接中和するだけでなく、抗酸化応答配列(ARE)の発現を制御するNrf2など、酸化ストレスに関連する細胞シグナル伝達経路を調節します。 |
| ヤギヨーグルトを組み合わせることで、アロニアポリフェノールのバイオアベイラビリティと胃腸安定性を高めるキャリアとして作用し、より効率的な吸収と全身的な抗酸化作用が得られる可能性があります。両成分の生理活性化合物の相乗作用が、遊離窒素酸化物ラジカル、タンパク質カルボニル基(PC)、終末糖化産物(AGE)の3-マレイミド-プロキシル(5-MSL)強度など、研究で観察された酸化ストレスバイオマーカーの大幅な減少に寄与していると考えられます。1日3回、アントシアニン258mgに相当するチョークベリージュース50mLを3ヶ月間摂取した効果を調べた研究では、チョークベリーサプリメント摂取後にLDLコレステロールが大幅に減少しましたが、空腹時血糖値、ヘモグロビンA1c(HbA1c)、総コレステロール、トリグリセリドの減少はわずかでした[31]。高用量(200mL)のアロニアジュースを1日2回、3ヶ月間摂取したところ、空腹時血糖値、ヘモグロビンA1c、コレステロール値が有意に低下し、血圧もわずかに改善したと報告されています[32]。健康な被験者では、食前にアロニアジュース100mLを摂取したところ、食後血糖値が有意に低下したことが示されています[33]。 |
| アントシアニンは天然の水溶性色素で、フラボノイド類に属し、強力な抗酸化物質です。アロニアは、広く流通しているベリー類の中で、アントシアニン含有量において絶対的な記録を保持しています。アロニアに含まれるアントシアニンは非常に強力で効果的です。ヤギヨーグルトとチョークベリージュースを併用すると、脂質過酸化とフリーラジカルのレベルが著しく低下することが実験結果で示されています(図2、活性酸素種参照)。C 反応性タンパク質 (CRP)は、炎症時にIL-6などのサイトカインに反応して肝細胞によって主に産生・分泌される主要な急性期タンパク質です。炎症性サイトカイン、特にIL-6の上昇は、C 反応性タンパク質やその他のマーカーとともに、2型糖尿病の管理における介入の一般的なターゲットです。 |
| 通常、IL-6とIL-10は炎症における役割が異なるため、相反する発現パターンを示します。IL-6は炎症性サイトカインであり、慢性的な低度炎症に反応してそのレベルが上昇することが多く、インスリン抵抗性や疾患の進行に寄与します[34]。一方、IL-10は抗炎症性サイトカインであり、通常はIL-6などのサイトカインを抑制する働きがあります。しかし、糖尿病ではIL-10レベルが低下することが多く、炎症が制御不能になります。この不均衡は、代謝機能障害を悪化させる炎症性状態への移行を反映しています[35]。 |
| 質の立体構造ダイナミクスと微小環境の変化を評価しました[30]。これにより、糖尿病性腎症の酸化損傷に関連するタンパク質の可動性および構造剛性の変化を検出することができました。並行して、不可逆的なタンパク質酸化の確立されたバイオマーカーであるタンパク質カルボニル含量を定量化し、酸化タンパク質損傷のより広範な指標を提供しました[36]。さらに、終末糖化産物を測定して、糖尿病性腎症などの高血糖および酸化促進状態で悪化することが知られているプロセスであるタンパク質の非酵素的糖化および酸化的架橋の程度を評価しました糖尿病性腎症の根底にある酸化ストレス関連メカニズムの調査では、部位特異的スピン標識、タンパク質酸化マーカー、および糖化最終生成物分析を組み合わせた多面的なアプローチが採用されました。ニトロキシドベースのスピン標識3-マレイミド-プロキシル(5-MSL)をEPR分光法(訳者注:電子常磁性共鳴、ESR分光法とも呼ばれる)と併用して、アルブミンなどのチオール含有タンパク[37]。これらのパラメータを統合的に解析することで、糖尿病性腎症の進行における酸化ストレスとカルボニルストレスを包括的に理解することができ、構造タンパク質の修飾と腎組織の機能障害との関連性を明らかにすることができます。ヤギミルクとアロニアジュースからなる食事介入は、様々な腎機能障害の患者において、酸化ストレスおよびカルボニルストレスマーカーの統計的に有意な減少をもたらしました。具体的には、介入後の3-マレイミド-プロキシル標識タンパク質移動度、タンパク質カルボニル、および終末糖化産物値は介入前と比較して有意に減少しており、酸化還元状態の改善とタンパク質の酸化修飾の減少を示しています。これらの知見は、食事成分の組み合わせが糖尿病性腎症患者の酸化ダメージに対する保護効果を発揮することを示唆しています。 |
| ヤギヨーグルトは、膵臓β細胞からのインスリン分泌を促進する上で重要な役割を果たすアミノ酸であるロイシンが特に豊富です。ロイシンはまた、血糖値とインスリン感受性を高める効果もあります。いくつかの研究では、ヤギヨーグルトにはプレバイオティクス効果と抗炎症作用を持つオリゴ糖が豊富に含まれていることが示されています。さらに、チョークベリー(アロニア・メラノカルパ)のフラボノイドは血中C 反応性タンパク質値を低下させ、炎症性サイトカインの産生を抑制しました。フラボノイドは強力な抗酸化物質であり、過酸化水素を分解することでフリーラジカルの生成を抑制し、新たなラジカルを生成することはありません。例えば、イソフラボンが豊富な大豆胚芽の摂取は、2型糖尿病患者の血漿中の抗酸化能とグルタチオン値を改善することが示されています[38]。フラボノイドを豊富に含む食事は、2型糖尿病および腎症患者のC 反応性タンパク質値と脂質過酸化レベルの低下と関連しています。ヨーグルトタンパク質の長期摂取は、2型糖尿病および腎症患者におけるC 反応性タンパク質、血糖値、総コレステロール、LDLコレステロール、トリグリセリドの低下にも関連しています。ヤギヨーグルトを摂取した糖尿病患者で観察されたサイトカインおよび脂質酸化生成物の減少は、酸化ストレスの低下を示唆しており、これはヤギミルクに含まれるオリゴ糖の多量含有に起因すると考えられます。全体として、これらの知見は、ヤギヨーグルトとチョークベリージュースを含む食事が、糖尿病に伴う炎症および酸化ストレスの緩和に効果的であり、代謝の健康改善に貢献する可能性があることを示唆しています。 |
| 4. 材料と方法 |
| 4.1. 原材料の供給源 |
| 本研究で使用したヤギヨーグルトは、学生農場から提供されたもので、季節変動の影響を受けます。品種はブルガリア白乳用ヤギです。ヤギの泌乳期間は年間平均305日で、通常は3月から4月、11月から12月にかけて行われます。ヤギは通常、8月下旬から9月上旬に人工授精され、子ヤギは1月から2月に生まれます。約60日間の哺乳期間の後、ヤギは機械搾乳を用いて1日2回、朝と夕方に搾乳されました。本研究では、アロニア・メラノカルパを含む実験用ヨーグルトの製造に使用した乳は、泌乳初期から中期、具体的には3月から7月にかけての午前中の搾乳時に採取した乳をプールしました。ヨーグルトはサンプル採取後すぐに調製し、最終製品が24時間以内に準備できるようにしました。ヨーグルトの生産量が限られていたため、本研究のサンプル数は制限され、結果として研究対象者数も制限されました。アロニア・メラノカルパジュースは、品質とトレーサビリティを確保するために、認定された地元の小売業者から仕入れた新鮮な果物をコールドプレスし、低温殺菌処理して作られた100%オーガニックジュースです。 |
| 4.2. ヨーグルト製造プロトコル |
| ヨーグルトの製造は、「牛乳・乳製品技術」セクションの研究室で、伝統的な発酵技術に従って行われた。まず、生ヤギ乳を90℃に加熱し、30分間その温度を維持する低温殺菌処理を行い、微生物の安全性を確保し、天然酵素を不活性化した。低温殺菌後、発酵に最適な条件を作り出すため、乳を46℃に冷却した。この段階で、Lactobacillus delbrueckii subsp. bulgaricusとStreptococcus thermophilus(Bankya, Sofia, BulgariaでLaktina 17として市販)を含むスターター培養物を1.5%添加した。添加した乳に、コールドプレスしたアロニア(Aronia Melanocarpa)果汁を3%加え、均一に分散するように十分に混合した。調製した混合物を200g滅菌容器に分注し、凝固が達成されるまで43℃で保温した。発酵が完了したら、ヨーグルトを直ちに10℃まで冷却して微生物の活動を停止させ、その後、さらなる分析を行うまで4~6℃で冷蔵保存した。 |
| 4.3. 試薬 |
| すべての試薬は分析グレードであり、Merck Bulgaria EAD(Sofia, Bulgaria)から購入しました。 |
| 4.4. 被験者および研究デザイン |
| 本研究では、2型糖尿病と診断された122名が登録され、男女比は約1:1.5でした。研究対象集団の人口統計学的多様性は、2型糖尿病集団の幅広い臨床的スペクトラムを反映しています(表1)。特に、参加者の59.4%が肥満に分類され、この集団における肥満の併存疾患としての有病率の高さが浮き彫りになりました。2型糖尿病の参加者は、推定糸球体濾過量(eGFR)および尿中アルブミン排泄量(UAE)の値に基づいて、糖尿病性腎症の重症度に基づいて3群に層別化されました。その後、これらの群の臨床的および臨床検査学的特徴を、年齢を合わせた42名の健康なボランティアからなる対照群と比較しました。脂質プロファイル分析を目的として、すべての参加者から一晩絶食後の早朝に静脈血サンプルを採取しました。EPR分析用の血液は採取後直ちに処理されました。残りのサンプルは、酵素結合免疫吸着法(ELISA)による検査のために-80℃で保存されました。血糖コントロールを評価するために、空腹時血糖値(FPG)とグリコヘモグロビン値(HbA1c)を測定しました。HbA1cは長期的な血糖曝露の指標として用いられました。本研究は、医学部および病院の機関研究委員会の倫理基準に従い、1964年のヘルシンキ宣言およびその後の修正、あるいは同等の倫理ガイドラインに概説されている倫理原則を遵守して実施されました。 |
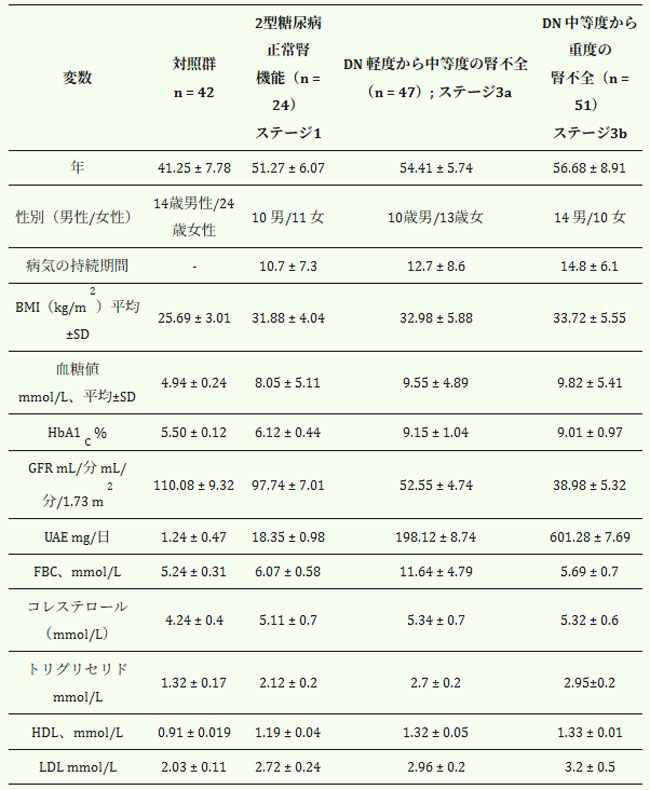
| 表 1. 腎機能に基づく患者層別化: ステージ 1: 腎機能が正常な 2 型糖尿病患者 (eGFR ≥ 90 mL/分/1.73 m2); ステージ 3a: 糖尿病性腎症および軽度から中等度の腎機能障害を伴う患者 (eGFR 59–45 mL/分/1.73 m2; UAE > 60 mg/日); ステージ 3b: 糖尿病性腎症および中等度から重度の腎機能障害を伴う患者 (eGFR 44–30 mL/分/1.73 m2; UAE < 30 mg/日) この層別化により、糖尿病性腎症における疾患進行と酸化ストレス、炎症、代謝機能障害との関連性を詳細に分析することができました。 |
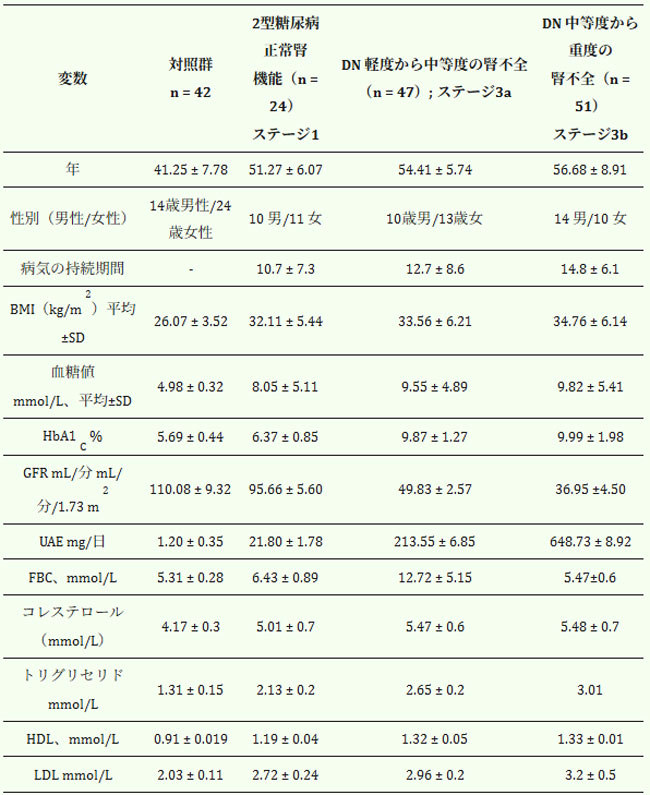 |
| ベースラインでは、2型糖尿病患者のうち54名(58%)が不十分な血糖コントロールを示しており、これはHアロニア・メラノカルパ果汁を配合したヤギヨーグルト200gを3ヶ月間毎日、管理食と併用して投与した。表2は介入後のアウトカムをまとめたものである。bA1c > 7%かつ空腹時血糖値 > 6.1 mmol/Lと定義されました(表1)。薬物療法に関しては、良好な血糖コントロールを示す2型糖尿病患者(n = 24)は、スルホニル尿素薬およびビグアナイド薬を含む経口血糖降下薬で治療されました。軽度から中等度の腎機能障害(eGFRステージ3a)を有する糖尿病性腎症患者(n = 47)のうち、24名がスルホニル尿素薬およびビグアナイド薬を投与され、残りの23名はスルホニル尿素薬と基礎インスリンの併用療法で治療されました。中等度から重度の腎機能障害(eGFRステージ3b、n = 52)の全患者は、食前速効型インスリンと夕方の基礎インスリン投与からなる基礎ボーラスインスリン療法を受けていた。42名の健康なボランティアと比較したところ、軽度の過体重(BMI 31~33)を呈していたのはわずか7名(7.4%)であった。研究参加者は性別でマッチングされた。その後、全患者に対し、アロニア・メラノカルパ果汁を配合したヤギヨーグルト200gを3ヶ月間毎日、制限食と併用して投与した。表2は介入後のアウトカムをまとめたものである。 |
| 表2. アロニア入りヤギヨーグルト200gを3ヶ月間毎日摂取し、食事療法を行った後の腎機能に基づく患者層別化 |
 |
| 4.5. 電子常磁性共鳴(EPR)分光法 |
| すべてのEPR測定は、標準共振器を備えたBruker BioSpin GmbH(Ettlingen Germany)を用いて室温で実施した。すべてのEPR実験は3連で実施し、3回繰り返した。スペクトル処理は、Bruker WIN-EPR バージョン2021およびSimFoniaソフトウェア バージョン2021を用いて行った。 |
| 4.5.1. 活性酸素種(ROS)生成物レベルの評価 |
| ROSレベルは、Shiら[39]の方法に若干の修正を加えて測定した。 |
| 4.5.2. 一酸化窒素(NO)濃度の評価 |
| Yoshiokaら[40]およびYokoyama ら[41]によって発表された方法に基づいて、血漿中の一酸化窒素ラジカル濃度を推定するためのEPR法を開発し、改良した。 |
| 4.5.3. 3-マレイミドプロキシル(5-MSL)によるタンパク質酸化 |
| 腎臓サンプル中のタンパク質およびアルブミンの障害の程度は、3-マレイミドプロキシルとのスピン結合を利用したin vivo EPR法によって評価された[42] |
| 4.6. 酵素免疫測定法 |
| すべての酸化ストレス(OS)マーカーは、市販のELISAキットを用いて、製造元のプロトコルに従って定量した。 |
| 4.7. 研究の限界 |
| 本研究の主な限界は、プラセボ対照群が設定されていないことである。アロニア・メラノカルパの既知の抗酸化作用および抗炎症作用を活用し、本研究は、酸化ストレスが主要な病因となっている2型糖尿病および糖尿病性腎症の患者に焦点を当てた。本研究の目的は、ヤギヨーグルトをベースとした食事介入が酸化ストレス(全生存期間)の緩和、代謝バランスの回復、および長期合併症の軽減に及ぼす影響を評価することであり、腎症の状態およびKDIGO 2022腎機能ステージ別に層別化したサブグループ間の比較解析を行った。 |
| さらなる制約として、横断研究デザインであるため時間的・因果関係の評価が不可能であること、また急性代償不全または進行性腎不全(eGFR < 30 mL/分/1.73 m2または血液透析中)の患者が除外されているため一般化可能性が制限されていることなどが挙げられます。腎機能とアルブミン尿は単一の時点で評価されたため、動的な変化を捉えきれていない可能性があります。さらに、薬剤、併存疾患、生活習慣因子などの測定されていない交絡因子が、観察された関連性に影響を与えている可能性があります。 |
| 4.8. 統計解析 |
| 統計解析はStatistica 8(StaSoft, Inc.、Tulsa, OK, USA)を用いて実施した。データは平均値±標準誤差(S.E.)として提示されている。群間差は一元配置分散分析(ANOVA)により評価し、その後、Fisherの最小有意差(LSD)事後検定により特定の群間差を同定した。p値0.05未満を統計的に有意と判定した。図はGraphPad Prism 10 for Windows 64-bit、バージョン10.6.0(2025)を用いて作成した。 |
| 5. 結論 |
| 酸化ストレスは体内で二面的な役割を果たしており、重要な調節機構として機能すると同時に、酸化還元バランスが崩れた際に病態の促進因子としても機能します。糖尿病、特に糖尿病性腎症においては、酸化還元不均衡と一酸化窒素シグナル伝達の変化が疾患進行の中心となります。本研究では、糖尿病患者の腎機能状態に応じて一酸化窒素および内皮型一酸化窒素合成酵素レベルが変化し、糖尿病性腎症初期段階では上昇が見られ、進行期では低下することが確認されました。重要な点として、ヤギヨーグルトとチョークベリー(アロニア・メラノカルパ)ジュースを豊富に含む食事の導入は、酸化ストレスと炎症の調節において有望な結果を示しました。この食事介入は、腎機能に応じて一酸化窒素および内皮型一酸化窒素合成酵素レベルを正常化しただけでなく、主要な炎症マーカー、脂質過酸化、および血糖値を低下させました。観察された効果は、アロニアに含まれるフラボノイドの抗酸化作用と、ヤギヨーグルトに含まれるロイシン、微量元素、多量元素などの成分の抗炎症作用およびインスリン抵抗性改善作用に起因すると考えられます。これらの知見は、2型糖尿病およびその合併症における酸化ストレス(消化器系疾患)と炎症の管理における機能性栄養の可能性を浮き彫りにしています。今後の研究では、これらの食事戦略を糖尿病治療における利用しやすい補助療法としてさらに検討していく必要があります。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Pharmaceuticals (Basel). 2025 Sep 19;18(9)に掲載されたEffect of Combination Therapy with Probiotic Bulgarian Goat Yoghurt Enriched with Aronia melanocarpa Fruit Juice in Patients with Type 2 Diabetes Mellitus and Complication of Diabetic Nephropathy: A Pilot Study.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


