ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(アロニア:研究の最前線) |
アロニア メラノカルパ (Michx.) エリオット果汁は神経保護効果を示し、 老齢ラットの認知機能と運動機能を改善します |
Elena Daskalova et al., |
|
|
| 概要 |
本研究の目的は、ポリフェノールを豊富に含むアロニア・メラノカルパ(Michx.)エリオット果汁(AMJ:以下アロニア果汁と記載)が、高齢ラットの学習能力、記憶力、および脳形態に及ぼす影響を調査することであった。健康な雄Wistarラット(24ヶ月齢)を2群に分け、アロニア果汁群にはアロニア果汁(10 mL/kg、105日間)を経口投与し、高齢対照群(CO)にはアロニア果汁を投与しなかった。活動ケージ試験では、アロニア果汁を投与したラットは、高齢対照群と比較して垂直運動回数が増加した(p < 0.05)。能動回避試験では、アロニア果汁を投与したラットは、学習セッション開始3日目、4日目、5日目の回避回数が、高齢対照群の各日と比較して増加した(p < 0.05)。 アロニア果汁の補給は歯状回における平均ニューロン数には影響を与えなかったが、海馬貫通路の神経線維密度を有意に増加させた(p < 0.05)。アロニア果汁の補給は海馬のアセチルコリンエステラーゼ活性を増加させた。これはコリン作動性神経の機能的活動の改善を示す指標である。これらの結果は、アロニア果汁が老齢ラットの課題学習能力を改善し、運動機能を改善したことを示唆している。アロニア果汁は海馬貫通路の神経線維密度を増加させることで神経保護効果を示した。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2. 材料および方法 |
| 2.1. 試薬 |
| 2.2. アロニア果汁 |
| 2.3. 実験動物 |
| 2.4. 糖類の高速液体クロマトグラフィー(HPLC)分析 |
| 2.5. 有機酸の高速液体クロマトグラフィー分析 |
| 2.6. フェノール化合物の高速液体クロマトグラフィー分析 |
| 2.7. アントシアニンの高速液体クロマトグラフィー分析 |
| 2.8. 総ポリフェノール分析 |
| 2.9. シャトルボックステスト – 負の強化を伴う能動回避テスト |
| 2.10. 運動活動のための活動ケージ行動試験 |
| 2.11. 組織学的検査 |
| 2.12. 形態計測分析 |
| 2.13. アセチルコリンエステラーゼ活性 |
| 2.14. 統計解析 |
| 3. 結果と考察 |
| 3.1. アロニア果汁の化学組成 |
| 3.2. 高齢ラットの認知機能および運動機能に対するアロニア補給の効果 |
| 4. 結論 |
| 5.ハイライト |
本文 |
| 1.はじめに |
| 加齢は神経変性疾患発症の主要な危険因子の一つです。加齢は認知機能の低下と関連しており、生活の質に大きく影響します。認知機能障害は老化の兆候の一つであり、脳構造の機能的、生化学的、形態学的変化に基づいています。酸化ストレスは、中枢神経系に影響を与える疾患の発症機序と関連している重要な事象です。これは、神経組織は酸素消費量が多く、鉄分と脂質(特に多価不飽和脂肪酸)の含有量が高く、抗酸化防御の活性が低いため、酸化ストレスに対して非常に敏感であることを考えると当然のことです(Koufen and Stark, 2000)。さらに、酸化ストレスに関連する低度の慢性炎症は加齢と正の相関関係にあり、明らかな疾患がない場合でも、老化プロセスにおける主要な因子の一つとなります(Pawelec et al., 2014)。天然の抗酸化物質を加齢に伴う変化に対抗するために用いることは、大きな可能性を秘めた戦略であり、健康的な老化という考え方は、植物性ポリフェノールの抗老化作用に関する広範な研究につながっています。ポリフェノールやその他の天然化合物は、抗酸化物質の供給源およびアセチルコリンエステラーゼの調節因子であることが証明されています(Figueira et al., 2017)。 |
| アロニアの果実は、ポリフェノール、特にアントシアニンの最も豊富な供給源の一つであり、非常に高い抗酸化作用を示します(Denev et al., 2013)。今日では、その健康効果から、アロニアは世界中で栽培されています。多くのin vitroおよびin vivo研究において、アロニアの果実を原料とした果汁、エキス、または機能性飲料は、抗炎症作用、抗変異原性作用、抗発がん作用、脂質低下作用、抗糖尿病作用、降圧作用、肝保護作用、免疫調節作用を有することから、幅広い用途に利用できることが実証されています(Valcheva-Kuzmanova et al., 2004, 2007a, b, c; Denev et al., 2012; Borowska and Brzóska, 2016)。専門誌では、アロニアの神経保護作用と老化、特に加齢に伴う脳の変化への影響に関するデータが限られています。最近の研究では、アロニアの果汁を亜慢性的に塗布すると、若い健康なラットの学習能力と記憶力が向上することが明らかになっています(Valcheva-Kuzmanova et al., 2013, 2014)。別の研究では、アロニア抽出物がHT22細胞(訳者注:HT22細胞は神経細胞の表現型を示し、認知、学習、記憶のような重要な脳機能に関与する必須の興奮性神経伝達物質であるグルタミン酸に対して非常に感受性が高い)のグルタミン酸誘発細胞死、活性酸素種、細胞内Ca2+レベルを低下させ、HT22細胞のミトコンドリア膜電位の抗酸化状態を高めることが実証されています(Lee et al., 2017)。しかし、我々の知る限りでは、アロニア果汁またはそのポリフェノールの神経保護効果、およびそれらが高齢哺乳類の認知機能と運動機能に及ぼす影響に関する研究は行われていません。ラットでは、ヒトと同様に、学習能力と記憶力は加齢とともに低下するため、この齧歯類は、加齢に伴う認知障害の回復に向けた臨床的に価値のある戦略を評価するのに適したモデルです。高齢ラットの記憶力の進行性低下は、海馬の根本的な構造的、細胞的、分子的変化と関連しており、おそらくその変化が先行していると考えられます(Morel et al., 2015)。中枢コリン作動系は認知機能の調節に不可欠であり、アルツハイマー病患者の前脳ではコリン作動性神経が広範に喪失していることがそれを証明しています。 アセチルコリンは、神経のスパイク活動と神経伝達物質の放出を調節することにより、シナプス可塑性に急性効果を発揮します (Dannenberg et al.、2015)。 しかしながら、定量組織化学法を用いてアセチルコリンエステラーゼを測定する先行研究では、高齢ラットでは若年対照群と比較して、コリン作動性細胞体領域(腹側淡蒼球および内側中隔核)および投射領域(皮質および海馬)におけるアセチルコリンエステラーゼ含量が大幅に減少していることが明らかになっています。同じ高齢ラット群では、水迷路課題の習得に重度の障害が認められています(Biegon et al., 1986)。アセチルコリンは、神経新生、脊髄およびシナプス形成に影響を及ぼすことで、神経回路に広範な影響を及ぼすことが示されている(Paez-Gonzalez et al., 2014)。 海馬は古くからヒトをはじめとする哺乳類の記憶機能に関与していることが示唆されているが、酸素消費量が多く、多価不飽和脂肪酸の含有量が高いため、酸化ダメージを受けやすく、様々な神経変性疾患を引き起こす可能性がある(Selvakumar et al., 2012)。そこで本研究の目的は、アロニア果汁が高齢ラットの行動および運動機能に及ぼす影響、ならびにそれらが海馬の形態変化および脳のアセチルコリンエステラーゼ活性とどのように関連しているかを調査することであった。 |
| 2. 材料および方法 |
| 2.1. 試薬 |
| Folin-Ciocalteu'sフェノール試薬はMerck社(Darmstadt, Germany)から提供された。シアニジン-3-O-ガラクトシドクロリド、シアニジン-3-O-アラビノシドクロリド、およびシアニジン-3-O-アラビノシドクロリドはExtrasynthese社(Genay Cedex, France)から購入した。没食子酸、クロロゲン酸、3,4-ジヒドロキシ安息香酸、p-クマル酸、カフェ酸、エラグ酸、フェルラ酸、カテキン、ルチン、ナリンギン、ナリンゲニン、エピカテキン、ミルセチン、ケルセチン-3-グルコシド、ケルセチン、ケンフェロール、グルコース、フルクトース、スクロース、ソルビトール、キナ酸、酒石酸、リンゴ酸、アスコルビン酸、α-ケトグルタル酸、クエン酸、シキミ酸、シュウ酸は、Sigma Aldrich(Steinheim, Germany)から購入しました。その他の溶媒はすべて分析用グレードで、現地の販売代理店から購入しました。 |
| 2.2. アロニア果汁 |
| アロニア・メラノカルパの果実は、2017年8月に認可農家のトドル・ペトコフ氏(Kazanlak, Stara Zagora district, Bulgaria)から、完熟期の状態で供給された。新鮮な果実はポリエチレン袋に入れられ、直ちに冷凍され、ジュース抽出まで-18℃で保存された。5kgの冷凍果実を室温で解凍し、実験室用ミキサーで均質化した。均質化物は褐色ガラス瓶に移し、恒温振盪水槽で60℃に1時間保温した。その後、果肉をチーズクロスで濾過し、得られた液体分画を遠心分離し、研究に使用した。 |
| 2.3. 実験動物 |
| 本研究には、実験開始時に24ヶ月齢、体重490~540gの雄Wistarラット12匹が用いられました。動物はプロヴディフ医科大学動物飼育室から提供され、標準的な実験室環境で飼育されていました。ラットは2群に分けられ、対照群(対照、n=6)と実験群(アロニア果汁、n=6)でした。前者には標準的な飼料と飲料水を自由に摂取させ、後者には飲料水で1:1に希釈したアロニア果汁を10 mL/kgの用量で投与しました。 この用量は、以前、健康なラットの記憶力改善に有効であることが示されている(Valcheva-Kuzmanova et al., 2014)。実験は105日間続きました。運動活動と記憶能力を記録し、実験期間終了時に動物をケタミン/キシラジン(90 mg/kg/10 mg/kg)の筋肉内投与で麻酔し、頸部断頭により安楽死させた。直後、各動物の脳を慎重に摘出し、氷冷生理食塩水で洗浄した後、左右対称に半分に分割した。右側脳は10%中性ホルマリンで固定し、組織学的検査を行った。左側脳からは海馬と前頭皮質を分離し、液体窒素で凍結して生化学分析に使用した。 |
| 実験プロトコルは、ブルガリア食品安全庁の動物倫理的扱いに関する委員会(No.102/10.07.2014)によって承認されました。すべての動物は、国立医学研究協会が策定した「実験動物の飼育原則」および国立衛生研究所が作成した「実験動物の飼育および使用に関するガイドライン」(NIH出版物No.86–23、1996年改訂)に従って飼育されました。 |
| 2.4. 糖類の高速液体クロマトグラフィー(HPLC)分析 |
| 糖類の高速液体クロマトグラフィー分析は、Agilent 1220 高速液体クロマトグラフィーシステム(Agilent Technology、USA)を用いて、バイナリポンプおよび示差屈折率検出器(Agilent Technology、USA)とともに実施した。カラムは、Zorbax Carbohydrate(5 μm、4.6×150 mm、Agilent)をガードカラムZorbax Reliance Cartridge(Agilent)に接続し、溶出液には80%アセトニトリルを使用し、流速1.0 ml/分、温度25 °Cで行った。得られた結果は、g/Lジュースとして表した。 |
| 2.5. 有機酸の高速液体クロマトグラフィー分析 |
| 有機酸の高速液体クロマトグラフィー測定は、Agilent 1220 高速液体クロマトグラフィーシステム(Agilent Technology、USA)を用いて、バイナリポンプおよびUV-Vis検出器(Agilent Technology、USA)を用いて実施した。有機酸の分離は、Agilent TC-C18カラム(5 μm、4.6 mm×250 mm)を用いて、25 °C、210 nmの波長で実施した。移動相は、25 mMリン酸緩衝液(K2HPO4/H3PO4)(pH 2.4)であり、流速は1.0 ml/分であった。得られた結果は、g/Lジュースとして表した。 |
| 2.6. フェノール化合物の高速液体クロマトグラフィー分析 |
| フェノール成分の高速液体クロマトグラフィー分析は、Denevら(2018)の報告に従って、バイナリポンプおよびUV-Vis検出器(Agilent Technology、USA)を備えたAgilent 1220 高速液体クロマトグラフィーシステム(Agilent Technology、USA)を用いて実施した。分離は、Agilent TC-C18カラム(5 μm、4.6 mm×250 mm)を用いて、25 °C、波長280 nmで行った。移動相は、0.5%酢酸(A)および100%アセトニトリル(B)を用い、流速0.8 ml/分で行った。グラジエント溶出は、14% Bから開始し、6分後から30分後にかけて25% Bまで直線的に増加し、40分後に50% Bまで増加させた。得られた結果は、果汁1Lあたりのmgとして表されました。 |
| 2.7. アントシアニンの高速液体クロマトグラフィー分析 |
| アントシアニンは、Agilent 1220 高速液体クロマトグラフィーシステム(Agilent Technology、Palo Alto, Ca)を用いて、バイナリポンプおよびUV-Vis検出器(Agilent Technology、USA)を用いて測定した。測定波長は520 nmであった。アントシアニンは、Agilent TC-C18カラム(5μm、4.6mm×250mm)を用いて25℃で分離した。移動相は、5%ギ酸(A)および100%メタノール(B)とし、流速は1.0ml/分とした。グラジエント溶出は、B濃度15%から開始し、20分後にB濃度30%まで直線的に増加させた。結果はmg/Lジュースとして表した。 |
| 2.8. 総ポリフェノール分析 |
| 総ポリフェノールは、SingletonとRossi(1965)の方法により、Folin-Ciocalteu試薬を用いて測定した。検量線には没食子酸を使用し、結果は果汁1リットルあたりの没食子酸当量(GAE)として表した。 |
| 2.9. シャトルボックステスト – 負の強化を伴う能動回避テスト |
| 能動回避用シャトルボックス自動反射調整装置(Ugo Basile, Comerio-Varese, Italy)を使用した。学習セッションは連続5日間とした。各日は30回の試行で構成され、以下のパラメータが設定された。6秒間の光とブザー(670 Hz、70 dB)、3秒間の0.4 mAフットショック、12秒間の休止。記憶保持セッションは、フットショックを除いて同じパラメータで7日後(12日目)に実施された。学習セッションと記憶保持セッション中の回避回数は自動的に記録された。各テストの前に、装置はきれいに拭き取り、乾燥させた。実験は午前9時から午後1時の間に行われた。 |
| 2.10. 運動活動のための活動ケージ行動試験 |
| 個々のラットの水平方向および垂直方向の活動は、Ugo Basile 活動ケージ装置(透明カバー付き動物ケージと電子ユニットから構成)によって記録されました。活動は、歩行活動評価用に設計された水平センサーによって検出されました。動物の動きは電子ユニットによってカウントされ、記録されました。水平方向および垂直方向の活動のデータは、事前に設定された間隔でデジタル形式で印刷されました。活動は、動物を試験ケージに入れた直後から5分間記録されました。運動活動の測定は、通常の実験室照明下で静かな部屋で行われました。各試験の前に、ケージはきれいに拭き、乾燥させました。実験は午前9時から午後1時の間に行われました。 |
| 2.11. 組織学的検査 |
| Bielschowskyブロック浸漬法は以下のように実施した。摘出した脳を冠状に3mm角のブロックに切断し、12%中性ホルマリン溶液で4~6週間固定した。次に、ブロックを水切りし、2%硝酸銀溶液に4日間浸漬した後、アンモニア性銀溶液に3時間浸漬した。蒸留水で十分に洗浄した後、20%中性ホルマリン溶液に18時間浸漬した。その後、洗浄し、40%アルコールで1時間、50%アルコールで1時間、70%アルコールで2時間、85%アルコールで2時間、95%アルコールで24時間、100%アルコールで2時間脱水し、シダーウッドオイルで清澄化し、パラフィン包埋後、12μmの厚さに薄切し、スライドガラスに封入した。スライドガラスはキシレンで脱パラフィンし、カバーした。 |
| 2.12. 形態計測分析 |
| 形態計測分析には、歯状回の細胞層および海馬の貫通路から得られた厚さ12μmの組織切片を用いた。顆粒ニューロンは、歯状回の顆粒層における位置によって同定した。ビエルショウスキー染色した切片の冠状脳切片を用いて、単位面積(50μm²)あたりのニューロン小体の平均数を測定した。神経線維密度は、単位面積(50μm²)あたりの神経線維数を計数することにより推定した。全ての試験において、動物1頭につき5枚の切片を検査し、各切片について少なくとも5つの領域を測定した。測定は、オリンパス社(Japan)のDP-Soft ver. 3.2ソフトウェアを用いて実施した。顕微鏡写真は、ニコン社製 Microphot SA 顕微鏡(Japan)とオリンパス社製 Camedia-5050Z デジタルカメラ(Japan)を組み合わせて撮影しました。 |
| 2.13. アセチルコリンエステラーゼ活性 |
| アセチルコリンエステラーゼ活性は、人工基質としてヨウ化アセチルチオコリン(ATCI)を供給し、Ellmanら(1961)の改良法を用いて測定した。この方法では、ヨウ化アセチルチオコリンの分解産物であるチオコリンと5,5-ジチオビス-(2-ニトロ安息香酸)との反応により、412 nmに吸収極大を有する黄色の陰イオンが生成される。吸光度の変化は3分以内に測定され、酵素活性の算出に用いられた。酵素活性は、加水分解された基質のマイクロモル数/分/mgタンパク質として表した。 |
| 2.14. 統計解析 |
| 統計解析にはSPSS 21を用いた。結果は平均値±標準誤差(SEM)として示されている。パラメトリック解析には、正規分布水準での対応のあるt検定、独立標本のt検定、一元配置分散分析(ANOVA)およびTukey検定を用いた。ノンパラメトリック解析には、Wilcoxonの符号順位検定およびMann-WhitneyのU検定を用いた。P < 0.05を統計的に有意と判定した。 |
| 3. 結果と考察 |
| 3.1. アロニア果汁の化学組成 |
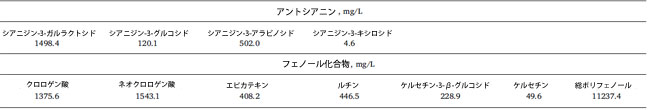
| 使用したアロニア果汁の糖類および有機酸の含有量と組成を表1に示す。果汁中の主な糖類はソルビトールであり、これは文献情報(Denev et al., 2018)と一致する。果汁中の有機酸に関しては、キナ酸とリンゴ酸が最も多く含まれている。アスコルビン酸の量も顕著である(Denev et al., 2018)。アロニア果汁の抗酸化活性に寄与すると考えられる個々のフェノール成分の量を表2に示す。結果から明らかなように、アロニア果汁はポリフェノールが特に豊富で、総含有量は11237.4 mg/Lである。アントシアニンの量も顕著で、2125.1 mg/Lです。これは主にシアニジンのガラクトシド配糖体とアラビノシド配糖体で構成されています。ヒドロキシケイ皮酸(クロロゲン酸およびネオクロロゲン酸)の量はさらに多く、累積含有量は2918.7 mg/Lです。 |
| 表1 アロニア果汁中の糖類および有機酸含有量 |
 |
| 表2.アロニア果汁中のアントシアニンおよびその他のフェノール化合物の含有量 |
 |
| 3.2. 高齢ラットの認知機能および運動機能に対するアロニア補給の効果 |
| フラボノイドは、ヒトの食事で最も一般的なポリフェノール化合物群であり、これを豊富に含む食品を定期的に摂取すると、高齢者の認知能力が向上し、認知機能低下のリスクが低下することが報告されています(Brickman et al., 2014)。アロニア果汁の記憶力改善効果は、若いラットを用いた受動回避試験で実験的に研究されており(Valcheva-Kuzmanova et al., 2014)、アロニア由来のアントシアニンが空間記憶を維持することが明らかになっています。 |
| 本研究では、能動回避テストを受けた対照群とアロニア果汁を補給した動物の成績を図1に示す。対照群の記憶保持テストで測定された回避回数は、1日目と比較して2日目に減少した(p < 0.05)。10 mL/kgのアロニア果汁を補給したラット群は、学習セッションの3日目、4日目、5日目に、同じ日の対照群の行動と比較して、回避回数が有意に増加した(p < 0.05)。アロニア果汁群の記憶保持テスト(12日目)で測定された回避回数は、対照群と比較して増加する傾向があった。 |
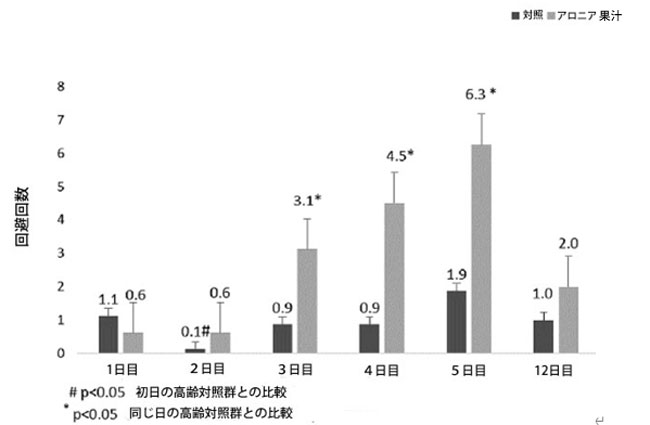 |
| 図1.アロニア果汁補給がラットの能動回避試験に及ぼす影響 |
| 活動ケージテストでは、アロニア果汁群は対照群と比較して、水平運動活動の相対単位数が増加する傾向が見られました。垂直運動活動の相対単位数は、アロニア果汁群で対照群と比較して有意に増加しました(p < 0.05)(図2)。自発的な運動と立ち上がりは、筋力、バランス、運動協調性に依存するため、加齢とともに減少することが知られています(Sumien et al., 2006)。 本研究の結果は、アロニア果汁の補給が高齢ラットの精神運動機能を改善することを示唆しています。 |
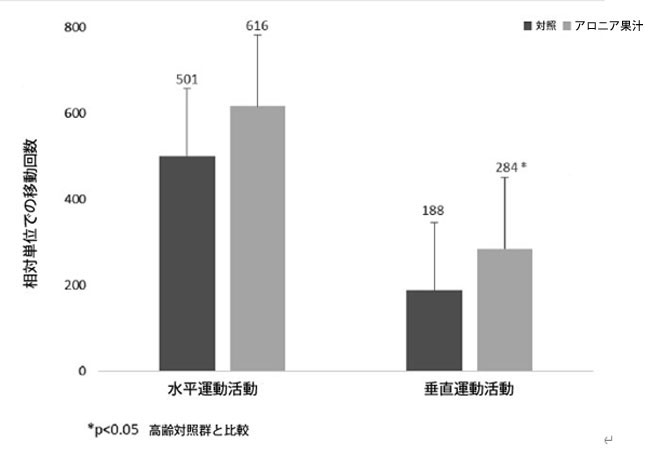 |
| 図2. アロニア果汁補給がラットの活動ケージテストに及ぼす影響 |
| 実験動物における認知機能改善の形態学的基盤を明らかにするため、脳の記憶関連部位である海馬(訳者注:海馬(かいば)は脳の記憶を司る重要な部位で、タツノオトシゴのような形をしており、短期記憶から長期記憶への情報変換や、新しい記憶の形成に不可欠です。ストレスや睡眠不足に弱く萎縮しやすい一方、運動や学習、良い生活習慣で神経新生(再生)も可能で、加齢による記憶力低下を防ぎ、判断力・創造力向上にも関与します)の構造を調べた。ビエルショウスキー銀染色は、軸索と樹状突起を可視化し、成熟神経の細胞内神経原線維ネットワークの詳細を明らかにする。神経細胞体は、銀分子が細胞内ミクロフィブリルに浸透しているため、楕円形と薄茶色に観察される。 神経の軸索と樹状突起は、神経網の黄金色の背景とは対照的に、絡み合った黒色の繊維として観察される(図3)。 |
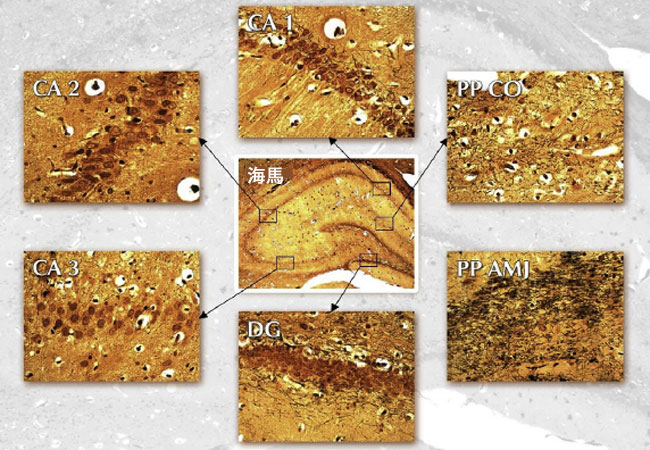 |
図 3. ラットの海馬。 Bielschowsky銀含浸。 海馬、拡大。 ×40; CA1-コルヌアンモニスエリア1; CA2 - アンモニア角エリア 2。 CA3 - アンモニア角領域 3、DG - 歯状回、PP CO - 穿孔路の古い対照群、PP AMJ - 穿孔路のアロニア添加グループ、倍率×400。 |
| 図3の中央部分は、ラットの脳の海馬を40倍で示しています。CA1、CA2、CA3の錐体層は明瞭に観察でき、海馬のこれらの領域を追跡することができます。 歯状回の顆粒層の神経は、この層を明瞭に描写しています。図3は、ラット海馬のCA1、CA2、CA3領域、歯状回(DG)、および貫通路(PP)を400倍で示しています。貫通路は海馬への主要な入力です。貫通路の軸索は嗅内皮質から始まり、歯状回の顆粒細胞、CA3領域、CA1領域、および海馬台核の錐体細胞に投射します。 |
| 海馬における平均神経数と神経線維密度を図4に示す。実験群間で平均神経数に差は認められなかった(p > 0.05)。アロニア果汁群の貫通路における神経線維密度は、対照群と比較して有意に高かった(p < 0.05)。 |
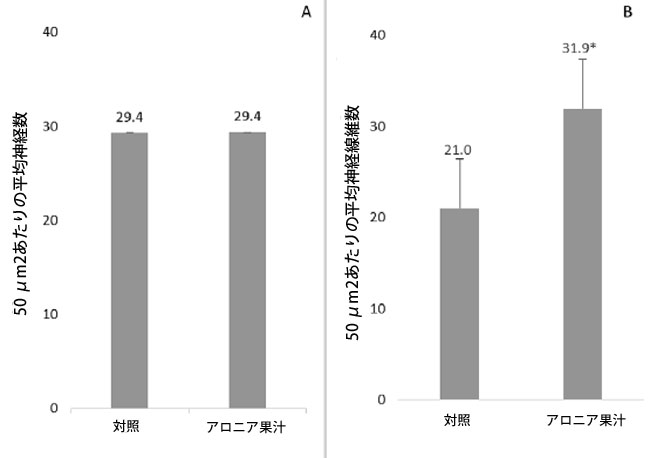 |
| 図4. ラット脳の歯状回顆粒層における単位面積あたりの平均神経量(n/50 μm2)(パネルA)と海馬貫通路における単位面積あたりの平均神経線維数(n/50 μm2)(パネルB)。アスタリスクは、アロニア摂取群の貫通路における神経線維密度が、高齢対照群と比較して有意に高い(p < 0.05)ことを示す。 |
| アロニア果汁補給が海馬および前頭前皮質におけるアセチルコリンエステラーゼ活性に及ぼす影響を調べた(図5)。 その結果、アロニア補給群のアセチルコリンエステラーゼ特異的活性は、高齢対照群と比較して有意に高かった(p < 0.05)。 |
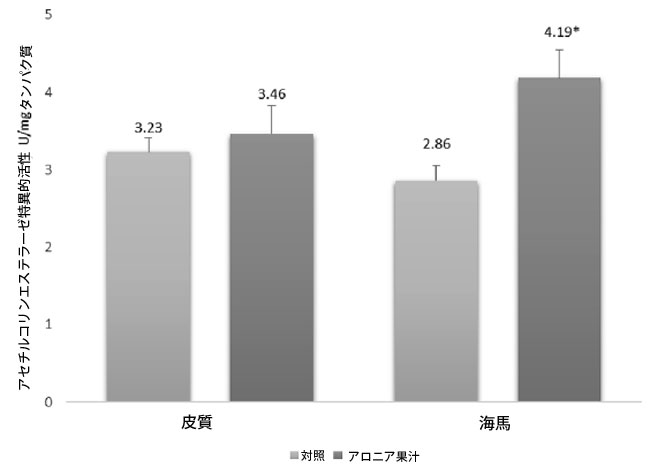 |
| 図5. 高齢対照群とアロニアを摂取した高齢ラットの脳におけるアセチルコリンエステラーゼ比活性。アスタリスクは、高齢対照群と比較してアロニアを摂取した群のアセチルコリンエステラーゼ比活性が有意に高かった(p < 0.05)ことを示す。 |
| 我々が観察したアセチルコリンエステラーゼ活性の上昇は、海馬におけるコリン作動性神経系の機能活動の改善を示す証拠であり、形態学的結果と一致しています。これらの結果は、アロニア果汁補給による神経線維数の増加によって説明できます。観察されたアセチルコリンエステラーゼ活性の上昇は、必ずしもアセチルコリン濃度の低下とは関連していないと考えられます。なぜなら、生存可能なコリン作動性神経線維の数が多いほど、伝達物質の産生量も増加する可能性が高いためです。コリンアセチルトランスフェラーゼ酵素とアセチルコリンエステラーゼは、コリン作動性神経の生理学的活動の特異的マーカーとして機能するタンパク質として知られています。さらに、どちらも神経のアセチルコリンの恒常性維持において重要な役割を果たしています(Fonnum, 1975)。コリン作動性神経系における神経伝達は、学習、記憶、睡眠などのプロセスに関与しています。さらに、コリン作動性神経支配は記憶の定着プロセスに直接関連しており(Bowen et al., 1982; Squire et al., 1992)、神経伝達の問題はこれらの機能の変化を引き起こし、それが老人性認知症やアルツハイマー病の原因の一つとなる可能性があります(Davies, 1983; Orta-Salazar et al., 2014)。基底前脳におけるコリン作動性神経の選択的病変は、海馬依存性記憶機能を著しく障害することから、中隔海馬のコリン作動性投射が記憶形成に関与していることが示唆されています(Berger-Sweeney et al., 2001)。 |
| 天然物由来の様々な抗酸化化合物(栄養補助食品)は、それぞれ神経細胞死または神経変性のin vitroモデルまたはin vivoモデルにおいて神経保護活性を示すことが示されています。これらの化合物の多くは一般的に抗酸化物質と考えられています。これらの化合物は、フリーラジカルを直接的に除去するか、例えば核因子赤血球由来2関連因子2転写因子経路の活性化を介して間接的に内因性細胞の抗酸化防御を高めるため、このように分類されます。これらの化合物の神経保護効果については、シグナル伝達カスケードの調節や遺伝子発現への影響など、別の作用機序も示唆されています(Kelsey et al., 2010)。ポリフェノールが神経系の健康を改善する可能性は、細胞内神経およびグリア細胞シグナル伝達との相互作用、末梢および脳血管の血流への影響、神経毒および神経炎症によって引き起こされる神経の損傷および喪失の軽減など、いくつかのメカニズムに関連していると考えられます(Spencer, 2010a)。アロニア由来のポリフェノール物質は、長期摂取により脳内に蓄積し、その抗酸化作用により神経細胞の抗酸化状態を改善する可能性があります。アロニア果実ポリフェノールの補給は、高齢マウスの脳内においてモノアミン(ノルエピネフリン、ドーパミン、5-ヒドロキシトリプタミン)のレベルを上昇させ、シクロオキシゲナーゼ-2、インターロイキン-1、形質転換成長因子ベータ1などの炎症性サイトカインの過剰な蓄積を抑制すると考えられます。さらに、補給は血液および脳組織の酸化還元バランスを調整することができます。アントシアニンは脳細胞におけるDNA損傷を抑制し、加齢マウスの脳におけるDNA損傷シグナル伝達経路におけるタンパク質発現を調節する(Wei et al., 2017)。フラボノイドが神経保護作用を示す他の側面としては、末梢および脳血管の血流に対する良好な作用が挙げられ、最終的にはシナプス可塑性プロセスと認知機能に影響を与える(Rendeiro et al., 2015)。フラボノイドとその生理学的代謝物は、cAMP応答配列結合タンパク質などのタンパク質を調節し、学習と記憶保持のプロセスに必要な脳由来神経栄養因子の産生を増加させることで、シグナル伝達経路におけるキナーゼを活性化する能力がある(Spencer, 2010b)。生体内研究では、ケルセチンが慢性鉛曝露によって引き起こされる障害のモデルにおいて記憶力と海馬シナプス可塑性を改善することが示されており(Hu et al., 2008)、コルヒチン投与による認知障害に対する神経保護効果があることが明らかになっています(Kumar et al., 2008)。 |
| 4. 結論 |
| 双方向能動回避試験の結果、アロニア果汁は高齢ラットの課題学習能力を有意に向上させることが示されました。さらに、運動機能も改善しました。観察された行動および記憶の変化は、海馬の貫通路における神経線維数の増加と一致しており、これはコリン作動性神経の機能活動の増加を示す指標となる可能性があります。これは、アロニア果汁の神経保護効果と神経可塑性効果の現れです。 |
| 5.ハイライト |
•アロニア果汁は、ポリフェノールとアントシアニンが非常に豊富です。 •アロニア果汁は、高齢ラットの運動機能と短期記憶を改善します。 •アロニア果汁は、海馬貫通路の神経線維密度を高めます。 •アロニア果汁は、コリン作動性神経の機能的活動を高めます。 •アロニア果汁は、高齢ラットにおいて神経保護作用を有します。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Food and Chemical Toxicology 132 (2019) 110674に掲載されたAronia melanocarpa (Michx.) Elliot fruit juice reveals neuroprotective effect and improves cognitive and locomotor functions of aged rats.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


