ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(アロニア:研究の最前線) |
マウスの高尿酸血症を軽減する ブラックチョークベリー(アロニア・メラノカルパ)の治療効果を解明 |
Chin-Yuan Liu et al., |
|
|
| 概要 |
背景:高尿酸血症は、脂質異常症、高血圧、冠動脈疾患、肥満、メタボリックシンドローム、2型糖尿病などの心血管疾患のリスクを高めるだけでなく、腎機能にも深刻な影響を与え、急性腎障害や慢性腎臓病につながる可能性があります。 |
| 方法:本研究は、オキソニック酸によって誘発された高尿酸血症マウスに対するブラックチョークベリー(アロニア・メラノカルパ)の健康効果を調査することを目的とします。 |
| 結果:実験結果から、ブラックチョークベリーはマウスに対して有意な毒性作用や悪影響を及ぼさないことが示されました。尿酸測定では、ブラックチョークベリーが尿酸値を抑制したことが示されました。さらに、高用量群ではキサンチンオキシダーゼ活性が有意に低下し、血清尿素窒素およびクレアチニン値も低下しました。ブラックチョークベリーは、高尿酸血症マウスのグルタチオン濃度を効果的に増加させ、マロンジアルデヒド濃度を低下させ、さらにアデノシンデアミナーゼ活性を著しく阻害しました。 |
| 結論:その効能は市販薬アロプリノールと同等であり、ブラックチョークベリーが尿酸値を下げる機能性食品として期待できることを裏付けています。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2. 方法 |
| 2.1. サンプル調製 |
| 2.2. 動物 |
| 2.3. 血清調製 |
| 2.4. 肝臓ホモゲネートの調製 |
| 2.5. 血中尿素窒素の測定 |
| 2.6. 血清クレアチニン量の測定 |
| 2.7. 血清中尿酸値の測定 |
| 2.8. キサンチンオキシダーゼ活性の測定 |
| 2.9. グルタチオン含量の測定 |
| 2.10. マロンジアルデヒド含量の測定 |
| 2.11. アデノシンデアミナーゼ活性の測定 |
| 2.12. 統計手法 |
| 3. 結果と考察 |
| 3.1. 体重、摂餌量、摂水量、および臓器重量 |
| 3.2. 血清血中尿素窒素およびクレアチニン |
| 3.3. 血清尿酸値とキサンチンオキシダーゼ活性 |
| 3.4. 高尿酸血症マウスにおけるグルタチオンおよびマロンジアルデヒドレベル |
| 3.5. オキソニック酸カリウム塩誘発性高尿酸血症マウスにおけるアデノシンデアミナーゼ活性 |
| 4. 結論 |
本文 |
| 1.はじめに |
| 高尿酸血症とは、血清中の尿酸濃度が過度に高い状態を指します。一般的に、血清尿酸値が男性で7mg/dL、女性で6mg/mLを超えると高尿酸血症と診断されます。高尿酸血症の世界的有病率は約19.37%で、男性と閉経後女性で高い発生率が観察されています(1)。病状が進行すると、痛風性関節炎、腎結石、腎障害を引き起こす可能性があります(2)。 |
| 尿酸はプリン代謝の最終産物であり、血清中の尿酸の大部分は内因性プリンに由来し、約3分の1は食事由来です。高尿酸血症は、尿酸の過剰産生と腎排泄不足によって引き起こされます。そのため、現在使用されている尿酸値を下げる薬剤は、主に尿酸排泄の促進とキサンチンオキシダーゼ(XO)の阻害によって作用します(3)。しかし、これらの薬剤はアレルギー、下痢、肝毒性、腎毒性などの副作用を伴うことがよくあります(4, 5)。そのため、高尿酸血症に対する安全かつ効果的な代替治療法が求められています。 |
| アロニア・メラノカルパ(Aronia melanocarpa)は、通称ブラックチョークベリーとも呼ばれ、ポリフェノール化合物とフラボノイドを豊富に含むベリー類です。主な有効成分には、クロロゲン酸、ネオクロロゲン酸、アントシアニン、プロアントシアニジン、ケルセチン誘導体などがあります。数多くの研究において、抗酸化作用、抗炎症作用、抗菌作用、降圧作用、脂質低下作用、抗糖尿病作用、肝保護作用、神経保護作用など、様々な健康効果が確認されています(6)。過去の研究では、ブラックチョークベリーがラットモデルにおいて、血清尿酸値の改善、キサンチンオキシダーゼ活性の低下、急性痛風に伴う炎症の抑制に効果があることが示されています(7)。さらに、ブラックチョークベリーは、炎症誘発因子、酸化ストレス、脂質過酸化、アポトーシスの発現を抑制し、腎機能を改善することで腎障害を軽減することが示されています(8)。 |
| 本研究では、国産のブラックチョークベリーを用いて、マウスの血清中の尿酸値(UA)、血中尿素窒素(BUN)、クレアチニン(CRE)を測定し、腎機能を評価しました。また、肝機能を評価するため、キサンチンオキシダーゼ、グルタチオン(GSH)、マロンジアルデヒド(MDA)、アデノシンデアミナーゼ(ADA)の活性も測定しました。ブラックチョークベリーの尿酸値低下作用は、オキソン酸カリウム塩(OA)投与によって誘発された高尿酸血症マウスにおいてさらに検討されました。ブラックチョークベリーは、尿酸産生を抑制し、血中尿素窒素を低下させ、クレアチニン値を低下させる可能性を示し、キサンチンオキシダーゼおよびアデノシンデアミナーゼの活性も阻害しました。これらの結果は、ブラックチョークベリーがマウスの腎機能と肝機能の両方を改善する可能性があり、尿酸値低下のための機能性食品として期待できることを示唆しています。 |
| 2. 方法 |
| 2.1. サンプル調製 |
| ブラックチョークベリーを搾汁した後、果汁を40メッシュの篩で濾過し、さらに真空濾過して皮と果肉を除去した。濾液を真空凍結乾燥機で凍結乾燥させ、得られた乾燥粉末をブラックチョークベリーとした。この粉末は、後の実験のために-20℃で保存した。 |
| 2.2. 動物 |
| 本研究は、国立嘉義大学実験動物管理委員会(承認番号:112021)の承認を得た。LASCO Biotechnology Co., Ltd.より5週齢の雄性ICRマウスを購入し、オキソニック酸カリウム塩(OA)を腹腔内投与して高尿酸血症モデルを作成した。マウスを1週間馴化させた後、無作為に6群(各群6匹)に分け、ブランク群、腹腔内投与によるオキソニック酸カリウム塩250mg/kg bw/日)誘発群、オキソニック酸カリウム塩+アロプリノール(10mg/kg bw/日)群、オキソニック酸カリウム塩+低用量サンプル(450mg/kg bw/日)群、オキソニック酸カリウム塩+中用量サンプル(900mg/kg bw/日)群、オキソニック酸カリウム塩+高用量サンプル(1800mg/kg bw/日)群とした。実験は1週間行われた。実験後、生化学分析のために心臓穿刺により血液を採取し、肝臓と腎臓を解剖した。臓器は生理食塩水で洗浄し、重量を測定した後、アルミホイルで包み、液体窒素で急速凍結した後、さらなる分析のために-80℃で保存した。 |
| 2.3. 血清調製 |
| 採取した血液を抗凝固剤を含まないチューブに入れ、室温で1時間凝固させた後、4℃、3,000rpmで10分間遠心分離して血清を分離し、-80℃で保存した。 |
| 2.4. 肝臓ホモゲネートの調製 |
| 肝臓(0.4g)をPBSでホモゲネートし、5,000rpm、4℃で10分間遠心分離し、上清を回収して-80℃で保存した。 |
| 2.5. 血中尿素窒素の測定 |
| 尿素酵素反応速度法キット(RANDOX社製)を用いて分析する。血清10μLおよび標準溶液1mLを、α-オキソグルタル酸、アデノシンにリン酸 、ウレアーゼ、GLDH(グルタミン酸デヒドロゲナーゼ)、NADH(還元型ニコチンアミドアデニンジヌクレオチド)、トリス緩衝液(pH 7.6)を含む反応試薬1mLに加え、37℃で30秒間反応させた後、340nmにおける吸光度を測定する。さらに60秒間反応を続け、340nmにおける吸光度を再度測定する。 |
| 計算式:血中尿素窒素=標準濃度×ΔAs試料,340nm/ΔA標準,340nm |
| 2.6. 血清クレアチニン量の測定 |
| クレアチニン市販キット(RANDOX社製)を用いて分析する。血清100μLと標準溶液1mLを、35μmol/Lピクリン酸および0.32mol/L水酸化ナトリウムを含む反応試薬1mLに加える。30秒後および150秒後に492nmの吸光度を測定する。 |
| 計算式:クレアチニン=標準濃度 × ΔA試料, 492 nm/ΔA標準, 492 nm |
| 2.7. 血清中尿酸値の測定 |
| 尿酸測定キット(RANDOX社製)を用いて測定する。血清20μLと尿酸標準液を、HEPES緩衝液、3,5-ジクロロ-2-ヒドロキシベンゼンスルホン酸、4-アミノフェナゾン、ウリカーゼ、ペルオキシダーゼを含む反応試薬1mLに加える。よく混合し、37℃のウォーターバス中で5分間インキュベートする。520nmにおける吸光度を測定する。 |
| 計算式:尿酸=標準濃度×(A試料, 520 nm/A標準 520 nm) |
| 2.8. キサンチンオキシダーゼ活性の測定 |
| 肝臓中のキサンチンオキシダーゼ活性は、キサンチンから尿酸への変換に基づいて測定する(9)。肝臓ホモゲネート100μLと尿酸標準溶液を、50μMキサンチンおよび5mM EDTAを含む反応試薬4.9mLに加える。37℃で30分間インキュベートした後、0.58M HCl 500μLを加えて反応を停止させる。波長290nmで吸光度を測定する。 |
| 2.9. グルタチオン含量の測定 |
| 肝臓ホモゲネート100μLを5% TCA溶液100μLに加え、氷上で5分間インキュベートする。12,000rpmで15分間遠心分離し、上清150μLを採取する。これをトリス/EDTA溶液(pH 8.2)750μLに加え、よく混合する。次に、5,5'-ジチオビス-(2-ニトロ安息香酸)(DTNB)溶液37.5μLを加え、5分間インキュベートした後、412nmで吸光度を測定する(10)。 |
| 2.10. マロンジアルデヒド含量の測定 |
| 肝組織ホモゲネート40μLとTEP標準品を120μLの脱イオン水と40μLの8.1% SDS溶液に加える。よく混合し、室温で5分間インキュベートする。次に、20%エタノール酸(pH 3.5)300μLと0.8% TBA試薬300μLを加え、95℃で1時間インキュベートする。冷却後、4,000rpmで10分間遠心分離し、上清の532nmにおける吸光度を測定する(11)。 |
| 2.11. アデノシンデアミナーゼ活性の測定 |
| Elabscience社製市販キット(代謝アッセイ)を用いて測定する。肝臓ホモゲネート10μLおよび標準溶液10μLを試薬1 180μLおよび試薬2 90μLに加える。37℃で7分間インキュベートした後、550nmで吸光度を測定する。その後、さらに37℃で10分間反応を続け、550nmで再び吸光度を測定する。 |
| 2.12. 統計手法 |
| 本実験の結果は平均値±標準偏差(SD)で表されます。データ解析はSPSS(Statistical Product and Service Solutions 22.0)を用いて実施しました。群間比較には一元配置分散分析(ANOVA)を用い、有意差比較にはDuncanの多重範囲検定を行いました。p値が0.05未満の場合、データに統計的に有意差があることを示します。 |
| 3. 結果と考察 |
| 3.1. 体重、摂餌量、摂水量、および臓器重量 |
| 毒性物質が実験動物に侵入すると、生理学的状態や代謝過程に影響を与え、体重の顕著な変化を引き起こす可能性があります。薬物やサンプルの腹腔内投与や経口投与が動物に毒性を引き起こすかどうかを観察するために、体重の変化は潜在的な中毒の予備的な指標として利用できます(12)。 |
| 表1は、高尿酸血症を誘発したマウスの体重変化を示す。陽性対照群を除き、群間で体重に有意差は認められなかった。陽性対照群では、薬物治療によって生理学的状態が改善し、摂食量と体重増加が改善したと考えられる。1日の摂食量と飲水量をモニタリングしたところ、マウス1匹あたりの平均摂取量はそれぞれ5.3gと9.1gであった。結論として、腹腔内オキソニック酸カリウム塩注射によって誘発された高尿酸血症マウスにおいて、ブラックチョークベリーの補給は毒性を示さず、体重、摂食量、飲水量にも有意な影響を与えなかった。 |
| 表1. オキソニック酸カリウム塩誘発性高尿酸血症マウスの体重、食事摂取量、水分摂取量の変化。 |
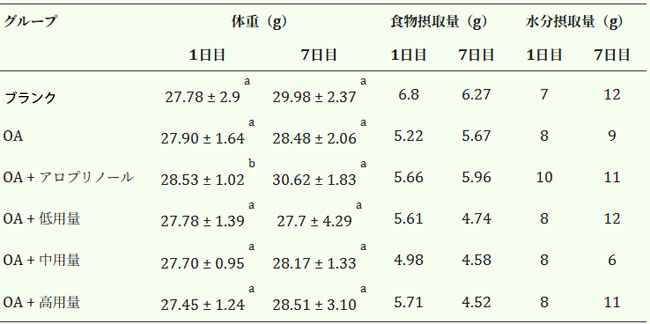 |
| 各値は平均値±標準偏差(n=6)で表されます。上付き文字が異なる行の値は有意差があります(p<0.05)。OA: オキソニック酸カリウム塩 |
| 3.2. 血清血中尿素窒素およびクレアチニン |
| 血中尿素窒素は肝臓で産生され腎臓から排泄される窒素分子であり、腎機能の評価に一般的に用いられている(13)。本実験では、異なる用量のブラックチョークベリーが高尿酸血症マウスの血中尿素窒素値を低下させるかどうかを評価した(表2)。オキソニック酸カリウム塩誘発群の血中尿素窒素値は13.51mmol/Lであったのに対し、対照群は4.54mmol/Lであった。低用量群、中用量群、高用量群では、血中尿素窒素値はそれぞれ10.21、9.56、4.86mmol/Lに低下し、オキソニック酸カリウム塩誘発群と比較してそれぞれ24.43、29.24、64.03%の低下を示した。特に、高用量群では有意な低下が見られ、アロプリノール投与群(6.81mmol/L)を下回った。さらに、高用量群はアロプリノールを投与されたオキソニック酸カリウム塩誘発マウスよりも優れた成績を示し、対照群との有意差は見られませんでした。これらの結果は、高尿酸血症マウスにおける高用量サンプル投与がBUNを低下させたことを示唆しています。 |
| 表2. 高尿酸血症マウスにおけるブラックチョークベリーの血中尿素窒素およびクレアチニン値への影響 |
 |
| 各値は平均値±標準偏差(n=6)で表されます。上付き文字が異なる行の値は有意差があります(p<0.05)。BUN:血中尿素窒素、CRE: クレアチニン、OA: オキソニック酸カリウム塩 |
| 表2は、高尿酸血症マウスにおけるブラックチョークベリーのクレアチニンレベルへの影響を示す。陰性対照群のクレアチニンレベルは38.87μmol/Lで、対照群(9.01μmol/L)の約3倍であった。低用量群、中用量群、高用量群(ブラックチョークベリー)のクレアチニンレベルはそれぞれ23.66、15.21、9.58μmol/Lであり、用量依存的に39.13、60.87、75.35%の減少を示した。高用量群のクレアチニンレベルは対照群と同程度であり、陽性対照群との有意差は認められなかった。これは、高用量クロチョークベリー投与が薬物投与と同等のクレアチニン減少をもたらし、未誘発マウスのクレアチニンレベルに近づけたことを示唆している。 |
| オキソニック酸カリウム塩によって引き起こされる高尿酸血症は、一酸化窒素関連の内皮機能障害を引き起こし、尿酸やその他の有機イオンの輸送能を低下させ、腎機能障害や腎障害を悪化させる可能性があります(14)。チェリーは免疫調節作用を持つことが知られており、様々なメカニズムを通じて免疫系を強化する可能性があります(14, 15)。これらの知見は、高用量のワイルドチェリーが高尿酸血症マウスのクレアチニン値を効果的に低下させることを示唆しており、ブラックチョークベリーが天然の腎臓保護剤として利用できる可能性を示唆しています。 |
| 3.3. 血清尿酸値とキサンチンオキシダーゼ活性 |
| ウリカーゼは、哺乳類において尿酸をアラントインに変換する酵素です。動物実験では、一般的に用いられるウリカーゼ阻害薬であるオキソン酸が、血清尿酸値を上昇させることで高尿酸血症を誘発します。オキソン酸は費用対効果が高く、作用が速く、高尿酸血症の新規治療薬の尿酸値低下効果を評価するための予備研究で広く使用されています(16, 17)。臨床的には、高尿酸血症は、尿酸排泄を促進する薬剤(プロベネシド、ベンズブロマロン、スルフィンピラゾンなど)または尿酸産生を阻害する薬剤(アロプリノール、フェブキソスタットなど)で治療されます。しかし、これらの薬剤には、腎毒性、肝障害、心血管疾患リスクの上昇などの副作用が伴います(18, 19)。このため、副作用が少なく尿酸値を下げる効果が期待できる高尿酸血症の代替治療法として、植物化学物質を豊富に含む天然物への関心が高まっています。 |
| 図1Aは、高尿酸血症マウスにおけるブラックチョークベリーの血清尿酸値への影響を示しています。オキソニック酸カリウム塩誘発マウスの血清尿酸値は、オキソニック酸カリウム塩投与1週間後、対照群(3.35mg/dL)と比較して5.40mg/dLに上昇しました。一方、アロプリノールを投与したオキソニック酸カリウム塩誘発マウスでは、対照群を下回る2.66mg/dLまで低下しました。低用量群、中用量群、高用量群では、血清尿酸値は用量依存的に低下し、それぞれ4.98、3.61、2.87mg/dLに達しました。高用量群は最も顕著な効果を示し、アロプリノール投与群と同等の結果を示しました。 |
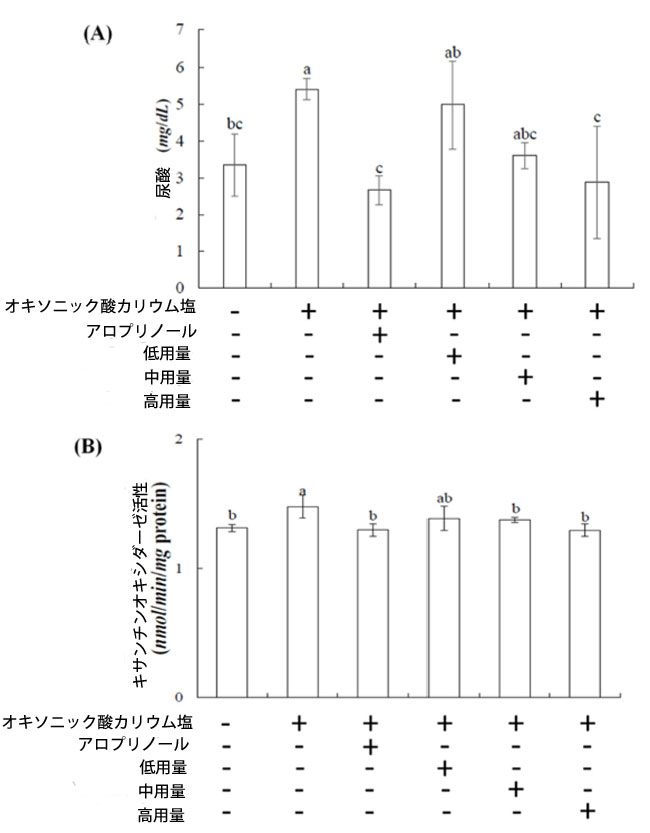 |
| 図1. 高尿酸血症マウスにおけるブラックチョークベリーの(A)血清尿酸値および(B)肝キサンチンオキシダーゼ活性への影響。各値は平均値±標準偏差(n=6)で表されている。上付き文字が異なる行の値は有意差がある(p<0.05)。 |
| 高尿酸血症の治療にアロプリノールを使用している患者は、透析が必要となるリスクが高くなります(10)。この研究では、マウスを用いた高尿酸血症治療において、ブラックチョークベリーの効果が合成薬アロプリノールと同等であることが示されました。この結果は、ブラックチョークベリーが顕著な尿酸値低下作用を有することを示唆しており、これはおそらくフェノール酸成分によるものと考えられます(19, 20)。そのため、ブラックチョークベリーは尿酸関連疾患を対象とした健康食品開発の有望な候補となっています。 |
| キサンチンオキシダーゼは、肝臓におけるプリン代謝の主要酵素です(21, 22)。この酵素はヒポキサンチンをキサンチンに酸化し、さらにキサンチンを尿酸に酸化することで、スーパーオキシドアニオン(O₂−)と過酸化物を生成し、細胞の酸化ストレスを増加させます。体内の尿酸が過剰になると、関節や周囲の組織で尿酸が結晶化することで高尿酸血症や痛風を引き起こす可能性があります(23)。プリンを多く含む食品の摂取量が増えると、キサンチンオキシダーゼの活性が過剰になり、高尿酸血症の有病率が上昇する可能性があります。アロプリノールとフェブキソスタットはキサンチンオキシダーゼ阻害剤ですが、重大な副作用を引き起こす可能性があります(24)。 |
| キサンチンオキシダーゼ阻害剤としての天然化合物の開発は不可欠です。図1Bは、ブラックチョークベリーが高尿酸血症マウスの肝臓におけるキサンチンオキシダーゼ活性に及ぼす影響を示しています。低用量群、中用量群、高用量群のキサンチンオキシダーゼ活性は、対照群と比較して有意差は認められませんでした。しかし、高用量群とアロプリノール投与群は、オキソニック酸カリウム塩誘発群と比較して有意な低下を示しました。これらの結果は、高用量サンプルがアロプリノールと同等の効力でキサンチンオキシダーゼ活性を効果的に低下させ、尿酸値を低下させることを示唆しています。 |
| 3.4. 高尿酸血症マウスにおけるグルタチオンおよびマロンジアルデヒドレベル |
| グルタチオン(GSH)はほとんどの哺乳類に存在し、グルタミン酸とシステインから合成され、主要な抗酸化物質として重要な役割を果たしています。鉄硫黄タンパク質の生成を助け、活性酸素種(ROS)を中和することで、酸化還元状態を制御します(25)。高濃度のグルタチオンは肝臓を酸化ストレスから保護します(26)。Zhangら(27)の研究によると、四塩化炭素(CCl₄)誘発性肝障害は、フリーラジカル消去反応中にグルタチオンが酸化型グルタチオンに変換されるため、グルタチオンを枯渇させることが示されています。特に、野生チェリーに含まれるアントシアニンは、肝臓のグルタチオンレベルを維持するのに役立つ可能性があります。 |
| 表3は、高尿酸血症マウスの肝臓におけるグルタミン酸(GSH)含量に対するブラックチョークベリーの効果を示した。対照群、オキソニック酸カリウム塩誘導群、アロプリノール投与群、低用量群、中用量群、高用量群のグルタチオン含量はそれぞれ2.82、1.90、3.18、3.29、3.47、3.88μmol/mgタンパク質であった。ブラックチョークベリー投与はグルタチオン含量の上昇傾向を示した。これらの結果は、ブラックチョークベリーの高用量投与がグルタチオン含量を増加させ、酸化ストレスによる肝障害を予防または軽減し、ひいては肝酸化ストレス障害を軽減する可能性を示唆している。 |
| 表3. オキソニック酸カリウム塩誘発高尿酸血症マウスの肝臓中のグルタミン酸およびマロンジアルデヒド含量。 |
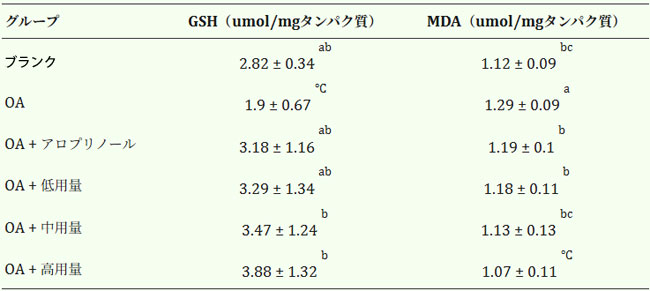 |
| 各値は平均値±標準偏差(n=6)で表されます。上付き文字が異なる行の値は有意差があります(p<0.05)。OA: オキソニック酸カリウム塩、GSH:グルタミン酸、MDA:マロンジアルデヒド |
| マロンジアルデヒドは脂質過酸化の指標として広く使用されており、特に活性酸素種(ROS)による細胞内の酸化ストレスを反映する(28)。マロンジアルデヒドは脂質膜構造を破壊し、深刻な細胞損傷を引き起こす可能性がある(29)。ある研究では、クロアチアゾリナに含まれるフラボノイドが肝臓でのCCl₄誘発性脂質過酸化を軽減できることが示されている(30)。表3は、オキソニック酸カリウム塩誘発性高尿酸血症マウスの肝臓におけるマロンジアルデヒドレベルに対するクロアチアゾリナの保護を示している。対照群、オキソニック酸カリウム塩誘発群、アロプリノール群、低用量群、中用量群、高用量群のマロンジアルデヒド濃度は、それぞれ1.09、1.31、1.13、1.14、1.09、および1.01μmol/mgタンパク質であった。 (31)は、アロプリノール投与がフルクトース誘発性非アルコール性脂肪肝モデルにおいて肝臓脂質代謝を調節し、マロンジアルデヒドレベルを低下させることを示した。これらの知見は、高用量のブラックチョークベリーが肝臓マロンジアルデヒドレベルを有意に低下させ、酸化ストレス関連の損傷を軽減できることを示唆している。 |
| 3.5. オキソニック酸カリウム塩誘発性高尿酸血症マウスにおけるアデノシンデアミナーゼ活性 |
| アデノシンデアミナーゼ(ADA)は、プリン代謝に関与する加水分解酵素であり、アデノシンと2'-デオキシアデノシンをそれぞれイノシンと2'-デオキシイノシンに変換する(32)。アデノシンデアミナーゼは、植物、細菌、動物など、様々な生物に存在している(33)。アデノシンデアミナーゼ阻害は、損傷組織中のアデノシン濃度を上昇させることで炎症を調節し、炎症反応を軽減することができる。図2は、高尿酸血症マウスの肝臓におけるワイルドチェリーのアデノシンデアミナーゼ活性への影響を示した。対照群、オキソニック酸カリウム塩誘発群、アロプリノール群、低用量群、中用量群、高用量群のアデノシンデアミナーゼ活性は、それぞれ6.99、11.33、3.58、7.50、5.47、3.89μmol/mgタンパク質であった。注目すべきことに、高用量群は対照群と比較してアデノシンデアミナーゼ活性が低いことが示されました。アデノシンデアミナーゼ活性は尿酸値の上昇とともに増加するため、ブラックチョークベリーを高用量で摂取することで尿酸値を低下させ、アデノシンデアミナーゼ活性を阻害し、結果として炎症を軽減することができます。 |
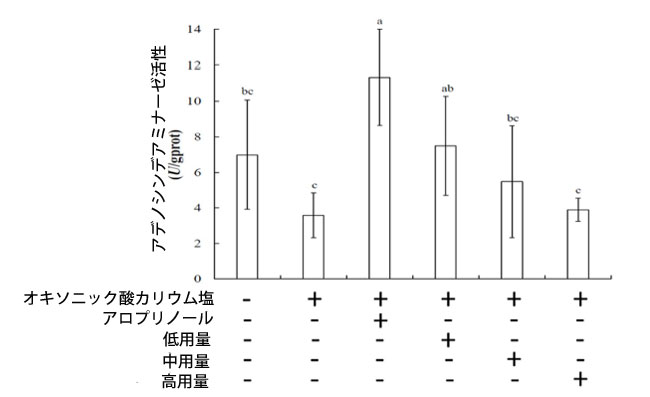 |
| 図2. 高尿酸血症マウスにおけるブラックチョークベリーの肝臓アデノシンデアミナーゼ活性への影響。各値は平均値±標準偏差(n=6)で表されている。上付き文字が異なる行の値は有意差がある(p<0.05)。 |
| 痛風は、血中の尿酸値が過剰になることによって引き起こされる炎症性疾患で、不溶性尿酸ナトリウム(MSU)結晶の形成につながります。これらの結晶は好中球の活性化と関節組織への浸潤を促し、患部に激しい痛みを引き起こします。不溶性尿酸ナトリウム結晶は、ヌクレオチド結合オリゴマー化ドメイン様受容体ピリンドメイン含有3(NLRP3)インフラマソームを介して酸化ストレスを媒介し、その後インターロイキン-1βの産生を誘発して炎症反応を悪化させます(34–36)。 |
| キサンチンオキシダーゼはプリン代謝経路の重要な酵素であり、臨床研究および実験研究からその活性が炎症誘発性作用を有する可能性が示唆されている(37)。現在、アロプリノールなどの非ステロイド性抗炎症薬(NSAID)を含む様々な抗痛風薬が利用可能であり、これらは急性痛風の第一選択治療薬として一般的に使用されている。しかし、それらの使用は、消化管毒性、腎毒性、消化管出血などの副作用によって制限されている。したがって、より効果的な抗痛風性関節炎薬の開発は依然として非常に重要である(38, 39)。近年、我々はブラックチョークベリーに含まれる生理活性化合物と抗酸化物質を特定した(40)。これらの知見は、ブラックチョークベリーが痛風の予防と管理に有効であることを示唆している。 |
| 4. 結論 |
| 高尿酸血症は、過剰な尿酸産生または排泄減少により血清尿酸値が異常に上昇する病態です。主な発症機序には、キサンチンオキシダーゼの過剰活性化とホスホリボシルピロリン酸合成酵素(PRPP合成酵素)の過剰活性が挙げられます。キサンチンオキシダーゼはキサンチンから尿酸への変換を促進し、過剰な尿酸産生につながりますが、ホスホリボシルピロリン酸合成酵素はプリンの合成を促進し、結果として尿酸産生を増加させます。尿酸はプリン代謝の最終産物であり、内因性(細胞代謝)および外因性(食事性)プリン分解の両方から生成されます。プリンを多く含む食事(赤身肉、内臓肉、魚介類など)、過剰な果糖摂取、アルコール摂取、肥満は、高尿酸血症の発症と密接に関連しています。本研究の結果は、ブラックチョークベリーがキサンチンオキシダーゼ活性と尿酸産生を低下させる可能性があることを実証しました。将来的には、痛風予防のための機能性成分として期待されます。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Front Nutr. 2025 May 14;12:1556527.に掲載されたUnveiling the therapeutic benefits of black chokeberry (Aronia melanocarpa) in alleviating hyperuricemia in mice.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


