ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
プロバイオティクスと筋肉の健康: 腸-筋軸を介したラクトバチルスのサルコペニアへの影響 |
Jingjun Zhu et al., |
|
|
| 要約 |
サルコペニアとは、骨格筋量と機能の低下を指します。死亡率の上昇と重度の障害により、サルコペニアの臨床的重要性はますます高まっています。サルコペニアの正確な原因は完全には解明されていませんが、腸内細菌叢(GM)はサルコペニアの病態形成に重要な役割を果たしており、腸内細菌叢の乱れが疾患の発症に関連している可能性を示唆するエビデンスが増えています。過去数十年でプロバイオティクスの使用が急増しましたが、サルコペニアの予防と治療への影響を検討した研究はほとんどありません。ラクトバチルスプロバイオティクスは腸内環境の維持と免疫サポートに広く使用されていますが、腸-筋軸を介したサルコペニアへの効果については未だ不明です。本レビューでは、治療の課題、サルコペニアにおける腸内細菌叢の役割、そして補助療法としてのラクトバチルスの可能性について考察します。さらに、炎症状態の緩和、過剰な活性酸素種(ROS)の除去、骨格筋代謝の改善、腸管バリア機能の強化、腸内細菌叢とその代謝物の調節など、ラクトバチルスが筋肉機能に影響を及ぼす可能性のあるメカニズムについても考察します。これらのメカニズムは相乗的に筋肉量と機能の維持に寄与する可能性があり、サルコペニアに対する微生物療法の発展に向けた有望な道筋となる可能性があります。 |
| 目次(クリックして記事にアクセスできます) |
| 1 .はじめに |
| 2.サルコペニアに対する薬物治療のジレンマ |
| 3.腸-筋軸において重要な役割をするプロバイオティクスラクトバチルス |
| 3.1 腸内細菌叢におけるラクトバチルス属の豊富さと多様性 |
| 3.2 免疫と炎症の制御 |
| 3.3 酸化ストレスの緩和 |
| 3.4 骨格筋代謝の調節 |
| 3.4.1 グルコース |
| 3.4.2 タンパク質 |
| 3.4.3 脂質 |
| 3.5 腸内細菌叢の代謝物への影響 |
| 3.5.1 短鎖脂肪酸(SCFA) |
| 3.5.2 リポ多糖(LPS) |
| 3.5.3 胆汁酸(BA) |
| 3.5.4 ビタミン |
| 4.サルコペニアにおけるラクトバチルス関連の臨床予防と治療 |
本文 |
| 1.はじめに |
| 欧州高齢者サルコペニアワーキンググループ(EWGSOP)の定義によると、サルコペニアとは、筋量と筋力またはパフォーマンスにおける機能の低下を指します(Cruz-Jentoft et al., 2019)。身体の老化に伴い、筋量と筋力は自然に減少します。サルコペニア患者では、このプロセスが著しく加速し、筋機能が急速に低下し、最終的には筋萎縮が進行します。これらの変化は、運動能力の低下、転倒、骨折、障害のリスク増加、さらには死亡率の上昇につながります(Gomes et al., 2017; Walston, 2012)。人口の高齢化の進行とライフスタイルの変化に伴い、サルコペニアの有病率は年々増加傾向にあります。注目すべきことに、60歳以上の人におけるサルコペニアの有病率は約10~50%に達し、世界的な健康問題となっています(Witham and Aihie Sayer, 2016)。したがって、サルコペニアの予防と介入は、その進行を緩和し、重篤な疾患や合併症のリスクを軽減するために不可欠です。 |
| サルコペニアの適切な診断と介入は容易ではありません。薬剤の効果は限られていることが多く、副作用を引き起こすこともあります。さらに、高額な治療費と個人差が相まって、リハビリテーションや栄養介入の結果にばらつきが生じています(Cho et al., 2022)。幸いなことに、革新的な腸-筋軸理論は科学界における研究の焦点となっており、腸の健康と筋肉の相互作用に関する理解に革命をもたらす可能性があります。「腸-筋軸仮説」によれば、筋肉の機能と代謝は、腸内細菌叢の量と構造に大きく依存しています。この仮説は、腸内細菌叢が、サルコペニアや筋萎縮などの筋肉関連疾患の予防と治療における潜在的な生物学的標的となる可能性を示唆しています(Ticinesi et al., 2017)。腸内細菌叢と骨格筋の相互作用は、複数のエビデンスから示唆されています(Kang et al., 2021; Lahiri et al., 2019; Manickam et al., 2018; Qiu et al., 2021)。したがって、食事の変更、サプリメント、活性化合物など、腸内細菌叢の不均衡を標的とした介入は、サルコペニアを軽減する可能性があります。腸内細菌叢が筋機能をどのように制御しているかを理解することは、患者の可動性と筋力を向上させるために特に重要です。 |
| フィルミクテス門に属する重要な細菌であるラクトバチルスは、腸内細菌叢における顕著な存在から大きな注目を集めています。そのサブグループはサルコペニアの進行に影響を与えることが示唆されており、マウス、細胞、ヒトを対象とした研究において保護効果を示しています(Kim et al., 2023; Lee et al., 2023; Ni et al., 2019; Rondanelli et al., 2022)。ラクトバチルスには有望な可能性があるにもかかわらず、我々の知る限り、サルコペニアにおけるその具体的な作用機序に関する明確かつ包括的なレビューは未だ存在しない。そこで我々は、サルコペニアにおけるラクトバチルスの役割を詳細に考察し、サルコペニアの効果的な治療法開発に向けた潜在的なメカニズムに関する新たな知見を提供することを目指します。 |
| 2. サルコペニアに対する薬物治療のジレンマ |
| 現在、運動や栄養介入といった非薬物療法がサルコペニアの第一選択治療となっています。臨床医、薬剤師、研究者などがサルコペニア治療薬の研究開発に尽力してきました。しかしながら、サルコペニアの病態は複雑であるため、サルコペニア治療薬として承認された薬剤は未だ存在しません。他の疾患の治療に臨床現場で使用されている薬剤の中には、筋肉に有益な効果をもたらす可能性があり、サルコペニアへの適用が拡大しています。これらの薬剤は治療において良好な臨床効果を示していますが、サルコペニア治療後に生じる可能性のあるいくつかの副作用を無視することはできません。例えば、テストステロンはRas/MEK/ERK経路を介して筋細胞の増殖を促進し、筋肉量と筋力を増加させます(De Spiegeleer et al., 2018)。しかし、治療リスクとして、血栓症、睡眠時無呼吸、がんなどが挙げられます(Morley, 2016)。選択的アンドロゲン受容体分子(SARM)は、重度の肝臓および腎臓障害を引き起こす可能性があり、精巣萎縮や男性不妊症にもつながる可能性があります(Efimenko et al., 2022)。さらに、ミオスタチン阻害薬(MI)の長期投与は、心血管疾患のリスクを高める可能性があります(Campbell et al., 2017)。成長ホルモン(GH)補充療法は筋肉量を増加させますが、筋力や機能の向上にはつながりません(Papadakis et al., 1996)。また、他のサルコペニア治療薬と比較して比較的高価です(Liu et al., 2007)。全体として、サルコペニア治療薬に対する安全かつ効果的な治療計画は存在しません。臨床現場において、治療の安全性と有効性をどのように革新し最適化し、サルコペニア患者にとって手頃な価格にするかは、依然として重要な課題です。 |
| 3.腸-筋軸において重要な役割をするプロバイオティクスラクトバチルス |
| 腸-筋軸は重要な生物学的メカニズムであり、腸内細菌叢が除脂肪体重、骨格筋量、そして身体機能の維持に極めて重要な役割を果たしていることを浮き彫りにしています。近年、腸-筋軸に関する非常に貴重な結果が明らかにされています(Liu Y. et al., 2023)。まず、腸内細菌叢を欠く無菌マウスは、腸内細菌叢を有する病原体フリーマウスと比較して、筋肉量、筋肉質、そして神経筋機能のより顕著な低下を示しました(Lahiri et al., 2019)。第二に、抗生物質を投与されたマウスでは筋萎縮が増加し、これは腸内細菌叢の不均衡と関連しており、回腸線維芽細胞増殖因子15(FGF15)のレベル低下が観察されましたが、FGF19の投与は筋萎縮を効果的に回復させました(Manickam et al., 2018; Qiu et al., 2021)。第三に、サルコペニア患者では、健常対照群と比較してラクトバチルス属が増加し、ユーバクテリウム属、ラクノスピラ属、フシカテニバクター属、ロゼブリア属が減少しました(Kang et al., 2021)。特に注目すべきは、プロバイオティクスは国連食糧農業機関(FAO)と世界保健機関(WHO)によって「生きた微生物」と定義されており、病原性微生物の増殖を抑制し、生理活性化合物を生成し、バランスの取れた局所微環境を維持することで、人体に有益な効果を発揮するということです(Hill et al., 2014)。ラクトバチルスは、長年商業的に利用されてきたプロバイオティクスの中で最も研究され、広く利用されています。ラクトバチルスは消化管の酸性環境でも生存することができます(Corcoran et al., 2005)。重要なのは、ラクトバチルスの亜種の大部分が腸の健康に有益であり、特に宿主の筋肉量と機能の回復を助ける可能性があることです。 |
| 例えば、ラクトバチルス・ラムノサス JY02由来の調整培地(CM)は、C2C12細胞において、デキサメタゾン(DEX)によるミオチューブ萎縮を軽減し、筋分解マーカーであるMuRF1およびアトロジン-1の発現を低下させることが観察されています。一方、ラクトバチルス・ラムノサスJY02サプリメントは、MHC Iβ、MHC IIα、Myo-Dなどの筋増強マーカーの発現を増強し、筋分解マーカーのレベルを低下させ、マウスモデルにおける筋萎縮症状を軽減することが報告されています(Lee et al., 2023)。さらに、ラクトバチルス・カゼイ LC122は、高齢マウスの大腿四頭筋(QM)と腓腹筋(GM)の筋量を増加させ、筋力と機能を向上させました(Ni et al., 2019)。これらの結果は大きな関心を呼び起こし、サルコペニアの補助治療として乳酸菌プロバイオティクスを選択する際に優先的に考慮すべき点があることを示唆し、その根底にあるメカニズムの探求へと私たちを駆り立てました。炎症状態の緩和、過剰な活性酸素種の除去、骨格筋代謝の改善、腸内細菌叢とその代謝物の調節は、乳酸菌がサルコペニアを軽減する潜在的なメカニズムとして特定されています(Chen L. et al., 2022; He et al., 2023; Hor et al., 2021; Yan et al., 2019)(図1)。これらの知見は、サルコペニア治療に新たなアイデアをもたらすだけでなく、腸-筋軸における乳酸菌の役割についての理解をさらに深めるものとなるでしょう。 |
 |
図1 ラクトバチルスがサルコペニアを緩和するメカニズム。 ラクトバチルスは様々な方法でサルコペニアを緩和することができます。 (1) 分子レベルでは、ラクトバチルスは免疫細胞の表現型と量を変化させます。腸管バリアを強化することでMAPKとNF-κBシグナル伝達経路に影響を与え、炎症因子のレベルを低下させます。また、抗酸化酵素のレベルを調節することで活性酸素種(ROS)とマロンジアルデヒド(MDA)を減少させ、一酸化窒素(NO)の生成を抑制し、酸化ストレスを軽減し、サルコペニアを改善します。 (2) 組織レベルでは、乳酸菌は骨格筋のグリコーゲン合成を促進し、グリコーゲンの分解を抑制し、タンパク質合成を促進し、タンパク質分解と脂肪蓄積を抑制し、腸内の善玉菌を増やし、悪玉菌を減らし、脂肪と筋肉群におけるブドウ糖の利用を促進します。さらに、ラクトバチルスは短鎖脂肪酸(SCFA)産生菌の数を増やし、胆汁酸の合成とコレステロール逆輸送を促進し、ビタミンの産生と吸収を促進することで、サルコペニアに対する治療効果を発揮します。 M1:M1マクロファージ、M2:2マクロファージ、Treg:制御性T細胞(訳者注:免疫系の過剰な反応を抑制し、自己免疫疾患やアレルギー、炎症などを防ぐ役割を持つT細胞の一種です。免疫システムの「ブレーキ」のような役割を果たし、免疫恒常性の維持に貢献します。)、Th17:Tヘルパー細胞17(訳者注:CD4陽性のヘルパーT細胞の一種で、IL-17を産生する細胞です。自己免疫疾患や感染防御において重要な役割を果たしますが、その機能が過剰になると自己免疫疾患を悪化させる可能性もあります)。 |
| 3.1. 腸内細菌叢におけるラクトバチルス属の豊富さと多様性 |
| ラクトバチルスは、ブドウ糖などの糖を発酵させて乳酸を生成する能力を持つグラム陽性嫌気性細菌です。フィルミクテス門に分類され、バチルス綱、ラクトバチルス目、ラクトバチルス科に属します。ラクトバチルス・ファーメンタム、ラクトバチルス・プランタラム、ラクトバチルス・サリバリウス、ラクトバチルス・アシドフィルス、ラクトバチルス・ラムノサスなど、いくつかの亜種が含まれます(Heeney et al., 2018)。この属は、ヒトの大腸および十二指腸内の全細菌集団のそれぞれ約0.3%および6%を占めると推定されています(Almonacid et al., 2019; Nistal et al., 2016)。200種を超える既知のラクトバチルス種のうち、ヒトの消化管と継続的かつ頻繁に相互作用しているのはごくわずかです。しかし、近年発見された種の数は大幅に増加しており、現在では50種以上のラクトバチルス種が健康なボランティアの糞便中で繰り返し確認されています(Rossi et al., 2016)。その中でも、最も豊富なラクトバチルス種には、主にラクトバチルス・カゼイ、ラクトバチルス・デルブリュッキー、ラクトバチルス・ラムノサス、ラクトバチルス・プランタルム、ラクトバチルス・マッシュルームオルムが含まれます。 |
| 腸内ラクトバチルスのレベルと骨格筋量指数の間には正の相関関係があることが実証されています。高齢者では、サルコペニア患者において特定の腸内細菌叢の割合が変化し、ラクトバチルス、バクテロイデス、プレボテラの割合が大幅に減少し、大腸菌の割合が増加することが示されています(Lou et al., 2024)。加速老化マウスの腸内においては、オドリバクター、オシリバクター、アナエロトランカスなどの細菌属が増加しており、筋肉およびミトコンドリア機能と負の相関関係にあることが確認されました。同時に、これらの細菌は炎症性サイトカインと正の相関関係にあり、抗炎症性サイトカインと負の相関関係にあることも示されました(Chen L. et al., 2022)。ラクトバチルスは腸内細菌叢の構成とβ細胞の多様性を回復させる可能性があり、これはサルコペニアの治療における役割の一つとなる可能性があります(Picca et al., 2019)。例えば、ラクトバチルス・パラカゼイは、筋肉量とミオシン重鎖(MyHC)の発現に関連するアッカーマンシア科とデイノコッカス科の菌群を増加させます。一方、インターロイキン-6(IL-6)とMuscle RING-Finger 1(MuRF1)の発現レベル上昇に関連するオドリバクター科とデイノコッカス科の特定の菌群の菌群を減少させます(Baek et al., 2023)。ラクトバチルスは腸内細菌叢の有益な細菌を増やすだけでなく、適切なコロニー形成を通じて腸上皮の健全性を高め、バクテロイデス属、大腸菌、赤痢菌などの有害細菌による感染や腸管腔への移行を抑制します(Karczewski et al., 2010)。また、栄養補給(短鎖脂肪酸、ビタミン、アミノ酸、アミンなど)や腸腔のpH値を下げる作用も有しており、有害細菌のコロニー形成を防ぎ、腸内細菌叢のバランスを維持します(Hong et al., 2018)。したがって、腸内環境のバランス維持におけるラクトバチルスの役割は軽視すべきではありません。 |
| 3.2 免疫と炎症の制御 |
| サルコペニア患者の腸内細菌叢バランスが乱れると、腸内免疫微小環境も乱れていました。腸内細菌叢に対する主要な防御機構として、腸粘膜には多様な免疫細胞が存在し、それらが連携して末梢血と腸粘膜環境の両方における免疫恒常性を維持しています。腸内細菌叢の不均衡は、免疫系の異常な活性化と慢性炎症状態につながる可能性があります(Zheng et al., 2020)。加齢に伴う筋委縮のプロセスは免疫系の異常によって悪化する可能性があり、免疫系によって引き起こされる慢性の低レベルの炎症は、サルコペニアの重要な要因の一つと考えられています(Saini et al., 2016)。ラクトバチルスは、免疫細胞の数、動員、分化を変化させることで、さまざまな角度から腸および全身の炎症反応の過剰な活性化を調節し、それによってサルコペニアの進行と悪化を制限する可能性があります。 |
| ラクトバチルスは、変性した免疫細胞の量と割合を回復させることで、筋萎縮の症状を緩和する可能性があります。まず、ラクトバチルス・ロイテリは、Treg/Th17比を上昇させることで、低下した全身免疫抑制機能を回復させ、抗炎症作用を高め、炎症誘発作用を抑制し、筋萎縮を抑制しました。転写因子Foxp3はTregの発達を制御し、Tregの活性はIL-35とIL-10によって調節されます。ラクトバチルス・ロイテリは、それぞれTリンパ球(CD3γ)、Th1リンパ球(Tbet)、Th17リンパ球(IL-17A)のレベルを回復させるだけでなく、Foxp3とIL-10のレベルを維持することで、組織内のTregの頻度を高めました(Bindels et al., 2016)。 ラクトバチルス・ロイテリに加えて、ラクトバチルス・ラムノサスも、TJ と GLP-2 のレベルをアップレギュレーションすることで腸のバリア機能を修復および維持し、最終的に腸間膜リンパ節の Th17/Treg と関連サイトカインのレベルを調節できるため、免疫細胞の相対的な豊富さに影響を与えるのに効果的でした (Guo et al.、2023)。 |
| さまざまな免疫細胞の量と割合を変えることに加えて、ラクトバチルスによって炎症を制御するために免疫細胞の表現型も変化を誘発されました。マクロファージ免疫代謝の変化は、筋肉萎縮の症状に関連しています。骨格筋の機能的代謝障害の状況では、マクロファージの表現型はM2(抗炎症)からM1(炎症誘発性)に変化します(Liu N. et al., 2023)。M1とM2は、完全に反対の機能を持つマクロファージの2つの表現型を表します。前者は、IL-1β、IL-6、IL-12、およびTNF-αを含む炎症誘発性サイトカインの高発現によって特徴付けられるのに対し、後者は主にIL-10およびTGF-βなどの抗炎症性サイトカインを産生します(Shapouri-Moghaddam et al., 2018)。 ラクトバチルス・ラムノサスGroELは、M1様マクロファージ関連マーカーの阻害とM2様マクロファージ関連マーカーの発現亢進により、マクロファージの表現型を調節し、筋肉内の炎症性圧を軽減します(Dias et al., 2021)。マクロファージマーカーの変化に加え、ラクトバチルス・ラムノサスGGは、単球動員およびM1マクロファージの活性化に関連するMCP-1およびCD11cのmRNA発現を有意に低下させ、M1細胞の浸潤および活性化を抑制することができます(Park et al., 2015)。 |
| 弁証法的観点から見ると、免疫細胞の分布と炎症性サイトカインの産生との間には相関関係が存在します。多数の免疫細胞が炎症性サイトカインを放出すると、これらのサイトカインが逆にそれらの細胞の動員と機能を阻害する可能性があります。多くの実験において、乳酸菌が炎症性サイトカインのレベルを変化させることが実証されています。ラクトバチルス・カゼイ シロタ(LcS)は、IL-10と短鎖脂肪酸(SCFA)のレベルを上昇させ、マクロファージによるTNF-αの産生を抑制し、TNF-αのレベルを低下させました(Chen L. et al., 2022)。さらに、他のラクトバチルス株も同様の効果を示します。ラクトバチルス・ロイテリ、ラクトバチルス・アシドフィルス、ラクトバチルス・ファーメンタム、ラクトバチルス・ブレビス、ラクトバチルス・ラムノサスは、IL-10のレベルを上昇させ、TNF-αの発現を低下させました(Archer et al., 2021; Peña and Versalovic, 2003)。一方、ラクトバチルスは抗炎症メディエーターの発現を亢進させた。免疫調節に関与する多機能因子であるG-CSFは、骨格筋の修復と再生に効果があることが証明されているTNF-α、IL-12、IL-23といった炎症促進メディエーターと負の相関を示した(Wright et al., 2017)。ラクトバチルス・ロイテリとラクトバチルス・ガセリはG-CSFの発現を亢進させ、アトロジン-1、MuRF1、LC3、カテプシンLといった萎縮マーカーを減少させた。IL-10の増加は、IFN-γやIL-2/IL-1βといった炎症誘発因子の産生を減少させ、炎症反応を緩和し、サルコペニアの進行を抑制した(Bindels et al., 2012)。 |
| 3.3 酸化ストレスの緩和 |
| 酸化ストレスは細胞損傷および老化と密接に関連している(Marzetti et al., 2013)。活性酸素種(ROS)は、主にスーパーオキシドアニオン、過酸化水素、ヒドロキシラジカルから構成され、好中球の抗菌ライブラリの重要な構成要素である。過剰な活性酸素種は、筋組織に酸化ストレスをもたらし、サルコペニアに関与する細胞内シグナル伝達経路を活性化する可能性がある(Bonetto et al., 2009)。酸化ストレスは脂質およびタンパク質の酸化を誘導し、筋細胞膜の構成および構造的完全性を破壊し、骨格筋機能の低下につながる可能性がある(König et al., 2001)。したがって、酸化ストレスの管理はサルコペニアの治療における効果的なアプローチとなり得る。 |
| 様々な研究により、ラクトバチルス菌株の高い抗酸化能が実証されています。ラクトバチルスの抗酸化作用は、活性酸素を除去し、抗酸化レベルを高める能力と密接に関連しています(Lin and Chang, 2000)。まず、ラクトバチルス・パラカゼイは、抗酸化関連遺伝子であるスーパーオキシドディスムターゼ(SOD)とカタラーゼ(CAT)の発現を促進し、酸化プロセスを阻害し、炎症を予防します(Lin et al., 2021)。ラクトバチルス・ファーメンタムは、抗酸化遺伝子の発現を増強するだけでなく、グルタチオンペルオキシダーゼ(GPx)の活性を介して組織内の過酸化物を除去し、筋肉を損傷する酸化ストレスを軽減し、筋肉を保護します(Hor et al., 2021)。第二に、ラクトバチルス・プランタルムは核因子赤血球2関連因子2(Nrf2)シグナル伝達経路を調節する能力を有し、それによって体内の抗酸化能を高め、酸化ストレスのバイオマーカーであるマロンジアルデヒド(MDA)のレベルを低下させます(Chen Q. et al., 2022)。第三に、ミトコンドリアは活性酸素種産生の重要な部位として機能します。機能不全のミトコンドリアは炎症と活性酸素種を増加させ、サルコペニアと強く関連しています(Picca et al., 2018)。これはラクトバチルス療法の新たな標的となる可能性もあります。ラクトバチルス・プランタルムはミトコンドリアの生合成を制御し、PGC1 α、SIRT1、NRF1、TFAM がミトコンドリア機能不全を防ぎ、炎症と活性酸素種産生を低減することで、最終的に老化マウスモデルのサルコペニアを軽減します(Chen et al., 2019)。さらに、ラクトバチルス株は、AMPK活性(訳者注:AMPK(AMP活性化プロテインキナーゼ)は、細胞内のエネルギー状態を感知し、代謝を調節する重要な酵素です)およびミトコンドリア調節関連遺伝子を調節することにより、筋肉の老化と闘う上で重要な役割を果たします。細胞エネルギーバランスの重要な調節因子として、AMPKはミトコンドリアのダイナミクスを調節するだけでなく、エネルギー消費を減らして資源を節約することで酸化ストレスに対抗し、筋肉機能の回復を促進します。この経路を通じて、ラクトバチルスは、腫瘍抑制タンパク質をコードするp53遺伝子の発現に影響を与えます。p53は、テロメアストレスによって引き起こされる老化の重要なマーカーであり、細胞周期停止、DNA修復、アポトーシス、細胞老化などの重要なプロセスを制御します(Qian and Chen, 2013)。具体的には、これらの株(LP-0291やLF-DR9など)は、AMPKの活性化に関連する局所の腓腹筋と脛骨筋におけるp53遺伝子の発現を低下させることができます。この一連のメカニズムは老化に抵抗する上で効果的なサポートを提供し、酸化ストレスを軽減するラクトバチルス株の大きな可能性を浮き彫りにしています (Hor et al.、2019)。 |
| さらに、過剰な一酸化窒素(NO)は細胞内の酸化還元バランスを崩し、炎症反応を引き起こし、筋組織の損傷や萎縮につながる可能性があります(Kaminski and Andrade, 2001)。一酸化窒素は、動物実験で検証されているように、筋組織の炎症、損傷、萎縮において重要な役割を果たしています(Hall et al., 2011)。ラクトバチルスは、一酸化窒素の産生を間接的または直接的に阻害することで酸化ストレスを軽減します。ラクトバチルス・プランタルムは、骨格筋に存在するシンシチン-1、一酸化窒素合成酵素(iNOS)、およびTNF-α遺伝子の発現レベルをダウンレギュレーションし、動物の筋組織における全体的なエネルギーバランスを回復させ、酸化反応を軽減します(Yi et al., 2021)。さらに、ラクトバチルス・ブレビスに含まれる酵素であるアルギニンデアミナーゼは、一酸化窒素の共通基質であるアルギニンを一酸化窒素合成酵素と競合させ、シトルリンとアンモニアに代謝することで一酸化窒素産生を阻害します(Zhang et al., 2014)。さらに、ラクトバチルスは正常な一酸化窒素およびGSHレベル(訳者注:GSHはグルタチオンの還元型のことで、グルタミン酸、システイン、グリシンの3つのアミノ酸から構成されるトリペプチドです。生体内では抗酸化物質として働き、活性酸素による酸化ストレスから細胞を守る役割を担っています)を回復させるだけでなく、筋原性星細胞の増殖を刺激し、抗老化関連ミオパシー効果も有します(Abdel-Halim et al., 2023)。 |
| 3.4 骨格筋代謝の調節 |
| 3.4.1 グルコース |
| 骨格筋はグルコース代謝に不可欠な器官であり、腸内細菌叢の構成は筋肉におけるグリコーゲン貯蔵に影響を与える。腸内細菌叢の調節異常は筋肉におけるグルコース利用を低下させ、グリコーゲン貯蔵不足につながり、ひいては筋肉の機能と質に影響を与え、筋萎縮を促進する(Daily and Park, 2022)。ラクトバチルスは直接的または間接的にグルコース代謝に影響を与え、それによって筋機能を改善する可能性がある。肝臓において、GSK-3βはセリン/スレオニンキナーゼであり、グリコーゲン合成酵素(GS)の活性を阻害する。また、ラクトバチルス・アシドフィルスはGSK-3βの発現を抑制し、グリコーゲン合成を促進する(Yan et al., 2019)。ラクトバチルス属をはじめとする腸内細菌叢の主な代謝産物である短鎖脂肪酸(SCFA)は、筋グリコーゲンの合成を促進することが証明されています(Fushimi and Sato, 2005)。グリコーゲンの摂取に関しては、ラクトバチルス・アシドフィルス菌とラクトバチルス・カゼイ菌を含むプロバイオティクスを豊富に含む発酵乳は、空腹時血糖値(FBG)とHbA1c値を低下させ、筋におけるグルコース吸収を促進することが示唆されています(Hu et al., 2017)。 |
| サルコペニアはインスリン抵抗性を伴うことが多く、両者は相互に病因となり、悪循環を引き起こします(Liu and Zhu, 2023)。ラクトバチルス株はインスリン抵抗性の低下に寄与し、結果としてサルコペニアの進行を抑制します。骨格筋のグルコーストランスポーター4(GLUT4)は、インスリン刺激によるグルコース取り込みを媒介します(Herman and Kahn, 2006)。食事誘発性肥満マウスにおいて、ラクトバチルスの投与はインスリン抵抗性の低下と耐糖能の改善をもたらしました。これは、骨格筋の小胞体ストレスの軽減、マクロファージの活性化の抑制、グルコーストランスポーター4の発現の促進によるものと考えられます(Tabuchi et al., 2003)。さらに、プロバイオティクスであるラクトバチルス・ラムノサス、ラクトバチルス・アシドフィルス、ビフィドバクテリウム・ビフィダムの混合物は、筋肉におけるインスリンシグナル伝達を制御し、肥満マウスのインスリン感受性と耐糖能を改善しました。この戦略は、筋肉組織におけるAktリン酸化レベルを完全に回復させ、TNF-αおよびIL-6転写産物の相対量を有意に減少させました(Bagarolli et al., 2017)。 |
| 3.4.2 タンパク質 |
| 骨格筋は、タンパク質の形で貯蔵されるアミノ酸の貯蔵部位として機能します(Baskin et al., 2015)。骨格筋タンパク質(MPS)の合成と筋タンパク質の分解(MPB)のバランスは、骨格筋の表現型、筋量、および機能にとって非常に重要です(Schiaffino et al., 2013)。タンパク質分解の増加とタンパク質合成の減少は、サルコペニアにおける筋萎縮の主なメカニズムです(Sartori et al., 2021)。腸内細菌叢の乱れは、腸管バリアの透過性、エンドトキシン転座、インスリン抵抗性の増加につながり、結果として筋タンパク質合成の障害につながります。 ラクトバチルス・プランタルムを摂取することで、腸内細菌叢の乱れを抑制し、マウスの筋萎縮マーカーであるアトロジン-1やLC3タンパク質の発現を抑制し、筋タンパク質合成を促進することが報告されています(Chen et al., 2016)。ラクトバチルス・プランタルム と ラクトバチルス・ラムノサスは、腸内細菌叢とその代謝産物の構造を調整するだけでなく、骨格筋におけるタンパク質合成遺伝子であるmTORとS6Kの発現を調節し、離乳豚の窒素代謝を最終的に促進します(He et al., 2023)。さらに、ラクトバチルス・ガセリで発酵させたホエイプロテインは、IGF-1-PI3K/AKT/mTOR経路の活性化を介して筋形成とタンパク質合成を促進し、FOXOを介したユビキチン-プロテアソーム経路(UPP)およびオートファジー-リソソーム経路(ALP)の調節を介してタンパク質分解を抑制し、デキサメタゾン(DEX)誘発性筋萎縮を抑制した。具体的には、ユビキチン-プロテアソーム経路関連分子であるアトロジン-1/MAFbxおよびMuRF1、ならびにALP関連分子であるLC3、カルパインL、BNIのmRNAおよびタンパク質発現の増加を抑制した(Jang et al., 2023)。ラクトバチルス・パラカゼイもまた、筋タンパク質恒常性維持に関与する主要なシグナル伝達経路を調節することで、骨格筋に有益な効果を発揮する。具体的には、これらのプロバイオティクスはFOXO3aの活性化を阻害し、その結果、ユビキチンを介した骨格筋タンパク質分解を制御する2つのE3ユビキチンリガーゼであるMuRF1とMAFbx/Atrogin-1の発現を抑制します。さらに、プロバイオティクスは筋萎縮を促進することが知られる経路であるNF-κBの活性化を阻害します(Zhong et al., 2023)。これにより、筋原性遺伝子発現とタンパク質合成の促進において中心的な役割を果たす経路であるAKTとmTORの活性化が促進されます。タンパク質分解を抑制し、タンパク質合成を促進するこの二重の作用は、筋分化と収縮機能の重要なマーカーであるMyHC(ミオシン重鎖)の発現増加につながります。これらのメカニズムは相まって、筋肉量、筋力、および機能の維持に貢献します(He et al., 2023; Zhang et al., 2024)。これらの研究結果を総合すると、ラクトバチルスは筋肉の萎縮を防ぎ、全体的な筋肉タンパク質の恒常性を促進する可能性があることが示唆されます。 |
| 3.4.3 脂質 |
| 臨床的には、サルコペニアはしばしば肥満を伴うため、肥満はサルコペニアの発症をさらに促進する可能性があります(Tardif et al., 2014)。このタイプの肥満性筋萎縮には、筋内脂肪蓄積と筋線維化が含まれます。体内の脂質の異常蓄積は、筋萎縮と筋脂肪変性を加速させます(Vial et al., 2020)。骨格筋の脂質代謝はラクトバチルスによっても制御されています。動物実験では、高脂肪・高ショ糖(HFS)食を摂取したラットの骨格筋脂肪含量の増加は、ラクトバチルス属およびプレボテラ属の相対的存在量の減少に関連している可能性があることが明らかになっています(Collins et al., 2016)。 ラクトバチルス・プランタルムは、CPT1、ACOX1、MCADなどの脂質酸化遺伝子のmRNA発現を増加させることで脂質酸化を改善し、SIRT1-PGC-1α経路を活性化することで脂質合成を抑制し、脂肪蓄積の減少につながります(Kwon et al., 2020)。さらに、ラクトバチルス・プランタルムを摂取することで、体重増加を伴わずに白色脂肪組織を減少させ、筋肉量を増加させ、腓腹筋における運動持久力に関与するI型線維の数を増加させ、筋機能低下による筋萎縮を予防することが報告されています(Chen et al., 2016)。 |
| アディポネクチン(APN)は、人体で最も多く発現しているアディポカインであり、炎症に抵抗し、筋肉を調節する役割を担っています(Krause et al., 2019)。アディポネクチンレベルとサルコペニアの関連性に関するメタアナリシスでは、サルコペニアのある人はサルコペニアのない人に比べてアディポネクチンレベルが低いことが示されています(Komici et al., 2021)。アディポネクチンはT-カドヘリンに結合してシグナルを活性化し、筋肉の再生を促進し、筋萎縮に抵抗すると考えられます(Tanaka et al., 2019)。ラクトバチルス・ラムノサスは、アディポネクチン分泌とAMPK活性化を刺激することでインスリン感受性を効果的に高め、脂質蓄積を減少させるとともに、高脂肪食を摂取したマウスの肝臓と骨格筋においてPPAR-a、CPT1、ACOXなどの脂肪酸酸化に関与する遺伝子の発現をアップレギュレーションします(Kim et al., 2013)。興味深いことに、食事誘発性肥満マウスにおける体脂肪、脂肪蓄積、脂質レベルの測定では、対照群とラクトバチルス・アシドフィルスを摂取したマウスとの間に差は見られませんでした(Arora et al., 2012)。したがって、ラクトバチルスの効能は菌株によって大きく異なります。多様な菌株のラクトバチルスは脂質代謝に異なる作用と働きを示し、これが様々な菌株を用いた研究結果の違いを説明できるかもしれません。 |
| 3.5 腸内細菌叢の代謝物への影響 |
| 3.5.1 短鎖脂肪酸(SCFA) |
| 短鎖脂肪酸は主に酢酸、プロピオン酸、酪酸から構成され、特定の嫌気性大腸細菌によって炭水化物を分解するために産生されます。これらの短鎖脂肪酸は、腸内恒常性、糖・タンパク質・脂質代謝、免疫系、そして体の炎症反応の維持に不可欠です(Tan et al., 2014)。最近の研究では、短鎖脂肪酸は以下の経路を通じて筋肉の調節に関与することが示唆されています(図2)。(1) 短鎖脂肪酸は遊離脂肪酸受容体2および3(FFAR2/3)に結合し、糖代謝とIGF-1の放出を促進します。IGF-1はPI3K/Akt/mTORシグナル伝達カスケードを活性化し、筋肉タンパク質の合成を促進し、FoxOをリン酸化して筋肉タンパク質の分解を防ぎます(Pekmez et al., 2019)。 (2) 短鎖脂肪酸はミトコンドリアアデニル酸活性化タンパク質を増加させる。AMP活性化タンパク質キナーゼ(AMPK)はカルニチンパルミトイルトランスフェラーゼ1(CPT-1)の活性を高め、脂肪酸酸化を促進する。(3) この制御は、ペルオキシソーム増殖因子活性化受容体ガンマコアクチベーター1-アルファ(PGC-1α)を介して行われる。PGC-1αは、多数の核内受容体および転写因子の活性化因子として機能し、CPT-1の発現を制御して脂肪酸酸化を促進する(Zong et al., 2002)。マウスモデルでは、CPT-1およびPGC-1αが筋肉量に及ぼす好影響が確認されており、筋萎縮を抑制する能力が示されている(Hénique et al., 2015)。 (4)短鎖脂肪酸は細胞内に受動的に拡散し、骨格筋の機能と代謝に重要な役割を果たすHDACの産生を阻害します。HDACはMyoD、MEF2、ミオジェニンといった筋原性調節因子のアセチル化状態を調節することで、筋細胞の発達と分化に影響を与えます。これには、骨格筋の萎縮促進、ミトコンドリア合成阻害、グルコースおよび脂質酸化プロセスの調節が含まれます(Tian et al., 2020)。 |
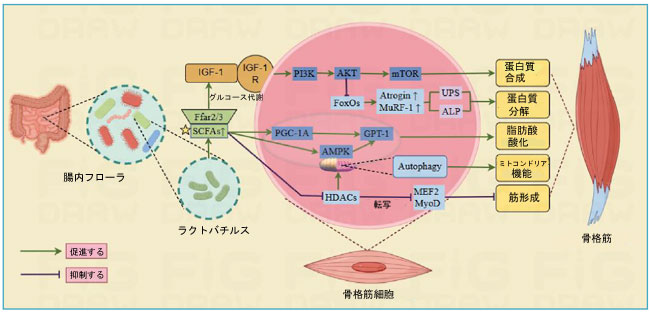 |
図2 ラクトバチルスは短鎖脂肪酸を介して骨格筋の伝達経路を制御する。 Ffar2/3:遊離脂肪酸受容体2および3、IGF-1:インスリン様成長因子、IGF1R:IGF-1膜受容体、MTOR:ラパマイシン標的タンパク質、CPT-1:カルニチンパルミトイルトランスフェラーゼ1、PGC-1α:ペルオキシソーム増殖因子活性化受容体ガンマコアクチベーター1α、PI3K:ホスファチジルイノシトールキナーゼ、AMPK:アデニル酸活性化タンパク質キナーゼ、FoxO:フォーク型転写因子、MuRF-1:筋特異的リングフィンガータンパク質1、Atrogin:ヒト筋萎縮タンパク質Fbox、HDAC:ヒストン脱アセチル化酵素、MEF2:筋細胞エンハンサー因子2、MyoD:筋原性分化抗原。 |
| ラクトバチルス属、ビフィドバクテリア属、フィルミクテス属、バクテロイデス属、放線菌属、エンテロコッカス・フェカリス属などの有益な腸内細菌は、短鎖脂肪酸(SCFA)の産生を促進します。短鎖脂肪酸は、腸-筋軸を介して骨格筋の代謝と筋線維の表現型を調節し、間接的に筋肉の健康に影響を与えます(Anachad et al., 2023)。ラクトバチルス属は、短鎖脂肪酸を産生する腸内細菌の重要な成長因子です。ラクトバチルス属は、単独で酢酸を産生するだけでなく、腸内で短鎖脂肪酸を産生する細菌を調節し、交配による短鎖脂肪酸の相互変換を促進します。例えば、酪酸を産生する細菌は、乳酸と酢酸を利用することで短鎖脂肪酸レベルを高めることができます(Morrison et al., 2006)。ラクトバチルス・プランタルムを経口摂取したマウスの盲腸内容物中の酢酸、プロピオン酸、酪酸の濃度は、有意に増加しました。酢酸産生細菌では、ペプトコッカス科およびルミノコッカス科UCG-004属の細菌の存在量が有意に増加しました。さらに、酪酸産生細菌、特にラクノスピラ科の細菌の存在量も有意に増加しました。これは短鎖脂肪酸レベルの改善とサルコペニアの緩和につながります。一方、ラクトバチルス・プランタルムの存在は、有益な短鎖脂肪酸産生細菌の存在量を増加させ、腸内病原性細菌(プロテオバクテリアや腸内細菌科など)の数を有意に減少させました(Lee C.-C. et al., 2021)。 |
| 現在進行中の研究の大部分は、乳酸菌(LAB)の影響を受ける短鎖脂肪酸のレベルを定量化することを目的としています。しかしながら、筋肉への影響は複雑です。濃度に加えて、個人差や比率についても更なる研究が必要です。ラクトバチルスが介在する様々な短鎖脂肪酸は、筋線維に対して異なる影響を及ぼします。プロピオン酸はI型筋線維の比率と正の相関を示しますが、I型筋線維の断面積はIIb型筋線維の比率と負の相関を示します。酪酸とIIa型筋線維の比率は正の相関を示します(Liu T. et al., 2023)。腸内における酢酸、プロピオン酸、酪酸のモル比は、それぞれおよそ60:20:20です(Markowiak-Kopeć and Śliżewska, 2020)。試験管内試験では、短鎖脂肪酸は用量依存的な効果を示し、C2C12ミオチューブにおけるグルコースの取込みは、組み合わせの割合によって変化することが示されています。短鎖脂肪酸単独の摂取ではグルコースの取込みは増加しません(Otten et al., 2023)。さらに、乳酸は短鎖脂肪酸のカテゴリーには属さないかもしれませんが、ラクトバチルスによって生成される必須化合物であり、短鎖脂肪酸の生成に不可欠な前駆体です。乳酸と筋萎縮の関連性については、さらなる研究が必要です。 |
| 3.5.2 リポ多糖(LPS) |
| 健全な腸管バリア機能は炎症を軽減し、栄養吸収を促進し、サルコペニアの発生予防に役立ちます(Baumgart and Dignass, 2002)。腸管の機械的バリアは、有害物質や病原体(リポ多糖など)の体内への侵入に対する第一線の防御線であり、主に腸管上皮上に保護層を形成する小さな細胞で構成され、接着結合(AJ)とタイト結合(TJ)によって相互につながっています。この複雑なネットワークは、消化管における細胞間透過性の主な決定要因となっています(Drolia and Bhunia, 2019)。タイトジャンクション(TJ)には、オクルディンやクローディンなどの膜貫通タンパク質、およびZO(閉塞帯タンパク質)などの表層膜タンパク質が含まれ、腸管上皮細胞(IEC)間の空間を密閉し、細胞極性を維持し、腸管バリアの浸透圧機能を維持するための重要な複合体として機能しています。腸管バリアの機能不全は、腸内細菌とその代謝物(リポ多糖など)が漏出して血流に入る原因となります。 |
| リピドA、コアオリゴ糖、O抗原を含むリポ多糖は、グラム陰性細菌の外膜に存在する強力なエンドトキシンです。過剰なリポ多糖が全身循環に移行し、血漿中のリポ多糖濃度が上昇すると、炎症が誘発され、サルコペニアの発症と進行が促進されます(Bindels and Delzenne, 2013)。骨格筋細胞はToll様受容体(TLR)を発現しており、病原体に関連する様々な分子パターンを識別できます(Boyd et al., 2006)。筋肉特異的な活性化に関与する転写因子である核因子κB(NF-κB)は、サルコペニアを誘発し、Toll様受容体/NF-κB経路を活性化します(Thoma and Lightfoot, 2018)。そのため、腸内細菌由来のリポ多糖が骨格筋細胞上のTLR4によって認識されると、核因子κB(NF-κB)が活性化され、インターロイキン-6(IL-6)と腫瘍壊死因子α(TNF-α)の産生につながります(Barton and Medzhitov, 2003)。マクロファージとT細胞によって分泌されるIL-6はタンパク質合成の阻害に関与し(Haddad et al., 2005)、マクロファージによって産生されるTNF-αはストレス応答の初期段階で細胞内のタンパク質分解とアポトーシスを誘導します(Li et al., 2005)。別の経路では、リポ多糖がMAPK活性化を介してAtrogin-1およびMuRF1遺伝子の発現を促進し、UPSとオートファジー-リソソーム経路の両方を活性化することで骨格筋タンパク質分解につながることが示されています(Ronnebaum et al., 2014)。 |
| ラクトバチルスは、腸管バリア機能の修復と保全、腸管恒常性の維持に極めて重要な役割を果たしており、筋萎縮の発生と進行に影響を及ぼしています。腸管上皮細胞の増殖とタイトジャンクションタンパク質関連成長因子の発現を刺激することで腸管バリアを保護し、受容体を特異的に認識した後、下流シグナル経路を変更することで炎症因子のバランスをとることができます。大腸菌k88に感染した離乳早期の子豚では、タイトジャンクションのダウンレギュレーションが観察され、腸粘膜の透過性が増加しました。しかし、ラクトバチルス・カゼイの投与により、この惨状は回避されました。ラクトバチルス・カゼイは、子豚のZO-1、オクルディン、クローディン-1などのタイトジャンクションの発現を回復させる顕著な能力を示し、腸管構造を強化しました。さらに、ラクトバチルス・カゼイは腸粘膜上皮細胞の増殖を促進することで再生と修復を促進し、腸上皮組織の完全性を保護します。同時に、腸の筋肉の厚さと絨毛の高さを増加させ、腸全体の健康をさらに改善します(Wang et al., 2019)。植物由来ラクトバチルス・と発酵乳由来ラクトバチルスからなるプロバイオティクス混合物は、高脂肪食を摂取したマウスにおいて、タイトジャンクション発現を増加させ、血漿中のリポ多糖レベルを低下させる能力があることが証明されています。また、GLP-1レベルを高め、小胞体(ER)ストレスを軽減し、末梢インスリン感受性を改善し、骨格筋量を増加させることもできます(Balakumar et al., 2018)。 |
| リポ多糖誘導性炎症因子の阻害に関して、ラクトバチルス・ラムノサス(LGG)は消化管において抗炎症作用を示した。特定の乳酸菌種は、マウスモデルにおいてリポ多糖誘導性炎症性損傷を軽減する特異的な能力を示した(Petrof et al., 2009)。ヒト平滑筋細胞(SMC)において、ラクトバチルス・ラムノサスのリポ多糖誘導性損傷に対する保護作用は、NF-κBサブユニットの両リン酸化を阻害し、ラクトバチルス・ラムノサス曝露後に発現が低下する表面TLR2の活性化に伴う炎症性サイトカインIL-6の分泌を抑制することで媒介される。さらに、ラクトバチルス・ラムノサスは抗炎症性サイトカインIL-10の分泌レベルを回復させる作用も有する(Ammoscato et al., 2013)。 |
| 3.5.3 胆汁酸(BA) |
| ケノデオキシコール酸(CDCA)やコール酸(CA)などの胆汁酸は、肝臓でコレステロールから内因的に合成されます。十二指腸で脂質として消化・吸収された後、脂質は遠位回腸と近位結腸へと運ばれます。そこで腸内細菌と胆汁酸塩加水分解酵素(BSH)の作用によって遊離胆汁酸へと変換されます。腸肝循環に入らなかった胆汁酸の一部は、結腸で腸内微生物によって代謝され、異性化と脱水酸化反応を経て非抱合型胆汁酸と二次胆汁酸が生成されます(Cai et al., 2022)。過去の研究では、12α-ヒドロキシ化コール酸(デオキシコール酸など)の濃度が骨格筋量と負の相関関係にあることが示されています。対照的に、12α-ヒドロキシ化されていないコール酸(ケノデオキシコール酸など)の濃度は骨格筋量と正の相関関係にある(Kobayashi et al., 2017)。また、低用量ウルソデオキシコール酸(UDCA)は、PKCシグナル伝達経路を介して癌誘発性活性酸素種の産生を阻害し、転写因子AP-1およびNF-κBの発現を阻害することで、炎症性サイトカインTNF-αの発現を誘導し、悪液質(脂肪や骨格筋組織の喪失など)の消費を減少させることも明らかにされている(Tschirner et al., 2012)。 |
| ラクトバチルスは胆汁酸代謝を調節し、消化管輸送に影響を与える。乳酸菌(LAB)は胆汁酸加水分解酵素を有し、この酵素は胆汁酸に対して耐性と脱抱合活性を示すため、乳酸菌は生存し、胆汁酸解離能を発揮することができる(Hernández-Gómez et al., 2021)。Joyce et al. (2014) は、胆汁酸代謝と全身遺伝子発現における腸内細菌叢の重要性を実証した。ラクトバチルス・プランタラムを投与されたマウスでは、肝臓における胆汁酸合成とコレステロール逆輸送に関連する遺伝子の発現レベルが上昇した。さらに、ラクトバチルス・プランタラムを投与されたマウスの肝臓、回腸、骨格筋において、胆汁酸受容体TRG5の発現が増加した(Kwon et al., 2020)。胆汁酸とTGR5の結合はD2活性を増強し(Watanabe et al., 2006)、骨格筋細胞中のT3濃度を上昇させ、骨格筋の発達と再生を促進する(Mullur et al., 2014)。しかし、マウスとヒトの胆汁酸プロファイルには大きな違いがあるため、胆汁酸、腸内細菌叢、そしてヒトにおける筋萎縮との相関関係を明らかにするには、さらなる研究が必要である。したがって、その根底にあるメカニズムの解明には依然として多くの課題が残されている(図3)。 |
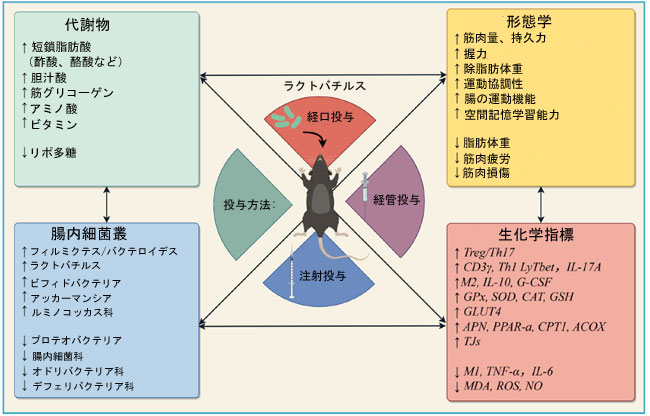 |
| 図3.ラクトバチルス投与後の筋萎縮マウス/ラットモデルの臨床所見 |
| 3.5.4 ビタミン |
| ラクトバチルスやビフィズス菌などのバランスの取れた腸内細菌叢は、ビタミンB群(B3、B5、B6、B7、B12)、葉酸、ビタミンKなどの必須ビタミンを供給します。様々なビタミンとサルコペニアの間には密接な関連があり、十分なビタミン摂取は筋肉量と機能の維持に不可欠です。腸内細菌叢によって産生されたこれらの化合物は、全身循環に入り込み、最終的には骨格筋細胞に影響を及ぼす可能性があります。特にビタミンDは顕著です(Bauer et al., 2013; Uchitomi et al., 2020)。高齢のサルコペニア患者では、血漿中のビタミンB12とビタミンDの低値が観察されています(Ates Bulut et al., 2017)。ラクトバチルスはビタミンの産生、吸収、代謝に影響を与え、サルコペニアを予防します。腸内細菌叢を正常化し、葉酸やビタミンB12を生成することで、骨格筋の合成と代謝を調節することができます。このプロセスは、高ホモシステイン血症によって引き起こされる酸化ストレスと内皮損傷を防ぐのに役立ち、それによって骨格筋の機能不全を予防します(Langille et al., 2014)。同様に、ラクトバチルス株はビタミンDレベルにも影響を与えます。研究では、ラクトバチルス・ロイテリNCIMB 30242が肝臓25-ヒドロキシラーゼ活性または7-デヒドロコレステロール(7-DHC)濃度を上昇させることでビタミンDの吸収を促進し、25(OH)Dの生成を増加させる可能性があることがわかっています(Jones et al., 2013)。研究では、ラクトバチルス・ラムノサスGGとラクトバチルス・プランタルムが、マウスとヒトの腸上皮細胞の両方でビタミンD受容体(VDR)タンパク質の発現を増加させ、転写活性を高めることができることもわかっています。これらのプロバイオティクスは、ビタミンD受容体シグナル伝達経路を活性化することで、最終的にビタミンDの吸収と、抗菌ペプチドであるカテリシジンなどの標的遺伝子の発現を促進し、抗炎症効果を発揮します(Wu et al., 2015)。別の研究では、ラクトバチルス・ラムノサスGGがコレカルシフェロールの腸管吸収を促進し、老人性骨粗鬆症におけるビタミンDトランスポーターのタンパク質レベルを上昇させることで25-ヒドロキシビタミンD3レベルを上昇させることも明らかになりました。これにより、ビタミンDの吸収に影響を与え、骨粗鬆症を治療します(Cheng et al., 2022)。多くの研究で、サルコペニアと骨粗鬆症の間には非常に重要な関連性があり、両疾患は類似した病態メカニズムを共有していることが示されています(Wang et al., 2024)。これが「オステオサルコペニア」という用語の由来です。ラクトバチルスに関する現在の研究は、骨粗鬆症(Bose and Sharan, 2024; Guo et al., 2023; Huang et al., 2022)またはサルコペニア(Kim et al., 2023; Lee et al., 2023; Ni et al., 2019; Rondanelli et al., 2022)に焦点を当てていますが、骨粗鬆症とサルコペニアの間には強い関連性があり、病態生理学的に共通していることを考えると、ラクトバチルスはビタミンDの産生と吸収を促進し、ビタミンD代謝を促進し、カルシウムの利用を改善する能力を持つことから、オステオサルコペニアの治療に大きな可能性を秘めています。 |
| 4. サルコペニアにおけるラクトバチルス関連の臨床予防と治療 |
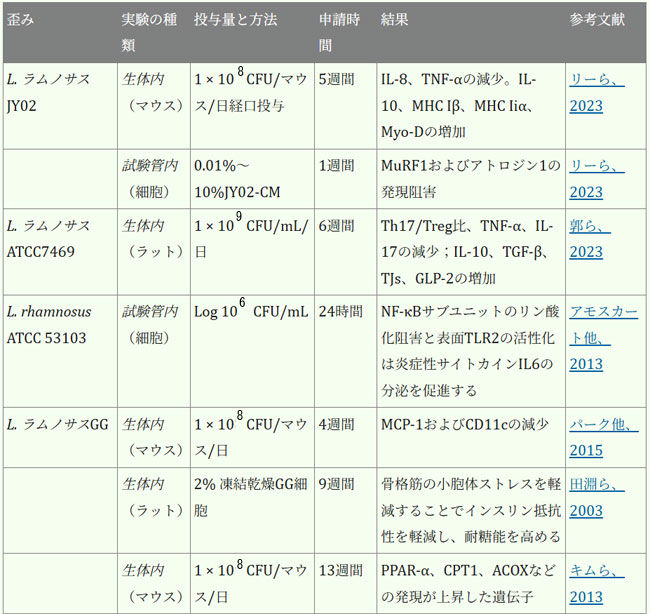
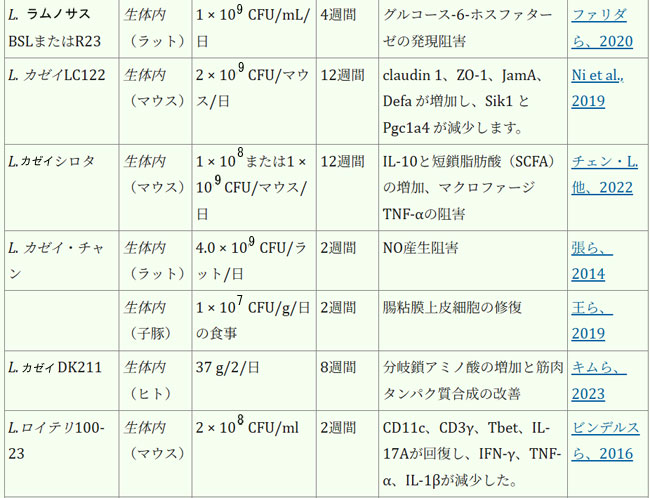
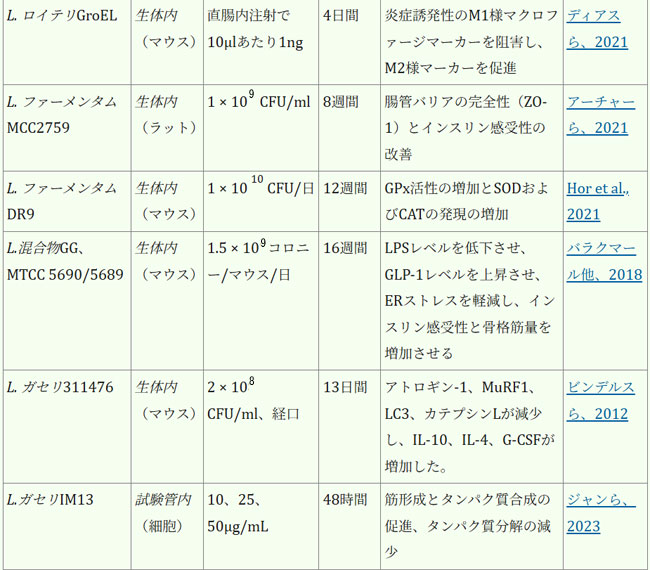
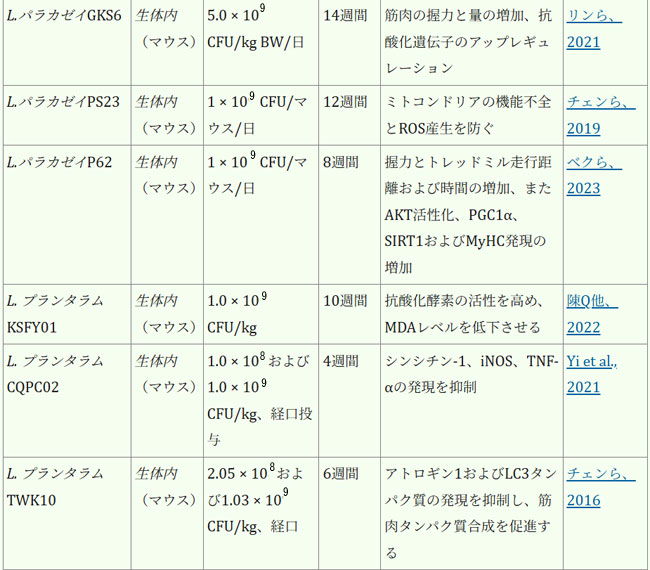
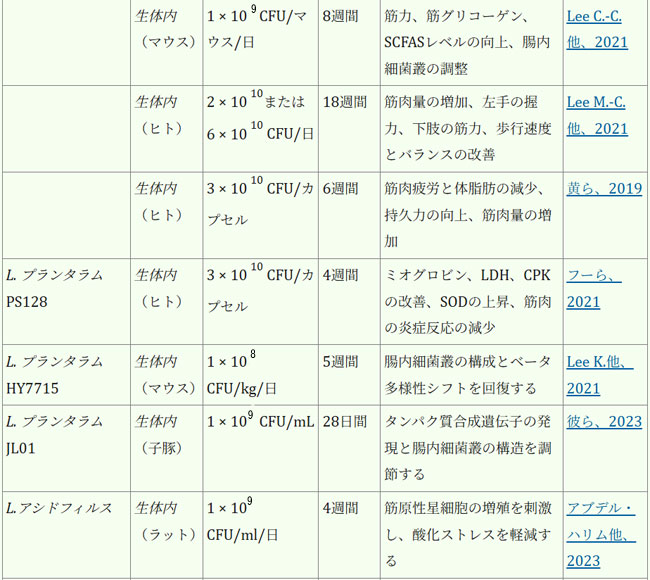
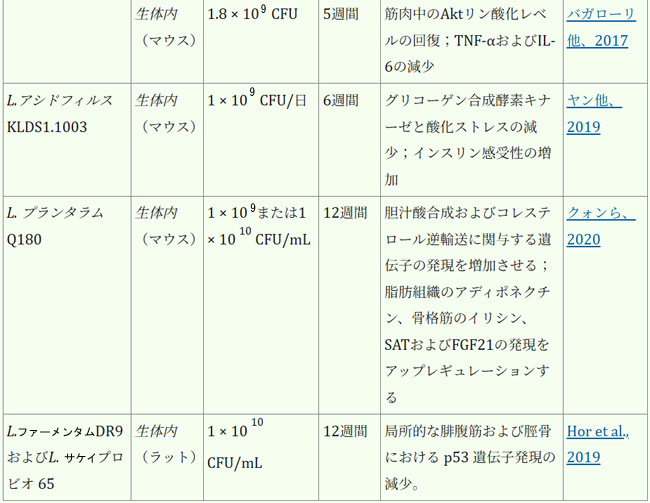
| 腸内細菌叢は、人間の健康全般の維持と疾患予防に不可欠です。表1は、各菌株の実際の有効性に関する詳細な情報を示しています。近年、ラクトバチルスの直接補給は、サルコペニアの予防または緩和、そして患者の生活の質の向上のための適切な治療選択肢として徐々に定着しつつあり、従来の薬物療法を補助または代替する効果的な手段と考えられています。複数のランダム化比較試験において、様々なプロバイオティクス、特にラクトバチルスの有効性が実証されています。これらの研究は、多様な集団を対象とし、特にサルコペニアに罹患している成人および高齢者に焦点を当てて実施されています。筋肉の健康促進という点では、ラクトバチルス・プランタルムPL-02とLY-66は筋肉量の増加と体脂肪蓄積の減少に効果があることが実証されており、筋肉脂肪変性症の緩和に役立ちます。筋肉脂肪変性症はサルコペニアの主要因子であり、サルコペニアの進行を効果的に予防します(Lee et al., 2024)。長期にわたる過度の運動は、筋線維の微小損傷や炎症反応を引き起こす可能性があります。患者は筋機能不全/筋力低下を発症する可能性があり、少数の患者では筋萎縮さえも発症する可能性があります(Rubio-Arias et al., 2019)。ラクトバチルスのサプリメント摂取は、これらの悪影響を効果的に緩和することができます。ラクトバチルス・プランタルムPS128を朝晩の食前に4週間カプセル2個(3 × 1010 CFU/カプセル)投与したところ、筋肉損傷(ミオグロビン、LDH、CPK)が減少し、抗酸化指標SOD(スーパー・オキサイド・ディスムターゼ)が有意に上昇し、マラソンランナーの筋肉炎症反応が減少しました(Fu et al., 2021)。同じ用量のラクトバチルス・プランタルム TWK10を6週間投与したところ、筋肉疲労が減少、持久力が向上しました。体組成の点では、ラクトバチルス・プランタルムTWK10の投与により、体組成(体脂肪、体重、筋肉量、BMI)に好ましい変化が見られました。特に高用量群では、専門的な運動トレーニングを受けていない健康な参加者において、体脂肪の有意な減少と筋肉量の増加が観察されました(Huang et al., 2019)。 |
| 表1. ラクトバチルスの生物に対する影響 |
 |
 |
 |
 |
 |
 |
| 高齢者は加齢とともに筋肉量と筋肉機能が徐々に低下し、サルコペニアになりやすくなります。こうした状況において、ラクトバチルスは筋肉への脂肪浸潤を抑制し、代謝プロセスを改善し、抗炎症作用を発揮することで、サルコペニアの進行を効果的に遅らせる重要な役割を果たします。脂質代謝の変化により筋肉への脂肪浸潤が起こりやすい肥満またはメタボリックシンドロームの患者において、ラクトバチルスは体組成の調整と脂質代謝の改善に役立ちます。さらに、アスリートやフィットネス愛好家など、激しい運動をする人にとって、ラクトバチルスのサプリメントは、運動に伴う筋肉の損傷を軽減し、全体的な筋肉の健康を維持するというメリットがあります。これは、筋肉の緊張や炎症につながる可能性のある高強度の運動を継続的に行う人にとって特に重要です。これらの効果は、サルコペニアのリスクを軽減するだけでなく、これらの集団における全体的な代謝の健康をサポートします。 |
| ラクトバチルスが筋肉の機能と質を改善する能力は、予防策として役立ちます。同様に、筋肉タンパク質合成の促進や炎症の軽減といったこれらの能力は、高齢者や慢性疾患患者のサルコペニア症状の緩和にも治療効果を発揮します。ラクトバチルス・カゼイDK211発酵ホエイプロテイン(1日2回、カプセル入り)を摂取(1群37g)し、8週間の摂取療法を行ったところ、中年健康男性48名において、プラセボ投与群と比較して、血漿中の分岐鎖アミノ酸濃度が上昇し、筋肉タンパク質合成、特に筋力と運動能力が向上しました(Kim et al., 2023)。同様に、サルコペニアを患う高齢者を対象に同様のラクトバチルス・カゼイ治療プロトコルを用いた別の研究でも、オメガ3脂肪酸、ロイシン、プロバイオティクスのラクトバチルス・パラカゼイPS23を配合した新しい食品を投与したところ、筋肉組織の炎症が軽減し、筋肉機能が回復するなど、類似の変化が見られました(Rondanelli et al., 2022)。さらに、ラクトバチルス・プランタルムTWK10を6週間補給すると、虚弱高齢者の筋肉量、握力、下肢筋力、歩行速度、バランスが向上する傾向があることがわかりました。補給期間が18週目まで延びるにつれて、その効果はさらに顕著になりました(Lee M.-C. et al., 2021)。上記の研究は、ラクトバチルス補給が、リスクのある集団の筋肉の消耗を防ぎ、すでにサルコペニアを経験している個人の回復を助けることができることを示しています。 |
5.限界と展望 |
| ラクトバチルス株はサルコペニアの軽減に有望性を示していますが、現在の研究には依然として解決すべき重要な限界があります。ラクトバチルスを介した微生物叢と代謝物は、重要な基礎的役割を果たしています。現在、多くの研究は微生物群集の分類情報を決定するために16Sシークエンシング技術に依存しており、特定のカテゴリーの精度が低下し、腸内微生物叢の真菌やウイルスの役割が考慮されていない可能性があります。このような統合的なアプローチは、サルコペニアに寄与するさらなる因子を明らかにし、より広範なマイクロバイオームを標的とした新たな治療介入への道を開く可能性があります。したがって、今後の研究では、腸内真菌やウイルスも含め、ラクトバチルスと相互作用してサルコペニアを軽減する可能性のある主要な微生物を徹底的に分析する必要があります。例えば、ショットガンメタゲノムシーケンシング技術は、種レベルおよび微生物群集の機能変化をより詳細な分類レベルで調査することができます(Ma et al., 2020)。さらに、特定の細菌群集と物質代謝との関連性はまだ十分に解明されておらず、ほとんどの研究は主に相関関係の特定に留まっています。将来的には、in vitro発酵シミュレーションやバイオセンサー技術を用いて、代謝物の生成とそれらがサルコペニアに及ぼす影響を検出することが期待されます。 |
| ラクトバチルス株は一般的に安全であると認識され、広く使用されていますが、膨満感やガスなどの軽度の胃腸症状が時折報告されています。特に免疫力が低下している人の場合、ラクトバチルスが過剰に増殖し、細菌転座を引き起こすことがあります。これは、腸内細菌が血流や内臓など体の他の部分に移動し、感染症につながる可能性があり、まれに菌血症などの全身感染症が発生したケースもあります(Doron and Snydman, 2015; Sanders et al., 2016)。これを考慮すると、個人の健康状態、マイクロバイオームの構成、および特定のニーズに合わせてカスタマイズされた、パーソナライズされたプロバイオティクス製剤の開発が求められています。選択されたラクトバチルス株が各個人の腸内マイクロバイオームに適合することを保証することで、利点を最適化し、副作用を最小限に抑えることができます。ラクトバチルス属の菌株はそれぞれ安全性プロファイルや機能特性が異なるため、例えばアルギニンとオルニチンからプトレシンとアグマチンを生成するラクトバチルス・ヒルガルディX1B株は、特に高濃度では人体に有害となる可能性があり、高血圧やアレルギー反応を引き起こしたり、亜硝酸塩と結合して発がん性ニトロソアミンを形成したりする可能性があります(Arena and Manca de Nadra, 2001)。そのため、慎重な菌株選択が不可欠です。例えば、ラクトバチルス・ラムノサスGGやラクトバチルス・プランタルムのように、長年安全に使用されてきた菌株は、特定の集団には好ましい場合があります。異なる菌株には多くの類似点がありますが、亜種ごとの固有の特性により、各菌株の抗サルコペニア特性や機能成分にばらつきが生じます(Baek et al., 2023)。このように、異なる菌株のラクトバチルスを組み合わせてより効率的なプロバイオティクスを開発したり、ラクトバチルスを他のプロバイオティクスやプレバイオティクスと併用したりすることで、ラクトバチルスの投与量を減らし、副作用のリスクを最小限に抑えることができる可能性があります。近年、アッカーマンシア・ムシニフィラやルミノコッカス・グナバスなどの新興微生物が、ラクトバチルスとの併用による効果を発揮する有力な候補として注目されています。しかし、ラクトバチルスの臨床応用における有効性は、活性の低さや消化管におけるバイオアベイラビリティの低さといった問題によって依然として阻害されています。併用療法に着目すると、効果的な投与法は、労力を半分に減らして効果を倍増させる可能性を秘めていると言えるでしょう。新興ナノテクノロジーは、プロバイオティクス/プレバイオティクス/シンバイオティクス、あるいはそれらの様々な組み合わせ向けに様々な形状のナノ粒子(NP)を設計することが可能であり、プロバイオティクスと腸粘膜組織との効率的な結合を促進し、標的への適切な放出を確実にします(Dangi et al., 2023)。さらに、プロバイオティクスの新しい包装方法(単一の細菌をアラビアガム(GA)とマルトデキストリンでカプセル化する)は、消化管環境下におけるラクトバチルス・アシドフィルスの生存率を飛躍的に向上させます(Arepally et al., 2020)。 |
| 6 結論 |
| サルコペニア治療におけるラクトバチルスの潜在的メカニズムをまとめ、ラクトバチルスがサルコペニアの症状緩和に直接的および間接的な役割を果たすことを明らかにしました。具体的には、ラクトバチルスは免疫調節、炎症および酸化ストレスの抑制、代謝の維持、骨格筋代謝のバランス調整、腸内微生物叢の調整において極めて重要な役割を果たしており、これらはすべて相互に作用し、サルコペニアにおける筋肉量と機能を保護します。サルコペニアに使用できる他の臨床疾患の治療薬は存在しますが、その安全性と有効性は、特に重度のサルコペニア患者においては依然として限られています。一方、ラクトバチルスは副作用が少なく、費用負担も少ない、より効果的な治療法を提供します。本レビューは、ラクトバチルスがサルコペニア治療の有望な選択肢となる可能性を示唆しています。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Front Microbiol. 2025 Mar 14;16:1559119. に掲載されたProbiotics and muscle health: the impact of Lactobacillus on sarcopenia through the gut-muscle axis.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


