ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
腸内細菌叢と宿主の健康の精密調節因子としての発酵乳製品: メカニズムの洞察、臨床的証拠、そして将来の方向性 |
Yuan Gao et al., |
|
|
| 要約 |
ヨーグルト、ケフィア、チーズ、発酵乳飲料といった乳製品は、腸内細菌叢と宿主の生理機能を調整する、多用途な食品ベースのモジュレーターとして注目されています。本レビューでは、生スターターカルチャーとその発酵由来代謝物(短鎖脂肪酸、生理活性ペプチド、菌体外多糖類)が相乗的に作用し、微生物多様性を高め、タイトジャンクションタンパク質の発現を介した上皮バリアの完全性の強化、そして免疫シグナル伝達の調節にどのように作用するかを示すメカニズム的知見を総合的に示します。臨床的エビデンスは、メタボリックシンドローム、高血圧、過敏性腸症候群(IBS)の患者群において、代謝パラメータ(空腹時血糖値、脂質プロファイル、血圧)の有意な改善と全身性炎症の軽減を裏付けています。本研究では、プロバイオティクスの生着、ポストバイオティクス収量、そして治療効果を左右する重要な調節因子(株特異性、宿主のエンテロタイプとFUT2遺伝子型、発酵パラメータ、マトリックス組成など)に焦点を当てます。有望な短期的成果にもかかわらず、現在の研究は異質なデザインと短い介入期間という制約があり、持続性と因果関係を確立するためには、長期にわたる適応型試験と統合的なマルチオミクス研究の必要性が強調されます。今後、ベースライン微生物叢プロファイリング、宿主遺伝学、そしてデータ駆動型発酵設計を活用した精密栄養フレームワークは、オーダーメイドの発酵乳製品製剤の開発を可能にし、これらの伝統的な食品を、代謝性疾患、炎症性疾患、神経免疫疾患の標的予防・管理のための次世代機能性マトリックスへと変貌させるでしょう。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. スターターと代謝物の役割 |
| 2.1. スターターの直接的な作用 |
| 2.1.1. ストレス耐性とコロニー形成 |
| 2.1.2. 競合阻害 |
| 2.2. 微生物代謝産物による間接的な調節 |
| 2.2.1. 短鎖脂肪酸(SCFA) |
| 2.2.2. 生理活性ペプチド |
| 2.3. 微生物群集構造のリモデリング |
| 3. 健康効果に関する臨床的エビデンス |
| 3.1. 肥満、糖尿病、および心血管疾患 |
| 3.2. 腸の炎症とバリア機能障害 |
| 3.3. 神経免疫調節 |
| 4. 有効性を調節する因子 |
| 4.1. 菌株特異性 |
| 4.2. 宿主の個体差 |
| 4.3. 発酵プロセスと組成 |
| 5. 現在の研究の限界と今後の方向性 |
| 5.1. 短期効果の優位性 |
| 5.2. 不明瞭なメカニズム:因果関係の確立における課題 |
| 5.3. 個別化介入 |
| 5.4. マルチオミクス統合 |
| 6. 結論 |
本文 |
| 1.はじめに |
| 過去数十年にわたり、都市化とグローバル化は私たちの食生活を変えてきました。人々は現在、飽和脂肪酸、単糖、乳化剤、化学添加物を多く含む超加工食品をより多く摂取しています。同時に、抗生物質やプロトンポンプ阻害薬の使用頻度が増加し、腸内細菌叢を乱し、ディスバイオシス(腸内細菌叢の乱れ)を引き起こしています[1]。ディスバイオシスは、炎症性腸疾患、肥満、2型糖尿病、心血管疾患などの慢性疾患の一因となります[2]。発酵乳製品(ヨーグルト、ケフィア、チーズ、培養乳飲料など)は、腸内細菌バランスを回復するための、文化的に受け入れられた食品ベースのアプローチを提供しています。これらのマトリックスは、生きたプロバイオティクス菌株(例:乳酸菌、ビフィズス菌、連鎖球菌)を供給するだけでなく、発酵中に生成される短鎖脂肪酸(SCFA)、生理活性ペプチド、菌体外多糖類、バクテリオシンなどのポストバイオティクス化合物を豊富に含んでいます[3,4]。乳製品マトリックスは、胃酸を緩衝し、プロバイオティクスの生着を促進するプレバイオティクス基質を提供し、カゼイン、ホエイプロテイン、カルシウム、リン脂質などの栄養素を供給することで、プロバイオティクスの生存を助けます。これらの栄養素と微生物代謝物は相乗効果を発揮し、腸粘膜の防御力を強化します。その場で産生された短鎖脂肪酸は、遊離脂肪酸受容体2/3(FFAR2/3)などのGタンパク質共役受容体と結合し、タイトジャンクションタンパク質(ZO-1、オクルディン)をアップレギュレーションし、TLR2/4を介して免疫シグナル伝達を調節し、それによってバリアの完全性を強化し、炎症を緩和します[5,6]。 |
| 新たな臨床および前臨床エビデンスは、発酵乳製品を定期的に摂取することで、腸内細菌叢の多様性が高まり、糞便中および全身の短鎖脂肪酸レベルが上昇し、炎症性サイトカインが抑制され、腸内細菌叢異常(ディスバイオシス)関連疾患における代謝バイオマーカーが改善することを示しています(図1)。メタアナリシスでは、ヨーグルトまたはケフィアの摂取による介入後に、空腹時血糖値、LDLコレステロール、全身CRPが有意に低下したことが報告されており、その効果の大きさは菌株組成、投与量、および宿主の遺伝子型によって影響を受けました[7,8]。発酵乳製品の治療効果を最大限に引き出すためには、高解像度オミクス(メタゲノミクス、メタボロミクス、トランスクリプトミクス)と、多様な食生活背景を対象とした適切に設計されたランダム化比較試験を統合した研究が今後必要となるでしょう。ベースライン微生物叢の腸内型、宿主の遺伝子マーカー(FUT2分泌状態など)、機械学習予測モデルを組み込んだ精密栄養フレームワークにより、生着、代謝産物の産生、長期的な健康成果を最適化するカスタマイズされた発酵乳製品処方が可能になります[9,10]。 |
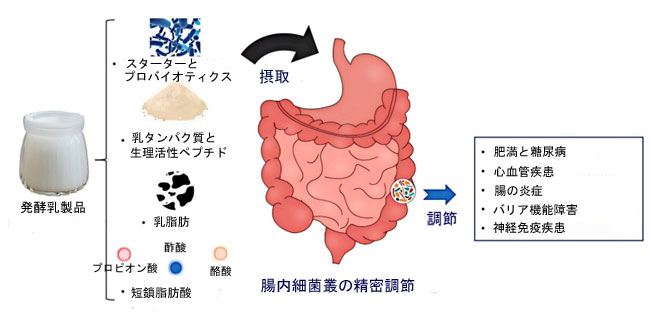 |
| 図1 腸内細菌叢と宿主の健康の精密調節剤としての発酵乳製品の概要 |
| 近年、発酵乳製品が有益な微生物群を増殖させ、短鎖脂肪酸の産生を高め、上皮バリア機能を強化する能力について、その特性解明において大きな進歩が見られました。しかしながら、既存の研究は、介入期間の短さ、発酵パラメータの不均一性、マルチオミクスと個別化宿主因子の不十分な統合といった制約を受けることが多く、これらが相まってメカニズムの明確化とトランスレーショナルな応用を阻害しています。本レビューは、発酵乳製品が腸内細菌叢をどのように制御するかを包括的にまとめ、その根底にある分子メカニズムを解説します。また、代謝、心血管、免疫の健康に関する臨床的エビデンスを評価し、精密栄養介入における主要な課題と将来の方向性を概説します。 |
| 2. スターターと代謝物の役割 |
| 2.1. スターターの直接的な作用 |
| 2.1.1. ストレス耐性とコロニー形成 |
| 発酵乳由来微生物は、胃の低pHと小腸の胆汁酸塩に耐えて大腸に生存する必要があります[11,12]。酸ストレスに対抗するため、ラクトバチルス属、ビフィドバクテリウム属、およびストレプトコッカス属の菌株は、F1F0-ATPaseプロトンポンプを利用し、アミノ酸の脱アミノ化によってアンモニアを生成し、膜脂質をリモデリングしてシクロプロパンと飽和脂肪酸を豊富にすることで細胞内pHを安定化させ、プロトン流入を抑制します[11,13]。十二指腸に入ると、胆汁酸塩加水分解酵素(BSH)が胆汁酸を脱抱合・解毒し、一方、細胞外多糖莢膜と細胞表面タンパク質が胆汁による細胞膜の破壊を防ぎます[12,14]。これらの内因性メカニズムは、シャペロンの上方制御などの適応ストレス応答と相まって、摂取された細胞の一部が粘膜上皮に一時的に付着し、蠕動運動による洗い流しに抵抗することを可能にする[15]。 |
| 発酵乳製品微生物は、消化管バリアを通過すると、直接的な病原体排除と間接的な代謝相互作用を介して腸内生態系を調節します[12]。宿主由来のグリカンや食物繊維を競合的に消費し、上皮接着部位を占拠し、抗菌代謝物(乳酸、バクテリオシン、過酸化水素)を分泌して腸管内pHを低下させ、大腸菌やクロストリディオイデス・ディフィシルなどの病原体を阻害します[12,16]。同時に、残留オリゴ糖の発酵によって短鎖脂肪酸(酢酸、プロピオン酸、酪酸)が生成されます。これらは大腸細胞のエネルギー源となり、タイトジャンクションの形成を促進し、粘液産生を促進してバリアの完全性を強化します[16,17]。乳酸菌(ラクトバチルス、ストレプトコッカス、ビフィドバクテリウムなど)によって産生された乳酸が、特殊な嫌気性菌(アナエロスティペス属、ユーバクテリウム・ハリー、コプロコッカス・カトゥスなど)によって抗炎症性の酪酸に変換されるという相互摂食相互作用は、代謝産物の多様化をさらに促進し、回復力のあるユーバイオティックコミュニティを支えています [11]。これらの乳酸利用細菌において、乳酸は発酵代謝中にNAD⁺再生のための電子シンクとして機能します。さらに、発酵乳製品に残留する乳糖は結腸に到達し、短鎖脂肪酸産生のための追加の基質として機能します [11]。コロニー形成の動態は菌株によって異なります。伝統的なスターターであるストレプトコッカス・サーモフィルスやラクトコッカス・ラクティスは、通過中に短時間しか生存せず、摂食が停止すると急速に個体数が減少します [18]。ラクトバチルス・ラムノサスGG(LGG)、ビフィドバクテリウム・アニマリス亜種ラクティスBB12、ラクトバチルス・プランタラムWCFS1などのプロバイオティクス株は、優れた接着タンパク質と炭水化物利用遺伝子座を有するため、腸内に数日から数週間付着し、場合によっては数ヶ月間も定着することができます[18,19]。このように、複合乳製品マトリックスにおいて、一過性スターターと持続性プロバイオティクスを組み合わせることで、即時の代謝刺激と持続的な微生物調節の両方が実現し、宿主の遺伝子、食事、健康状態を考慮した個別化された介入を設計するための青写真となります[11,15]。 |
| 2.1.2. 競合阻害 |
| 発酵乳製品中のプロバイオティクス株が腸内病原菌に対して発揮する競合阻害には、重なり合う生態学的戦略が根底にある。第一に、生態学的ニッチの先取りにより、病原菌は必須の資源と接着部位を奪われる。ラクトバチルス属やビフィドバクテリウム属などのプロバイオティクスは、宿主由来の糖鎖や食物繊維を巡って大腸菌やサルモネラ属との競合に打ち勝ち、「定着抵抗性」を確立する[20]。ムチン受容体(MUC2など)への高親和性結合と上皮ニッチの占有を通じて、プロバイオティクスは病原菌の接着を阻害し、局所的な鉄分と炭水化物のプールを枯渇させ、侵入菌の増殖を抑制する[21]。 |
| 発酵由来の標的抗菌性分泌物は、病原体抑制をさらに増幅します。乳酸菌は、菌株特異的なスペクトルを持つ多様なバクテリオシン(ナイシン、プランタリシン、ロイテリン、ペディオシン)を産生します。ラクトコッカス・ラクチス由来のナイシンは膜孔を形成し、バクテリオシン産生培養物を含む熟成チェダーチーズ中で、大腸菌O157:H7の菌数を60日間で2 log単位以上減少させます[22,23]。L.ロイテリ由来のロイテリンは、サルモネラ属菌によるクォラムセンシング依存性バイオフィルム形成の阻害を含む幅広い抗菌活性を示します[24]。糖タンパク質およびポストバイオティクスペプチド(例:L.カゼイShirata由来)は、結腸粘液モデルにおいてクロストリディオイデス・ディフィシルのバイオフィルムを60%以上破壊します[20]。 |
| これらの二重のメカニズムは相乗的に作用し、腸内生態系を再構築します。マウス大腸炎モデルにおいて、L. ロイテリ KUB-AC5の投与は、生態学的排除と直接的な抗菌効果の両方をもたらし、サルモネラ誘発性炎症および病原体負荷を有意に軽減しました[25]。臨床的には、ケフィアの毎日摂取(300 mL/日)により、過敏性腸症候群(IBS)患者の糞便中大腸菌が40%減少し、血清ゾヌリンが18%減少しました(p < 0.01)。これは、バリア機能の強化を反映しています[26]。今後の研究では、菌株特異的なバクテリオシン産生動態の定量化、様々な発酵条件下での複数菌株の相乗効果の調査、そして腸内環境の健康と疾患予防に対する長期的なプロバイオティクス介入の評価が求められます。 |
| 2.2. 微生物代謝産物による間接的な調節 |
| 2.2.1. 短鎖脂肪酸(SCFA) |
| 乳製品に生息するラクトバチルス属、ビフィドバクテリウム属、およびストレプトコッカス属の菌株の発酵活性により、発酵マトリックス中にミリモル濃度の酢酸、プロピオン酸、および酪酸が生成される[27,28]。ウォーターケフィアは、乳酸菌、酢酸菌、酵母の共生培養物を含むデキストランを豊富に含むグレインと糖溶液(ショ糖、ブドウ糖、果糖など)および乾燥果物(イチジク、ナツメヤシなど)を培養して作られる、乳製品を含まない弱アルコール性で酸性の発酵飲料です。in vitro発酵において、6時間後に約48.3 mMの酢酸と約13.8 mMのプロピオン酸、24時間後に約6.8 mMの酪酸が生成しました[28,29]。短鎖脂肪酸は宿主と微生物間のクロストークの重要なメディエーターであり、FFAR2/3などの受容体を介して免疫機能、代謝機能、上皮機能を調節します[29,30]。その結果、内腔pHが約5.5~6.0に低下し、酸に敏感な病原体(大腸菌、クロストリディオイデス・ディフィシルなど)が選択的に阻害され、一方でフィーカリバクテリウム・プラウスニッツィやロゼブリア属などの酸耐性常在菌が促進されます[31,32]。 |
| 動物およびヒトの研究では、発酵乳製品の摂取後に用量依存的に短鎖脂肪酸が増加し、酢酸、プロピオン酸、酪酸の増加がバリア機能の向上および内毒素血症の減少と相関していることが実証されている [27,33]。げっ歯類の大腸炎モデルでは、ケフィアの補給により近位結腸の短鎖脂肪酸が上昇し、タイトジャンクションタンパク質(例:ZO-1)がアップレギュレーションされ、全身性リポ多糖(LPS)レベルが低下した [33]。プロピオン酸は免疫細胞のFFAR3を介して作用し、インターロイキン6(IL-6)および腫瘍壊死因子α(TNF-α)の分泌を抑制する [34,35]。さらに、酪酸強化発酵乳を併用すると、マウスモデルにおける結腸の活性化B細胞核因子κ軽鎖エンハンサー(NF-κB)の活性化が低下し、相乗的な抗炎症効果が強調された [31,36]。これらの知見は、短鎖脂肪酸を介した健康効果を最適化する上で、菌株の特異性、発酵パラメータ、そして投与量の重要性を強調しています[29,30]。これらの研究を総合すると、乳製品の発酵中に生成される短鎖脂肪酸は、腸内微生物群集と宿主の生理機能に正確かつ用量依存的な影響を及ぼすことが示されています(図2)。 |
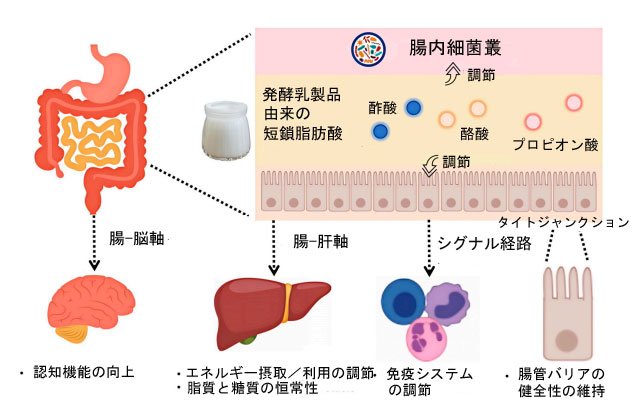 |
| 図2 腸内細菌叢と宿主の健康の精密調節因子としての発酵乳製品由来の短鎖脂肪酸の概要 |
| 2.2.2. 生理活性ペプチド |
| 発酵乳製品中の生理活性ペプチドは、主に微生物による乳タンパク質分解および酵素加水分解によって生成されます。乳酸菌は発酵過程において、β-カゼインおよびκ-カゼインからイソロイシン-プロリンープロリン(IPP)やバリン-プロリン-プロリン(VPP)などのトリペプチドを遊離させます[37,38]。これらのペプチドは、薬物ベースのアンジオテンシン変換酵素(ACE)阻害薬と同様に、低マイクロモル濃度でアンジオテンシン変換酵素を阻害します[37,38]。イソロイシン-プロリンープロリン(IPP)およびバリン-プロリン-プロリン(VPP)を豊富に含む発酵乳のランダム化比較試験では、高血圧または高血圧前症の人の収縮期血圧がわずかながら有意に低下することが示されていますが、その効果はペプチドの投与量と研究デザインによって異なります[37,39]。標準的なラクトトリペプチド以外にも、高タンパクヨーグルトに含まれるαs1-カゼインf(24–32)とβ-カゼインf(193–209)もアンジオテンシン変換酵素を阻害し、腸管運動に影響を及ぼす可能性のあるオピオイド様活性を示す[40]。 |
| 発酵乳由来ペプチドには、降圧作用に加え、免疫調節作用や抗酸化作用もある。ラクトフェリシンは、ラクトフェリンのタンパク質分解によって生成される25残基のペプチドで、活性酸素種を除去し、病原細菌の増殖を阻害することで粘膜保護に寄与する[41]。ストレプトコッカス・サーモフィルスによって生成されるκ-カゼイン断片は、樹状細胞におけるIL-10分泌を促進し、それによって制御性T細胞の分化を促進し、炎症反応を減弱させる[42]。ラクトバチルス・ラムノサスGGによって分泌される可溶性タンパク質p40とp75は、ERK1/2およびPKCβ1シグナル伝達経路を介して、サイトカイン誘導ストレス下でもCaco-2タイトジャンクションの完全性を維持し、細胞間透過性の上昇を阻害する[43,44]。ペプチドの収量とスペクトルは、発酵条件(株の選択、基質組成、pH、培養期間)に大きく依存する。イヌリンなどのプレバイオティクス繊維との共発酵は、ラクトフェリシンなどの特定のペプチドの放出を倍増させる可能性があり、また、pH 4.0~4.5に制御された酸性化はトリペプチドの安定性を最大化します[37,45]。発酵乳製品はまた、「ポストバイオティクス」ペプチドやγ-アミノ酪酸などの低分子化合物も生成し、これらは不安を軽減し、腸管脳相関に影響を与える可能性があります[41]。今後の研究では、プロテオーム解析とペプチドミクス解析を臨床試験と組み合わせ、スターター培養物と基質を最適化し、微生物と宿主がどのように相互作用してこれらのペプチドを吸収し、その効果を誘発するかを明らかにする必要があります。 |
| 2.3. 微生物群集構造のリモデリング |
| 発酵乳製品の長期摂取は、腸内細菌叢の大幅な構造リモデリングを引き起こし、微生物多様性の向上、生態系バランスの最適化、機能特化を特徴とします。健康な成人8名(女性2名、男性6名、年齢18~54歳)を対象とした無作為化対照試験では、42日間毎日250g以上のヨーグルトを摂取したところ、腸内細菌叢の多様性が増加しました。これは、シャノン指数の上昇とラクトバチルス属菌の増加によって示され、ヨーグルトの定期摂取が微生物群集構造を再構築できることを実証しました[46]。プロの女子サッカー選手では、28日間ケフィア(1日200mL)を摂取することで、微生物多様性(シャノン指数およびChao1指数)とアッカーマンシア・ムシニフィラおよびフェカリバクテリウム・プラウスニッツィーの菌数が増加し、運動能力の向上と相関していました[47]。メタボリックシンドロームの成人において、12週間毎日ケフィア(180 mL/日)を摂取したところ、放線菌の相対的存在量が増加し(p = 0.023)、メタボリックシンドロームのいくつかのパラメータに好ましい効果が認められました[48]。以前のメタアナリシスでは、ヨーグルトの摂取は腸内細菌叢の代謝を調節することで効果を発揮し、間接的に2型糖尿病の発症率を低下させる可能性があることが示されています[49]。このリモデリングは、外因性菌株と常在菌群の間の動的な相互作用を強調しています。 |
| ヨーグルトは、最も一般的かつ理想的なプロバイオティクスキャリアと言えるでしょう。菌株特異的な介入により、菌群集組成がさらに洗練されます。ビフィドバクテリウム・アニマリス亜種ラクティスBB-12(9 × 107 CFU/kg·bw)を8週間補給したところ、プレボテラの増殖が選択的に阻害され、クロストリジウム、ブラウチア、バクテロイデスの増殖が減少し、高脂肪食を摂取した齧歯類モデルの肥満が改善されました[50]。一方、ラクトバチルス・カゼイDG®®(2.4 × 107 CFU/日、8週間)を摂取したところ、回腸嚢内微生物叢のαおよびβ多様性が優先的に高まり、回腸嚢炎患者の保護的変化が見られました[51]。不活化プロバイオティクスを含むヨーグルトも腸内環境の改善に効果があります。二重盲検プラセボ対照試験では、ラクトバチルス・ヘルベティカスCP790で発酵させた加熱処理牛乳を飲むと、腸内のデスルフォバクテロタのレベルが低下し、便秘が緩和され(便の粘稠度が良くなり、いきみが少なくなった)、気分状態が改善した[52]。 |
| 個人差はこれらの影響を調節する。ある研究では、ヨーグルトの摂取が腸内細菌叢のコミュニティ構造(β多様性)における個人差にどのような影響を与えるかを、TwinsUKコホート研究の参加者1004名から16S rRNAと全ゲノムメタゲノムデータを解析することで評価した[53]。その結果、ヨーグルトは他の宿主因子や環境因子と比較して、全体的なコミュニティ構造にほとんど影響を与えないことが示された[53]。最近の研究では、腸内生理学的パラメータ(消化管通過時間やpH値など)も、個人差のある微生物叢構成を決定する重要な要因であることが示唆されている。これらのパラメータは、微生物叢の構成と代謝産物の産生に大きな影響を与える[54]。 |
| さらに、民族性と習慣的な食生活はリモデリングの軌道に影響を及ぼします。米国で実施された研究では、少なくとも12の属/部族レベルの微生物の存在量が、異なる民族グループ間で再現性のある形で変動することが明らかになりました[55]。これらの微生物群はしばしば相乗的なクラスターを形成し、遺伝的変異と高い相関性があります[55]。別の研究では、健康的な食事指数が高いほど、糞便中の酪酸/(酢酸+プロピオン酸)の比率が高くなることがわかっており、食事の全体的な質がさまざまな短鎖脂肪酸の相対的な存在量を調節できることを示唆しています[56]。単一の食品や栄養素と比較して、全体的な食生活パターン(地中海式ダイエットや植物ベースの食事など)は、腸内細菌叢の多様性と短鎖脂肪酸の産生に対して、より広範で持続的な促進効果があります[57]。 |
| 今後の研究では、ショットガンメタゲノミクスとメタボロミクスを活用し、菌株と投与量の相乗効果をマッピングし、宿主と微生物の代謝ネットワークを解明し、個々の微生物および遺伝子プロファイルに合わせて発酵乳製品の配合をカスタマイズする必要があります。このような精密栄養アプローチは、発酵乳製品の潜在能力を最大限に活用し、ユービオシス(腸内細菌叢)の回復と代謝の健康改善を図り、地域コミュニティを対象とした介入を最適化することが期待されます。 |
| 3. 健康効果に関する臨床的エビデンス |
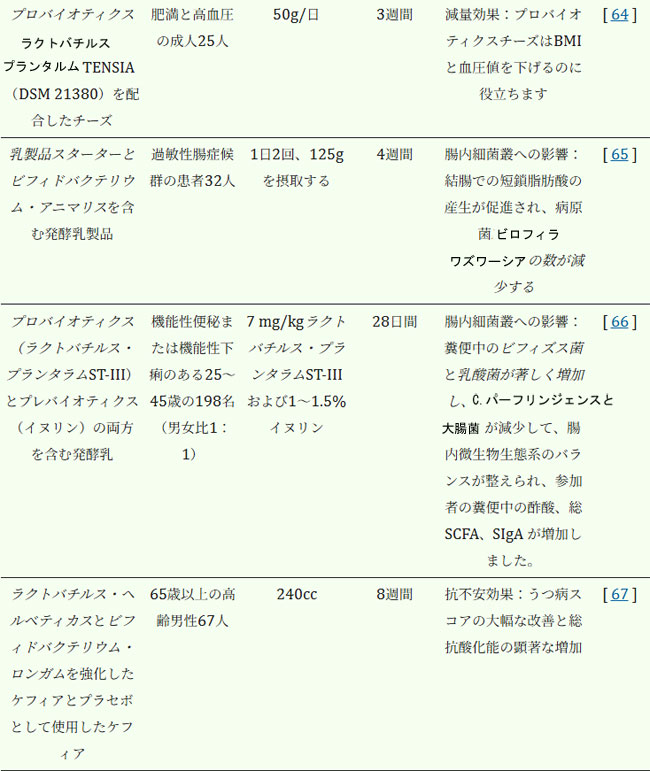
| ケフィア、ヨーグルト、チーズなどの発酵乳製品は、新たな臨床エビデンスによって裏付けられた幅広い健康効果をもたらします。これらの製品は、肥満、糖尿病、心血管疾患の管理、腸の炎症やバリア機能不全の緩和、そして腸管脳相関を介した神経免疫系の調節において重要な役割を果たす可能性があります。表1は、臨床モデルにおける発酵乳製品が腸内細菌叢と宿主の健康に及ぼす役割をさらに詳細に示しており、これらの製品が腸内細菌叢と宿主の健康にどのような影響を与えるかについて、より具体的な臨床的知見を示しています。 |
| 表 1. 臨床モデルにおける腸内細菌叢と宿主の健康における発酵乳製品の役割* |
 |
 |
 |
 |
 |
 |
| * メタアナリシスの結果は提示されませんでした。 |
| 3.1. 肥満、糖尿病、および心血管疾患 |
| 新たな臨床データは、ケフィアが血糖管理における効果的な補助食品であることを裏付けています。2型糖尿病(T2DM)と新たに診断された成人男性42名を対象とした臨床試験では、ケフィア摂取が血糖コントロールに及ぼす影響が評価されました[70]。参加者は無作為に2つのグループに分けられ、一方のグループはメトホルミンのみを投与され、もう一方のグループは10週間にわたり、メトホルミンとケフィア1杯を併用投与されました[70]。この研究では、メトホルミンと併用してケフィアを摂取したグループは、メトホルミンのみを摂取したグループと比較して、空腹時血糖値とHbA1c値の両方が有意に低下したことが明らかになりました(p < 0.05)[70]。これらの変化は、インスリン感受性の向上、およびインスリン調節性グルコーストランスポーターであるグルコーストランスポーター4型(GLUT4)の末梢組織への移行増加と相関しており、ケフィアが腸内細菌叢を介した血糖コントロールに役割を果たしていることを示唆しています[58]。チリの成人を対象とした、検証済みのオンライン調査を用いた性別・年齢層別横断研究では、乳製品、特にチーズの摂取量が多いほど、肥満リスクが低下することが有意に示されました(調整OR 0.70、95%CI 0.51~0.96、p < 0.05)[71]。 6件のランダム化比較試験(n = 323)のメタアナリシスでは、ケフィアを4~12週間摂取すると、空腹時血糖値(WMD = −10.28; 95% CI: −16.53~−4.02; p = 0.001)が有意に低下し、血清インスリン(WMD = −2.87; 95% CI: −3.96~−1.78; p < 0.00001)も低下したが、血糖コントロールを測る重要な指標であるヘモグロビンA1c(HbA1c)の減少は統計的に有意なレベルには達しなかった(p = 0.08)[72]。 |
| メタボリックシンドロームのコホートでも同様の所見が観察されました。新たなエビデンスにより、ケフィアの摂取はメタボリックシンドローム患者の脂質プロファイルに有益な効果をもたらす可能性があることが示唆されています。62名を対象としたランダム化比較試験では、参加者は12週間にわたり毎日180 mLのケフィアまたは無発酵牛乳を摂取しました[59]。ベースラインのLDL-コレステロール値が130 mg/dLを超えていた被験者のうち、ケフィア群はLDL-コレステロールが7.6%、アポリポタンパク質Bが5.4%減少しましたが、これらの変化は牛乳群と比較して統計的に有意ではありませんでした[59]。さらに、アポリポタンパク質A1値はケフィア群で3.4%上昇したのに対し、牛乳群では2.4%減少しました(p = 0.03)[59]。メタボリックシンドロームの患者48名を対象としたランダム化比較試験では、参加者は12週間、ケフィアまたはヨーグルトを毎日均等に摂取するよう割り当てられました[60]。ケフィアを摂取したグループは、空腹時血糖値が95±9 mg/dLから83±8 mg/dL(p < 0.05)に有意に低下しましたが、HbA1c値には2つのグループ間で有意差は認められませんでした[60]。プロバイオティクス強化ヨーグルトも、用量依存的な代謝効果を発揮します。対照試験では、ラクトバチルス・アシドフィルスLa5とビフィドバクテリウム・ラクティスBb12を含むヨーグルトを1日300 g、6週間摂取したところ、従来のヨーグルトと比較して、LDコレステロールが7.45%(p < 0.05)、総コレステロールが4.54%低下し、動脈硬化指数も改善しました[73]。これらの脂質効果と一致して、プロバイオティクスヨーグルトは LDL/HDL 比を 3.13 ± 1.00 から 2.07 ± 0.71 (p = 0.016) に低下させることが示されていますが、トリグリセリドと総コレステロールの変化は有意ではありませんでした [61]。概して、メタアナリシスはプロバイオティクス乳製品が血糖値と脂質エンドポイントを改善できることを強調しており、コントロールが不十分な人やインスリン抵抗性のある人ではその効果がより強くなります [62]。12 件の RCT (合計 n = 684) を対象とした別のメタアナリシスでは、2 型糖尿病患者に毎日プロバイオティクスを補給すると、C 反応性タンパク質が 1.34 mg/L (95% CI -1.76 ~ -0.92、p < 0.00001) 低下し、全身性炎症の軽減を反映していることが示されました [74]。 |
| 発酵乳製品は、メカニズム的には複数の生理活性物質を産生します。発酵乳製品は、脂質代謝、血管緊張、炎症性シグナル伝達を調節する様々な生理活性化合物を含有し、心臓保護効果をもたらします。ヨーグルトやケフィアに天然に含まれる共役リノール酸(CLA)は、HMG-CoA還元酵素を阻害し、肝臓LDL受容体を活性化することで、コレステロール低下作用を発揮します[75,76]。研究により、短鎖脂肪酸、特に酪酸は、内皮細胞上のGPR43などのGタンパク質共役受容体を活性化することで抗炎症作用を発揮することが実証されています。この活性化はNF-κBシグナル伝達経路の阻害につながり、炎症性サイトカインや接着分子の発現を減少させます[77]。酪酸などの短鎖脂肪酸(スターター培養物と共生する常在菌の両方によって産生される)は、内皮細胞上のGPR43に結合してNF-κBシグナル伝達を抑制し、発酵乳製品を長期摂取すると血清CRPが10~25%減少する[78]。一方、33件のランダム化比較試験を対象としたメタアナリシスでは、共役リノール酸を豊富に含む乳製品の摂取後にLDLコレステロール値が有意に低下したことが報告されている(95%信頼区間-0.25~-0.11、p < 0.001)。[79] |
| 牛乳の摂取は通常、心血管疾患(CVD)リスクに大きな影響を与えません。しかし、発酵乳製品(ヨーグルト、チーズなど)は心血管疾患リスクを低下させ、心血管疾患に有益な可能性があることが研究で示唆されています[80]。多国籍PUREコホートでは、1日に2サービング以上の乳製品を摂取した人は、主要な心血管イベント(HR 0.84、95% CI 0.75–0.94、p = 0.0004)、心血管疾患による死亡(HR 0.77、95% CI 0.58–1.01、p = 0.029)、脳卒中(HR 0.66、95% CI 0.53–0.82、p = 0.0003)のリスクが低下しました。牛乳とヨーグルトの摂取はこれらの有益性とも関連していました[81]。一方、150人の健康な成人を対象とした研究では、ビフィドバクテリウム・アニマリス亜種ラクティス、ストレプトコッカス・サーモフィルス、ラクトバチルス・デルブルッキ(107 CFU/g)を含む発酵乳製品を30日間毎日摂取したところ、腸内細菌叢の多様性が全体的に増加し、食物イソフラボンをホルモンや心血管系に有益な可能性のある生理活性化合物であるエクオールに変換する能力を持つ種であるスラッキア・イソフラボニックコンバーテンスとアドラークレウツィア・エクオリファシエンスが著しく増加した[63]。肥満と高血圧を有するロシア人成人において、プロバイオティクスであるラクトバチルス・プランタラムTENSIA(DSM 21380)を配合したチーズは、BMI(p = 0.031)および血圧(p = 0.0640)の低下に反映され、メタボリックシンドロームの症状を有意に緩和した[64]。GWASデータの2標本メンデルランダム化解析では、遺伝的に予測されたチーズ摂取は、多血管性アテローム性動脈硬化症(冠動脈性、末梢血管性、その他の血管性AS)および様々なアテローム性動脈硬化性心血管疾患(冠動脈疾患、狭心症、心筋梗塞、心不全、完全虚血性脳卒中、末梢動脈疾患、認知障害など)のリスク低下と因果関係にあった[82]。中国カドゥーリー・バイオバンクと英国バイオバンクのデータを組み合わせた分析と最新のメタアナリシスの結果、乳製品の総摂取量が多いと、新規心血管疾患リスクが3.7%低下し、脳卒中リスクが6%低下することが明らかになりました[83]。これらの効果は主にチーズと低脂肪乳製品によるものでした。しかし、全乳は中国では冠動脈性心疾患(CHD)リスクを9%上昇させるのに対し、英国ではその関連は保護的でした[83]。 15件の前向き研究のメタアナリシスでは、チーズの摂取量が多い場合と少ない場合の比較が、総心血管疾患相対リスク0.90、95%信頼区間0.82〜0.99)、冠動脈性心疾患(相対リスク0.86、95%信頼区間0.77〜0.96)、および脳卒中(相対リスク0.90、95%信頼区間0.84〜0.97)のリスクと逆相関しており、非線形の用量反応関係では、チーズを1日あたり約40g摂取するとリスクが最大限に減少することが示された[84]。 |
| 宿主遺伝子はプロバイオティクスへの反応を調節する(FUT2分泌菌は、発酵乳製品摂取後にビフィズス菌の多様性とエンリッチメントがベースラインで高いことが示されている)。これは、個別化された有効性の必要性を強調している[85]。一方、ケフィアのような複雑なマトリックスにおいて、一過性スターター培養物(例:ストレプトコッカス・サーモフィルス)と持続性プロバイオティクス(例:ラクトバチルス・ラムノサスGG)を組み合わせることで、即時の代謝調節と持続的な微生物叢リモデリングの両方が実現する。したがって、今後の研究では、菌株と投与量の組み合わせを改良し、宿主遺伝子修飾因子を解明し、宿主遺伝子型解析、メタゲノミクス、メタボロミクス、血管イメージングなどの精密栄養アプローチを統合することで、発酵乳製品製剤を最適化し、代謝の健康と心血管リスクの最大低減を実現する必要がある。 |
| 3.2. 腸の炎症とバリア機能障害 |
| プロバイオティクスを豊富に含む発酵乳製剤は、特に炎症性腸疾患(IBD)において、腸の炎症を緩和し、上皮細胞の完全性を回復させるという明確な効果を示している(表1)。デキストラン硫酸ナトリウム(DSS)誘発性大腸炎モデルにおいて、ラクトバチルス・ラムノサスGG発酵乳は組織病理学的スコアを低下させ、結腸長を維持した。これらの効果は、上皮細胞のEGFR/Aktシグナル伝達を活性化し、サイトカインおよび酸化ストレス誘発性のタイトジャンクション破壊を阻害するラクトバチルス・ラムノサスGG由来タンパク質p40およびp75によるものと考えられる[86]。ラクトバチルス・ラムノサスGGによって分泌される別のタンパク質HM0539は、TLR4/MyD88軸の制御とそれに続くNF-κB活性化を抑制し、結腸組織における炎症誘発性メディエーターの産生を阻害し、顕著な抗炎症作用を示す[87]。ケフィアなどの伝統的な発酵食品には、粘膜バリア機能を高め、大腸の炎症や腸管バリア機能障害を軽減するムチン分解常在菌であるアッカーマンシア・ムシニフィラがさらに豊富に含まれています[26,88]。 |
| 短鎖脂肪酸(主に酢酸、プロピオン酸、酪酸)は、発酵乳製品摂取後の腸管バリア強化における重要なメディエーターである(図2)。酪酸とプロピオン酸は、上皮細胞上のGPR43などのGタンパク質共役受容体のリガンドとして作用し、細胞内シグナル伝達を誘導し、ヒストン脱アセチル化酵素(HDAC)阻害、ヒストンのアセチル化増加、タイトジャンクション遺伝子(例:ZO-1、オクルディン)の転写活性化を引き起こす[89]。この分子カスケードは、上皮透過電気抵抗を高め、細胞間透過性を低下させ、代謝機能障害を有するコホートにおいて循環LPS濃度の20~30%の低下と相関する[90]。さらに、in vitro および in vivo 研究では、酪酸が Caco-2 単層細胞中の ZO-1 およびオクルディンタンパク質の発現を直接的にアップレギュレーションする一方で、短鎖脂肪酸による治療は炎症性刺激下でもバリアの完全性を維持することが確認されている [91]。動物モデルは、短鎖脂肪酸 によるバリア修復のメカニズムを証明している (図 2)。複数の乳酸菌 (ストレプトコッカス・サーモフィラス、ラクトバチルス・ブルガリクス、ラクトバチルス・プランタルムA3 など) で発酵させた牛乳から抽出した脂肪酸は、腸内細菌叢の改善 (アッカーマンシア や ラクトバチルスなどの有益な細菌の増加)、IL-6 および TNF-α の発現の減少、MAPK シグナル伝達経路における JNK リン酸化の阻害により炎症を緩和することで、マウスの DSS 誘発性大腸炎を軽減する [92]。 短鎖脂肪酸以外に、発酵乳製品由来の細胞外多糖類(EPS)、乳酸(LA)、発酵ホエイは、炎症性サイトカインを大幅に減らし、タイトジャンクションタンパク質(ZO-1、オクルディン、クラーディン-1など)の発現を促進し、腸管バリア機能を改善することで、結腸組織の炎症状態を緩和します[93,94]。 |
| これらの知見は、ヒトにおけるトランスレーショナルデータによって裏付けられています(表1)。ビフィドバクテリウム含有発酵乳製品を毎日摂取した過敏性腸症候群(IBS)患者28名を対象とした研究では、摂取開始11日後に腸内での短鎖脂肪酸(酪酸を含む)産生の増加、潜在的に病原性のあるビロフィラ・ワズワーシアの減少、過敏性腸症候群症状の改善が見られました[65]。さらに、複数菌株のプロバイオティクスヨーグルトを用いたランダム化クロスオーバー試験では、継続摂取によりウォッシュアウト期間中も短鎖脂肪酸産生とバリアタンパク質発現が上昇することが示され、積極的介入を超えた持続的な効果が示唆されました[95]。プロバイオティクスとポストバイオティクス化合物の相乗効果は、抗炎症効果を増強します。機能性便秘または下痢の被験者がラクトバチルス・プランタラムST-IIIとイヌリンを含む共生発酵乳を14日間毎日摂取したところ、糞便中のビフィズス菌とラクトバチルスの菌数が有意に増加し、有害細菌(クロストリジウム・パーフリンゲンスと大腸菌を含む)が顕著に減少し、短鎖脂肪酸と分泌型IgAの値が上昇し、同時に腸内細菌叢のバランスと免疫機能が改善した[66]。 |
| 今後の研究では、縦断的なヒト試験を活用し、メタゲノミクス、メタボロミクス、機能的読み取りを組み合わせたマルチオミクスを精密プロバイオティクス戦略と統合して、短鎖脂肪酸生成を最適化し、菌株固有の効能を明らかにし、発酵パラメータ(菌株の選択、基質組成、処理条件)を改善し、それによって炎症性腸疾患(IBD)および関連する炎症性疾患における腸バリアサポートを最大限にするようにカスタマイズされた発酵乳製品処方を開発する必要があります。 |
| 3.3. 神経免疫調節 |
| 神経活性ポストバイオティクスおよび発酵乳製品由来の代謝物は、腸-脳軸を介して抗不安作用および抗神経炎症作用を発揮することが明らかになりつつある(表1)。マウスモデルにおいて、ケフィアの補給は、糞便中の酪酸産生細菌、特にラクノスピラ科およびラクノクロストリジウムの増殖を促進することにより、動物のマイクロバイオームを著しく増強することが明らかになった[96]。同時に、ケフィアは糞便中の微生物叢の組成と大腸および脳における短鎖脂肪酸産生(特に酪酸およびプロピオン酸)の両方を調節し、それによって微生物叢-腸-脳軸を調節し、最終的には脳の健康状態を改善する[96]。自閉症マウスモデルでは、ケフィア介入により腸内細菌叢の再形成、免疫機能の改善、反復的な定型行動の減少が見られ、細菌叢-免疫-脳軸を介した抗不安作用と行動調節作用が実証されました[97]。別のランダム化二重盲検プラセボ対照臨床試験では、ケフィア発酵中のビフィドバクテリウムとラクトバチルスの特定の株による8週間の介入後、高齢者のうつ病スコアは有意に改善しましたが、炎症性および酸化ストレスマーカーへの影響は限られていました[67]。基本的なメカニズムは、異なる供給源からのケフィアが、全身免疫と結腸および腸内細菌叢の5-HTシグナル伝達経路に異なる影響を与え、それによって報酬関連行動を調節することを示唆しています[67]。これは発酵飲料自体が複雑な「ポストバイオティクス」であることを示しています[67]。 |
| 発酵乳製品の代謝物は、神経免疫への影響を伴う適応免疫を調節する。γ-アミノ酪酸(GABA)強化発酵乳は、脳内および循環血中のγ-アミノ酪酸濃度を上昇させ、酸化ストレスの軽減、PI3K/AKT/mTORおよびGABAB-cAMP-PKA-CREBシグナル伝達経路の調節、腸内細菌叢の再構築により、げっ歯類の老化モデルにおいて気分と認知機能を改善する[98,99,100]。ヒトでは、ヨーグルトとチーズの摂取量が多いほど、大学生のスピルベルガー状態特性不安評価尺度(STAI)3で測定された不安スコアが低くなることと相関しており、発酵乳由来γ-アミノ酪酸のトランスレーショナルな関連性を示唆している[101]。新たな研究では、腸-脳経路における協調的なγ-アミノ酪酸濃度の変動と微生物コミュニティの再構築が、神経心理学的調節機構に相乗的に影響を及ぼすことが明らかになっている[102]。 |
| 発酵由来ペプチドは神経免疫恒常性をさらに増強する。高齢マウスに発酵乳製品由来のトリプトファン-チロシン(WY)ペプチド(10 mg/kgを14日間)を経口投与すると、海馬におけるリポ多糖(LPS)誘導性ミクログリア炎症反応が抑制され、長期増強(LTP)障害および認知機能低下が改善されることから、このポストバイオティクスペプチドセグメントには抗神経炎症作用があることが示唆されている[103]。慢性ストレスマウスモデルにおいて、ラクトバチルス・ガセリ505発酵乳由来のPep14/21を前処理すると、視床下部-下垂体-副腎(HPA)軸関連遺伝子およびタンパク質の発現が低下し、大腸炎症マーカーが減少し、不安様行動が有意に改善することから、発酵乳由来ペプチドが脳-腸軸に対して双方向の調節作用を示すことが明らかになった[104]。 |
| 発酵乳製品の神経免疫への効果を包括的に理解するには、3つの主要なアプローチが不可欠です。(1) メタゲノム、メタボロミクス、神経イメージングデータを統合し、微生物株やγ-アミノ酪酸、短鎖脂肪酸などのポストバイオティクスと脳機能を関連付ける[96,101]、(2) γ-アミノ酪酸などの神経活性化合物の産生を高めるための発酵パラメータの最適化[103,104]、(3) 個々の反応に影響を与える宿主の遺伝的およびエピジェネティック因子の特定[98,99,100]。これらの戦略は、発酵乳製品を標的とした神経免疫介入へと転換する、精密栄養学の基盤となります。 |
| 4. 有効性を調節する因子 |
| 4.1. 菌株特異性 |
| 発酵乳製品の治療効果は、構成するプロバイオティクス菌株の遺伝的および機能的多様性に左右されます。単一種内においても、ゲノムにコードされた形質が重要な生存能力と定着能力を左右します。例えば、ラクトバチルス・ラムノサスGGは優れた耐酸性と粘液付着性(SpaCBA線毛を介した)を示し、投与後最大1週間まで糞便中に回収されます[105,106]。腸管模倣条件下での比較トランスクリプトミクスにより、ラクトバチルス・プランタラムWCFS1は菌体外多糖(EPS)生合成遺伝子をアップレギュレーションし、バイオフィルム形成を促進する一方、ラクトバチルス・アシドフィルスNCFMは胆汁酸塩加水分解酵素(BSH)の産生を優先し、独自の基質特異性を持つ2つの異なるbsh遺伝子座(bshAおよびbshB)を介して胆汁耐性を付与することが明らかになった[107,108]。これらの機能的特異性は、菌株の生存だけでなく、抗菌代謝物の分泌能力や宿主免疫の調節にも影響を与える。 |
| 複数種製剤における菌株間の相互作用は、健康効果をさらに向上させます。ストレプトコッカス・サーモフィラスとラクトバチルス・デルブルッキ亜種ブルガリクスの共生関係はよく知られており、相乗効果をもたらすパートナーシップは、ラクトバチルス・デルブルッキ亜種ブルガリクスが乳タンパク質をペプチドと遊離アミノ酸に分解し、ストレプトコッカス・サーモフィラスが葉酸とギ酸を供給してパートナーの成長を刺激し、代謝産物の生合成を促進するという、相互摂食のダイナミクスの好例です[109,110]。逆に、競合的または拮抗的なダイナミクスが出現する可能性もあります。特定のビフィズス菌株は、併用する乳酸菌の働きを阻害する有機酸またはバクテリオシンを産生するため、適合性スクリーニングの必要性が強調されます[111]。乳酸菌と酵母を組み合わせた伝統的なケフィアコンソーシアムは、人工微生物コミュニティが複数の代謝経路を活用して抗菌スペクトルを拡大し、回復力を高めることができる例です。 |
| 宿主と微生物の適合性は、個別化をさらに進める要素です。株の生着と機能的影響は、ベースラインの微生物叢構成などの個々の要因に依存します。ラクトバチルス・パラカゼイCNCM I-1518、CNCM I-3689、およびラクトバチルス・ラムノサスCNCM I-3690を含む健康な被験者でのランダム化比較試験では、全体的な微生物叢のα/β多様性に有意な変化は見られませんでした[68]。しかし、異なる用量での各候補株のコロニー形成量、および機能ゲノムへの寄与には有意な差が見られました[68]。全ゲノム比較解析により、ストレプトコッカス・サーモフィラスの異なる株は、酵母多糖類、乳糖代謝、およびストレス耐性に関連する遺伝子において遺伝子型の違いがあり、それが宿主内での生存および機能的パフォーマンスの違いにつながる可能性があることが示されています[112,113,114]。これらの多様な特性は、ストレプトコッカス・サーモフィラスに対する様々な介入につながり、微生物叢の構造、ムチンの変化、そして宿主の代謝に様々な程度の影響を与えます。これは、同じ種内であっても、異なる株のプロバイオティクス効果が大きく異なることを示しています[112,113,114]。メタゲノムプロファイリングと機械学習に基づく予測モデリングの進歩により、宿主と微生物叢の相互作用に合わせた精密なプロバイオティクス介入の設計が可能になり、次世代の発酵乳製品療法への道が開かれています。 |
| 4.2. 宿主の個体差 |
| ベースラインの腸内細菌叢構成における個人差は、発酵乳製品を用いた介入の有効性を決定的に左右する。ベースラインにおける微生物のα多様性が高い参加者は、一貫してプロバイオティクス補給に対してより顕著な反応を示す[115,116]。例えば、部分加水分解グアーガムを用いた対照試験では、シャノン指数が3以上の「反応者」は有意な症状緩和と微生物相の変化を経験したのに対し、多様性が低い参加者は変化が最小限であった[115]。この研究は食物繊維に焦点を当てているが、発酵乳製品を用いた介入によるプロバイオティクスについても同様のパターンが報告されている。ヒトにおいて、プロバイオティクス株は、便中のプロバイオティクスの検出ではなく、各個人のベースラインの宿主および微生物相のプロファイルによって、部位および株依存的に非常に個別化された方法で腸粘膜に定着する[116]。この定着プロセスは、粘膜コミュニティの構成と腸内遺伝子発現において、短期的で個別的な変化を引き起こすに過ぎない[116]。抗生物質投与後のプロバイオティクスの補給は、腸内細菌叢を普遍的に回復させたわけではなかったが、宿主依存性が顕著であり、宿主因子が腸内細菌叢に決定的な影響を与えることを実証した[117]。 |
| 宿主遺伝子はパーソナライゼーションをさらに深化させ、α1,2-フコシルトランスフェラーゼ2(FUT2)「分泌型」遺伝子型がプロバイオティクスの生着と機能の重要な決定因子として浮上しています。分泌型であることは、機能的なα1,2-フコシルトランスフェラーゼ2(FUT2)によって定義されます[85]。α1,2-フコシルトランスフェラーゼ2は、常在菌の基質および接着部位として機能するフコシル化粘膜グリカンの発現を制御します[85]。非分泌型(rs601338 G428Aなどの不活性化α1,2-フコシルトランスフェラーゼ2アレルのホモ接合体)では、ビフィドバクテリウム属細菌の個体数と多様性が著しく減少し、発酵乳製品中のプレバイオティクスオリゴ糖の代謝能力が低下します[85]。 α1,2-フコシルトランスフェラーゼ2分泌型遺伝子型はビフィドバクテリウム群集の豊富さと密接に関連しており、粘膜糖化が宿主の遺伝的決定因子として腸内細菌叢の形成に影響を及ぼすことが明らかになっている[85]。乳児と成人の両方において、非分泌型状態は粘膜関連ビフィドバクテリウムの低レベルおよび炭水化物代謝経路の変化と相関しており、短鎖脂肪酸の産生とバリア機能の低下につながる[118]。これらの遺伝的影響はα1,2-フコシルトランスフェラーゼ2だけにとどまらず、宿主の遺伝的変異が微生物の表現型の多様性を促進し、遺伝子状態が複数の分類群および系統にわたる微生物叢の構成を形作る[119]。しかし、これらの多型性と発酵乳製品の結果を関連付ける決定的な臨床データは依然として限られている。 |
| 宿主と微生物の相互作用をパーソナライズされた栄養に統合するには、3つの補完的な戦略が不可欠です。まず、ベースラインの微生物叢プロファイリング(エンテロタイプ分類とα多様性指標)により、特定の発酵乳製品配合から最も恩恵を受ける可能性の高い個人を特定できます[115,116]。 第二に、宿主遺伝子型解析を組み込むと、プロバイオティクスとスターターの生着と代謝を制御する粘膜の糖化と免疫応答が明らかになり、これらの予測が精度向上します [65,66,67,68,85,86,87,88,89,90,91,92,93,94,95,96,97,98,99,100] |
| [101,102,103,104,105,106,107,108,109,110,111,112,113,114,115,116,117,118]。 |
| 第三に、マルチオミクスデータセット(メタゲノミクス、メタボロミクス、宿主ゲノミクス)と機械学習アルゴリズムを用いた予測モデリングにより、菌株の選択、投与量、マトリックス組成を動的に調整し、微生物のシフトと健康アウトカムを維持することが可能になります[68,107,108]。これらの要素を統合することで、精密発酵戦略は、集団全体への推奨から、腸内生態系の調節と臨床効果を最適化する真に個別化された介入へと移行することができます。 |
| 4.3. 発酵プロセスと組成 |
| 発酵パラメータと製品組成は、乳製品マトリックスが腸内細菌叢をどのように形成し、健康効果をもたらすかを決定づける重要な要素です。伝統的な自然発酵は、原料または地域環境に存在する土着の微生物群集を利用して生化学的変換を開始・促進します[119]。得られた製品は、微生物および化学組成の多様性に富んでいますが、バッチ間のばらつきが大きく、望ましくない微生物が増殖した場合の安全性への懸念も生じます[119]。一方、工業的発酵では、定義されたスターター培養物と厳密に管理された処理条件(温度、pH、酸素、栄養供給)を用いて、生産性、一貫性、安全性を最大限に高めます[119,120]。スターター培養物内の菌株の多様性は、多種多様な菌株間の相互作用によって証明されるように、機能的な成果を左右します[120]。具体的には、ラクトバチルス、ロイコノストック、ラクトコッカス、酵母からなるケフィア関連菌群は、より広範な代謝物(例えば、短鎖脂肪酸、菌体外多糖類、生理活性ペプチド)を生成し、マウスおよびヒトモデルの両方で微生物の多様性と腸管バリア機能を高めます [120]。また、乳マトリックスの組成(脂肪含量、タンパク質構造、プレバイオティクスオリゴ糖)は、微生物の増殖と代謝物のバイオアベイラビリティに影響を及ぼします。脂肪含量はプロバイオティクスの増殖速度と正の相関関係にあります。高脂肪乳製品はスターターの発酵活性を著しく高めます [121]。最後に、発酵後の処理(熱処理、噴霧乾燥)は、微生物の生存率と代謝物の安定性を変化させる可能性があります。低温殺菌ケフィアは、生存率が低下したにもかかわらず、菌体外多糖類によるIL-10誘導を維持しており、非生存性ポストバイオティクスは機能を維持することを示しています [28]。 |
| 微生物生態学と分析技術の進歩を活用することで、乳製品発酵のあらゆる段階を意図的に設計し、健康効果を最適化できるようになりました。相補的な細菌株と酵母株を組み合わせた、カスタマイズされたスターターコミュニティを設計することで、短鎖脂肪酸、生理活性ペプチド、多糖類の正確なブレンドを生成することができます[121]。発酵条件(温度、pH、時間)を微調整することで、代謝経路を目的の産物へとさらに誘導し、乳マトリックス(脂肪、タンパク質、オリゴ糖の組成)を調整することで、微生物の増殖と代謝産物の利用可能性を調整できます[119,120]。最後に、適切な後処理(穏やかな低温殺菌や精密濾過など)により、安全性や保存安定性を損なうことなく、重要なポストバイオティクスが保存されます[119,120]。この統合されたデータ駆動型のアプローチにより、本物の風味を再現するだけでなく、腸の調整、抗炎症、代謝のメリットをターゲットにした発酵乳食品が生まれ、機能性食品設計の新たな基準を確立します。 |
| 5. 現在の研究の限界と今後の方向性 |
| 5.1. 短期効果の優位性 |
| 発酵乳製品介入に関する現在の臨床試験は、圧倒的に短期的なデザイン(4~12週間)を採用しており、持続的な微生物叢の調節と長期的な健康効果に関する知見が限られています。最近のシステマティックレビューでは、プロバイオティクス強化乳製品マトリックスと非プロバイオティクス対照群を比較した52件のランダム化比較試験(RCT)が特定されました。そのうち80%以上が8~12週間の介入期間を設け、糞便中の短鎖脂肪酸濃度、炎症性サイトカイン(IL-6、TNF-α)、または乳酸菌の一時的な増加といった急性エンドポイントを評価しました[8]。既存の研究では、発酵乳製品に対する急速な代謝および免疫学的反応が確認されていますが、微生物群集の再構築が摂取中止後も持続するかどうか、また、長期曝露下での慢性疾患(例:メタボリックシンドロームや炎症性腸疾患(IBD))の進行については未解明のままです。さらに、急激な摂取中止がリバウンドによる腸内細菌叢の異常を誘発する可能性については、現在の研究の枠組みでは未だ考慮されていない[8]。 |
| 短期ランダム化比較試験への依存は、いくつかの重大な限界をもたらします。第一に、食事介入はしばしば腸内細菌叢の急速な変化を引き起こし、介入終了後すぐにベースラインに戻ります。発酵食品試験のレビューは、永続的な健康推奨を行う前に長期的な研究の必要性を強調しています[122]。また、潰瘍性大腸炎における糞便細菌叢移植研究でも、短期的な効果は継続的な治療なしではしばしば減衰することが示されています[123]。第二に、短期研究では適応的な微生物-宿主動態が考慮されていません[124]。例えば、ナイシンなどの乳製品由来のバクテリオシンへの長期曝露は、耐性病原体サブポピュレーションを選択する可能性がありますが、このリスクは12週間の試験では評価されていません[124]。第三に、フィルミクテス/バクテロイデス比のような重要なマイクロバイオームのバイオマーカーは、数ヶ月にわたって個人内変動が大きく、短期的なスナップショットでは長期的な代謝結果を信頼できない予測指標となる[124]。 |
| これらの制約を乗り越えるためには、今後の研究では縦断的かつ適応的な試験設計と統合的なバイオマーカー戦略を採用する必要がある。長期の介入・離脱サイクル(例:6ヶ月間の投与と3ヶ月間の休薬)は、微生物叢の回復力と宿主の「代謝記憶」を解明するだろう[125]。メタゲノムシーケンシング、短鎖脂肪酸(SCFA)および胆汁酸の標的メタボロミクス、免疫調節遺伝子座におけるDNAメチル化解析などの宿主エピゲノムプロファイリングを組み合わせたマルチオミクス統合は、発酵乳製品の摂取によって活性化される持続的な調節ネットワークの包括的なマッピングを可能にする[125]。このアプローチは、微生物の機能ダイナミクス、代謝産物を介したシグナル伝達、および宿主のエピジェネティックリプログラミングを体系的に結び付け、持続的な免疫代謝適応を解明する[125]。最後に、多様な栄養環境(高繊維食と高脂肪食)における12ヶ月間の観察コホート研究を通して、現実世界の食生活の文脈化を行うことで、習慣的な摂取パターンが効能にどのような影響を与えるかを明らかにする[125]。発酵乳製品が単なる一時的な調節因子として機能するのか、それとも慢性疾患の予防と管理のための基礎的な食事療法として機能しうるのかを明らかにするためには、これらの設計とバイオマーカーのギャップに対処することが不可欠である。 |
| 5.2. 不明瞭なメカニズム:因果関係の確立における課題 |
| 多くの研究で、発酵乳製品摂取が腸内細菌叢の変化と健康改善を結びつけていますが、直接的な因果関係を確立することは依然として困難です。観察研究や短期介入では、ラクトバチルス菌レベルの上昇が血糖値の改善や糞便中のカルプロテクチンの減少と関連しているなど、微生物と宿主の相関関係が頻繁に特定されていますが、これらの関連性から、腸内細菌叢の変化と臨床転帰、あるいは食事中の生理活性成分による宿主を介した効果との因果関係を明らかにすることはできません[126]。例えば、腸内細菌叢の乱れはメタボリックシンドロームや炎症性腸疾患(IBD)と強く結びついていますが、横断的解析では時間的な関係について明確な結論は出ていません。微生物の異常は、病態の引き金となる場合もあれば、疾患によって引き起こされる環境変化への適応として生じる場合もあります[126]。この限界は、ディスバイオティック状態が病態に先行するのか、それともその下流の結果なのかを明らかにするために、縦断的研究デザインの必要性を強調している[126]。同様に、食事誘発性の短鎖脂肪酸の増加は、腸内細菌叢の変化を反映している可能性もあれば、外因性菌株による食物繊維の直接的な発酵を反映している可能性もあり、この曖昧さがメカニズムの解釈を困難にしている[4]。 |
| 動物モデル(無菌(GF)マウスと抗生物質を投与したげっ歯類)は、因果関係を調査するための制御された環境を提供しますが、トランスレーショナルリサーチの限界があります。腸内細菌叢が存在しないため、無菌マウスは免疫系が未発達で、腸の構造と機能が異常であり、代謝調節が制限されており、不安様行動を示します[127,128]。これらの特徴により、無菌マウスは腸内細菌叢と宿主の相互作用を研究するための強力なツールとなりますが、ヒトの生理学的状態のシミュレーションへの適用には限界もあります[127,128]。抗生物質誘発性の腸内毒素症を用いた実験モデルは、高用量で広域スペクトルのレジメンに依存することが多く、微生物コミュニティの非選択的な枯渇を引き起こし、ヒト研究で観察される段階的な食事介在性の生態学的変化とは異なるアーティファクトを生み出します[127,128]。これらの方法論的枠組みは、粘膜免疫応答、腸管運動のダイナミクス、ホルモン変動といった、相互制御機構を通じて微生物群集と動的に相互作用する重要な宿主因子をしばしば見落としている[127,128]。その結果、宿主と微生物の相互依存性を解明できないため、健康アウトカムの因果関係を微生物のメカニズムのみに帰属させることが困難になる。 |
| 発酵乳製品研究における因果関係のギャップを埋めるためには、マルチオミクスとシステム生物学の統合が不可欠となっている。近年のマルチオミクス統合の進歩は、メタゲノムシーケンシングと非標的メタボローム解析を組み合わせることで、酪酸や免疫調節性インドール誘導体などの機能的に重要なポストバイオティクス代謝物への微生物生合成遺伝子クラスターの体系的なマッピングが可能になることを示している [129,130]。同時に、宿主由来の多層データセット(トランスクリプトームプロファイルや免疫関連DNAメチル化パターンなどのエピゲノム修飾にまたがる)は、微生物コミュニティが宿主における長期的な免疫・代謝適応を調整する持続的な制御メカニズムを明らかにする [129,130]。これらの分子論的知見に基づき、固定株コンソーシアムと定義された代謝物出力を含む標準化された発酵乳製品製剤を用いた厳密に管理されたヒトクロスオーバー試験によって、用量反応関係を明らかにすることができる [69]。これらの試験は、腸内細菌叢と代謝プロファイルが時間の経過とともにどの程度安定しているかを明らかにすることもできます[69]。例えば、ビフィドバクテリウム・ビフィダムYIT 10,347を含む発酵乳を対象とした二重盲検プラセボ対照クロスオーバー試験では、胃腸機能と腸内代謝プロファイルに有意な改善が見られ、その効果はウォッシュアウト期間を通して持続したことから、段階的な介入・離脱設計の価値が強調されました[69]。 |
| 最後に、無菌またはヒト化げっ歯類モデルを用いた合成微生物生態学的アプローチにより、特定の代謝物の因果関係を検証することができます。クローン病患者の微生物叢に酪酸産生細菌(例えば、フェカリバクテリウム・プラウスニッツィと6種類の酪酸産生細菌の混合物)を補充したところ、酪酸産生が大幅に増加し、in vitroで上皮バリアの完全性が改善されました[131]。この研究は、酪酸産生細菌が腸の健康に有益な効果をもたらすことを直接的に証明しています[131]。研究者らは、酪酸産生菌株の有無にかかわらず腸内微生物叢コンソーシアムを設計し、相関関係を超えて、酪酸が腸内バリアを強化し、炎症誘発性シグナル伝達を阻害することを直接的に実証し、因果メカニズムを証明しました[131]。 |
| 5.3. 個別化介入 |
| 個々の腸内細菌叢プロファイルを活用した精密栄養は、発酵乳製品のメリットを最大化する方法を提供します。マルチオミクス(メタゲノミクス、メタボロミクス、宿主ゲノミクス)を統合することで、反応者と非反応者を層別化する予測的な微生物叢バイオマーカーの同定が可能になります[132]。例えば、バクテロイデス優勢型エンテロタイプは、ケフィア摂取後の短鎖脂肪酸産生の増加と関連付けられています[132]。最近の試験では、ベースラインの微生物多様性と胆汁酸塩加水分解酵素遺伝子座などの機能的遺伝子クラスターを活用して、発酵乳による代謝改善を予測しています[133,134]。精密発酵乳製品介入をリアルタイムで実施するには、技術革新が不可欠です。スマートフォンに接続できる携帯型ナノポアシーケンサーにより、自宅で毎週腸内マイクロバイオームのプロファイリングが可能になり、即時のフィードバックに基づいて適応的な食生活の調整が可能になります。さらに、機械学習、媒介分析、メンデルランダム化といった高度な分析手法は、発酵乳製品の摂取計画をカスタマイズするための実用的なアルゴリズムを提供します[135]。最後に、機能性食品の3Dプリントを通じて、特定のプロバイオティクス株を個別化されたプレバイオティクスマトリックスに埋め込むことで、プロバイオティクスの定着と代謝産物の生成を促進することができます[135]。 |
| これらの進歩にもかかわらず、依然として重要な課題が残っています。(1) データ解釈とプライバシー:消費者は複雑なマイクロバイオームレポートに圧倒される可能性があり、データの所有権と同意に関する堅牢な枠組みが欠如しています[133,134,135]。(2) パーソナライズされた発酵乳製品の規模拡大には、pH、温度、基質供給をリアルタイムで制御できるモジュール式バイオリアクターに加え、血糖モニタリングや微生物叢シーケンシングなどの継続的なバイオデータを統合し、適応的な食事フィードバックを提供するアルゴリズム栄養プラットフォームが必要です[133,134,135]。このセンサーネットワークパラダイムにより、発酵乳製品は一般的なプロバイオティクス製剤の枠を超え、将来的には炎症性調節異常の管理に特化した神経代謝プログラムされた治療マトリックスとして発展する可能性があります。 |
| 5.4. マルチオミクス統合 |
| メタゲノミクス、メタボロミクス、トランスクリプトミクスを統合することで、発酵乳製品への介入に対する宿主-微生物叢間の因果関係を明らかにする比類のない枠組みが提供される[136,137,138]。メタゲノミクスは、微生物の全DNAを配列決定し、短鎖脂肪酸生合成経路をコードする遺伝子クラスターなど、種特異的な遺伝子クラスターを同定することにより、分類学的および機能的ブループリントの両方を提供する[136,137,138]。メタボロミクスは、界間シグナル伝達のメディエーターとして機能する微生物および宿主の代謝物(短鎖脂肪酸、胆汁酸、インドール誘導体)を定量化することで、これを補完する[136,137,138]。トランスクリプトミクスは、宿主組織や微生物集団における動的な遺伝子発現を捉え、食事中のポストバイオティクスがどのように上皮細胞と免疫細胞の反応をリアルタイムで調節するかを明らかにします[136,137,138]。 |
| QIIME 2(Quantitative Insights Into Microbial Ecology 2)、MOTHUR、MetaPhlAn(Metagenomic Phylogenetic Analysis)などのバイオインフォマティクスツールは、マルチオミクス統合をサポートし、16S rRNA遺伝子、ショットガンメタゲノム、メタトランスクリプトミクス、メタボロミクスのデータセットを統一されたフレームワーク内で同期処理することを可能にします[130]。ランダムフォレストからメタ学習モデルに至るまでの機械学習フレームワークは、これらの高次元データセットを統合するためにますます適用されており、ベースラインのマルチオミクスプロファイルに基づいて発酵乳製品に対する個別化された反応を予測することを可能にします[139]。その期待にもかかわらず、マルチオミクス統合は、プラットフォーム間のバッチ効果、新規微生物遺伝子の不完全な参照データベース、および異なるデータタイプを調和させるための計算の複雑さなどの課題に直面しています[139]。将来的には、研究の優先事項として、時間分解能を向上させるための縦断的サンプリング、細胞タイプ特異的な反応を解明するための空間分解オミクス技術(単一細胞トランスクリプトミクスやレーザーマイクロダイセクションなど)の活用、そして再現性を高めるための標準化されたデータフォーマットの確立に重点を置くべきである。これらの課題を克服することで、統合型マルチオミクスアプローチは発酵乳研究におけるメカニズムの解明をもたらし、個々の宿主-微生物生態系に応じて処方をカスタマイズする精密栄養戦略に情報を提供するだろう。 |
| 6. 結論 |
| 発酵乳製品は、複数の相補的メカニズムを通じて腸内微生物生態系を調節することが一貫して示されている。ラクトバチルス、ビフィドバクテリウム、フェカリバクテリウム・プラウスニッツィなどの有益な菌群を豊富に含み、菌群の多様性と機能的レジリエンスを高める[140]。その複雑なマトリックスは、生きたプロバイオティクス株と発酵由来のポストバイオティクス(短鎖脂肪酸、生理活性ペプチド、細胞外多糖類、バクテリオシン)を供給し、タイトジャンクションタンパク質の発現と免疫細胞の活性化を介して粘膜バリアの完全性を相乗的に高める[9,141]。臨床解析では、ヨーグルトまたはケフィアの定期摂取が、メタボリックシンドローム、高血圧、および過敏性腸症候群(IBS)の患者群において、空腹時血糖値、LDLコレステロール、血圧、および全身性炎症マーカーを有意に低下させることが示されており、その効果の大きさは菌株の組成と投与量によって調節される[62,65,79,81]。さらに、発酵乳製品の摂取は生体内での短鎖脂肪酸産生を促進し、大腸細胞のエネルギー源となる大腸内の酪酸およびプロピオン酸濃度を上昇させることで、前臨床大腸炎モデルにおける炎症誘発性シグナルを抑制し、バリア機能を強化することが報告されている[134,142]。 |
| 発酵乳製品の効能は、複数の調節因子によって大きく左右されます。菌株間のゲノム的および機能的な異質性は、生存、接着、および代謝プロファイルを決定します[106,143]。例えば、ラクトバチルス・ラムノサスGG SpaCBA線毛は、一過性スターターと比較して優れた粘液結合能を有し、一方、ケフィア中のストレプトコッカス・サーモフィルスと酵母コンソーシアムは、相互共生的なクロスフィーディングを通じてポストバイオティクススペクトルを拡大します[106,143]。宿主因子、例えばベースラインのエンテロタイプ、α1,2-フコシルトランスフェラーゼ2(FUT2)分泌遺伝子型、消化管通過時間、粘膜のグリコシル化などは、プロバイオティクスの生着と反応の程度を決定づけるため、臨床試験への介入前に微生物叢と遺伝子プロファイリングを実施することの重要性が浮き彫りになっています[115,116,117,118]。発酵パラメータ(pH、温度、基質比)と後処理(熱処理、精密濾過)は、ペプチド収量と短鎖脂肪酸組成をさらに形作り、機能的出力をカスタマイズするための手段となります[9,120,121]。メタゲノミクス、メタボロミクス、ペプチドミクス、トランスクリプトミクスを統合することで、研究者は株と用量の相互作用や宿主と微生物の代謝ネットワークをマッピングし、発酵乳製品を個々のプロファイルに合わせて調整する精密な栄養フレームワークを構築することができます[132,133,134]。 |
| こうした進歩にもかかわらず、重大な知識ギャップが依然として存在しています。臨床試験のほとんどは短期(4~12週間)にとどまっており、微生物シフトの持続性と長期的な健康転帰に関する知見は限られています。レジリエンス(回復力)と代謝記憶を評価するには、介入と離脱を繰り返す長期設計と1年間の観察コホートが必要です[8,122,123,124]。特定のポストバイオティクス代謝産物と臨床エンドポイントを結び付ける因果メカニズムは、ヒト化モデルにおける人工コンソーシアムと、標準化されたマトリックスを用いた厳密に管理されたクロスオーバー試験による検証が必要です[107,108,109,110,134]。個別化された有効性には、ベースラインのマルチオミクスと宿主遺伝学を統合した予測アルゴリズムが必要であり、カスタマイズされた発酵乳製品のスケーラブルな生産には、モジュール式バイオリアクターとリアルタイムの微生物モニタリングが必要です[133,134,135]。発酵乳製品を伝統的な食品から代謝、炎症、神経免疫疾患の標的治療法へと変革するには、縦断的なマルチオミクス研究、精密介入試験、データ駆動型発酵設計が必要である[132,133,134,135]。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Foods. 2025 May 29;14(11):1946.に掲載されたFermented Dairy Products as Precision Modulators of Gut Microbiota and Host Health: Mechanistic Insights, Clinical Evidence, and Future Directions.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


