ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
アルツハイマー病における腸内細菌叢-腸-脳軸の調節異常と プロバイオティクス補給によるその調節 |
Moira Marizzoni et al., Brain, Behavior, and Immunity Volume 131, January 2026, 106138 |
|
|
| 要約 |
背景:腸内細菌叢-腸管-脳軸は、アルツハイマー病(AD)の病態生理に関与していることが示唆されている。プロバイオティクスは、様々なマウスモデルにおいて、おそらく腸内細菌叢-腸管-脳軸の調節を介してアルツハイマー病の進行を抑制したが、ヒトにおけるデータは依然として限られている。 |
| 目的:本研究では、腸内細菌叢、炎症誘発性マーカー、およびその他の腸内細菌叢-腸管-脳軸メディエーターの差異が、疑似アルツハイマー病(アルツハイマー病の疑いのある患者)の発症と関連しているかどうかを評価した。また、12週間のプロバイオティクス投与が腸内細菌叢-腸管-脳軸に及ぼす影響も評価した。 |
| 方法:ブレシア(イタリア)のIRCCS Istituto Centro San Giovanni di Dio Fatebenefratelliにおいて、疑似アルツハイマー病患者45名と健常者47名を登録した。疑似アルツハイマー病群における12週間のプロバイオティクス補給の効果を検証するため、非対照臨床試験を実施した。糞便微生物叢の構成、腸管および血中の炎症マーカー、および微生物叢関連代謝物は、全参加者において補給前、疑似アルツハイマー病患者においてのみ補給後に評価された。 |
| 結果:疑似アルツハイマー病患者は、健常者(HC)と比較して、腸の炎症、腸内細菌叢プロファイルの変化、血中トリプトファン代謝の変化、およびグルタミン酸レベルの低下を示した(p値<0.049)。プロバイオティクス補給はこれらの変化を部分的に調節し、疑似アルツハイマー病において、いくつかの炎症誘発性メディエーターの減少と、酪酸などの腸内細菌叢関連保護因子の増加を示した(p値<0.040)。 |
| 結論:これらの知見は、アルツハイマー病における腸内細菌叢-腸管-脳軸の変化の存在を確認し、腸内細菌叢の構成ではなく機能の調節を介してプロバイオティクス補給が有益な効果をもたらす可能性を示唆している。これらの結果とその臨床的意義を確認するには、さらなる研究が必要である。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 材料および方法 |
| 2.1. 研究対象臨床コホート |
| 2.2. 探索的介入試験 |
| 2.3. 16SリボソームRNA遺伝子のシーケンシング |
| 2.4. 糞便カルプロテクチン |
| 2.5. 血中バイオマーカー |
| 2.6. 統計解析 |
| 3. 結果 |
| 3.1. 擬似アルツハイマー病患者は腸内炎症があり腸内細菌叢プロファイルが変化していた |
| 3.2. 疑似アルツハイマー病患者は腸管関連代謝物および血中炎症が変化していた |
| 3.3. プロバイオティクス治療は微生物叢関連代謝物および炎症を調節した |
| 4. 考察 |
| 5. 結論 |
本文 |
| 1.はじめに |
| アルツハイマー病は、認知機能障害、記憶喪失、情緒および機能障害を特徴とする、広範囲に及ぶ重篤な神経変性疾患です(Kamatham et al., 2024)。分子レベルでは、病態はアミロイドβ線維の細胞外沈着と、神経細胞内における高リン酸化タウタンパク質の神経原線維クラスターの蓄積によって特徴付けられます(Roda et al., 2022)。腸内細菌叢組成の変化は、アルツハイマー病患者において広く報告されており(Cattaneo et al., 2017; Vogt; et al., 2017; Zhuang et al., 2018)、局所および全身性炎症、血液組織バリア透過性障害(Novoa et al., 2022、Sochocka et al., 2019)、および脳機能に影響を与えることが知られているさまざまな腸内代謝物の変化(Kesika et al., 2021、Sochocka et al., 2019)に寄与している可能性があります。 |
| 腸内細菌叢が行動や認知に影響を及ぼし、ひいては脳が腸内細菌叢プロファイルを調整するという証拠は、中枢神経系と腸管神経系が同じ内分泌、免疫、神経、代謝経路を介してリンクされている双方向ネットワークである腸内細菌叢-腸管-脳軸の定義に貢献しました(Cryan et al., 2019)。アルツハイマー病の病態生理に関係していることが示唆されている腸内細菌叢-腸管-脳軸メディエーターには、サイトカインやその他の免疫応答メディエーター、神経伝達物質、および短鎖脂肪酸、トリプトファン由来の活性分子、胆汁酸などの細菌代謝物が含まれます(Cryan et al., 2019、Marizzoni et al., 2023、Meier-Stephenson et al., 2022、Mulak, 2021)。 |
| プレバイオティクス、プロバイオティクス、糞便微生物移植、そして食事療法は、アルツハイマー病における補助的な治療介入として提案されている(Varesi et al., 2022)。例えば、いくつかの前臨床データは、腸内細菌叢-腸管-脳軸の調節を介して、行動変容やアルツハイマー病病態に対するこれらの介入の有益な効果を実証している(Bonfili et al., 2017, Kaur et al., 2020, Prajapati et al., 2025)。さらに、最近のヒトデータを用いたメタアナリシスでは、プロバイオティクスの補給が軽度認知障害(MCI)およびアルツハイマー病における認知機能を向上させることが示唆されており、そのメカニズムは炎症や酸化ストレスの調節、そして腸内細菌叢関連代謝物の産生に関わるものと考えられる(Chui et al., 2024, Den et al., 2020, Xiao et al., 2025)。しかしながら、プロバイオティクスの生理学的効果に関する利用可能なエビデンスは依然として限られています。私たちの知る限り、プロバイオティクスに対する腸内細菌叢-腸管-脳軸メディエーターの大規模なパネルの評価は、アルツハイマー病の疑いのある患者において、未だ報告されていません。腸内細菌叢を標的とした治療に対する腸内および循環血中の炎症、微生物叢の構成、そして代謝変化を評価する多次元的アプローチは、腸内細菌叢-腸管-脳軸が認知障害に寄与するメカニズムの解明と新たな治療標的の特定に役立つ可能性があります。 |
| したがって、本研究では、腸内細菌叢、炎症誘発マーカー、およびその他の腸内細菌叢-腸管-脳軸メディエーターの違いが擬似アルツハイマー病と関連しているかどうか、またこれらの生物学的特徴が12週間のプロバイオティクス治療によって調整できるかどうかを評価しました。 |
| 2. 材料および方法 |
| 2.1. 研究対象臨床コホート |
| 2018年3月から2019年9月にかけて、ブレシアのIRCCS Istituto Centro Fatebenefratelli San Giovanni di Dioにおいて、認知機能健常対照群(HC)47名と55歳から89歳の擬似アルツハイマー病患者45名が登録された。本集団の人口統計学的および臨床的特徴は、擬似アルツハイマー病患者が健常対照群と比較して高齢であることを除いて予想通りであった(p値 = 0.019、表1および補足表S2)。 |
表1. 研究参加者の社会人口学的および臨床データ。 図は平均値±SDおよび数(%)を示す。 略語:APOEe4、アポリポタンパク質Eのε4アレル;HC、健常対照群;pAD、擬似アルツハイマー病(アルツハイマー病の疑いのある患者)。 |
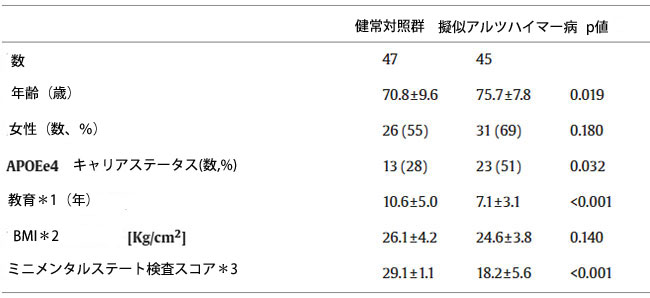 |
*1)2 つの健常対照群と 1 つの擬似アルツハイマー病でデータが欠損しています。 *2)3 つの健常対照群と 4 つの擬似アルツハイマー病でデータが欠損しています。 *3)2 つの健常対照群と 2 つの擬似アルツハイマー病 でデータが欠損しています。 |
| 確立された診断基準(Albert et al., 2011、McKhann et al., 2011)に基づく臨床評価に基づき、擬似アルツハイマー病と定義された。擬似アルツハイマー病および健常者はともに地域在住者であった。擬似アルツハイマー病の診断を裏付けるため、病歴および家族歴に加え、過去の認知機能低下エピソードの評価も収集された。除外基準には、検体採取前3か月以内の抗生物質または抗炎症治療、および精神疾患の診断の存在が含まれていた。ベースラインでは、参加者はミニメンタルステート(Mental State Examination(MMSE))(Folstein et al., 1975)および臨床的認知症尺度(Clinical Dementia Rating(CDR))(Morris, 1993)スケールによる神経心理学的評価を受け、自記式食事質問票(補足方法1)に回答した。静脈血サンプルは、PAXgene™ Blood RNA Tubes(PreAnalytiX社)およびBD Vacutainers®(Becton Dickinson社)を用いて採取しました。便サンプルは、被験者の自宅で滅菌プラスチックカップを用いて採取し、-20℃で最大4日間保存した後、IRCCS Istituto Centro Fatebenefratelli San Giovanni di Dioに送付し、サンプル処理まで(約280±177日間)-20℃で保存しました。本研究は、「Comitato Etico dell'IRCCS San Giovanni di Dio – Fatebenefratelli」(Brescia, Italy)の倫理委員会の承認を受け、登録番号は92/2017および95/2018です。参加者全員から書面によるインフォームドコンセントを得ました。 |
| 2.2. 探索的介入試験 |
| この親試験の一環として、擬似アルツハイマー病患者に対し、複数種プロバイオティクスであるProxian®1(Errekappa Euroterapici)の補給からなる探索的介入試験への参加が提案されました。Proxian®はスティック製剤で1日1本を12週間投与されました。各スティックには、腸内細菌叢のバランス維持を目的とした、腸内保護されたマイクロカプセル化されたプロバイオティクス株であるBifidobacterium lactis BS05(DSM 23032)とLactiplantibacillus plantarum LP01(LMG P-21021)が含まれていました。また、この製剤には、天然のセレンと亜セレン酸ナトリウムを豊富に含み、抗酸化作用を持つ、非生菌性のチンダル化細菌株であるLactobacillus buchneri LB26(DSM 16341)も含まれていました。さらに、認知機能と免疫応答をサポートするために亜鉛も配合されていました。探索的介入研究への参加に同意した擬似アルツハイマー病患者は、サプリメント投与終了時に血液と便のサンプルを提供しました。ミニメンタルステート検査スコアはプロバイオティクス投与後に収集されましたが、すべての被験者で同じ時期に収集されたわけではなく、治療終了1か月後、1~3か月後、3か月後以上の3つのカテゴリーに分類することができました。 |
| 2.3. 16SリボソームRNA遺伝子のシーケンシング |
| 便DNAを単離し、細菌リボソームRNA 16S(rRNA 16S)遺伝子の可変領域V3およびV4を16S Illuminaプロトコルに従ってシーケンシングした。生の16S rRNA遺伝子データはQIIME2(Bolyen et al., 2019)(補足方法2)を用いて処理した。属および門レベルでの絶対存在量は、各サンプルに割り当てられたリードの総数で正規化した。分類が不完全な属(すなわち、いずれかのレベルで「__」で終わる52属)、真核生物ドメインに割り当てられた属、または全サンプルにおける相対存在量が10-3未満である属は除外した。 |
| 2.4. 糞便カルプロテクチン |
| RIDASCREEN®カルプロテクチン(R-Biopharm Italia S.R.L.)免疫測定は、製造業者のプロトコル(補足法3)に従って測定直前に解凍した凍結糞便検体を用いて実施した。 |
| 2.5. 血中バイオマーカー |
| 炎症性遺伝子(全リストは補足表S1を参照)の発現解析と4種類の短鎖脂肪酸(酢酸、プロピオン酸、吉草酸、酪酸)の濃度は、それぞれリアルタイムPCRとガスクロマトグラフィー(GC)を用いて測定した(詳細はMarizzoni et al., 2020a、Marizzoni et al., 2020bおよび補足方法4および5を参照)。トリプトファン代謝により生成される化合物は、以前に記載された方法(Mandal et al., 2024および補足方法6)に若干の修正を加えて、液体クロマトグラフィー-質量分析法(UPLC-MS)を用いて定量した。 |
| 2.6. 統計解析 |
| 統計解析は、特に記載がない限り、R (v.4.3.0) とRstudio (v2023.03.1+446) を用いて実施した。便中カルプロテクチンおよび血液変数は正規性を保証するためにln変換し、ベースラインにおける臨床診断の影響は、年齢を共変量とした一元配置分散分析を用いて評価した。群平均値から2.5標準偏差を超える値または2.5標準偏差未満の値は解析から除外した。αおよびβの多様性は、年齢およびバッチを共変量とした一元配置分散分析および順列多変量分散分析(PERMANOVA、Rパッケージ:vegan v2.6~4 (Oksanen et al., 2012))を用いてそれぞれ解析した。グループ間の微生物属の差異は、年齢とバッチを交絡変数として MaAsLin2 (Microbiome Multivariable Associations with Linear Models、MaAsLin2 R パッケージ v 1.14.1) に実装された線形混合モデルを使用して評価されました。 |
| 擬似アルツハイマー病患者を対象とした縦断的解析では、正規性検定を実施し外れ値を除去した後、年齢と時間を固定効果、被験者IDを変量効果とする線形混合効果モデルを、アルファ多様性、糞便カルプロテクチン、血液変数に適用した。アルファ多様性については、バッチも共変量として含めた。ベータ多様性については、年齢とバッチを交絡因子としてPERMANOVAを用いて時間の影響を評価した。時間または腸内細菌叢-腸管-脳軸プロバイオティクス関連の変化に関連する微生物属は、MaAsLin2を用いて評価した。 |
| この目的のため、補給後に有意に変化が認められたメディエーターのデルタを二値化し、1は増加(グルタミン酸、5-ヒドロキシインドール酢酸、酪酸、IL-10)または減少(アントラニル酸、吉草酸、NLRP3、IL-6、MIF、TNFα)を示すものとした。MaAsLin2は、時間と二値化デルタを固定効果、年齢、バッチ、被験者IDをランダム効果として実施した。MaAsLin2については、FDRが0.25未満(本パッケージの標準デフォルト)であったため、有意水準はp < 0.05とした。サプリメント摂取後のミニメンタルステート検査スコアの変化は、本研究で報告されているように臨床的に有意と判断されました(Muir et al., 2024)。軽度認知障害(CDR = 0.5)および軽度アルツハイマー病(CDR = 1)患者では2ポイントの変化、中等度から重度アルツハイマー病(CDR = 2または3)患者では3ポイントの変化が認められました。特に記載がない限り、すべての図はPrism 10(バージョン10.4.1)を使用して生成されました。 |
| 3. 結果 |
| 3.1. 擬似アルツハイマー病患者は腸内炎症があり腸内細菌叢プロファイルが変化していた |
| 我々の第一の目的は、特定の腸内細菌叢構成プロファイルと関連して、患者の腸内における炎症状態の可能性を評価することであった。腸内炎症のよく知られたマーカーであるカルプロテクチンの値を糞便サンプルで測定したところ、擬似アルツハイマー病患者では健常者と比較してベースライン値が高かった(p値<0.001、図1A)。次に、特異な腸内細菌叢プロファイルの存在が擬似アルツハイマー病と関連しているかどうかを検証したところ、群内ブレイ・カーティス(訳者注:生態学と生物学において、ブレイ・カーティスの相違性は、各サイトの数に基づいて、2 つの異なるサイト間の種組成の相違性を定量化するために使用される統計です)距離とジャカード(訳者注:2つの集合がどれだけ共通しているかを示す指標です)距離に差があり、擬似アルツハイマー病では健常者と比較して個人間変動が小さいことが明らかになった(PERMANOVA、いずれもp値=0.011、図1B)。これは、擬似アルツハイマー病群内の個人は健常対照群よりも類似性が高いことを示唆している。アルファ多様性については、糞便微生物叢の豊富さと多様性を示す指標であるピエルーの均等性およびシャノン多様性において差は認められなかった(p値 > 0.352、補足図1A)。統計的に有意ではないものの、擬似アルツハイマー病患者群では、健常対照群と比較して、バクテロイデス門およびプロテオバクテリア門の菌数が増加し、フィルミクテス門、ヴェルコミクロビア門、およびアクチノバクテリア門の菌数が減少したと報告されている(補足図1B)。属レベルでは、擬似アルツハイマー病患者は健常者と比較して、Fusicatenibacter、Clostridium sensu stricto 1、Intestinibacterの存在量が低く、[Eubacterium] coprostanoligenes群、Rhodospirillales_uncultured、Desulfovibrio、CAG-352、Faecalitalea、およびNegativibacillusの存在量が高かった(MaAsLin2、q値 < 0.222、図1C-D)。これらの変化は、便の保存期間と質問票によるタンパク質摂取量とは無関係であり、質問票によるタンパク質摂取量は擬似アルツハイマー病で健常者よりも高かった(p = 0.031、補足表S3)。 |
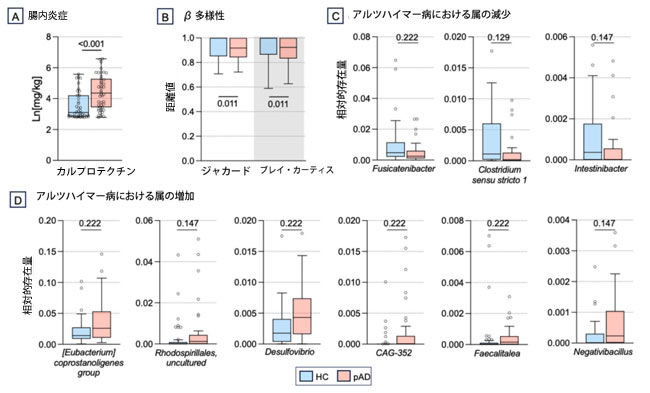 |
図1. 擬似アルツハイマー病と健常者のベースラインの糞便中カルプロテクチン (A)および腸内細菌叢(B-D)の比較。 データは箱ひげ図で示され、黒の水平線は中央値、円は被験者の値を示す。 略語:HC:健常対照群、pAD:擬似アルツハイマー病群 |
| 3.2. 疑似アルツハイマー病患者は腸管関連代謝物および血中炎症が変化していた |
| 擬似アルツハイマー病患者の腸管における局所炎症および腸内細菌叢の変化を観察し、これらが血中腸内細菌叢-腸管-脳軸メディエーターの変化と関連しているかどうかを調べた。 |
| 擬似アルツハイマー病患者は、グルタミン酸、およびトリプトファン代謝によって産生される生理活性化合物(トリプトファン、キサンツレン酸、セロトニン、およびその代謝産物である5-ヒドロキシインドール酢酸)の濃度が有意に低いことが特徴であることがわかった(p値 < 0.029、図2A-B)。一方、アントラニル酸は擬似アルツハイマー病群で健常対照群と比較して増加していた(p値 = 0.001、図2B)。また、擬似アルツハイマー病では健常対照群と比較して、キヌレニン(p値 = 0.064)および3-インドールプロピオン酸(p値 = 0.083)の減少傾向、ならびに3-ヒドロキシキヌレニン(p値 = 0.074)およびニコチンアミド(p値 = 0.062)の増加傾向も認められた(補足図1C)。短鎖脂肪酸については差異は検出されませんでしたが (補足図 1D)、擬似アルツハイマー病患者では 健常者よりも炎症誘発性サイトカイン IL-8 の発現が増加 (p 値 = 0.048、図 2C) し、TNF-αの傾向も見られました (p 値 = 0.097、補足図 2F)。(訳者注:TNF-α(腫瘍壊死因子-α)は、炎症反応や免疫応答を調節するサイトカインであり、細胞の増殖、分化、アポトーシス(細胞死)など、多くの生体プロセスに関与しています)。 |
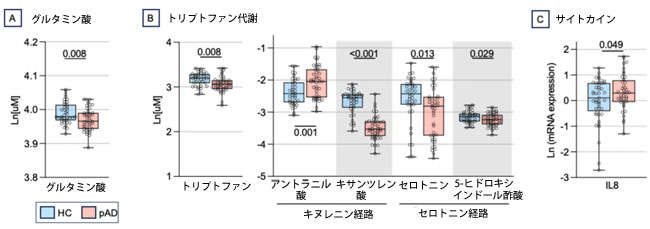 |
| 図2. 疑似アルツハイマー病と健常対照群における腸内細菌叢-腸管-脳軸メディエーターの比較。 具体的には、血漿グルタミン酸(A)、トリプトファン代謝によって産生される生理活性化合物(B)、および炎症性サイトカインIL-8(C)。データは箱ひげ図で示され、黒の水平線は中央値、円は被験者の値を示す。 略語:HC:健常対照群、pAD:疑似アルツハイマー病患者群。 |
| 3.3. プロバイオティクス治療は微生物叢関連代謝物および炎症を調節した |
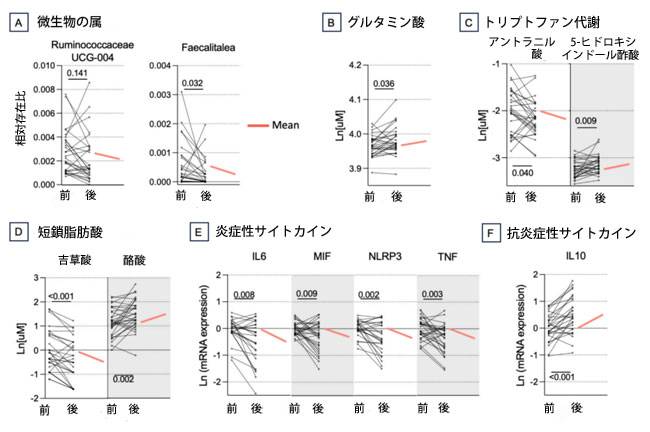
| 次に、12週間のプロバイオティクス補給が擬似アルツハイマー病患者における腸内細菌叢-腸管-脳軸の特異的な生物学的変化を抑制できるかどうかを検証した。12週間のプロバイオティクス治療によって腸内細菌叢-腸管-脳軸が調節されるかどうかを検証したところ、Pielouの均等性指数(p値 = 0.070、補足図2A)は増加傾向を示したが、Shannon多様性指数およびBray-Curtis距離とJaccard距離で示される微生物叢構造には有意な変化は認められなかった(p値 > 0.05)。しかし、プロバイオティクスによる調節は属レベルで確認され、Ruminococcaceae UCG-004およびFaecalitaleaの個体数減少が報告された(q値 < 0.141、図3A)。特に、Faecalitalea はベースラインの 健常対照群と比較して 擬似アルツハイマー病患者群で増加していることがわかりました (q 値 = 0.222、図 1)。 |
 |
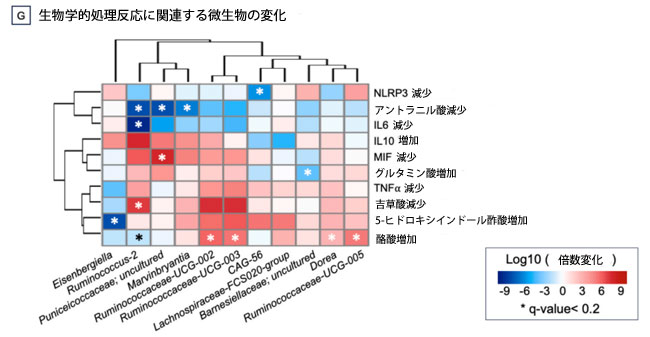 |
図3. プロバイオティクス治療は、アルツハイマー病の疑いのある患者における微生物叢、その代謝産物、および炎症を調節しました。 データは、微生物属(A)、グルタミン酸(B)、トリプトファン代謝により産生される生理活性化合物(C)、短鎖脂肪酸(D)、および炎症誘発性サイトカイン(E)および抗炎症性サイトカイン(F)の血中遺伝子発現レベルについて、各時点の平均値とともにスパゲッティプロットとして提示されている。線形混合モデルを用いて計算された、微生物、サイトカイン、および短鎖脂肪酸の変化間のすべての有意な関連性をまとめたヒートマップ(G)。 色の凡例:−log(q値)* 符号(係数)。有意な関連性を示すセルは色分け(赤または青)され、アスタリスク(* 符号はq値 < 0.2を示す)が重ねて表示されている。相関ヒートマップは、corrplotパッケージ(v0.95)を使用して視覚化された。 |
| 微生物叢関連代謝物に関しては、プロバイオティクスの摂取により吉草酸およびアントラニル酸が減少し(p値 < 0.040)、酪酸、5-ヒドロキシインドール酢酸、グルタミン酸が増加した(p値 < 0.036、図3B-D)。トリプトファン、キヌレニン、キヌレン酸については増加傾向が報告された(p値 < 0.100、補足図2F)。さらに、末梢炎症に対する効果が血中に検出され、プロバイオティクスはIL6、TNF-α、NLRP3、MIFといった炎症性サイトカインのレベルを低下させ(p値 < 0.009、図3E)、抗炎症性サイトカインIL10のレベルを増加させた(p値 < 0.001、図3F)。プロバイオティクス摂取後、糞便中カルプロテクチンの平均レベルは減少しましたが、有意差には達しませんでした(p値 = 0.413、補足図2B)。 |
| 次に、微生物叢の属が腸内細菌叢-腸管-脳軸メディエーターの有意な増加または減少と関連しているかどうかを評価したところ、11属がそのような血液変化と有意に関連していることが分かりました(q値<0.020、図3G)。炎症プロセスに関与するメディエーターの減少と相関する5属(CAG-56はNLRP3と相関、Ruminococcus-2はIL6、吉草酸、アントラニル酸と相関、プニセイコッカス科に属する1つの未培養細菌はMIFとアントラニル酸と相関、Marvinbryantiaはアントラニル酸と相関)、5属は既知の有益な代謝物である酪酸の上昇と相関(Ruminococcus-2、Ruminococcaceae-UGC-002、-003、-005、Dorea)、Eisenbergiellaは5-ヒドロキシインドール酢酸の上昇と相関、そして、グルタミン酸レベルの上昇を伴うバルネシエラ科への移入が示唆された。最も強い相関が認められたのは、酪酸の上昇(5.19 < FC < 5.26、0.024 < q値 < 0.069)、IL6の減少(FC = -9.01、q値 = 0.069)、およびアントラニル酸の減少(-7.67 < FC < -6.18、0.053 < q値 < 0.085)に関連する属であった。 |
| 最後に、プロバイオティクスの補給は、治療終了1ヶ月後に4名の擬似アルツハイマー病患者、および3ヶ月以上経過後に2名の擬似アルツハイマー病患者の認知機能にプラスの影響を及ぼしました(図4)。ベースラインで臨床的認知症尺度(CDR)が1であった2名の被験者を除き、追跡調査で悪化を示した患者はいませんでした。この2名は、補給終了から3ヶ月後にそれぞれ擬似アルツハイマー病が2点と5点減少したと報告しています。 |
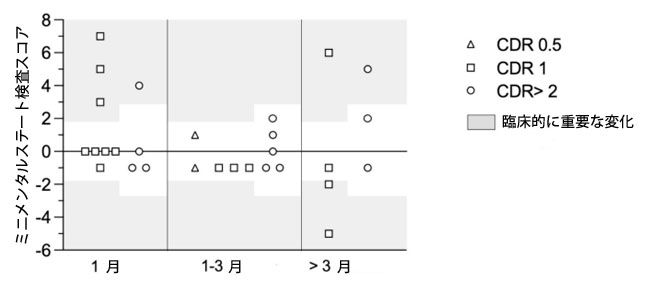 |
図4. 擬似アルツハイマー病患者における治療前後のミニメンタルステート検査(MMTSE)の差異。 各記号は患者1名に対応しています。灰色の背景は、(Muir et al., 2024)で報告されている臨床的に有意な変化に対応しています。CDRスコアが0.5および1の患者では2ポイントの変化が有意と判断され、CDRスコアが2または3の患者では3ポイント以上の変化が有意と判断されました。 略語:CDR、臨床認知症評価尺度スコア。 |
| 4. 考察 |
| 本研究の主な知見は、擬似アルツハイマー病が腸管および末梢の炎症、微生物叢構成の変化、そしてトリプトファン代謝や神経伝達物質グルタミン酸に関連するものを含む腸内細菌叢関連代謝物の調節異常を特徴とすることを確認した。また、擬似アルツハイマー病患者に12週間のプロバイオティクス補給を行うことで、末梢炎症を軽減し、有益な微生物叢関連代謝物の循環血中濃度を上昇させ、これらの血液変化が糞便細菌構成と関連していることを示した。 |
| 患者と対照群の微生物の違いを調べたところ、特にClostridium sensu stricto 1とIntestinibacterの減少、Eubactrium coprostanoligenes、Rhodospirillales、Desulfovibrioの増加が見られました。これは、過去の研究結果(Cammann et al., 2023, Grabrucker et al., 2023, Haran et al., 2019, Ling et al., 2020, Marizzoni et al., 2023, Quattrini et al., 2025; Vogt; et al., 2017)と一致しています。さらに、擬似アルツハイマー病患者ではFusicatenibacterの減少が見られました。Fusicatenibacterは一般的に腸内環境の健康に有益と考えられており、慢性自己免疫疾患である関節リウマチ患者における抗炎症作用と関連付けられています(Yu et al., 2021)。さらに、擬似アルツハイマー病患者は対照群よりもCAG-352とFaecalitaleaの存在量が多いことが報告されており、これはCAG-352がストレスに対する脆弱性を高める役割(Chen et al., 2022)とFaecalitaleaがアルツハイマー病のよく知られた危険因子である糖尿病におけるインスリン反応の調節に役割を果たす(Ma et al., 2020)ことを裏付けています。 |
| 擬似アルツハイマー病患者で発見された腸管および全身の炎症は、当研究グループおよび他の研究グループによる過去の研究結果を裏付けるものであり(Grabrucker et al., 2023、Leblhuber et al., 2015)、慢性活性化の状況下では末梢炎症が潜在的に有害であるという知見とも一致しています(Pagoni et al., 2022、Walker et al., 2021)。炎症性分子に加えて、微生物代謝物は脳機能および行動に影響を与えることが知られている他の腸内細菌叢-腸管-脳軸メディエーターです(Cryan et al., 2019)。最近のエビデンスは、トリプトファン代謝がアルツハイマー病の病因に関与していることを指摘しており、特に一部のトリプトファン代謝物が免疫応答の調節およびアミロイドのオリゴマー化および凝集の阻害において果たす役割に重点が置かれています(Meier-Stephenson et al., 2022)。実際、トリプトファンはキヌレニン、セロトニン、インドールの3つの主要経路を経て様々な生理活性化合物に代謝されます。本研究では、文献データと一致して、擬似アルツハイマー病におけるトリプトファンの血中減少(Whiley et al., 2021)と、後述するように擬似アルツハイマー病におけるその下流経路すべての調節不全を報告しました。キヌレニン経路に関しては、他の研究でアルツハイマー病患者の血漿中キサンツレン酸濃度が低いこと(Giil et al., 2017、Whiley et al., 2021)、および前臨床アルツハイマー病におけるアントラニル酸の上昇(Oxenkrug, 2024)が確認されています。さらに、これら2つの代謝物の血中変化は、グルタミン酸とともに、10年間追跡調査された認知症のない参加者における認知症リスクの増加と関連していることが示されています(Chouraki et al., 2017)。グルタミン酸はグルタミン酸の中性型であり、ここで報告されているように、血漿(ここでおよびChang et al., 2021)およびアルツハイマー病患者の脳(Antuono et al., 2001、Hattori et al., 2002、Rupsingh et al., 2011)で減少していることがわかっています。セロトニン経路に関しては、血中セロトニンとその代謝物である5-ヒドロキシインドール酢酸の減少を発見しました。これらの化合物の両方の減少は、アルツハイマー病患者の血液、脳脊髄液、および脳で広く報告されています(Morimoto et al., 2017、Sekiya et al., 2024)。セロトニンレベルの低下は、認知症のない被験者における機能低下および軽度の行動障害の発症リスクの増加と関連付けられています(Sim et al., 2025)。インドール経路は、主に腸内微生物代謝の結果です。その主要代謝物の一つである3-インドールプロピオン酸は、in vitroおよびアルツハイマー病の動物モデルにおいて抗アミロイド作用および神経保護作用を持つことが知られています(Bendheim et al., 2002、Chyan et al., 1999、Hwang et al., 2009)。一貫して、擬似アルツハイマー病患者では対照群と比較して3-インドールプロピオン酸が減少する傾向が見られました。しかしながら、別の研究では、約5年間の観察期間中安定していた軽度認知障害と比較して、アルツハイマー病に進行する軽度認知障害ではこの代謝物のレベルが高かったことが報告されており(Huang et al., 2021)、アルツハイマー病のさまざまな段階におけるインドールおよびその他のトリプトファン由来代謝物の役割を完全に解明するには、さらなる研究が必要であることが示唆されています。トリプトファン代謝とグルタミン酸に加え、短鎖脂肪酸も評価しましたが、診断がそれらの濃度に及ぼす影響は確認できませんでした。これは、ベースライン解析に含まれていた健康な被験者の数が少なかった(N = 10)ためと考えられます。以上のエビデンスを総合すると、これらの腸内細菌叢-腸管-脳軸分子の一部がアルツハイマー病の発症と進行に影響を与え、腸内細菌叢と脳の共生関係において中心的な役割を果たしているという仮説を支持するものです。しかしながら、どの腸内細菌叢-腸管-脳軸分子がアルツハイマー病の発症と進行に影響を与えているかを確認するには、縦断的な研究が必要です。 |
| この研究のもう一つの重要な目的は、12週間のプロバイオティクス補給が、対照群と比較して擬似アルツハイマー病患者群のベースラインで観察された変化を打ち消すことができるかどうか、また腸内細菌叢-腸管-脳軸で重要な役割を果たす分子を調節できるかどうかを評価することでした。私たちの探索的介入研究では、腸内細菌組成の明らかな調節にもかかわらず、プロバイオティクス補給は、微生物叢によって生成される代謝物(すなわち、短鎖脂肪酸)またはその生成が影響を受ける代謝物(すなわち、インドール)の変化を誘発することが示されました。これは、プロバイオティクスが腸内微生物叢の一時的な定着を介して効果を発揮する(Zmora et al., 2018)、他の常在微生物の活性と相互作用を調節する(Grazul et al., 2016)、およびT細胞と樹状細胞間のコミュニケーションとして免疫および炎症メカニズムに直接影響を与える(Cristofori et al., 2021)という現在の考えと一致しています。ここでは、プロバイオティクスは、炎症誘発性サイトカイン(IL6、MIF、NLRP3、TNFα)、吉草酸、アントラニル酸(Shaw et al.、2023)などの免疫活性化プロセスに関与するいくつかの分子のレベルを低下させ、抗炎症性サイトカイン(IL10)、酪酸、インドール(Chakraborty et al.、2024、Chyan et al.、1999)などの潜在的な保護因子を増加させました。これらの有益な効果はすべて、アルツハイマー病の前臨床モデルで広く報告されています(Kaur et al., 2020、Li et al., 2024、Song et al., 2022、Sun et al., 2020、Sun et al., 2021、Zhu et al., 2023)が、私たちが知る限り、擬似アルツハイマー病患者におけるこれらすべての因子を測定して全体像を示した研究はこれが初めてです。 |
| 非常に重要であること(Mathewson et al., 2016)、吉草酸がいくつかの神経変性関連バイオマーカー(pTau-181、神経フィラメント軽鎖、グリア線維性酸性タンパク質)と関連付けられていること(Marizzoni et al., 2025)と合わせて、これらの知見は、プロバイオティクス誘導性の調節がアルツハイマー病におけるいくつかの重要な末梢プロセスに有益な効果をもたらす可能性があることを示唆しています。本研究および既存の研究は、方法論的にかなりの異質性とばらつき(使用したプロバイオティクス、病期、評価したバイオマーカーなど)、そしてサンプル数が少ないことに留意すべきである。したがって、マイクロバイオーム調節介入とアルツハイマー病の複雑な関連性を解明するには、より適切に設計され、管理された研究が必要である。 |
| 入手可能な アルツハイマー病臨床研究のほとんどは、プロバイオティクスの認知機能 (Akhgarjand et al., 2022、Fei et al., 2023、Xiao et al., 2020) または脳萎縮 (Asaoka et al., 2022) に対する効果を評価していました。末梢炎症を評価した研究は少数で、IL1beta (Hsu et al., 2023)、C 反応性タンパク質 (Tamtaji et al., 2019)、TNF-α、IL8、および IL12p70 (Ton et al., 2020) の減少として測定された一般的な抗炎症効果が報告されています。1 つの研究ではトリプトファンとキヌレニンを評価し、私たちの結果と一致して、プロバイオティクス摂取後の アルツハイマー病患者のキヌレニン濃度の上昇を確認しました (Leblhuber et al., 2018)。本研究の結果は、プロバイオティクスの補給がセロトニンとグルタミン酸を対照群のレベルまで回復させ、酪酸を増加させ、吉草酸を減少させるという有益な効果を初めて示唆しています。プロバイオティクス摂取後のセロトニン、グルタミン酸、短鎖脂肪酸の血中濃度に関するヒトのデータは不足していますが、これまでの研究では、食事と遺伝子組み換え食品の組成がこれらすべてのバイオアベイラビリティに影響を与える可能性が示唆されています(Gruenbaum et al., 2024、Socała et al., 2021)。セロトニンのバランス調整は、アルツハイマー病患者における対照群と比較してセロトニン濃度が低下していることに起因する可能性があり、興奮や易怒性など、アルツハイマー病に伴ういくつかの症状を改善する可能性があります(Siddique et al., 2009)。グルタミン酸シグナル伝達の変化はアルツハイマー病の重要な側面ですが(Zott & Konnerth, 2023)、食事や微生物由来のグルタミン酸が疾患の病態生理に寄与するかどうかはまだ調査されていません。私たちは以前、正常から認知症までの認知能力を持つ高齢者において、血漿酪酸値の高さと血漿吉草酸値の低さが、内皮細胞の完全性と脳アミロイドーシスの低下と関連していることを発見しました(Marizzoni et al., 2020a、Marizzoni et al., 2020b)。酪酸が上皮細胞の完全性に 本研究にはいくつかの限界がある。介入研究は非対照試験であるため、プロバイオティクスの効果に関する因果関係について明確な結論を導き出すことはできない。しかしながら、本研究結果は、プロバイオティクス投与後に特定の分析対象物質が明確に変化したことを明らかにしており、将来の試験におけるアウトカム指標としての可能性を示唆している。補給後の認知機能評価を体系的に収集しなかったため、末梢プロバイオティクスによる変化と認知機能改善の関係について推論を導くことはできない。しかしながら、ミニメンタルステート検査の結果では、補給終了1ヶ月後に評価した中等度アルツハイマー病患者12名のうち4名に臨床的改善が見られ、3ヶ月以内に悪化した患者はいなかった。さらに、アミロイドおよびタウ病変の存在を確認するためのバイオマーカーは使用しておらず、それらに対するプロバイオティクスの効果も評価していない。さらに、血液サンプルの細胞組成は評価されておらず、遺伝子発現に観察された差異が免疫細胞量の変化によるものである可能性も否定できない。最後に、16S rRNA 遺伝子の配列決定では細菌の機能的特徴を明らかにすることができなかったため、微生物叢に関する機能情報を取得するために微生物叢関連代謝物の定量化を実施しました。 |
| 5.結論 |
| 結論として、本研究の結果は、アルツハイマー病における腸内および全身性の炎症、ならびに疾患の行動および認知機能の変化に関与する腸内細菌叢関連代謝物の不均衡を介した、腸内細菌叢-腸管-脳軸の調節不全を裏付けるものである。さらに、プロバイオティクスの補給が、主に炎症誘発性メディエーターの減少と保護因子の増加を通じて、これらの変化を抑制する潜在的な有益効果を実証した。最後に、腸内細菌叢はアルツハイマー病において顕著な末梢変化を誘導するための有効な標的であると考えられるが、これらの知見とその臨床的意義を確認するにはさらなる研究が必要である。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Brain, Behavior, and Immunity Volume 131, January 2026, 106138に掲載されたMicrobiota-gut-brain axis dysregulation in Alzheimer's disease and its modulation through probiotic supplementation.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


