ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
加齢に伴う腸疾患に対する植物化学物質の老化治療的可能性 |
Célia Maria Costa et al., |
|
|
| 要約 |
ここ数十年、世界中で平均寿命が延び、同時に様々な加齢関連疾患の有病率も増加しています。老化経路の中でも、細胞老化と慢性炎症(インフラメージング)は、腸内恒常性維持とディスバイオーシス(腸内細菌叢の乱れ)に関連していると考えられています。細胞老化は、ストレスに反応して起こる、本質的に不可逆的な細胞周期停止の状態です。老化細胞(SC)は代謝活性を維持しますが、増殖せず、炎症性因子やその他の因子を分泌し、老化関連分泌表現型(SASP)を形成します。老化細胞の蓄積は、脳、骨、消化管、その他の臓器や組織における様々な加齢関連疾患の発症と関連付けられています。腸内細菌叢は加齢とともに大きな変化を遂げ、良好な(健康な)老化または疾患と密接に関連しています。老化治療薬(セノセラピューティック)は、老化細胞を除去したり、老化関連分泌表現型因子の放出を調節したりすることで、老化に伴う炎症誘発性状態の影響を軽減する化合物です。抗酸化作用や抗炎症作用を持つフィトケミカル、フェノール化合物、テルペンも、老化に関連する細胞経路に作用することから、老化治療薬として期待されます。本レビューの目的は、腸内細菌叢、細胞老化、炎症老化、そして疾患の関連性を解明し、腸内細菌叢との相互作用に焦点を当て、フィトケミカルを潜在的な老化治療薬として探求することです。これらの相互に関連するプロセスを協調的に標的とすることで、健康的な老化を促進するための新たな戦略が生まれる可能性があります。 |
| グラフィカル アブストラクト |
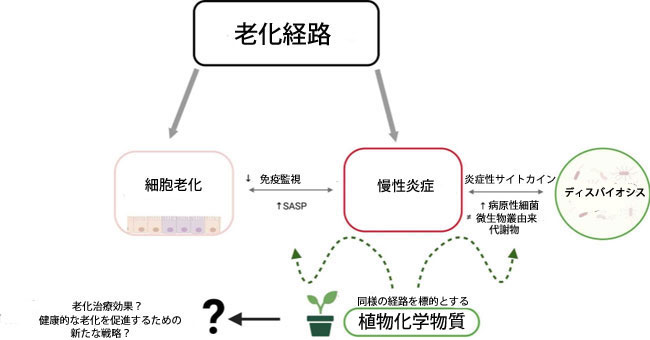 |
SASP:老化関連分泌表現型、ディスバイオシス:腸内細菌叢の乱れ |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 細胞老化 |
| 2.1. 誘導因子 |
| 2.2. 細胞老化、老化、そして疾患 |
| 3. 腸管における加齢変化 |
| 3.1. 生涯にわたる腸内細菌叢構成の変動 |
| 3.2. 腸内細菌叢、老化、免疫老化、そして炎症老化 |
| 3.3. 老化、腸内代謝物、そして腸疾患 |
| 4. 老化治療薬としての植物化学物質 |
| 4.1. 老化治療薬:合成化合物と天然化合物 |
| 4.2. 老化抑制剤/老化形態制御剤としての植物分子 |
| 4.3. 腸疾患に対する栄養補助食品としての植物分子 |
| 5. 今後の展望 |
| 6. 結論 |
本文 |
| 1.はじめに |
| 過去数十年にわたり、世界的に平均寿命は延びており、現在の推計では、2015年から2050年の間に60歳以上の人口は倍増するとされています(WHO、2024年)。しかし、高齢化に伴い、複数の衰弱性疾患が同時または相次いで発症する可能性があります。そのため、この人口動態の変化は、医療および社会福祉サービスに負担をかける可能性があります。この問題に対処するため、国連は2021年から2030年を「健康な高齢化の10年」と宣言しました。この問題に対処するための戦略を策定するための学術研究の必要性が急務となっています。 |
| 老化の生物学的定義、その原因、そしてその結果については、議論の余地があります。世界保健機関(WHO)は、老化を「様々な細胞および分子レベルの損傷が時間の経過とともに蓄積し、身体的および精神的能力の漸進的な低下、疾患リスクの増大、そして最終的には死に至る状態」と定義しています(WHO, 2024)。様々な細胞プロセスや代謝経路を考慮した老化の説明を試みる理論はいくつかあり、その中には、変異蓄積説、細胞老化、テロメア短縮/機能不全、酸化ストレス、あるいは免疫学的観点からの炎症老化(Kirkwood, 2018、Weinert and Timiras, 2003)などがあります。近年、新たな学際研究分野である「ジェロサイエンス(Geroscience)」が出現しました。この分野の目標は、加齢に伴う多疾患の軽減と健康寿命の延伸を目的として、老化の核となるメカニズムに対処するための、生物学的に駆動された新たな治療法および予防法を創出することです。ジェロサイエンス仮説は、主要な生物学的プロセス/経路が、多くの加齢関連疾患および慢性疾患の病態生理における根本原因であると仮定しています。したがって、これらの基本的な老化経路を標的とする治療法は、これらの疾患をまとめて遅延、予防、緩和、または治療することができ、結果として健康寿命にプラスの影響を与える可能性があります。老化経路を特定の細胞/分子標的と捉える人もいますが、より広範なプロセスと捉える人もいます(Campisi et al., 2019)。López-Otín、Blasco、Partridge(López-Otín et al., 2013)は、基本的な老化メカニズムを、テロメア侵食、エピジェネティックな変化、ゲノム不安定性、幹細胞の枯渇、細胞老化、ミトコンドリア機能不全、タンパク質恒常性の喪失、細胞間コミュニケーションの変化、栄養感知の調節不全というクラスターに分類することを提案しました。さらに、彼らは加齢に伴う損傷の主な原因を、拮抗的反応と統合的反応に分類することを提唱しました。例えば、テロメアの短縮は細胞老化につながる主な原因であり、ひいては慢性炎症を引き起こす可能性があります(Zhu et al., 2019)。 |
| 提案されている可能性の中で、慢性炎症経路は、持続的な炎症誘発状態と適応免疫応答の低下を伴う免疫老化/炎症老化軸の存在を示唆しています(Santoro et al., 2021)。免疫老化状態には、免疫機能の全般的な低下を特徴とする加齢に伴う一連の変化が含まれますが、主に適応免疫応答に影響を及ぼすものです。炎症老化は、自然免疫応答の慢性的な刺激を伴う、低レベルの慢性炎症誘発状態を伴います。これらの免疫変化は、複数の疾患の発症や健康寿命の短縮と密接に関連しています(Fulop et al., 2018)。加齢に伴って頻繁に観察される免疫システム(IS)全体の機能低下と炎症状態の亢進に加えて、細胞レベルでは老化が関連するメカニズムと考えられています。しかし、この謎は解明されつつあるものの、内分泌への関与など、この経路には未解明な点が数多く残されています。ストレスや細胞損傷の蓄積に応じて、細胞はアポトーシス、オートファジー、または老化のいずれかを起こします。細胞が特定の経路のみに進入し、他の経路には進入しないメカニズムは未だ解明されていない (Dodig et al., 2019)。一方で、細胞老化は胚発生、組織修復、腫瘍形成の抑制に不可欠である。一方で、高齢者に見られるような持続性老化細胞の蓄積は、複数の臓器の機能不全の一因となる (Giaimo and d'Adda di Fagagna, 2012)。老化は、本質的に不可逆的な細胞周期停止と捉えることができ、老化関連分泌表現型の発生を伴う。老化関連分泌表現型は、インターロイキン、ケモカイン、成長因子、プロスタノイド、ブラジカイン、非コードヌクレオチド、その他の生理活性分子の分泌を伴う可能性があり、これらの分子はオートクリン、パラクリン、さらには内分泌活性を有し、組織変性、老化の拡大、炎症、腫瘍形成に寄与する。さらに、β-ガラクトシダーゼ活性(SA-β-gal)の増加は老化の特徴と考えられることがよくありますが、このマーカーは老化細胞に限定されるわけではなく、すべての老化細胞によって発現されるわけでもないことに留意することが重要です(Birch and Gil, 2020、Di Micco et al., 2021、Kumari and Jat, 2021、Tripathi et al., 2021)。 |
| 腸の恒常性は、栄養素やエネルギーの吸収・生産、バリア機能の維持、免疫プライミングなど、腸が果たす極めて重要な機能に加え、人体の様々なシステムとの密接なつながりから、個人の健康全般にとって不可欠です。これらの機能や相互作用の一部は、宿主と共生する微生物群によって担われています。代表的なヒト微生物群集は腸内(腸内細菌叢:GM)に存在し、その構成は個人によって異なりますが、生涯を通じて変化する可能性があります。多くの要因の中でも、加齢は腸内細菌叢構成の大きな変化と関連しており、共生群と病原性群のバランスを崩し、微生物多様性の低下を引き起こすことがあります。この状態は、ディスバイオシス(腸内細菌叢の乱れ)と呼ばれます。腸内細菌叢の乱れと慢性疾患の有病率の間には相関関係が認められており、腸と腸管免疫系(IS)の相互作用を示唆しています(Nagpal et al., 2018、Ragonnaud and Biragyn, 2021)。さらに、Branca、Gulisano、およびNicolettiによるレビューによると、加齢に伴い腸管バリア機能の低下が起こり、腸管透過性が高まると考えられています(Branca et al., 2019)。これにより、細菌、毒素、炎症性化合物が上皮バリアを通過し、全身性炎症を悪化させ、炎症性腸疾患(IBD)などのいくつかの消化器(GI)疾患の発症を促進します。このように、食物および微生物叢由来の代謝物は、高齢者の腸内恒常性と全体的な代謝において重要な役割を果たしています。例えば、宿主の健康において重要な役割を担うことがよく知られている短鎖脂肪酸(SFCA)産生細菌の量は、高齢者でしばしば減少しています(Nagpal et al., 2018)。 |
| 老化細胞が脂肪組織、心臓、肺、皮膚組織に悪影響を及ぼすことが報告されており、老化細胞の蓄積と老化関連分泌表現型が慢性疾患や老年症候群と関連していることを示す前臨床研究からのエビデンスも蓄積されています。したがって、腸管における老化細胞の蓄積が恒常性を乱し、加齢に伴う消化器疾患の一因となる可能性は十分に考えられます(Gasek et al., 2021, Kaur et al., 2020, Ogrodnik et al., 2019, Saccon et al., 2021)。しかし、老化が腸管に及ぼす影響についてはほとんど分かっていません。さらに、老化細胞のセクレトーム(訳者注:セクレトームとは、細胞が分泌するタンパク質などの総称です。細胞の「通信物質」のようなもので、成長因子、サイトカイン、ホルモン、エクソソーム、マイクロベシクルなどが含まれます。これらは、細胞間コミュニケーションや、組織の再生・修復などに関与します。)を除去または調節するための新たな治療法の探索が重要です。 |
| いくつかの合成薬剤は、前臨床研究において老化の影響を軽減する可能性を示しています。例えば、ダサチニブ、ナビトクラックス、HSP90阻害剤は特定の種類の老化細胞を除去することができ(老化細胞除去作用)、メトホルミン、ラパマイシン、ルキソリチニブ、アスピリンは老化関連分泌表現型を調節すること(老化細胞形態形成作用)ができます(Fuhrmann-Stroissnigg et al., 2017, Roos et al., 2016, Xu et al., 2015, Zhu et al., 2017, Zhu et al., 2015)。しかし、これらの薬剤は副作用によって使用が制限される可能性があり、他の代替薬の研究が進められています。興味深いことに、フラボノイドやフェノール酸など、いくつかの種類の植物化学物質には、抗酸化作用と抗炎症作用があります。 老化細胞が炎症を悪化させ、酸化促進環境を促進する可能性があることを考慮すると、これらの化合物は天然物ベースの老化治療(セノセラピー)の検討において現実的な選択肢となる可能性があります。実際、ケルセチン、フィセチン、クルクミン、プロシアニジンC1など、いくつかの天然物は、in vitroおよびin vivoで老化細胞およびそのセクレトームに作用する能力を示しています(Boccardi and Mecocci, 2021、Kim et al., 2019、Xu et al., 2021; Yousefzadeh et al., 2018; Zhu et al., 2017; Zhu et al., 2015)。 |
| 本レビューの目的は、加齢に伴う消化管疾患における老化細胞負荷と腸内恒常性に関する理解のギャップを検証することです。もう一つの目標は、栄養補助食品を用いたアプローチを通して、植物化学物質が腸内環境の健康を促進し、加齢に伴う変化を緩和し、ひいては健康的な老化全体に貢献する可能性を探ることです。 |
| 2. 細胞老化 |
| 細胞老化は老化の特徴の一つであり、細胞周期の恒久的な停止を特徴とします。ストレスに対する防御反応として、細胞はアポトーシス、オートファジー、あるいは老化へと移行しますが、どの経路を辿るかを決定する因子は未だ包括的に解明されていません (Dodig et al., 2019)。細胞が老化する可能性は、きっかけとなる刺激の強度と持続時間、刺激の種類、そして起源となる細胞の種類に依存すると仮説が立てられていますが、線維芽細胞と上皮細胞は他の細胞種よりも老化しやすい可能性があります (Abbadie et al., 2017)。 老化細胞は免疫監視下にあり、通常はマクロファージ、T細胞、NK細胞などの様々な自然免疫細胞や、一部の獲得免疫細胞サブタイプによって除去されます(Di Micco et al., 2021、Prata et al., 2018)。老化細胞は適応を伴いながらも代謝活性を有しています。例えば、老化細胞はアポトーシスに対する抵抗性を高め、場合によってはBCL-2抗アポトーシスファミリータンパク質の発現や老化関連分泌表現型因子の産生を介して抵抗性を高めます。老化細胞は静止細胞とは異なります。後者はG0期で可逆的な細胞周期停止状態にあるのに対し、老化細胞の細胞周期停止は通常G1期で起こります(Kumari and Jat, 2021)。静止細胞に存在する代謝適応の一部は 老化細胞でも発生しますが、老化関連分泌表現型などの他の代謝適応は 老化細胞でより顕著です (Terzi et al.、2016)。 |
| 細胞老化は、老化の誘発因子、老化細胞の種類、老化誘発からの経過時間、生理学的状況などによって異なる表現型サブセットからなる複雑かつ不均一なメカニズムです(Herranz and Gil, 2018、Kumari and Jat, 2021)。さらに、老化細胞を同定するための感度と特異性を兼ね備えたマーカーは広く受け入れられていません。多くの研究者は、老化細胞を同定するために複数のバイオマーカーを用いたアプローチを用いることに同意しています。González-Gualdaet al. (2021) は、細胞周期停止、構造的および形態学的変化、老化細胞サブタイプに関連する特定の特徴などの形質を評価することにより、in vitroで老化を評価する戦略を提案しています。形態学的には、老化細胞は一般的に細胞質と核の比が増加し、肥大化して扁平化します。がん誘発性老化では、核が顕著になり、ヘテロクロマチン構成の典型的な変化が観察され、顕微鏡コピー、DAPI染色、またはその他の免疫組織化学技術で検出可能な老化関連ヘテロクロマチンフォーカス(SAHF)の形成につながります(Frey et al., 2018、González-Gualda et al., 2021)。老化誘発因子と細胞の種類に応じて、p16、p53、p21などの細胞周期停止に関連するサイクリン依存性キナーゼの発現、タンパク質レベル、および/または活性が発生する可能性があります。老化はまた、アポトーシス抵抗性、リソソーム含量の増加、部分的なワールブルグシフト(ミトコンドリアのクエン酸回路と酸化的リン酸化から、効率の低い嫌気性解糖プロセスへ)を伴うミトコンドリアの機能不全、およびSASP因子の放出などの代謝変化も誘発します。老化に伴い、リソソーム中の老化関連β-ガラクトシダーゼ(SA-β-Gal)含量の増加とpH 6での活性が認められ、組織化学染色によって容易に検出できます(Di Micco et al., 2021, James et al., 2015, Kwon et al., 2019)。老化関連分泌表現型は非常に多様ですが、炎症性サイトカインであるIL-6およびIL-8は老化細胞中に高頻度に存在します(Di Micco et al., 2021, González-Gualda et al., 2021)。我々の知る限り、消化管老化細胞に対して完全な感度と特異性を持つ老化マーカーはこれまで報告されていません(Choi et al., 2023)。 |
| 2.1. 誘導因子 |
| 細胞老化は、DNA損傷、酸化ストレス、複製の繰り返し、テロメアの短縮または機能不全、がん遺伝子、放射線、化学療法剤、機械的ストレスまたは剪断ストレス、感染症、ヘムタンパク質、飽和脂質など、様々な因子によって誘導される可能性がある(Anderson et al., 2019, Di Micco et al., 2021, Ishaq et al., 2022, Kumari and Jat, 2021, Nath et al., 2024, Tripathi et al., 2021)。核DNA損傷の場合、シグナル伝達カスケードであるDNA損傷応答(DDR)は、細胞周期進行におけるチェックポイントのような役割を果たす(Wu et al., 2023)。一部のDNA損傷応答因子はDNA損傷部位に蓄積し、チェックポイント複製停止を強化するDNA修復フォーカスを形成する可能性がある。このような損傷が持続すると、細胞は老化に入ります。活性酸素種(ROS)はミトコンドリア代謝に本来的に関与していますが、酸化還元の不均衡はタンパク質、DNA、脂質の構造損傷につながります(Juan et al., 2021)。したがって、活性酸素種への曝露が増加すると、損傷の蓄積と細胞機能の喪失につながり、ひいては老化表現型に寄与する可能性があります。さらに、酸化ストレスによって誘発される老化は、機能不全のミトコンドリアの蓄積と関連付けられています。核DNA損傷とミトコンドリア機能不全の間には双方向の関係が存在すると提唱されています(Miwa et al., 2022)。テロメアの短縮は、最初に報告された老化誘発因子の1つです(Zhu et al., 2019)。細胞分裂のたびに、テロメラーゼの発現がない場合、テロメアの長さは短縮します。テロメア末端のキロベースペアが臨界値を超えると、DNA損傷応答が活性化され、老化が促進されます。しかし、DNA損傷はテロメア自体の長さや複製に伴う短縮の有無にかかわらず、テロメア自体にも関連している可能性があります。DNA損傷はテロメアを含む細胞ゲノムにランダムに影響を及ぼす可能性があり、そのような場合、DNA損傷応答カスケードが誘発され、効率的な修復が不可能な損傷を受けたテロメアにおいて持続的に活性化されます(de Magalhães and Passos, 2018)。これが老化の開始に寄与します。がん遺伝子もまた老化を誘発する要因となり得ます。がん遺伝子は活性酸素種によって活性化され、過剰増殖状態、DNA複製パターンの変化、そしてテロメアなどの脆弱領域におけるDNA損傷の蓄積を引き起こします(Zhu et al., 2020)。 |
| 細胞は老化誘導因子に反応して、複製老化(RS)またはストレス誘導性早期老化(SIPS)に入ることがあります。テロメアが極端に短くなると、その機能喪失によって複製老化が誘導され、これはいくつかの種類の体細胞に共通する老化状態です。ストレス誘導性早期老化の発症は、通常、前述の酸化ストレスまたはがん遺伝子活性化に関連しています(Kaur and Farr, 2020)。興味深いことに、DNA損傷は両方のタイプの老化の頻繁かつ一般的な誘導因子です。これは、テロメアも損傷の蓄積やその他のストレス要因を受ける可能性があり、最終的にDNA損傷応答を引き起こすことが多いためです。複製老化とストレス誘導性老化の両方をシミュレートできる細胞培養モデルが開発されています(Bielak-Zmijewska et al., 2014)。例えば、複製老化誘導は、高齢のドナーから細胞を単離するか、初代培養細胞株を使用して複製限界に達するまで継代培養することによって達成できます。 ストレス誘導性早期老化は、細胞を十分な時間ストレス因子にさらすことによって、初代細胞株または形質転換細胞株のいずれでも誘導できます (Ott et al.、2018)。 |
| 2.2. 細胞老化、老化、そして疾患 |
| 細胞老化と老化関連分泌表現型因子の分泌は、有益にも有害にもなり得るため、諸刃の剣と捉えることができる。一部の研究者は、これを拮抗的多面発現の例として挙げている(Giaimo and d'Adda di Fagagna, 2012)。例えば、細胞老化は、中腎などの一時的な構造の胚リモデリングや胎盤の形成と機能に不可欠なプロセスである(Da Silva-Álvarez et al., 2019)。さらに、細胞老化は組織修復や創傷治癒のプロセスにも関与する可能性がある(Wilkinson and Hardman, 2020)。最後に、老化はp53、p16、p21経路の上方制御を介して損傷細胞の増殖を制限することで、腫瘍抑制の重要なメカニズムです(Dodig et al., 2019)。一方、加齢に伴い、おそらくは腸管免疫系による老化細胞の除去の失敗と老化関連分泌表現型因子の分泌によって細胞老化が蓄積し、炎症誘発性環境が生じます。これは今度は腫瘍の発生を促進し、糖尿病、肺疾患、アテローム性動脈硬化症、消化管疾患など、老化の加速を特徴とするいくつかの加齢関連疾患、老年症候群、その他の病態と相関していることが示されています(Kumari and Jat, 2021)。複数の著者は、老化細胞の蓄積といくつかの組織の機能低下/喪失との間に潜在的な因果関係を指摘しています(Wilkinson and Hardman, 2020)。これは前臨床研究でも示されており、老化細胞の除去によって複数の加齢関連表現型の緩和が得られた(Pignolo et al., 2020)。主にマウスを用いた広範な研究により、老化と骨粗鬆症、虚弱、心血管疾患、肺線維症、腎疾患、神経変性疾患、脂肪肝、代謝機能障害、変形性関節症など、いくつかの疾患との因果関係が確立されている。老化細胞の負荷と上記の各疾患との関連を示す既存の証拠に関する包括的かつ詳細な情報については、最近のレビュー(Kaur and Farr, 2020、Palmer et al., 2022、Pignolo et al., 2020、Suda et al., 2023、Tchkonia et al., 2021、Wyles et al., 2022)を参照することをお勧めします。 |
| 要約すると、細胞老化は、DNA損傷や酸化ストレスなどのストレス因子への反応として、本質的に永久的な細胞周期停止を特徴とする重要な生物学的プロセスです。老化は発達、組織修復、がん予防に有益な役割を果たす一方で、加齢に伴う持続性老化細胞の蓄積は慢性炎症や加齢関連疾患の一因となる可能性があります。これらの細胞を特定し、新たな治療法で標的とすることで、老化による悪影響を軽減し、全体的な健康状態を改善できる可能性が期待されます。 |
| 3. 腸管における加齢変化 |
| 3.1. 生涯にわたる腸内細菌叢構成の変動 |
| 腸内細菌叢は、ヒト宿主と密接に相互作用する数百万の共生微生物群を含み、一部の研究者は腸内細菌叢自体を一つの生物とさえ呼んでいます。腸内細菌叢は、細菌、ウイルス、古細菌、単細胞真核生物など、複数の種類の微生物で構成されています。これらの微生物群の中で最も多くを占める細菌群は、全微生物叢のほぼ98%を占め、フィルミクテス門、バクテロイデス門、プロテオバクテリア門、放線菌門の4つの主要門に属しています。腸内細菌叢とヒト宿主の間には共生関係があり、相互に有益な関係であり、主に産生される代謝物によって媒介されています。例えば、腸内細菌叢は難消化性繊維を発酵させて短鎖脂肪酸(SCFA)を生成するため、腸内細菌叢は食物の消化と栄養素の吸収において重要な役割を果たします。これらは主に結腸上皮細胞に吸収され、エネルギー源やムチン生成の原料として利用されるか、さらに血流に乗って他の組織に運ばれ、そこで炭水化物や脂質の代謝調節に寄与するなど、さまざまな効果を発揮します(Cӑtoi et al.、2020、Ragonnaud and Biragyn、2021)。 |
| 微生物のコロニー形成は出生後に始まり、出産形態(例:自然分娩 vs. 帝王切開)、民族、栄養、免疫刺激、その他の環境要因に大きく依存します。しかし、幼少期の腸内細菌叢はビフィズス菌が優勢な単純な構造をしています。時が経つにつれて複雑さが増し、12歳頃に安定し始め、その後中年期まで安定した状態を保ちます。加齢に伴い、腸内細菌叢は様々な変化を遂げます。ヒトを対象とした縦断的研究や介入研究が不足しているため、これらの変化と老化との因果関係を特定することは困難ですが、いくつかの暫定的な結論が導き出されています。例えば、野生型マウスの糞便微生物叢移植を受けた早老マウスは、移植を受けなかったマウスよりも長生きしました(Wang et al., 2021)。さらに、アッカーマンシア・ムシニフィラを併用した糞便微生物移植を受けた早老マウスは、未治療の早老マウスと比較して寿命が延長した(Narasimhan et al., 2021)。これは、腸内細菌叢と長寿の相関関係を示唆している。種レベルでの一般的な差異を指摘することは困難であるが、門レベルでは、フィルミクテス門とプロテオバクテリアの増加、バクテロイデス門の減少など、確認できる変化がある。さらに、腸内細菌、連鎖球菌、ブドウ球菌といった、炎症誘発性の病原性細菌の増殖が報告されている(Askarova et al., 2020)。他の研究者は、このような腸内細菌叢組成の変化を、亜優勢種の個体数増加を伴う再編成と見ている。腸内細菌叢の文脈において、α多様性の概念は、特定の環境における微生物種の多様性(豊かさ)と豊富さ(均一性)を指すため、非常に重要です。α多様性の低下は、高齢者や虚弱者でよく見られ、通常、ディスバイオシス(腸内細菌叢の乱れ)、認知障害、炎症性病態に関連しています(Badal et al., 2020)。さらに、同じ社会集団内に住む人々の間で微生物叢が伝播するという証拠も増えています(Ragonnaud and Biragyn, 2021)。最近では、介護施設に入居している個人の腸内細菌叢構成に類似性が見られるだけでなく、介護施設全体で入居1年後に炎症性および病原性の種の増加とディスバイオシスの有病率の増加という一般的なパターンも観察されています(Haran et al., 2021)。対照的に、しばしばサクセスフル・エイジングの例として考えられる100歳以上の高齢者の腸内細菌叢は、一般の高齢者集団の腸内細菌叢とは異なっています。例えば、フィルミクテス門は依然として優勢な門ですが、多様性の喪失が見られ、特にクロストリジウム・クラスターXIVaの減少とクロストリジウム・クラスターIVの再編成が見られます。さらに、100歳以上の高齢者は、いくつかの病原性細菌を含むプロテオバクテリアの存在量が多い一方で、酪酸産生細菌の存在量が増加しています(Cӑtoi et al., 2020)。 |
| ディスバイオシスは、微生物群集構造における大きな変化または不均衡と定義されることが多い。これらの変化が加齢に伴って起こる場合、免疫機能障害や併存疾患を伴って発生することが多い。腸上皮は細胞のターンオーバーが速く、陰窩に存在する幹細胞によって通常3~5日ごとに再生される。この組織はDNA損傷に対して非常に敏感である。細胞は上方に移動するにつれてアポトーシスを起こし、腸管腔へと排出される。加齢に伴い、腸管構造もいくつかの変化を起こし、上皮バリアの完全性、再生能力、粘液層の構成、蠕動運動に影響を与えます。さらに、加齢腸では、陰窩と絨毛のサイズが増大し、陰窩の数は減少し、パネート細胞(抗菌ペプチドや宿主防御に重要なその他の成分を放出する分泌細胞)、杯細胞(粘液を産生する細胞)、幹細胞などの細胞構成が変化し、腸陰窩の再生機能が低下していることが示唆されます。これは通常、リーキーガット(腸漏れ)を引き起こし、細胞のターンオーバーが低下します。これにより、腸内細菌叢由来の代謝産物が腸内を通過し、加齢に伴う全身性炎症、すなわちインフラマジン(炎症老化)の一因となります(Bosco and Noti, 2021、Nalapareddy et al., 2022)。 |
| 3.2. 腸内細菌叢、老化、免疫老化、そして炎症老化 |
| 腸内細菌叢、老化、免疫老化、炎症老化、そして疾患発症の関係は「循環的な因果関係」を表しており、これらのメカニズムのどれが原因または結果であるかを判断することは困難です。前述のように、炎症老化は免疫老化の概念と関連する老化の柱の一つですが、炎症老化が免疫老化とどのように関連しているかは完全には解明されていません(Fulop et al., 2018、Santoro et al., 2021)。免疫老化の状態は、主に適応応答に影響を及ぼす免疫機能の全体的な低下と定義できます。この過程で、T細胞などの免疫細胞のサブセットが老化するように見えます。炎症老化は、自然免疫応答の慢性的な刺激と関連しています。進化論的な観点から見ると、腸管免疫系における加齢に伴う変化は、様々な課題への反応と捉えることができます(Fulop et al., 2018、Santoro et al., 2021)。高齢者の多くが加齢に伴う疾患を抱えているという事実は、炎症が有害な役割を果たす不適応、つまり不均衡を示唆しています。対照的に、長寿で成功した人々は、事実上サクセスフル・エイジングのモデルであり、様々な課題に適応し、適切にバランスのとれた免疫応答を維持できているため、疾患の発症が遅延または軽減されている可能性があります(Fulop et al., 2018)。炎症老化には、免疫老化、酸化ストレス、加齢に伴う細胞破片の蓄積と処理能力の低下、テロメアの短縮、核DNA損傷など、多くの要因が寄与する可能性があります。その他の要因としては、過剰なエネルギーや栄養素、遺伝的素因、老化細胞から放出される老化関連分泌表現型因子、腸管壁を介した炎症性細菌産物の腸管壁外への転座などが挙げられます(Campisi et al., 2019, Santoro et al., 2021)。Narasimhan et al. (2021) は、全身性炎症を引き起こす可能性のある慢性炎症(インフラメイジング)は、老化細胞、ディスバイオシス、そして腸管壁のリーキーガットに起因すると示唆しています(図1)。また、腸内細菌叢の加齢に伴う変化が慢性炎症の誘因となると考える人もいます(Fernandes et al., 2019, Santoro et al., 2021, Santoro et al., 2020)。腸管由来の炎症は、消化管全体に広がる広範なパターン認識受容体の存在と関連している可能性があり、これらの受容体は局所腸間膜リンパ節を介して腸管粘膜全体との継続的なコミュニケーションを確保しています(Nagpal et al., 2018)。したがって、慢性炎症経路とその腸管関連誘導因子を標的とすることは、加齢関連疾患の予防または緩和のための有益な戦略となる可能性があります。 |
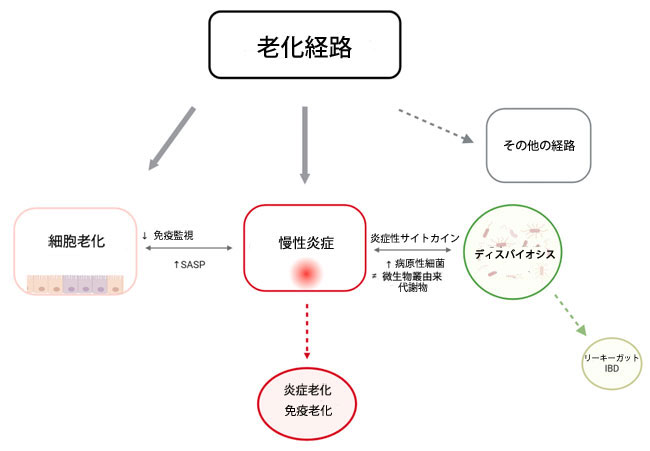 |
図1. 細胞老化、慢性炎症、腸内およびその微生物叢の関係を示す模式図。 SASP:老化関連分泌表現型、ディスバイオシス:腸内細菌叢の乱れ、リーキーガット:腸漏れ、IBD: 炎症性腸疾患 |
| 3.3. 老化、腸内代謝物、そして腸疾患 |
| 腸内細菌叢由来代謝物は、腸の恒常性と疾患において重要な役割を果たします。これらは通常、食事由来代謝物(短鎖脂肪酸、インドール誘導体など)、新規合成代謝物(多糖類A、ポリアミン、細菌性ビタミンなど)、そして宿主によって生成され腸内細菌叢によって修飾される代謝物(二次胆汁酸など)に分類されます(Agus et al., 2021、Liu et al., 2022、Wu et al., 2021)。これらの代謝物の潜在的な利点を詳細に説明することは、本レビューの範囲を超えています。読者はLiu et al. (2022)などの包括的なレビューを参照することができます。実際、腸内細菌叢は多数の生理活性代謝物を産生することができ、この分野は未だほとんど研究されていません。それらの中でも、短鎖脂肪酸(酢酸、酪酸、プロピオン酸)は最も研究されている代謝産物のクラスであり、腸の恒常性維持に幅広い利点を発揮することが報告されているため、言及に値します。その利点には、管腔内pH値を低下させる維持、善玉菌の増殖促進、粘液産生の調節(腸バリアの維持に役立つ)、全体的な代謝へのプラスの影響などが含まれます(Silva et al.、2020)。これらの短鎖脂肪酸は結腸細胞によって吸収されてエネルギー源として使用され、残りの脂肪酸は循環系に入り、他の組織や臓器に到達します。多くの機能の中でも、プロピオン酸と酢酸は、それぞれ糖新生と脂肪生成に寄与する肝臓基質として機能します。酪酸は局所的に作用して、ヒストン脱アセチル化酵素と関連するシグナル伝達経路を阻害することで抗発がん効果を発揮し、それによって大腸がん細胞の増殖を抑制します。しかし、腸内の短鎖脂肪酸やその他の有益な代謝物の濃度は加齢とともに低下します。これはおそらく、腸内細菌叢組成の変化と、糖分解代謝からタンパク質分解代謝への優先代謝経路の変化によるものと考えられます(Askarova et al., 2020、Cӑtoi et al., 2020)。さらに、これらの変化は、健康な腸内細菌叢の乱れによって出現し、増殖すると疾患につながる可能性のある日和見微生物である病原微生物に利益をもたらす可能性があります。腸管バリア機能のこのような阻害は、炎症誘発性経路を活性化し、炎症性腸疾患などの炎症性疾患の発症に寄与する可能性があります。潰瘍性大腸炎やクローン病を含むこの疾患群は、現在加齢関連疾患として分類されていないものの、高齢患者の間で増加しています(Faye and Colombel, 2022)。この傾向は、これらの疾患の死亡率が比較的低く、一般人口における発症率が安定していることが、これらの疾患を患う高齢者の増加につながっていると考えられます。これらの疾患が老化する免疫系とどのように相互作用するかを考えることは興味深いことです。炎症性腸疾患を患う高齢患者は、生物学的老化に伴う老化細胞の自然な蓄積を経験する可能性があります。相関関係のみが確立されているものの、炎症、テロメア機能不全、老化、そして炎症性腸疾患は相互に関連した経路を介して作用します。例えば、クローン病患者は細胞老化分子マーカー(p21およびp16)の発現とテロメアの変化が増加しており、これらは疾患の進行や粘膜炎症に関連している可能性があります(Faye and Colombel, 2022, Hold et al., 2014, Sienkiewicz et al., 2023; Tchkonia and Kirkland, 2018; Wyles et al., 2022)。 |
| 細胞老化は細胞増殖を制御することで炎症性腸疾患における重要なプロセスである可能性があるが、老化関連分泌表現型因子への継続的な曝露は炎症をさらに悪化させる。損傷組織において老化細胞を除去するために動員されるマクロファージは、動員数の減少とマクロファージの損傷により、その機能を果たすことができないという仮説がある(Prata et al., 2018)。その結果、細胞老化が蓄積し、炎症をさらに悪化させる可能性がある。さらに、高齢の炎症性腸疾患患者は寿命が短く、糖尿病、心血管疾患、認知症などの加齢に伴う疾患を発症するリスクが高い(Sienkiewicz et al., 2023)。腸内細菌叢とその代謝物が炎症性腸疾患の病態形成に及ぼす影響は無視できない。 炎症性腸疾患患者の腸内細菌叢では、特定の分類群の分布状況の変化を伴う多様性の低下が見られ、その結果、群集構造が変化しています(Alshehri et al., 2021, Vestergaard et al., 2024)。門レベルでは、フィルミクテス門とバクテロイデス門の割合が減少し、プロテオバクテリアと放線菌の割合が増加しています。さらに、フェカリバクテリウム・プラウスニッツィ、クロストリジウム属、バクテロイデス・フラギリスなどの善玉菌の存在量も減少しているようです。その結果、短鎖脂肪酸の産生量だけでなく、ムチンや抗菌ペプチドの産生も減少し、タイトジャンクションタンパク質の調節異常も生じます。同時に、腸内細菌科に属する潜在的な病原菌(凝集性および侵襲性の大腸菌およびH2S産生菌)が増加し、転座する(Baldelli et al., 2021、Lavelle and Sokol, 2020)。興味深いことに、このシナリオは潰瘍性大腸炎よりもクローン病でより顕著である(Sultan et al., 2021)。 |
| したがって、腸内細菌叢の加齢に伴う変化は健康に大きな影響を与え、炎症老化や免疫老化などの病態に寄与します。腸内細菌叢の構成は生涯を通じて変化し、成人期には安定しますが、加齢とともに多様性が低下し、しばしばディスバイオシス(腸内細菌叢の乱れ)を引き起こします。この不均衡は、炎症の増加や加齢関連疾患への感受性の上昇と関連しています。短鎖脂肪酸などの有益な代謝物の存在は減少し、炎症誘発性の菌種が増加します。これらの変化は腸内環境の健全性を損ない、全身性炎症を促進し、炎症性腸疾患などの疾患と関連しています。加齢に伴う腸内細菌叢の変化を理解し、その変化を標的とすることで、健康への悪影響を軽減できる可能性があります。 |
| 4. 老化治療薬としての植物化学物質 |
| 4.1. 老化治療薬:合成化合物と天然化合物 |
| 老化治療薬は重要性が高まっており、その作用機序に基づき、老化細胞除去薬(セノリティックス)または老化細胞阻害薬(セノモルフィック)に分類できます。老化細胞除去薬(訳者注:セノリティクスとは、老化細胞を特異的に除去する化合物の総称です。老化(senescence)と分解・除去(lytics)を組み合わせた言葉で、体内に蓄積する老化細胞を標的にして死滅させることで、加齢に関連する疾患の予防や治療への応用が期待されています)は、生存促進経路およびアポトーシス抑制経路に関連する酵素を標的とすることで、老化細胞において選択的にアポトーシスを誘導する薬剤です。最もよく用いられるメカニズムは、エフリン依存性Srcキナーゼ、BCL-2、またはHSP90(細胞増殖に関連するシャペロンタンパク質ファミリー)を標的とするもの、あるいはp53またはp21経路を標的とする化合物です(Fuhrmann-Stroissnigg et al., 2017、Roos et al., 2016、Wissler Gerdes et al., 2020、Zhu et al., 2015)。老化細胞除去薬に関する最近の革新的な戦略の一つとして、細胞毒性薬剤を封入したガラクトース被覆ナノ粒子を用いた栄養補助食品としてのアプローチがあります。このナノ粒子は、SA-β-Galの量と活性の増加により、老化細胞を選択的に標的とすることができます(Di Micco et al., 2021)。文献では、様々な老化細胞除去薬が同定されており、それらが老化細胞を標的として除去するメカニズムも明らかにされていますが、最も確立された老化細胞除去薬はダサチニブ、ケルセチン、フィセチンです(Zhang et al., 2023)。 |
| ダサチニブを投与した動物を用いた最近の前臨床試験では、代謝機能と脂肪組織の改善が示されています(Islam et al., 2023)。また、ダサチニブとケルセチンを併用した高齢動物では、老化マーカーの悪化や特定の循環血中または脂肪組織常在免疫細胞の増加を特徴とする炎症老化が緩和されたことが示されています(Ruggiero et al., 2023)。ダサチニブは、単独またはケルセチンとの併用で、糖尿病性腎疾患(Hickson et al., 2019)、特発性肺線維症(Justice et al., 2019)、およびアルツハイマー病(Gonzales et al., 2023)の特定の側面に対処する安全かつ効果的なアプローチとして、第I相および第II相臨床試験で検証されています。天然フラボノイドであるフィセチンは、炎症および虚弱性を軽減する作用(NCT03675724およびNCT03430037)、ならびに骨格の健康を改善する作用(NCT04313634)について、現在進行中の第II相臨床試験において老化細胞除去薬としての有効性が検討されています(Chaib et al., 2022)。老化細胞除去薬とは対照的に、老化細胞阻害薬(セノモルフィック)(訳者注:セノモルフィックとは、老化細胞の表現型のうち、慢性炎症を惹起するなどの「負の作用」のみを阻害(主に、老化関連分泌表現型因子の分泌を低下)する標的薬の総称である)は、転写レベルでの老化関連分泌表現型因子産生を阻害するか、分泌された老化関連分泌表現型因子の作用を中和することによって作用します(Zhang et al., 2023)。これらの化合物は、老化関連分泌表現型因子の放出に関連する経路(mTOR、JAK/STAT経路、p38MAPKなど)、老化関連分泌表現型遺伝子を制御する転写因子(NF-κBなど)、またはIL6、IL8、IL1α、TNF-αなどの老化関連分泌表現型因子に対する特異的中和抗体を標的とすることができます(Di Micco et al., 2021、Kaur et al., 2020、Lagoumtzi and Chondrogianni, 2021)。このクラスの化合物の中では、メトホルミン、ラパマイシン、ルキソリチニブが最もよく知られています。2型糖尿病治療薬であるメトホルミンは、老化防止剤(ゲロプロテクター)(訳者注:ゲロプロテクターは、老化や加齢に伴う疾患の根本原因に作用し、動物の寿命を延ばすことを目的としています)として有望な結果を示しています。実際、疫学研究では、糖尿病患者と非糖尿病患者の両方において、加齢関連疾患の発症率と全死亡率の低下が実証されています。多数のin vitroおよびin vivo前臨床研究において、メトホルミンは炎症性サイトカイン、NF-κBシグナル伝達のダウンレギュレーション、およびNrf2-Gpx7の活性化を介して、細胞老化を含むいくつかの老化特性に作用する可能性が示唆されています(Kulkarni et al., 2020)。mTOR阻害剤であるラパマイシンは、当初は抗真菌化合物として発見されましたが、免疫抑制剤および抗増殖剤として認識されました(Suto and Karonitsch, 2020、Wang and Eisen, 2022)。最近では、細胞株および動物モデルを用いた前臨床試験において、少なくとも環境変動が最小限に抑えられ、老化細胞負荷が軽減され、老化関連分泌表現型が軽減される条件下では、メトホルミンが寿命を延ばす可能性があることが示唆されています(Wang et al., 2017、Zhang et al., 2023)。おそらく、セノリティック薬はセノモルフィック薬よりも優位性があると考えられます。なぜなら、老化細胞の除去は老化関連分泌表現型阻害剤の持続投与に代わる決定的な解決策となるからです。しかし、老化細胞の完全除去および/または長期除去の副作用は検討されていないため、この点は明確ではありません(Di Micco et al., 2021)。さらに、このような薬剤は老化細胞を正確に標的とし、アポトーシスを誘導する必要があります。 |
| 合成老化治療化合物は、全身作用および固有の用量依存的毒性に関する疑問を提起する(Kaur et al., 2020)。例えば、別の老化細胞除去薬であるナビトクラックスは、血液毒性を引き起こす(González-Gualda et al., 2020)。一方、多くの植物化学物質は抗酸化作用および抗炎症作用を有し、潜在的な老化細胞除去作用または老化形態形成作用を示唆している(Zhang et al., 2023)。しかし、天然化合物は老化細胞に対する選択的作用に加えて、複数の標的および相互作用を有する可能性がある(Zhang et al., 2023)。これは、その広範な作用機序と全身作用を考慮すると、植物化学物質を老化治療薬として研究することの重要性が高まっていることを示しています。 |
| 4.2. 老化抑制剤/老化形態制御剤としての植物分子 |
| 老化防止剤(ゲロプロテクター)という概念は登場したが、定義や基準については科学界全体でコンセンサスが得られていない。しかしながら、老化防止剤は、健康寿命の延伸を目的として、細胞老化などの分子的、細胞的、または生理的な老化の特徴を減弱させるべきであるという点では、ある程度の合意が得られている(Moskalev, 2023; Schork et al., 2022)。老化防止剤は、抗酸化作用、抗糖尿病作用、免疫調節作用を持つ化合物であり得る(Moskalev et al., 2017)。興味深いことに、抗炎症作用および抗酸化作用を持つ分子は、重複する経路により、老化の抑制または老化関連分泌表現型の調節を通じて老化治療作用を示す可能性が高い(Zhang et al., 2023)。 |
| 医学的には、植物由来製品は主要な医薬品源であり、伝統中国医学において数千年にわたり使用されています。合成医薬品や微生物由来医薬品の台頭にもかかわらず、植物由来化合物は依然として大きな生理活性ポテンシャルを有しています(Islam et al., 2021、Xiao and Bai, 2019)。植物分子、すなわち植物の二次代謝物は、生化学プロセスへの影響について広く研究されており、興味深い生理活性ポテンシャルを示しています。これらの化合物は構造的に多様であり、フェノール化合物、植物ステロール、テルペン、窒素含有化合物、硫黄含有化合物に分類でき、さらにサブクラスに分類されます(Twaij and Hasan, 2022、Wang et al., 2022)。フェノール化合物(PC)は、植物代謝物の中で最も研究が進んでいるグループの一つであり、フェノール酸、フラボノイド、スチルベン、リグナン、タンニンに分類されます(図2)。これらは野菜、果物、穀物に豊富に含まれており、バランスの取れた食事にも含まれています(Direito et al., 2021)。フェノール化合物の長期欠乏は、2型糖尿病、胃腸障害、神経変性疾患、さらには特定の癌のリスク増加と相関関係にあることが示されています(Cory et al., 2018、Kasprzak-Drozd et al., 2021)。しかし、ヒトにおけるフェノール化合物の効果を正確に判定することは、食事摂取量の大きな変動、関連する食習慣、食品間でのフェノール化合物含有量の差、食品マトリックスとのフェノール化合物の相互作用、そして個人差のある代謝への影響など、いくつかの理由から困難です(Eseberri et al., 2022, Kasprzak-Drozd et al., 2021)。しかし、疫学研究を通じて、ポリフェノールを豊富に含む食品の摂取と疾患予防との相関関係を見出すことが可能となっています(Scalbert et al., 2005)。フェノール化合物には抗酸化作用、抗炎症作用、抗菌作用、抗腫瘍作用といった明確な潜在能力があるにもかかわらず、バイオアベイラビリティが低いため、治療への応用は限られてきました(Albuquerque et al., 2021, Kasprzak-Drozd et al., 2021)。テルペンは植物二次代謝物の中で最大かつ最も多様なクラスを占めているにもかかわらず、天然の老化防止剤としての可能性を考慮すると、研究はこれまであまり進んでいません(Proshkina et al., 2020)。テルペンは、炭素数によってモノテルペン、セスキテルペン、ジテルペン、トリテルペン、テトラテルペン、ポリテルペンに分類されます。これらの化合物とその誘導体は、化粧品や皮膚への応用に関連しており、かゆみや痛みを和らげる軟膏やクリームなどの製剤への使用を含め、ヘルスケアや製薬業界において重要な役割を担っています(Jahangeer et al., 2021)。このクラスの植物化学物質は、in vitroおよびin vivo研究において、抗炎症作用、抗腫瘍作用、抗酸化作用、抗菌作用、抗真菌作用、抗ウイルス作用、抗寄生虫作用、抗凝固作用、鎮痛作用、鎮静作用などの生理活性を有することが実証されています(Rodríguez and Johnson, 2023)。テルペンの中には、溶解性や生物学的利用能が低く、不安定で、場合によっては揮発性を示すものもあります。 |
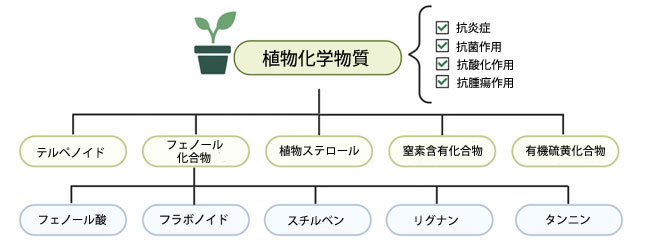 |
| 図 2. さまざまな種類の植物化学物質と、それらに関連する最も一般的な生理活性特性の概略図。 |
| フェノール類は、腸内細菌叢の組成や腸管上皮に影響を及ぼす可能性についても研究されてきました。フェノール化合物が腸内細菌叢に及ぼす影響の一例として、アッカーマンシア・ムシニフィラに対するプレバイオティクス様作用が挙げられます(Alves-Santos et al., 2020)。フェノール化合物の腸内細菌叢への影響は一般化されておらず、多くの影響はフェノール化合物ごとに特異的です。さらに、フェノール類には抗菌作用もあり、これが他の有益な細菌を増加させる作用機序である可能性があります。他の報告では、フェノール類が腸内細菌叢の多様性の全体的な増加に寄与する可能性があることが示唆されています(Farràs et al., 2020)。腸内細菌叢によるフェノール化合物のバイオコンバージョンは、この相互作用の別の側面を表しており、これらの化合物の生物学的利用能と有効性に影響を与えます(Santino et al., 2017)。これらの植物化学物質は、前臨床研究で実証されているように、NF-κB経路を介して腸の炎症にも対処することができます(Laurindo et al., 2023)。さらに、フェノール化合物は接合タンパク質をアップレギュレーションすることで腸のバリア機能の維持にプラスの影響を与える可能性があります(Sandoval-Ramírez et al., 2021)。また、フェノール化合物は上皮透過性と炎症シグナルを制御するAMPKを活性化し、腸の恒常性維持に寄与するという報告もあります(Domínguez-Avila et al., 2021)。細胞の観点から見ると、フェノール化合物はシグナル伝達経路に作用し、それが増殖、アポトーシス、分化、酸化還元バランスなど、様々な細胞プロセスに影響を与える可能性があります。さらに、フェノール化合物は腫瘍抑制遺伝子を上方制御し、細胞周期停止を誘導し、NF-κB(免疫応答に関連する転写因子)および NrF2 活性化(抗酸化応答に関連する転写因子)をモデル化することさえできます(Direito et al., 2021、Fakhri et al., 2022)。 たとえば、フィセチンは、抗炎症、抗酸化、抗菌、抗発癌活性が認められている天然に存在するフラボノイドです(Ravula et al., 2021)。 さらに、BCL-2 経路を介してアポトーシスを選択的に誘発できるため、潜在的な老化細胞除去薬です(Partridge et al., 2020、Yousefzadeh et al., 2018、Zhu et al., 2017)。 |
| 4.3. 腸疾患に対する栄養補助食品としての植物分子 |
| フェノール化合物は、老化に関連する細胞プロセスに影響を与え、炎症を軽減し、腸内細菌叢組成を高めることから、老化治療薬としての可能性を示唆しています。このことから、フェノール化合物は老化を標的とし、炎症性腸疾患(IBD)などの腸の炎症関連疾患を管理する上で有用となる可能性があります。例えば、ケルセチンは強力な抗酸化物質であり、老化細胞における抗アポトーシス遺伝子および経路を阻害する老化抑制剤と考えられているフラボノイドです。さらに、ケルセチンはクルクミンやレスベラトロールと同様に、大腸炎の動物モデルにおいて有効性と安全性が報告されている化合物です(Martin and Bolling, 2015)。緑茶カテキンやオリーブ由来ポリフェノールなど、他のいくつかの化合物も老化治療の可能性を示し、炎症性腸疾患関連の炎症を緩和する能力も示しています(H Farzaei et al., 2015、Sharma, 2021、Yousefzadeh et al., 2018、Zhang et al., 2023)。しかしながら、これらの化合物の有効性は弱く、作用機序の一部は完全には解明されていないことを指摘しておくことが重要です。 |
| テルペンは腸の炎症を治療する可能性もあるかもしれません。私たちが知る限り、臨床試験は実施されていませんが、予備研究では、カルノシン酸、グリチルリチン、コンパウンドK、オレウロペインが安全性と免疫調節作用を持つことが示唆されています(Rodríguez and Johnson, 2023)。Araruna、Serafim、Alves Juniorら(Araruna et al., 2020)は、12種類のテルペンの抗炎症活性をin vitroおよびin vivoモデルで検討し、炎症性腸疾患治療の可能性について検証しました。その結果、テルペンは幅広い経路で抗炎症活性を発揮するという考えが裏付けられました。例えば、ゲラニオールとオレアノール酸は炎症性サイトカインの放出を阻害し、NF-κBを阻害しますが、D-リモネンとチモールはMAPKシグナル伝達経路を抑制します。テルペンは、腸内細菌叢組成を正に調整することで腸の恒常性維持にも寄与する可能性があります。例えば、カルノシン酸は大腸炎マウスモデルにおいて炎症を軽減し、潜在的な病原体の増殖を抑制することが報告されています(Du et al., 2023)。ジンセノサイドRk3は細菌の多様性を高め、プロバイオティクス細菌の増殖を促進することが報告されています(Bai et al., 2021)。さらに、テルペンはその特性から老化防止剤としても機能する可能性があります。Proshkina et al. (2020) は、化合物が老化防止効果を持つ可能性を示唆する様々な基準(ストレス耐性、毒性、寿命延長、老化バイオマーカーなど)に基づいて、多数のテルペンを系統的に検討し、ほとんどのテルペンクラスに老化防止効果を含む老化防止効果を持つ化合物が含まれていると結論付けました。例えば、フコキサンチンはヒト線維芽細胞における老化に対する保護効果を示し、ジンセノシドとルペオールはβ-SA-Gal、p16、p21、p53などの老化マーカーをダウンレギュレーションし、樟脳は細胞老化を減弱させる能力を示した(Liu et al.、2021; Song et al.、2014)。 |
| これらの化合物の効果を調査した研究を包括的に検討した結果、腸の炎症を緩和することを目的とした経路と、細胞老化に関与する経路、特に炎症性サイトカインに関連する経路との間に類似点が明らかになりました。表1は、フェノール化合物とテルペンが腸管関連疾患および細胞老化経路に及ぼす影響を調査した主要な研究をまとめたものです。この表は、これらの植物化学物質の抗炎症作用、抗酸化作用、抗老化作用など、多面的な作用を強調しており、抗炎症作用と抗酸化作用を持つ化合物が老化治療の可能性を持つ可能性があるという考えを裏付けています。 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
| 食事中の植物化学物質は、腸内細菌叢に直接影響を与えたり、腸内細菌叢によってさらに代謝されたりする可能性があります。ポリフェノールはこの現象の典型的な例であり、腸内細菌叢に対してプレバイオティクス効果を発揮したり、腸内微生物によって生体内変換されたりする可能性があります(Gadecka and Bielak-Zmijewska, 2019)。ポリフェノールは、小腸上皮細胞の刷子縁に存在する酵素であるラクターゼ-フロリジン加水分解酵素によってアグリコンに加水分解され、受動拡散によって吸収されます。しかし、ポリフェノールは一般的に吸収されにくく、ほとんどがそのまま結腸に到達します。結腸に到達すると、腸内細菌叢酵素は加水分解、開裂、または還元反応を触媒することができます。ポリフェノールは代謝物に抱合され、より容易に吸収されます(Davinelli and Scapagnini, 2022, Wu et al., 2021)。しかしながら、生体内変換反応は植物化学物質の種類や遺伝子組み換え体の組成に依存するため、非常に多様で予測や分類が困難です。この多様性により、植物化学物質が遺伝子組み換え体によって、元の分子とは全く異なる生物活性を持つ小分子に分解される可能性があるため、無数の結果が生じます。さらに、これらの生体内変換の結果、元の化合物よりも毒性が低い化合物も高い化合物も生成される可能性があります。例えば、炎症性腸疾患(IBD)のマウスモデルにカルノシン酸を投与したところ、炎症や遺伝子組み換え体の組成に効果があったことに加え、糞便のメタボロームプロファイルが変化し、グルタミン-グルタミン酸とトリプトファンの代謝が促進されました(Du et al., 2023)。別の例として、遺伝子組み換え体によるアミグダリンの有毒なシアン化物への加水分解が挙げられますが、これは中毒を引き起こしません。対照的に、潜在的に神経毒性のあるアルカロイドであるトリカブトは、遺伝子組み換えによって腸管吸収が低下する化合物に変換されます (Wang et al., 2022)。 |
| 複数の種類の植物化学物質(フィトケミカル)に共通する抗炎症、抗酸化、抗腫瘍作用は、それらの潜在的な老化治療効果を示唆しています。実際、植物化学物質が標的とする経路は、細胞老化や炎症性腸疾患において変化する経路としばしば重複しています。さらに、いくつかの分子自体、特に老化細胞や腸管恒常性維持に関して、その有益な効果が認められていることに加え、これらのフィトケミカルが持つ生理活性ポテンシャルを考慮すると、遺伝子組み換えによる代謝についても研究する価値があります。 |
| 5. 今後の展望 |
| 細胞老化の研究は、老化科学と非常に関連性の高い研究分野であり続けています(Gasek et al., 2021)。しかし、老化細胞集団は非常に多様であり、老化には異なるタイプがあり、これらの細胞は異なるヒト組織間でセクレトーム(訳者注:セクレトームとは、細胞が細胞外へ分泌するタンパク質、エクソソーム、サイトカイン、成長因子などの総称です)、代謝、表現型などの特徴を獲得するわけではありません。線維芽細胞の老化は広く研究されていますが、消化管、特に腸管に関連する組織の老化に関する研究は不足しています。例えば、腸管上皮細胞の細胞ターンオーバーが高いことを考えると、老化が腸にどのように影響するか、具体的にはどの細胞が老化細胞量と老化関連分泌表現型放出に最も寄与しているかを詳細に理解することが重要です。そのため、腸管老化を探求し、これらの組織に特有の新たな特性を調査することは興味深いでしょう。複製またはストレス誘導による老化をin vitroでシミュレートし、ますます複雑化する細胞培養モデルを用いて、様々な細胞タイプにおける老化の特徴を完全に解明することは有用であろう。さらに、こうした研究は、腸管における老化の標準化モデルの基礎を築き、新たな老化治療薬のスクリーニングに有用な基準を明らかにすることにもつながる可能性がある。補完的な観点から、老化細胞の蓄積と老化関連分泌表現型因子の持続的な放出が、様々な組織(骨、脳、筋肉など)におけるいくつかの疾患の発症に影響を及ぼすことが示されている。したがって、老化細胞とその老化関連分泌表現型が腸の炎症や腸内細菌叢の乱れに寄与し、それが炎症性腸疾患などの疾患に影響を及ぼす可能性があると推論するのは妥当である。しかし、老化と慢性腸炎とのこの潜在的な関連性については、まだ十分に研究されていない。 |
| 植物化学物質は、広範囲に研究されてきた多様な生理活性を包含しています。中でも、フェノール化合物とテルペンは、抗炎症作用と抗酸化作用を持つことから、老化防止剤として特に研究されてきました。これらの作用は、加齢に伴う多くの合併症を軽減します。単一の化合物が複数の経路を介してこれらの効果を発揮する可能性があります。これらの経路は、老化の発現に関与する経路と重複する可能性があります。したがって、これらの植物化学物質を老化治療薬(セノリティクス)(訳者注:セノリティクスは、細胞老化に対処する治療法で、老化や加齢関連疾患に起因する老化細胞を標的とする戦略です。セノリティクスには、老化細胞を選択的に殺す「セノリティクス」、老化細胞の分泌物を抑制する「セノモルフィックス」、および免疫系が老化細胞を標的とするのを助ける戦略などがあります)として研究し、関与する経路を解明することは重要です。そうすることで初めて、植物化学物質は、重篤な副作用を引き起こす可能性のある合成老化治療薬の代替となる可能性があります。しかしながら、植物化学物質のバイオアベイラビリティが低いため、その有効性が阻害される可能性があります。さらに、バイオコンバージョン反応を介して遺伝子組換え体と相互作用することで、バイオアベイラビリティだけでなく、バイオポテンシャルも変化する可能性があります。 フェノール化合物とテルペンは数が多いため、それらの代謝によって生成される腸内代謝物を予測・分類することは困難です。そのため、ファイトケミカルの2つの側面(できれば動物モデル)を明らかにすることが重要です。それは、生成される腸内代謝物と、これらの化合物が結腸に到達して生理活性を維持するデリバリーシステムを用いた標的放出の影響です。 |
| 6. 結論 |
| 加齢に伴う細胞老化と疾患の発症には明確な関連性がある。さらに、腸管止血は、腸内細菌叢組成と炎症を制御することで、疾患老化であれ健常老化であれ、老化に深く関与していると考えられる。細胞老化と腸内細菌叢の新たな関連性はますます重要になってきており、腸管上皮構造の加齢に伴う変化は腸内細菌叢の乱れによって引き起こされ、それがリーキーガット(腸漏れ)などの病態につながる可能性がある。腸内細菌叢由来の代謝物は、老化関連分泌表現型によって誘発される炎症を局所的または全身的に増強させる可能性がある。一方で、これらの化合物は老化関連分泌表現型を抑制し、老化とその有害な影響に対処する可能性も秘めている。同時に、植物化学物質は老化防止剤(ゲロプロテクター)として機能し、細胞老化への影響と腸内細菌叢への正の相関関係など、複数の老化経路に対処する可能性を秘めている可能性がある。これにより、老化関連分泌表現型の蓄積、炎症、そして最終的には健康的な老化を妨げる可能性のある病気を防ぐ方法として、植物化学物質の補給を通じて健康な腸内細菌叢を維持する新しい戦略が明らかになる可能性があります。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Ageing Research Reviews Volume 104, February 2025, 102619に掲載されたThe senotherapeutic potential of phytochemicals for age-related intestinal disease.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


