ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
老化抑制性植物化学物質の腸内細菌叢への影響:包括的レビュー |
Hee Soo Kim , Chang Hwa Jung |
|
|
| 要約 |
加齢に伴う腸内環境の健全性維持を目的として、腸内組織から老化細胞を選択的に除去するセノリティックス(老化細胞除去薬)の利用への関心が高まっています。この戦略は、腸の老化を遅らせ、腸内細菌叢を良好に調整することで腸の健康を向上させるセノリティックスの可能性を強調しています。特定の植物由来の植物化学物質は、有望なセノリティックス効果を示しています。これらの化合物は、老化細胞を除去する能力に加え、抗酸化作用と抗炎症作用も示し、加齢関連疾患の主要な原因である酸化ストレスと炎症を軽減します。腸内から老化細胞を選択的に除去することで、セノリティックス効果を持つ植物化学物質は腸内の炎症環境の改善に寄与し、多様な微生物群集の増殖を促進します。最終的に、これらのセノリティックス効果を持つ植物化学物質を食事から摂取することで、老化した腸管上皮細胞を標的として除去し、より健全な腸内微小環境を維持するのに役立ちます。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.老化細胞の主要生存経路を標的とする |
| 3.老化細胞死抑制作用を有する |
| 4.老化抑制性植物化学物質は腸内細菌叢の不均衡を改善する |
| 5.結論 |
本文 |
| 1.はじめに |
| 老化細胞は、炎症性サイトカイン、ケモカイン、成長因子、プロテアーゼを高濃度に含む、SASP(訳者注:SASP(細胞老化随伴分泌現象、以下SASPと表示)とは、増殖を停止した老化細胞が、炎症性サイトカインや増殖因子など様々な生理活性物質を周囲に分泌する現象です。この現象は、組織修復に役立つ一方で、慢性炎症を引き起こし、がんの促進や加齢性疾患の悪化にも関与する、「両刃の剣」のような役割を持つことが注目されており、加齢研究の重要なテーマとなっています)として知られる複雑な混合物を分泌します[1]。これらの因子は周囲の健康な細胞の老化を誘導します[2]。したがって、老化細胞の蓄積を阻害することは、健康的な老化と様々な加齢関連疾患の予防に不可欠です。セノリティック(Senolytic)は、「senescence(老化)」と「lytic(溶解する)」(分解する)という言葉に由来し、老化細胞を標的として除去することで老化を遅らせるように設計された新しいクラスの薬剤です。セノリティックは、老化細胞を選択的に除去し、健康な細胞を保持することでSASPの発現を抑制します[3]。 |
| 細胞老化は、がん遺伝子の活性化、酸化ストレス、ミトコンドリア機能不全、放射線照射、化学療法など、様々な内因性および外因性刺激に反応して起こる、安定的かつ不可逆的な細胞周期停止である[4-8]。老化細胞はアポトーシスに抵抗するために「生存促進ネットワーク」を活性化し、老化細胞除去薬はこのネットワークを破壊することで細胞死を誘導する[9]。米国食品医薬品局(FDA)承認のダサチニブやケルセチンなどの薬剤は、有望な老化細胞除去薬の候補として報告されている[10]。タマネギに含まれるフラボノイドであるケルセチンは、植物化学物質の老化細胞除去薬としての可能性を示している。この化学物質の有益な用途により、老化細胞除去特性を持ち副作用が最小限である他の天然植物化学物質の特定への関心が高まっている。 |
| 2.老化細胞の主要生存経路を標的とする |
| 老化細胞除去薬の開発は、老化細胞における主要な生存促進経路の中和に主に焦点を当てています。これらの標的経路には、ミトコンドリアアポトーシス、細胞周期停止、シグナル伝達、ストレス応答経路に関わる抗アポトーシス経路が含まれます[11-14]。老化細胞除去薬が効果を発揮する主要なメカニズムは、B細胞リンパ腫2(Bcl-2)およびBcl-extra-large(Bcl-xL)(訳者注:233アミノ酸残基のタンパク質で、アポトーシス抑制因子として作用します)を標的としてミトコンドリアアポトーシスを誘導することです[15]。植物由来のフラボノールであるフィセチンは、抗アポトーシスタンパク質を阻害し、Bcl-2関連X(Bax)やBcl関連キラー(Bak)などのアポトーシス促進因子の活性化を促進します[16]。このプロセスによりミトコンドリア外膜が透過性となり、続いてシトクロムCが放出され、老化細胞でアポトーシスが誘導されます。さらに、腫瘍抑制タンパク質p53(訳者注:p53(ピー53)は「ゲノムの守護神」とも呼ばれる重要ながん抑制遺伝子であり、細胞がDNA損傷などのストレスを受けると活性化し、細胞周期を停止させて修復を促したり、修復不能なら細胞死(アポトーシス)を誘導してがん化を防ぐタンパク質です)は老化細胞除去薬の主要な標的です。p53は細胞周期停止を誘導しアポトーシスを促進することで細胞の恒常性維持に重要な役割を果たし、損傷を受けた潜在的にがん化する細胞を排除します[11]。マウスのダブルミニット2アンタゴニストであるNutlin-3a(訳者注:Nutlin-3a(ナットリン-3a)は、がん治療の標的となるMDM2タンパク質を阻害する低分子化合物で、がん抑制タンパク質p53を活性化させ、がん細胞のアポトーシス(プログラム細胞死)や細胞周期停止を誘導する効果が期待され、研究されています)を用いてp53の活性を高めると、老化細胞でアポトーシスが誘導されます[17]。p53を標的とするもう1つの戦略は、フォークヘッドボックス(FOX)-O4とp53の相互作用を破壊することです。FOXO4-D-レトロインベルソ(FOXO4-DRI)は、老化細胞の生存に重要なこの相互作用を阻害するように設計された合成ペプチドです。 FOXO4-DRIはFOXO4とp53の結合を競合的に阻害することでp53を放出し、アポトーシス経路を活性化する[18]。 |
| シグナル伝達経路の調節不全は、老化細胞の生存に寄与することが多い。ホスファチジルイノシトール3キナーゼ(PI3K)/AKT経路の阻害は、細胞の生存と増殖を抑制し、老化細胞のアポトーシスの増加につながる[19]。この阻害は他の経路にも影響を及ぼし、全体的な老化細胞除去効果を高める。Src、Fyn、Yesを含むSrcファミリーキナーゼは、細胞の増殖、分化、生存など、さまざまな細胞プロセスで重要な役割を果たしている[20]。Srcキナーゼを阻害すると、これらの経路が破壊され、老化細胞が効果的に除去される[21]。Srcキナーゼ阻害剤は、免疫療法や老年医療において、がん細胞を標的とし、加齢に伴う慢性炎症性疾患を治療するために使用できる[22]。細胞ストレスを管理する分子シャペロンである熱ショックタンパク質90(HSP90)は、老化細胞の維持と生存に重要な役割を果たしている[23]。老化細胞における熱ショックタンパク質90を標的とすることで、重要な生存経路を阻害し、アポトーシスを増加させることができます。ゲルダナマイシン、17-AAG、17-DMAGなどの様々な阻害剤は、熱ショックタンパク質90を標的とすることで老化細胞の生存率を選択的に低下させます[14]。この戦略は、老化細胞が正常細胞よりも過剰なストレス依存性を示すことを利用して行われます。 |
| これらのメカニズムに加えて、強心配糖体は心血管組織と腎臓組織のナトリウム-カリウムアデノシン三リン酸酵素(Na+/K+-ATPase)輸送酵素に影響を及ぼします。これは細胞内の電気化学的勾配の不均衡を引き起こし、脱分極と酸性化につながることで細胞死を誘導します[24]。酸化抵抗性1(OXR1)は、酸化ストレスに対する細胞防御に重要な役割を果たす抗酸化タンパク質です[25]。酸化抵抗性1は、酸化還元恒常性の維持と酸化的損傷からの細胞保護に不可欠なさまざまな抗酸化酵素の発現を調節することにより、細胞の抗酸化能を高めます。酸化抵抗性1の機能を阻害すると、これらの抗酸化防御メカニズムが排除され、活性酸素種(ROS)の生成が増加し、細胞死を引き起こします[26]。老化細胞はまた、変化したオートファジー活性を示します。ラパマイシンやカロリー制限模倣薬などの化合物を用いたオートファジーの調節は、老化細胞の生存に影響を与える[27, 28]。これらの化合物は古典的な老化細胞除去薬ではないが、SASPを調節し、老化細胞負荷の軽減に寄与する。老化細胞除去薬の代表的な分子標的を図1に示す。 |
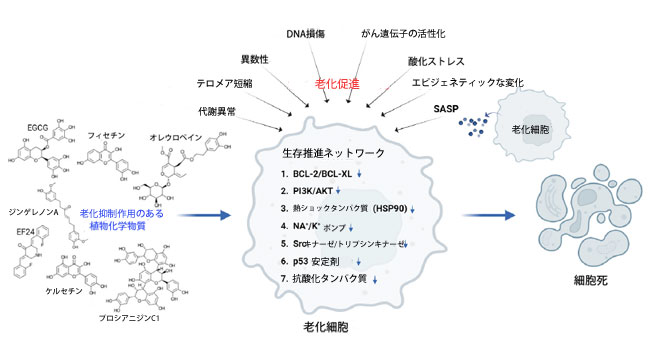 |
| 図1. 老化細胞死に関与する分子マーカーと経路。 |
| 3.老化細胞死抑制作用を有する植物化学物質 |
| 老化細胞死抑制作用を有する植物化学物質は、老化細胞死を誘導し、老化細胞由来の炎症を軽減し、組織機能を改善する。しかし、様々な植物化学物質の中で、老化細胞死抑制作用を発揮するものはごくわずかである。老化細胞死抑制作用を有する注目すべき植物化学物質としては、ケルセチン、フィセチン、クルクミンなどが挙げられる[29-31]。ケルセチンは、PI3K/AKT経路やBCL-2経路を含む複数の経路を標的とし、ヒト臍帯静脈内皮細胞(HUVEC)およびマウス胎児線維芽細胞(MEF)における老化を抑制することが報告された、初めて報告された老化細胞死抑制作用を有する植物化学物質である[13, 29]。ケルセチンは、ダサチニブと併用することで、様々な組織における老化細胞数を効果的に減少させ、身体機能と認知能力を改善し、動物モデルにおいて寿命を延長させる[32]。最初のヒト試験では、この併用により、血液、皮膚、脂肪組織の老化関連マーカーレベルが効果的に低下し [10]、特発性肺線維症の少数の患者における身体機能が改善しました [33]。フィセチンはまた、PI3K/AKTおよびBCL-2経路を含むいくつかのシグナル伝達経路を標的とし、これらの経路を阻害することで老化細胞の生存率を低下させます [30]。フィセチンは老化細胞の数を減らし、炎症を軽減し、加齢マウスの認知機能と身体能力を改善します [34]。クルクミンは、Errc1-/- マウスの一次MEFで弱い老化細胞破壊活性を示します [30]。老化細胞破壊特性を持つクルクミン類似体であるEF24は、ヒトWI-38線維芽細胞、IMR-90線維芽細胞、HUVEC、およびヒト腎上皮細胞でBCL-2ファミリータンパク質レベルを低下させることにより老化細胞死を誘導します [35緑茶に含まれる代表的な機能性植物化学物質であるエピガロカテキン没食子酸(EGCG)は、H2O2によって老化が誘導される3T3-L1前脂肪細胞において、p53を介した細胞周期停止を誘導し、PI3K / AKTおよびBCL-2経路を阻害することで老化抑制活性を示す[36]。 |
| ポリフェノールのプロシアニジンC1は、老化細胞除去作用によりマウスの寿命と平均余命を延長させる[37]。活性酸素産生を促進し、ミトコンドリア機能不全を誘導することで、老化細胞を選択的に除去する。この作用は、NADPHオキシダーゼ活性化因子、アポトーシスのp53発現誘導調節因子、および切断型カスパーゼ3レベルの上昇と関連している。ショウガに含まれるポリフェノールでクルクミンと構造的に類似するジンゲレノンAは、電離放射線によって誘導された老化WI-38ヒト線維芽細胞において、抗アポトーシスタンパク質Bcl-xLの発現を低下させることでアポトーシスを誘導する[38]。オリーブの葉と果実に最も多く含まれるポリフェノールであるオレウロペインは、初代培養された変形性関節症軟骨細胞における老化細胞の蓄積を抑制する[39]。オレウロペイン処理は、蓄積した老化細胞の数を有意に減少させ、老化バイオマーカーであるp16Ink4aおよびp53/p21Cip1のレベルを低下させます。また、インターロイキン(IL)-6、シクロオキシゲナーゼ-2、IL-1βなどのSASP因子の分泌を抑制します。上記の老化抑制作用を持つ植物化学物質は、表1に示されています。 |
| 表1.老化細胞除去作用のある植物化学物質のリスト |
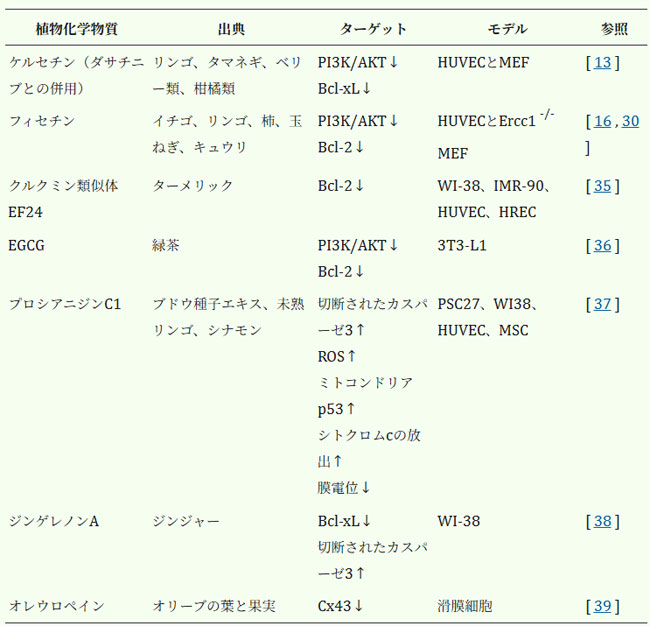 |
| PI3K、ホスホイノシチド3キナーゼ;AKT、プロテインキナーゼB;Bcl-xL、B細胞リンパ腫-超大型;Blc-2、B細胞リンパ腫2;ROS、活性酸素種;Cx43、コネキシン43;EGCG、エピガロカテキン没食子酸 |
| 4.老化抑制性植物化学物質は腸内細菌叢の不均衡を改善する |
| 腸粘膜組織は人体で最も多くの共生微生物を宿しており、無害な抗原に対する不要な免疫応答を抑制し、免疫細胞と協力することで、宿主と腸内細菌叢の恒常性維持に重要な役割を果たしている[40]。しかし、腸内細胞の老化に伴い、SASP因子レベルが増加し、周囲の細胞の老化が促進され、腸内炎症が増加する[41]。老化した腸管上皮細胞もまた、腸内細菌叢の不均衡に寄与する[42]。加齢に伴う腸内細菌叢の不均衡は、代謝産物や免疫応答を変化させることで腸管上皮細胞の老化を引き起こし、慢性炎症を引き起こす可能性がある(図2)[43, 44]。老化細胞除去薬ダサチニブとケルセチンの併用は、腸の老化を緩和するだけでなく、免疫機能を高めることで老化に伴う微生物バランスの乱れも改善する[45]。老化細胞除去薬投与は、回腸、盲腸、結腸における老化細胞マーカー(p16Ink4aおよびp21Cip1)とSASPおよび炎症マーカー(Cxcl1、Il1β、Il6、Mcp1、およびTnfα)を減少させることから、ダサチニブとケルセチンは高齢マウスの腸管細胞老化と炎症負荷を軽減することがわかる。さらに、老化細胞除去薬投与はフィルミクテス/バクテロイデス比を低下させ、腸の炎症および老化と負の相関関係にあるアッカーマンシア・ムシニフィラの存在量を増加させる。さらに、セノリティック治療は、ルミノコッカス、ドレア、コプロコッカス、オシロスピラ、バクテロイデス、サッターレラなどの他の分類群の存在量を増加させます。これらの分類群のほとんどは、様々な炎症性および老化マーカーと負の相関関係にあるため、セノリティック治療は腸内細菌叢を有益に調節することを示唆しています。炎症性腸疾患(IBD)モデルでは、老化細胞の蓄積が炎症を伝播させるSASP因子の放出につながりますが、フィセチン治療は、老化と炎症に関連するp53、p16、Bcl2、Cxcl1、Mcp1、およびmiRNAの発現を阻害します。フィセチンはまた、有益な腸内細菌であるアッカーマンシア・ムシニフィラを増加させ、微生物のアンバランスを改善することで腸の健康を改善します[46]。この結果は、老化抑制薬による治療が老化負荷を軽減し、SASP因子のダウンレギュレーションを抑制することで炎症誘発性環境を緩和し、有益な腸内細菌の維持を促進する可能性があることを示唆しています。研究では、老化抑制薬治療に関連する特異的かつ明確な腸内マイクロバイオームシグネチャーが、高齢マウスの腸管上皮細胞の老化と炎症状態の変化に直接的または間接的に関連することが明らかになっています。一方、若年マウスでは、この介入によって微生物組成は変化しませんでした。しかし、老化抑制薬と腸内細菌叢の相互作用が直接的なものなのか、それとも宿主の生理機能や代謝の変化を介しているのかを評価するには、さらなる研究が必要です。 |
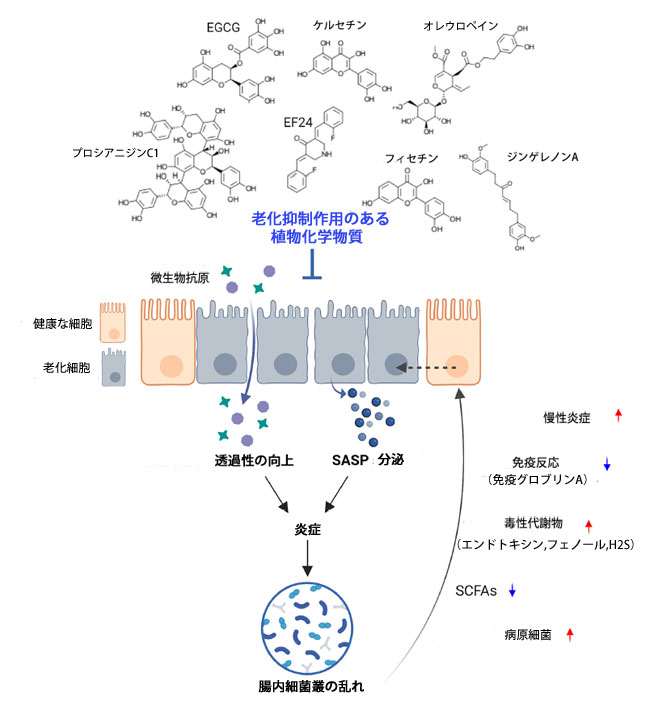 |
| 図2.老化した腸細胞に対する老化除去薬の効果を示す模式図。 |
| 老化細胞除去作用のある植物化学物質が老化した腸内細胞を調節し、腸内環境を改善するメカニズムに関する研究は限られています。しかし、多くの研究で、植物化学物質が腸内細菌叢を変化させることで腸の健康を高めることが報告されています。老化細胞除去作用のある植物化学物質は、腸内細胞の老化を緩和し、相乗的に腸内環境を改善します。エピガロカテキン没食子酸とクロロゲン酸の組み合わせは、細胞の老化と腸内細菌叢に有益な効果を発揮します。エピガロカテキン没食子酸は、炎症性サイトカインのレベルを低下させることで腸の炎症を抑制し、フィルミクテス/バクテロイデス比を回復させ、ラコノスピラ科、ムリバキュラ科、リケネラ科などの有益な細菌科の存在量を増加させます[47]。細胞老化を起こしやすい脂肪組織や腸組織は、DNA損傷マーカー、細胞周期阻害剤、加齢に伴う分泌表現型の調節因子の発現を著しく減弱させるため、エピガロカテキン没食子酸の慢性的な摂取から恩恵を受ける[48]。さらに、エピガロカテキン没食子酸は病原細菌の増殖を抑制し、微生物の多様性を維持するため、細胞の老化と腸内細菌叢の異常を緩和することで、潜在的な抗老化効果が得られる。炎症性腸疾患のマウスモデルでは、プロシアニジンC1投与により、炎症と粘液層の劣化を防ぐ保護効果を発揮する[49]。プロシアニジンC1は、粘液層の再構築をサポートするアッカーマンシア・ムシニフィラの存在を著しく増加させる[50]。さらに、プロシアニジンC1で治療したマウスの糞便移植では炎症性腸疾患に対する保護効果が実証されており、老化細胞除去療法により腸内細菌叢とその代謝物が変化し、それが腸細胞に抗炎症効果を発揮することを示唆している。パーキンソン病(PD)マウスモデルにおいて、フィセチンの経口投与はラコノスピラ科の存在量を有意に増加させ、大腸菌・赤痢菌やバチルスなどの病原細菌の存在量を減少させた[51]。ラコノスピラ科は、核因子κBの活性化を阻害することで腸の炎症を軽減する有益な短鎖脂肪酸である酪酸を産生する[52]。腸内細菌叢の構成と多様性を変化させることは、神経変性に対する神経保護効果を発揮する可能性があり、パーキンソン病の新たな治療法となる可能性を示唆している。本研究では、植物化学物質の老化細胞除去効果を直接検証したわけではないが、老化細胞除去剤のこれらの利点は老化細胞を選択的に除去することによる可能性があることを示唆している。 |
| 腸内細菌叢と腸管上皮層は、老化細胞除去薬と宿主免疫系との相互作用の主要な場であり、腸管免疫恒常性と透過性の両方に影響を及ぼします。老化細胞除去薬による治療は、主に腸管とその細菌叢における加齢に伴う病態の抑制を目的としています。老化細胞除去薬の腸内細菌叢への影響は表2にまとめられています。老化細胞除去薬の短鎖脂肪酸と微生物代謝への影響に関するさらなる調査は、これらの薬剤を包括的に理解するために不可欠です。腸内細菌叢と細胞老化の間には双方向の関係があることが示唆されています。食事成分の生体内変換によって腸内細菌叢から分泌される代謝物は、腸管細胞の老化に直接影響を及ぼします。逆に、腸管上皮および線維芽細胞における老化細胞の蓄積は、SASPとともに腸管細胞機能と免疫活性化を変化させます[53]。これらの相互作用は、腸内細菌叢、老化抑制薬、老化マーカー間の複雑かつ動的な相互作用を浮き彫りにしており、その根底にあるメカニズムを解明するためにはさらなる研究が必要です。 |
| 表 2. 老化細胞除去性植物化学物質の腸内細菌叢への影響。 |
 |
| IBD(炎症性腸疾患)、PD(パーキンソン病)、EGCG(エピガロカテキン没食子酸) |
| 5.結論 |
| 老化細胞除去作用のある植物化学物質と加齢に伴う腸内微生物環境への影響に関する研究は少なく、包括的なエビデンスが不足しているものの、先行研究では、これらの化合物が高齢者の腸内環境を改善する可能性が示されています。腸壁と微生物の相互作用は加齢とともにますます重要になり、腸壁における老化細胞の蓄積は腸内環境を不安定化し、全身性炎症の一因となります。したがって、老化細胞除去作用のある植物化学物質は、加齢に伴う腸内微生物環境を改善する可能性があります。これらの化合物は、老化細胞を標的とし、その負担を軽減することで、腸内細菌環境の安定性を回復し、炎症を軽減し、健康な腸内細菌叢の形成を促進します。しかし、これらの化合物の具体的な効果を検証し、作用機序を解明するには、さらなる研究が必要です。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、J Microbiol Biotechnol. 2024 Nov 18;34(11):2166–2172.に掲載されたImpacts of Senolytic Phytochemicals on Gut Microbiota: A Comprehensive Review.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


