ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
乳がんの病因と予後における腸内細菌叢-肥満軸 |
Huiyue Zhang et al., |
|
|
| 要約 |
背景 |
| 乳がんは依然として世界的に大きな健康問題であり、全がん症例の11.7%を占め、世界の女性のがん関連死亡原因の第2位を占めています。乳がんの進行において、腸内細菌叢のディスバイオシス(訳者注:腸内細菌叢の乱れ)と肥満関連代謝機能障害との相互作用がますます明らかになっています。本レビューは、乳がんを有する肥満患者における腸内細菌叢の役割を明らかにすることを目的としています。 |
| 方法 |
| 2015年7月から2025年1月までの出版物について、PubMedおよびWeb of Scienceデータベースを用いて体系的な文献検索を実施しました。検索用語は、腸内細菌叢、腸内細菌叢、肥満、ディスバイオシス、免疫、マイクロバイオームです。論文の選択では、乳がん患者における微生物の変化、肥満とがん進行の機序的関連性、腸内細菌叢を標的とした介入を検討した研究を優先しました。原著研究と権威あるレビューの両方を組み入れ、手作業による参考文献スクリーニングを補足しました。 |
| 考察 |
| 肥満は、腸管由来β-グルクロニダーゼ活性を介して全身性炎症、アディポカイン分泌の変化、ステロイドホルモン代謝の阻害を引き起こし、乳がんの発症および再発を悪化させる可能性があります。分岐鎖アミノ酸(BCAA)や短鎖脂肪酸(SCFA)などの腸内細菌叢の乱れによって引き起こされる代謝物は、発がん性シグナル伝達経路や免疫抑制性の骨髄由来抑制細胞(MDSC)を活性化し、腫瘍の免疫回避を促進します。一方、食事療法、プロバイオティクス、糞便微生物移植(FMT)は、腸内細菌叢の乱れを軽減し、腸管バリアを強化し、抗腫瘍免疫を回復させ、化学療法への反応性を高め、再発を減少させます。しかしながら、乳がんのサブタイプに関連する微生物シグネチャー(訳者注:微生物シグネチャー(microbial signatures)は、特定の環境、健康状態、または疾患(神経変性疾患など)に関連する特有の微生物群集プロファイルや代謝産物を指します。これらは腸内細菌叢の分類(バクテロイデスやフィルミクテスなど)や、環境変化に対する生態系の応答を特定するために利用され、疾患の診断やバイオマーカーとして重要です。 )の解明と、微生物叢を標的とした治療法の最適化には依然として課題が残っています。 |
| 結論 |
| 因果関係を明らかにし、微生物バイオマーカーを検証し、前臨床研究の知見を臨床応用につなげるためには、今後の縦断的研究が必要である。腸管-乳腺軸に焦点を当てることは、肥満に起因する乳がんにおける精密腫瘍学に変革をもたらす可能性を秘めている。 |
| 主要メッセージ |
| 1.腸内細菌叢、肥満、乳がんの相互作用に関する体系的な統合 |
| 2.肥満に起因する腸内細菌叢の乱れは、免疫経路を介して乳がんを悪化させる。 |
| 3.プロバイオティクスは乳がんを抑制し、高脂肪食誘発性肥満を軽減し、腸内細菌叢代謝物の食事による調節は乳がんの予後を改善する。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 乳がんを合併する肥満患者における腸内細菌叢の役割 |
| 2.1. 乳がん患者における腸内細菌叢 |
| 2.2. 肥満者における腸内細菌叢 |
| 2.3. 乳がんを患う肥満患者における腸内細菌叢 |
| 3. 腸内細菌叢のディスバイオシスと肥満、炎症、および乳がん発症を結びつけるメカニズム |
| 4. 腸内細菌叢およびその代謝産物と肥満、乳がんおよび介入戦略との関連性 |
| 5. 免疫療法を受ける乳がん患者の予後に対する腸内細菌叢介入の影響 |
| 6. 展望と限界 |
| 7. 結論 |
本文 |
| 1.はじめに |
| 2000年代半ば以降、女性における乳がんの発生率は徐々に上昇しており、年間約0.6%の増加と推定されています[1]。この傾向が続くと、2040年までに乳がんの発生率は年間300万人以上の新規診断と100万人以上の死亡に増加すると予測されており、その主な原因は人口増加や高齢化といった人口動態の変化です[2]。特に、50歳未満の女性(年間1.1%)では、50歳以上の女性(年間0.5%)よりも多く発生しており、この発生率の上昇は、出生率の低下と肥満の増加によって部分的に説明されます[3]。 |
| 歴史的に、がんは主に宿主の遺伝的要因とエピジェネティック(訳者注:エピジェネティクス(Epigenetics)は、DNAの塩基配列(遺伝暗号)を変えずに、細胞が遺伝子の働き(オン/オフ)を化学的な修飾により制御・調節する仕組みを研究する学問です。環境要因(食事、ストレス、生活習慣)により変化し、細胞分裂後も受け継がれる後天的な情報であり、がんや老化、細胞分化において重要な役割を果たします。 )な変化の両方によって形成されると考えられてきました [4]。がんの大部分において、主要な寄与因子は重要ながん遺伝子と腫瘍抑制遺伝子の自然発生的な体細胞変異であり、これらはライフスタイルの選択、肥満、発がん物質への曝露など、さまざまな危険因子によって制御されます。しかしながら、過去60年間の豊富なエビデンスから、がんの病因における感染症の極めて重要な役割が実証されており、微生物は世界のがん症例の約13%と関連しており、毎年約220万人の新規症例に相当します [5]。重要なのは、腸内細菌叢が宿主と共生関係を維持する数兆個の腸内微生物からなる高度な生態系を構成していることです。腸内細菌叢の変化は、免疫応答の調節に重要なケモカインとサイトカインの合成に影響を与える可能性があるため、さまざまな健康問題につながる可能性があります。さらに、微生物叢は、宿主における発がん過程(がんの発生、進行、転移など)において、良い影響と悪い影響の両方において主要な役割を果たしている [6]。そのメカニズムとしては、細胞増殖とアポトーシスのバランスを崩し、遺伝子改変を引き起こし、炎症を誘発し、免疫反応を変化させ、共代謝に影響を与える可能性がある。既存の研究では、微生物のディスバイオーシスと肺がん [7]、乳房がん [8]、食道がん [9]、胃がん [10]、結腸・直腸がん [11,12]、肝臓がん[13,14]、胆道がん [15]、膵臓がん [16–18]、前立腺がん [19]、子宮頸がん [20] との関連性が確立されている。がんに関連する微生物種の変化は、がんを促進する形質を持つ安定した病原性微生物叢が存在するという考えを裏付けている。 |
| 過去数十年にわたり、世界中で過体重(BMI [BMI] 25-29.9 kg/m2)または肥満(BMI ≥ 30 kg/m2)に分類される人の割合が急増しています。世界がん研究基金と米国がん研究所による最近の発表では、脂肪組織の蓄積と食道腺がん、大腸がん、膵臓がん、閉経後乳がん、子宮内膜がん、腎臓がんなどのさまざまながんとの強い関連性が強調されています [21]。これは、アディポカイン代謝の変化、局所炎症、酸化ストレス、免疫応答の変化に関連している可能性があります [22]。さらに、包括的なメタアナリシスで明らかになったように、肥満患者は乳がん、大腸がん、または子宮がんと診断された場合、全死亡率が上昇する可能性があります。さらに、乳がん、大腸がん、前立腺がん、胃食道がんの患者も再発率が顕著に増加する可能性がある[23]。そこで本研究は、乳がんを患う肥満患者における腸内細菌叢の特徴を明らかにし、それらの関連性、そして免疫、代謝、予後への影響を調査することを目的として計画された。 |
| 2. 乳がんを合併する肥満患者における腸内細菌叢の役割 |
| 2.1. 乳がん患者における腸内細菌叢 |
| 一般的に、乳がん患者は健常者と比較して腸内細菌叢に顕著な変化を示す可能性があり、特定の微生物群が乳がんの進行および治療への反応と関連している可能性を示唆しています[8]。微生物のディスバイオーシスは、遺伝的素因、心理的ストレス、食習慣、身体活動レベル、授乳習慣、分娩方法、抗生物質の使用、喫煙、年齢、アルコール摂取など、乳がんの多くの危険因子と関連していることが報告されています[24]。例えば、乳がんと診断された患者では、健常者と比較して腸内細菌叢のα多様性が有意に低下していることが実証されており、この患者集団では、バクテロイデス属と比較してフィルミクテス属の相対的存在量が顕著に増加しています[25]。さらに、乳がん患者は、健康な女性と比較して、ビフィドバクテリウム、赤痢菌、クロストリジウム、大腸菌、バクテロイデス・ユニフォミス、フェカリバクテリウム・プラウスニッツィ、クロストリジウム・ハセウェイ、アッカーマンシア・ムシニフィラ、およびクロストリジウム・パーフリンゲンスのレベルが著しく低いことが示されています[26]。菌種レベルでは、がん患者は健康な対照群と比較して、オドリバクター属、ブチリシモナス属、およびコプロコッカス属の存在量が少ないことが示されています[27]。特に、進行期乳がん患者では、バクテロイデス属、クロストリジウム・コッコイデス属、クロストリジウム・レプタム属、およびブラウチア属の検出率が高くなります[28]。さらに、ある研究では、閉経前の乳がん患者では、健康な閉経前者と比較して、バクテロイデス・フラギリス、アナエロスティペス、スッターレラ、ヘモフィルス・パラインフルエンザの菌数が有意に増加していることが明らかになりました。一方、これらの患者では、ビフィドバクテリウム・ロンガム、ビフィドバクテリウム・ビフィダム、ビフィドバクテリウム・アドレセンティス、フェカリバクテリウム・プラウスニッツィ、ルミノコッカス・グナバス、ロチア・ムシラギノーサの菌数が著しく減少していました[29]。さらに、閉経後の乳がん患者では、大腸菌、クレブシエラ、プレボテラ・アムニ、エンテロコッカス・ガリナラム、放線菌属の菌数が増加していることが発見されています。 HPA0247、シュワネラ・プトレファシエンス、エルウィニア・アミロヴォラの減少がみられたが、ユーバクテリウム・エリゲンスとラクトバチルス・ヴァギナリス [8]は健康な閉経後者と比較して減少した(表1)。 |
表1. 異なる月経状態の 乳がん患者に関連する 腸内細菌叢の変化 |
| 近年、いくつかの研究で、腸内細菌叢が乳がんの異なるサブタイプに特異的であることが明らかになっています。エストロゲン受容体陽性乳がんでは、アドラークロイツィア属とパラバクテロイデス属が保護因子として、セリモナス属が危険因子として特定されました。一方、エストロゲン受容体陰性サブタイプでは、デスルフォビブリオ属が保護効果を示し、ルミノコッカス科(UCG013)は保護傾向を示唆する結果を示しました。機序的には、アドラークロイツィアに関連する機能遺伝子であるCACNA1Sの高発現は乳がん患者の良好な予後と相関し、セリモナスに関連する機能遺伝子であるERBB4の高発現は予後不良を予測しました[30]。トリプルネガティブ乳がん(TNBC)では、腸内細菌叢は主に免疫微小環境を調節することで疾患の進行と免疫療法への反応に影響を及ぼします。研究によると、アッカーマンシア・ムシニフィラ、ビフィズス菌ロンガム、バクテロイデス・フラジリス、ルミノコッカス科などの微生物種は、免疫チェックポイント阻害剤(抗PD-1/PD-L1抗体など)への反応性向上に関連していることが示されています。そのメカニズムとしては、樹状細胞の活性化、短鎖脂肪酸などの代謝産物を介したCD8陽性T細胞の抗腫瘍活性の増強、そして腫瘍免疫微小環境のリモデリングなどが考えられます。一方、フェカリバクテリウムとクロストリジウムの相対的な存在量は、免疫療法への反応性の低下と相関していることが示されています[31]。これらの知見は、プロバイオティクスの補給や食事療法など、異なる腸内細菌叢サブタイプの腸内微生物特性を標的とした介入が、患者の予後改善に向けた有望な新たな戦略となることを示唆しています。 |
| さらに、最近のヒト腫瘍マイクロバイオームに関する研究では、乳がん、肺がん、卵巣がん、膵臓がん、骨がん、皮膚がん、脳腫瘍の7種類の固形腫瘍に特定の細菌成分が存在することが明らかになりました[32]。それぞれの腫瘍は独自のマイクロバイオームを示し、特に乳がんに関連するマイクロバイオームは、他のがん種と比較して、その豊富さと多様性において際立っていました。著者らはメタボロームに関する知見を提供し、乳がんは酸化ストレスの上昇を特徴とすることを指摘しました。さらに、活性酸素種を解毒する化合物であるマイコチオール(訳者注:マイコチオール (MSH) は、放線菌(結核菌など)に特有の主要な低分子チオール化合物で、細胞内の酸化還元バランスの維持や解毒において重要な役割を果たしています。)を産生する細菌がかなりの割合で存在することを発見しました。 |
| 2.2. 肥満者における腸内細菌叢 |
| 腸内細菌叢は、肥満を含む代謝障害発症の重要な因子として認識されています。腸内細菌叢は、宿主のエネルギーバランスと免疫応答を著しく調節する内分泌器官として機能します。例えば、無菌マウスでは肥満の兆候が見られなかったのに対し、肥満マウスでは肥満の兆候が見られ、肥満発症における腸内細菌叢の役割が強調されています[33]。さらに、集団ベースの調査では、肥満者の腸内細菌叢組成は一般集団と比較して顕著に異なることが明らかになりました[34]。高脂肪食(HFD)の摂取は、肥満に関連する腸内細菌叢の乱れと関連していることが確認されています。この腸内細菌叢の乱れは、総微生物叢数の減少、細菌種の豊富さの変化、腸管透過性の亢進を特徴とします[35]。フィルミクテス門に属するブドウ球菌属とクロストリジウム属は、肥満と正の相関関係にあることが実証されています[36]。重要なのは、フィルミクテス門には酪酸を生成できる種が多数含まれており、酪酸と酢酸の合成が促進されると、肥満者のエネルギー抽出が促進される可能性があることです[36]。さらに、酢酸は肝臓内で脂肪生成と糖新生の前駆体として吸収され、利用されます[37]。バクテロイデス門に分類されるバクテロイデスは、ルーワイ胃バイパス術[39,40]および腹腔鏡下スリーブ状胃切除術後の代謝障害を伴う過体重および肥満の女性において、肥満と逆相関関係にあることが明らかになっています[38]。放線菌門のビフィズス菌は、妊婦、子供、正常体重の母親の乳児など、複数の集団で肥満と逆相関しています[36]。ビフィドバクテリウム属の菌種は胆汁酸を脱抱合する能力を有しており、このプロセスによって脂肪の吸収を低下させる可能性がある [41]。バクテロイデス門やフィルミクテス門に加えて、クリステンセネラ科やアッカーマンシア属、ビフィドバクテリア属、メタノバクテリア類、ラクトバチルス属などの特定の細菌分類群も肥満との関連が発見されている [42]。最近の研究では、クリステンセネラ科が体重減少や皮下脂肪組織における遺伝子発現に関係していることが示唆されている。注目すべきことに、この科の相対的有病率は宿主の BMI と逆相関を示した [42,43]。さらに、ラクトバチルス・ロイテリとラクトバチルス・ガセリは肥満の有病率と正の相関を示したのに対し、ラクトバチルス・パラカゼイは逆相関を示した。これは細菌と肥満の種依存的な関連を支持しており、同じ属内の異なるメンバーが異なる方法で肥満に影響を与える可能性がある[44]。 |
| 2.3. 乳がんを患う肥満患者における腸内細菌叢 |
| 過体重または肥満の女性は、健康体重の女性よりも乳がんを発症するリスクが高い[28]。重度の肥満は、乳がん関連死亡リスクを約2.26倍に上昇させる可能性がある[45]。BMIは、乳がん患者の腸内細菌叢組成の主要な調節因子である。具体的には、過体重または肥満に分類される患者は、非肥満患者と比較して、フェイカリバクテリウム・プラウスニッツィ、 フィルミクテス、ブラウティア属などの特定の腸内細菌叢の総量が少ない[46]。肥満に起因する腸内細菌叢の変化に関する別の研究では、原発性または転移性乳がんと診断された患者は、アッカーマンシア・ムシニフィラの存在量が高いことが示された[47]。 腸内細菌叢は特定の短鎖脂肪酸(SCFA)の合成を促進し、ペプチドYY [48]、グレリン、インスリン、およびグルカゴン様ペプチド-1(GLP-1)産生の上昇との相関関係が確立されていることが示されています [49]。腸内細菌叢によって調整されるGLP-1は、明らかに食物摂取とインスリン放出の両方を調節できます。肥満患者は、非肥満の人と比較してこのホルモンのレベルが低いことが発見されています [50]。腸内細菌叢によって生成される酪酸のレベルは、肥満の人で低下していると報告されています [51]。この特定の短鎖脂肪酸は、脂肪細胞でのレプチン産生を刺激し、L細胞からのGLP-1の放出を増加させることができるため、エネルギーバランスの維持に不可欠です [52]。レプチンは、脂肪組織によって特異的に分泌されるホルモンである最初のアディポカインであると認められています [53]。レプチンは、受容体であるレプチン受容体に結合し、JAK/STAT、MAPK、PI3K/AKTなど、複数の重要な細胞内シグナル伝達経路を直接活性化することで、乳がん細胞の増殖、生存、遊走、浸潤能を促進します。レプチンは、インスリン様成長因子1と上皮成長因子受容体を相乗的に活性化したり、炎症因子とノッチ、インターロイキン-1、レプチンのクロストークネットワークを形成したりすることで、トリプルネガティブ乳がんの悪性化を総合的に促進します。さらに、レプチンはエストロゲン受容体αと相互作用してエストロゲンシグナル伝達経路を活性化し、ホルモン受容体陽性乳がんの発生を促進します[54]。その後、アディポカインとしてアディポネクチン、腫瘍壊死因子α(TNF-α)、インターロイキン-6(IL-6)などが同定され、これらの放出が腫瘍の増殖と関連していることが観察されています[55](図1)。 |
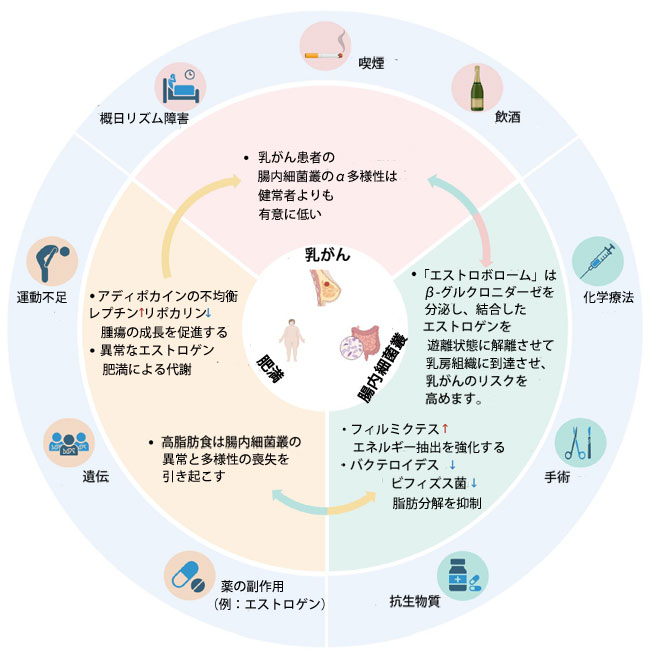 |
図1. 乳がん、腸内細菌叢、そして肥満は相互に作用し合います。 乳がんは、喫煙、飲酒、ストレス、概日リズムの乱れ、放射線療法といった内因性および外因性要因の影響を受けます。気分の落ち込みや不健康な食生活も腸内細菌叢を変化させる可能性があります。乳がんには多様なマイクロバイオームが存在します。ストレス、運動不足、遺伝、薬剤の副作用(例:エストロゲン)、高脂肪食は肥満の一因となる可能性があります。肥満者では、アディポカインの不均衡(例:レプチンの増加、アディポネクチンの減少)やエネルギー代謝の乱れ(例えば、短鎖脂肪酸によるGLP-1およびPYY分泌の調節は間接的にインスリン感受性に影響を与えます)がよく見られます。乳がんと肥満はどちらも腸内細菌叢の乱れに寄与します。乳がん患者では、クロストリジウム・コッコイデスや大腸菌などの細菌レベルが上昇し、アッカーマンシア・ムシニフィラ、ビフィドバクテリウム、フェカリバクテリウムなどの細菌レベルは低下します。肥満は、慢性炎症(例:TNF-αおよびIL-6の上昇)、フィルミクテス/バクテロイデス比の上昇、酪酸産生の低下を引き起こします。閉経後肥満者のエストロゲン代謝異常は、乳がん発症リスクを悪化させます。特定の腸内細菌叢は、エストロゲン代謝を直接制御し、乳がん発症に影響を与える可能性があります。乳がん、肥満、腸内細菌叢の乱れはすべて、慢性的な低レベルの炎症と代謝障害に寄与し、相乗的に疾患の進行を促進します。 |
| 3. 腸内細菌叢のディスバイオシスと肥満、炎症、および乳がん発症を結びつけるメカニズム |
| 腸内ディスバイオシスは、肥満と慢性の低レベルの炎症の両方と関連していることが示されています。言い換えれば、腸内細菌叢の構成の変化と多様性の低下は、エネルギーバランスに影響を与え、脂肪蓄積を調節することで肥満を誘発する可能性があります。同時に、腸内細菌叢の調節不全は、細胞接着タンパク質を損傷し、上皮バリアを破壊し、腸管透過性を高め、腸管内容物を宿主の末梢組織と接触させ、宿主細胞による炎症性サイトカインの分泌を促します。慢性炎症反応の誘導により、最終的には肥満関連腸内細菌叢の進行を促進する可能性があります[56,57]。 |
| 最近、肥満乳がん患者(BMI > 24)の腸内細菌叢に有意に多く含まれるデサルフォビブリオ属は、腫瘍サイズおよび増殖マーカーであるKi67レベルと正の相関関係にあることが注目されています。さらに、動物モデルの構築に基づく別の研究では、高脂肪食が腸内細菌叢の異常を引き起こし、デサルフォビブリオの存在率の増加を特徴とすることが示されました。この腸内細菌叢の変化は、その後、微生物代謝の結果として、分岐鎖アミノ酸(BCAA)、特にロイシンの遊離につながりました。循環血中に存在する微生物叢に由来するロイシンは、骨髄にある骨髄前駆細胞のmTORC1シグナル伝達経路に関与し、結果として多形核骨髄由来抑制細胞(PMN-MDSC)の分化を促進します。そして、免疫抑制分子(例:S100A8/S100A9)を介してCD3+ T細胞の活性を抑制することで、多形核骨髄由来抑制細胞は腫瘍の免疫回避を促進し、最終的に乳がんの進行を加速させる可能性がある[58](図2)。 |
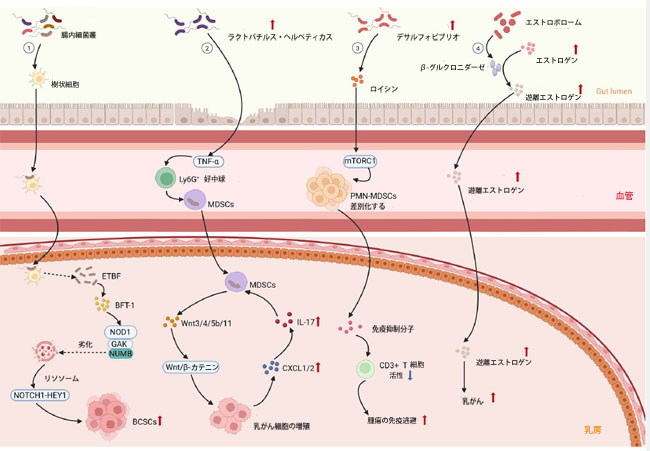 |
図2. 腸内細菌叢は免疫応答を介して乳がんを促進する。 ①腸内細菌は樹状細胞に捕捉される。樹状細胞は上皮細胞のタイトジャンクションを開き、細菌を血管系を介して乳がん組織に輸送する。乳がん組織中の腸管毒素原性バクテロイデス・フラギリス(ETBF)は毒性タンパク質BFT-1を分泌する。BFT-1はNOD1に直接結合して安定化させる。ヌクレオチド結合オリゴマー化ドメイン1 (NOD1)はサイクリンG関連キナーゼ(GAK)と相乗的に作用してNUMBをリン酸化させ、リソソーム分解を促進する。このプロセスはNOTCH1-HEY1シグナル伝達経路を活性化し、乳がん幹細胞(BCSC)の増殖を促進する。 ②H. hepaticusはTNF-αを活性化し、Ly6G+好中球の浸潤を促進し、乳がん組織における骨髄由来抑制細胞(MDSC)の蓄積を促進する。これらの骨髄由来抑制細胞は組織に入り込み、Wnt3/4/5b/11を高発現する。これらは、Wnt/β-カテニンシグナル伝達経路の活性化を介して乳腺上皮細胞におけるβ-カテニンの異常な核移行を引き起こし、それによって細胞増殖と発癌を誘導する。一方、乳がん細胞関連間質成分から放出されるCXCL1/2ケモカインは、IL-17によって誘導される受容体に結合し、骨髄由来抑制細胞のリクルートを促進する。 ③デサルフォビブリオは微生物代謝を介してロイシンの放出を引き起こし、それが骨髄骨髄系前駆細胞のmTORC1シグナル伝達経路を活性化し、多形核骨髄由来抑制細胞の分化を促進する。多形核骨髄由来抑制細胞は免疫抑制分子を介してCD3+ T細胞の活性を抑制し、腫瘍免疫回避を促進する。 ④エストロゲン代謝に影響を与え、循環ホルモンと排泄ホルモンのバランスを調節する腸内細菌叢のコミュニティは、エストロゲノムとして知られている。 β-グルクロニダーゼという酵素を産生し、この酵素は抱合型エストロゲンを遊離型エストロゲンに加水分解します。遊離型エストロゲンは血流を介して最終的に乳房組織に到達し、乳がんのリスクを高めます。 |
| 乳房のマイクロバイオームは、特定の微生物群、その構成、および固有の特性によって定義される特殊な環境を表しています [59]。プロバイオティクスは、経口投与によって乳腺炎の治療に有意に有効であることが確認されており、母乳中に検出されています [60]。これは、腸内細菌叢と乳房組織の間に潜在的な関連があることを強く示唆しています。その形成は、乳輪からの細菌の移動と腸乳腺経路によって、免疫細胞が腸内細菌をリンパ節に運び、さらに乳房組織に運ぶことで生じると仮説が立てられています [61,62]。腸の樹状細胞は、上皮のタイトジャンクションを破壊する細菌を内部化することができ、代替の回避経路を示しています [63]。樹状細胞は、その遊走性に基づいて、血管網を介して乳腺組織などの遠隔部位への移動を可能にします (図 2)。 |
| 一方、腸管毒素原性バクテロイデス・フラギリスは、タキサン化学療法に反応しない乳がん患者で高レベルであることが調査された。化学療法は腸内細菌叢を破壊しその環境を変化させることが知られていることを考えると、この発見は特に注目に値する。腸管毒素原性バクテロイデス・フラギリス(ETBF)は、その最小限のバイオマスにもかかわらず、毒性タンパク質バクテロイデス・フラギリス毒素-1(BFT-1)を放出し、乳がん細胞の幹細胞性の維持を促進し、化学療法に対する抵抗性に寄与している[64]。機構的には、BFT-1はヌクレオチド結合オリゴマー化ドメイン含有1(NOD1)と直接相互作用してNOD1タンパク質を安定化させることができる。特に、NOD1はアルデヒド脱水素酵素乳がん幹細胞上で発現レベルが上昇し、サイクリンg関連キナーゼ(GAK)と連携してNUMBをリン酸化して、リソソーム分解を促進した。このプロセスはその後NOTCH1-HEY1シグナル伝達経路を活性化し、乳がん幹細胞の集団の増加をもたらした[64](図2)。 |
| さらに、肥満に関連する全身性炎症は、マウスの肝臓と腸管に生息する病原菌であるヘリコバクター・ヘパティカスの関与によって誘発される局所免疫応答を増悪させる可能性がある[31]。乳腺腫瘍素因を持つマウスモデルにおいて、ヘリコバクター・ヘパティカス・インテスティナリスは乳腺および腸管の腫瘍形成を増強させることが示唆されている。さらに、消化管内の常在細菌は遠隔臓器に播種し、がんの発生を促進する可能性がある。ヘリコバクター・ヘパティカスによる腸内細菌叢の乱れは細菌の拡散を促進し、腸内細菌が乳腺に移行して炎症誘発性環境を形成する可能性がある[65]。別の動物実験では、ヘリコバクター・ヘパティカス感染がTNF-α依存性経路を介して腫瘍量の増加という形で発現し、発がん作用を示すことが報告されている[66]。この作用はリンパ球抗原6複合体遺伝子座G6D+(Ly6G+)好中球の活性化および浸潤と密接に関連しており、好中球の減少は腫瘍形成を著しく抑制することができる[66]。さらに、ヘリコバクター・ヘパティカス誘発性炎症は乳腺組織における骨髄由来抑制細胞の蓄積を促進する可能性がある。これらの骨髄由来抑制細胞はWnt3/4/5b/11を高発現し、Wnt/β-カテニンシグナル伝達経路を活性化することで乳腺上皮細胞におけるβ-カテニンの異常な核移行を促進し、細胞増殖と発癌を誘導する。同時に、IL-17を発現する肥満細胞と腫瘍微小環境はCXCL1/2ケモカインを分泌して追加の骨髄由来抑制細胞をリクルートし、それによって乳がんの発達を促進する正のフィードバックループを形成する[65](図2)。 |
| 実際、乳房内の免疫調節機構は乳がんの存在によって影響を受ける可能性があり、この影響はラクトバチルス・ヘルベティカス由来の発酵乳の摂取によってさらに調整されます。マウスを用いた研究では、ラクトバチルス・ヘルベティカスR389発酵乳を乳がん細胞注入と同時に投与されたマウスでは、血清および乳腺中のIL-6レベルが大幅に低下し、IL10レベルがそれに応じて上昇しました。このサイトカインプロファイルは、最終的に乳がん細胞の増殖抑制に寄与しました[66]。この研究では、誘発乳がんを起こしたBALB/c(Bアルビノc)マウスを使用して、ラクトバチルス・アシドフィルス(L.アシドフィルス)が免疫反応に及ぼす影響を研究しました。彼らの研究結果は、L.アシドフィルスの連日投与が、脾臓細胞培養における主要な免疫調節性サイトカインであるIL-12の分泌を増強し、同時に実験マウスにおける腫瘍の増殖を抑制することを示唆している[67]。さらに、ラクトバチルス・ヘルベティカスはマウスにおいて高脂肪食誘発性肥満の影響を軽減する可能性がある[68]。しかし、ヒトに対する発がん性に関する直接的な証拠は未だ限られており、今後のさらなる研究が必要である。 |
| 4. 腸内細菌叢およびその代謝産物と肥満、乳がんおよび介入戦略との関連性 |
| プロバイオティクスは、宿主に有益な活性微生物群であり、ラクトバチルス、ビフィズス菌、グラム陽性球菌などの3つの主要グループに分類できます。プロバイオティクスは、その能力に関する広範な研究に基づき、宿主に有益な微生物叢を供給する安全かつ効果的な選択肢として機能します[69]。最新の研究では、プロバイオティクスは、適切な量を投与することで宿主に健康上の利益をもたらす生きた微生物と定義されています[70]。現在、肥満に関連する乳がんに対するプロバイオティクスの可能性は広く注目されています。 |
| 周知の事実であるが、性ホルモンの調節異常、すなわちホルモンの不均衡は乳がん発症の重大な危険因子であり、これは乳がんの様々なサブタイプにおいて臨床所見と分子学的特徴の両方に明らかである [71,72]。エストロゲン代謝とホルモンバランスは特定の消化管微生物によって影響を受けることが明らかにされている [73]。エストロボローム微生物叢はβ-グルクロニダーゼ酵素を合成し、エストロゲンを改変して血流への吸収を促進し、その後肝臓で処理されてから消化管に分泌される。その後、細菌性β-グルクロニダーゼがこれらの化合物の脱抱合を触媒し、腸肝循環を介して非結合エストロゲンとして再吸収され、乳房組織を含む様々な遠隔臓器への遊離エストロゲンの分布を促進すると考えられる [74](図 2)。乳がん患者の乳頭吸引液中のβ-グルクロニダーゼ濃度は、健常女性よりも高い [75]。さらに、エストロゲン様特性を示す代謝物は、消化管内の酸化還元過程、およびエストロゲンに反応する成長因子の合成刺激によっても生成され、発がん性を示す可能性がある。注目すべきことに、β-グルクロニダーゼ産生細菌は、クロストリジウム・レプタムやクロストリジウム・コッコイデスなどのクロストリジウム綱、ルミノコッカス科 [28,76]、および大腸菌/赤痢菌群 [77] 内にも様々である。クロストリジウム目の相対的存在量とエストロゲン代謝物とその親エストロゲンの比率の間には明らかな正の相関関係が確認されており、逆にバクテロイデス属とは逆の相関関係が認められている。さらに、閉経後者のエストロゲン代謝は、糞便微生物叢の多様性と関連していることが検証されている[78]。乳がん患者の糞便検体では、連鎖球菌レベルが、エストロゲンのグルクロン酸抱合体を分解する酵素であるβ-グルクロニダーゼ/β-グルコシダーゼの活性と有意に関連していることが確認され、それによって体内のエストロゲンの再循環が促進される[79]。現在、繊維とポリフェノールを豊富に含む食事が乳がん患者、特にBMIが高い患者の生存率を改善するために提案されている[66,80]。例えば、食物繊維は腸内細菌叢の多様性に影響を及ぼし、腸内β-グルクロニダーゼの活性を低下させ、それによってエストロゲンの脱抱合とそれに続く再吸収を減少させることが文書化されている[81]。 |
| 大豆製品の摂取はイソフラボンの摂取を可能にし、乳がんリスクを低下させる可能性があります。日本で行われた研究では、味噌汁の摂取と乳がん発症率に逆相関関係があることが示されました[82]。別のコホート研究では、大豆とイソフラボンが閉経後女性の乳がんを予防する可能性があることが示されました[83]。ラクトバチルス・カゼイ・シロタと大豆イソフラボンを含むプロバイオティクス飲料は、乳がんの発症に逆相関することが明らかになっています[84]。大豆が乳がんを予防するメカニズムは、大豆イソフラボン、特にゲニステインとダイゼインが持つ二重のエストロゲン作用と抗エストロゲン作用に起因すると考えられます。さらに、グラム陽性細菌を含むラクトバチルス属は、そのプロバイオティクス特性によって、タモキシフェンやその他の内分泌系標的薬の抗がん活性を高め、エストロゲン受容体陽性乳がんの発生を低下させる可能性があります。ある研究では、ヒバマタ抽出物(訳者注:ヒバマタ(Fucus vesiculosus)は、北大西洋や北海沿岸の岩礁に自生する、ブラダーラックとしても知られる一般的な褐藻類です。ヨウ素、ミネラル、アルギン酸を豊富に含み、健康食品や化粧品(美白・保湿)の原料として利用されます。また、新陳代謝を活発にする効果や抗酸化作用も注目されています)が、さまざまな女性がん細胞株でエストロゲン受容体の活性化とエストラジオールの合成を阻害できることがわかりました[85]。フコイダンを投与された乳がんのマウスでは、腸内細菌叢の多様性と組成が向上し、腸管バリアの強化に寄与し、乳がんの予防に役立つことが検出されました[86](図3)。フソバクテリウム・モルティフェラムとブラウティア属CAG-257は、植物リグナンをエンテロリグナン、特にエンテロジオール[87]とエンテロラクトンに変換します。さらに、その後エンテロラクトン(ENL)に変換される植物リグナンの投与、またはエンテロラクトン自体の直接使用は、乳がんの増殖を阻害または遅延させることが実証されています[88](図3)。 |
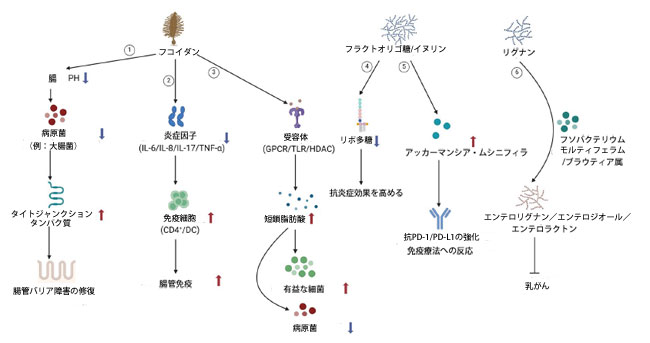 |
図3. プロバイオティクスとプレバイオティクスは代謝を通じて乳がんを阻害します。 ①褐藻多糖体は、腸内微小環境のpHを下げることで、大腸菌などの病原細菌の増殖を抑制します。また、病原細菌が腸管上皮細胞に付着するのを防ぎ、タイトジャンクションタンパク質の発現を促進することで、腸管上皮バリアを保護します。 ②褐藻多糖体は、免疫細胞(CD4+ T細胞、樹状細胞など)の成熟を直接誘導し、炎症性サイトカイン(IL-6、IL-17、TNF-αなど)の発現レベルを低下させることで、腸管免疫機能を高めます。 ③褐藻多糖体は、腸管上皮細胞に発現している受容体にリガンドとして結合し、短鎖脂肪酸の産生を促進し、有益細菌の増殖を刺激し、有害微生物の数を減らし、フローラ構造を調整します。 ④フルクトオリゴ糖とイヌリンは血清リポ多糖類濃度を低下させ、抗炎症効果を高めます。 ⑤フルクトオリゴ糖とイヌリンはアッカーマンシア・ムシニフィラなどの善玉菌の選択的増殖を促進し、抗PD-1/PD-L1免疫療法への反応を高める可能性があります。 ⑥ 植物リグナンはフソバクテリウム・モルティフェラムとブラウティア属によってエンテロリグナン、エンテロジオール、エンテロラクトンに変換され、乳がんの増殖を抑制します。 |
| ヒト化乳がんモデルにおいて、ユーバクテリウム・レクタル、ユーバクテリウム・エリゲンス、ユーバクテリウム・ベントリオスム、コリンセラ・アエロファシエンスを用いた糞便微生物移植(FMT)は腫瘍の増殖を抑制することができる[89]。HFD-FMT(アッカーマンシア・ムシニフィラ、エンセファリトゾーン・インテスティナリス、ムリバクルム・カエシムリスを含む微生物)による雌マウスの遺伝子改変は、この集団における乳がん発症リスクの上昇と関連していた。粘液好性アッカーマンシアの投与は、糞便微生物移植後の無菌マウスにおいて腫瘍浸潤リンパ球数を増加させた。これらの特定の菌株の追加は、抗腫瘍免疫チェックポイント阻害(ICB)の有効性を向上させる可能性があり、将来の臨床応用への有望な道を示唆している[90]。 |
| プレバイオティクスは、通常、食物繊維またはポリフェノールに分類され、宿主によって消化されない物質です。これらの化合物は、宿主内に生息する微生物が優先的に利用する栄養素を提供することで、様々な健康効果を発揮します[70]。よく見られるプレバイオティクスには、フラクトオリゴ糖、イヌリン、ガラクトオリゴ糖があります[70]。プレバイオティクスはアスパラガスやニンニクなどの食品に含まれていますが、高用量のフラクトオリゴ糖、ガラクトオリゴ糖、イヌリン、キシロオリゴ糖は、研究においてサプリメントとしてよく使用されています[91]。これらの基質は、乳酸菌とビフィズス菌の増殖を促進する可能性があります[70,92]。肥満マウスモデルにおいて、オリゴフルクトースを投与したところ、12週間で血清中のリポ多糖類濃度が40%減少しました。これは、リポ多糖類が循環リポ多糖類によって引き起こされる可能性のある全身性炎症の調節において重要な役割を果たすことを示唆しています[93,94](図3)。血清リポ多糖類は乳がんの転移に関与していることが確認されており、血流中のリポ多糖類濃度を低下させることの重要性が強調されています[95]。乳がん治療におけるプレバイオティクスの補給は、乳がん治療におけるそのような報告はないものの、他のがんにおいて研究されています。マウスモデルにおいて、イヌリンまたはムチンは、腸内細菌叢分類群を変化させ、抗腫瘍免疫応答を増強することで、メラノーマの増殖を遅らせました[96]。さらに、イヌリンはマウスモデルにおいて大腸がん細胞の増殖を阻害することができます[96]。イヌリンを投与されたマウスにおいて、アッカーマンシア・ムシニフィラは最も顕著な増加を示し、大腸がんの進行を抑制しました。さらに、この細菌種は抗PD-1/PD-L1免疫療法(訳者注:PD-1(Programmed cell death-1)とPD-L1(Programmed cell death-ligand 1)は、私たちの免疫システムが自分自身の細胞を攻撃しすぎないようにするための「ブレーキ」の役割を果たすタンパク質です。がん細胞はこの仕組みを悪用して、免疫の攻撃から逃れています。)に対する治療効果と相関関係にあることが示されています[96,97](図3)。全体として、プレバイオティクスは有益な微生物を増殖させ、炎症を軽減することで、乳がん患者の治療前、治療中、そして治療後に効果を発揮する可能性があり、その効果をより包括的に検証するための更なる研究の必要性を強調しています。 |
| 5. 免疫療法を受ける乳がん患者の予後に対する腸内細菌叢介入の影響 |
| 現在、米国でがんを克服した800万人の女性のうち、乳がんを克服した人は約50%を占める[98]。乳がんと診断された人の約30%は、一般的に長期生存の予後は良好であるにもかかわらず、最終的に死亡する可能性がある。これらの死亡は主に、初期の多元的治療後に様々な期間の臨床的寛解が得られた後に、疾患の再発によって発生する。したがって、腫瘍の再発予防が不十分であることが、乳がん関連死亡のかなりの部分を占める主な原因となっている[99]。肥満と原発性乳がんの発症リスクの上昇を関連付ける疫学的知見と同様に、肥満は乳がん再発の可能性の上昇[100–103]と、乳がん関連死亡の可能性の30~40%の上昇と相関している可能性がある[104,105]。外科手術を受ける肥満患者は、全身介入(化学療法、ホルモン療法、放射線療法など)を受ける非肥満乳がん患者と比較した場合、麻酔関連合併症を発症するリスクが高くなる可能性があります[106]。 |
| 複数の抗腫瘍治療法の適用に関しては、主な目的は、悪性細胞を根絶して疾患の寛解を達成し、再発の可能性を最小限に抑えることです。ほぼすべての治療法は、大きな進歩にもかかわらず、健康な細胞に対して毒性を示し、さまざまな副作用を引き起こし、そのいくつかは患者の生存を危険にさらす可能性があります。一方、腸内細菌叢は抗がん療法とも深い相互関係を示しています[107]。放射線療法、化学療法、免疫療法、およびその他の治療介入は、患者のマイクロバイオームを変化させる可能性があります。同時に、このマイクロバイオームの構成は、これらの治療の有効性と関連する副作用の発現に影響を及ぼす可能性があります[108]。乳がん管理における主要な課題は、さまざまな臨床的、生物学的、および心理社会的要因によりメカニズムが十分に解明されていない化学療法の副作用と耐性に対処することです。化学療法は微生物多様性を破壊し、腸内細菌叢の乱れや消化管毒性を引き起こす可能性があり、がん生存者におけるマイクロバイオームの変化と長期的な効果との関連性は確立されている[109]。しかしながら、乳がんに対する化学療法と胃腸管への影響との関連性に焦点を当てた研究は乏しい。先行研究では、術前化学療法を受けた女性において、シュードモナス属細菌の検出率が顕著に上昇し、乳がん組織内の細菌多様性が減少したこと、そして未治療患者の腫瘍組織におけるプレボテラ属細菌の存在が減少したことが報告されている[110]。 |
| 腫瘍内の細胞内微生物叢は腫瘍生物学の重要な側面であり、様々ながんで観察されているものの、その役割は明らかではありません。乳腺特異的ポリオーマウイルスミドルT抗原過剰発現マウス(MMTV-PyMT)モデルの構築により、腫瘍内細菌の除去により原発腫瘍の増殖を妨げることなく肺転移の可能性を低下させることができることが明らかになりました。これらの細菌はアクチン細胞骨格の再配置を介して流体せん断応力への抵抗性を高めることで、転移中の宿主細胞の生存率を向上させると考えられます。例えば、胆汁腫瘍と正常組織では主要な細菌属(ブドウ球菌、腸球菌、連鎖球菌、乳酸菌)に違いがあり、腫瘍微生物叢から特定の細菌株を送達することで、2つの異なるマウスモデルにおいて転移を促進できることが示されています[111]。 |
| ある研究では、ラクトバチルス・ジョンソニーとブルーベリーエキスの補給が、腸内細菌叢の多様性と脂質代謝にかなりの変化をもたらしたことが示された[112]。L. ジョンソニーは、高脂肪食を摂取したすべての参加者で長鎖脂肪酸の血清レベルを上昇させたことがわかった。逆に、ブルーベリーエキスを投与した高脂肪食を摂取した動物の脂肪組織では、長鎖脂肪酸レベルの減少が記録された。さらに、高脂肪食を摂取したすべての被験者は、L. ジョンソニーの投与後にステロール調節エレメント結合タンパク質1とステロール調節エレメント結合タンパク質切断活性化タンパク質のタンパク質レベルの低下を示した。ブルーベリーと組み合わせたL. ジョンソニーの存在は、腸内細菌叢の多様性、特にβ多様性を著しく変化させた。 L. ジョンソニーと ブルーベリーの両方を補充した 高脂肪食を摂取した動物の回腸では、α 多様性の顕著な低下が記録されたのに対し、L. ジョンソニーまたは ブルーベリーのいずれかを補充した低カロリー食を摂取した被験者の回腸では、増加が明らかでした。したがって、L. ジョンソニー と ブルーベリー の補充は、腸内細菌叢多様性と脂質代謝に有意な変化をもたらしました。さらに、悪性腫瘍患者における免疫チェックポイント阻害への反応は、腸内細菌叢と有意な関連があります。ある研究では、常在細菌 L. ジョンソニーのより顕著な存在と 免疫チェックポイント阻害の治療効果との間に正の相関関係が示されました [113]。L. ジョンソニーまたはトリプトファン由来のインドール-3-プロピオン酸 (IPA) の適用は、CD8 T 細胞によって促進される αPD-1 免疫療法の有効性を著しく高めることができます。メカニズムレベルでは、L. ジョンソニーはクロストリジウム・スポロゲネスと連携してインドール-3-プロピオン酸を合成することができる。この代謝物はCD8 T細胞の幹様特性の制御に不可欠であり、Tcf7のスーパーエンハンサー領域におけるH3K27のアセチル化を増加させることで、前駆細胞が疲弊したCD8 T細胞の発生を促進する[113]。さらに、インドール-3-プロピオン酸は乳がんにおける免疫チェックポイント阻害の応答性を高めることができる。 |
| 6. 展望と限界 |
| 最近の研究により、スリーブ状胃切除術(訳者注:スリーブ状胃切除術は、胃の大部分(約80%)を細長く(バナナ状)切除し、胃の容量を小さくすることで食事量を減らす減量・代謝改善手術です。腹腔鏡下に行われ、食欲ホルモン(グレリン)の分泌を抑えて満腹感を得やすくします。)は、腸管上皮細胞のリモデリングを介して乳がん免疫療法の効果を強力に増強することが明らかになっています。具体的には、スリーブ状胃切除術に富むクロストリジウム属細菌は、インバリアントナチュラルキラーT細胞を活性化する循環血中分岐鎖アミノ酸濃度を上昇させます。このメカニズムはαPD-1療法と相乗効果を示し、マウスにおいて腫瘍容積を71%減少させました。重要な点として、経口分岐鎖アミノ酸補給はこの効果を模倣し、腫瘍量を最大74%減少させ、非侵襲的な治療戦略を提供することが挙げられます。これらの知見は、現在の治療に抵抗性のある乳がん(トリプルネガティブ乳がん)患者に対する微生物および代謝バイオマーカーの有用性を示唆しています[114]。さらに、本研究は、肥満乳がん患者に対するマイクロバイオームを中心とした逐次的な治療戦略を示唆しています。糞便微生物移植や肥満外科手術(例:スリーブ状胃切除術)といった侵襲的なアプローチは、腸管上皮細胞のリモデリングが免疫療法の効果を強力に増強できることを初めて実証しています。鍵となるのは、分岐鎖アミノ酸などのエフェクター代謝産物を同定することです。これらの代謝産物は、抗腫瘍免疫を活性化することで、糞便微生物移植とスリーブ状胃切除術の両方の抗腫瘍効果を媒介します。その結果、臨床的アプローチは、侵襲的な処置から、特定の微生物代謝産物を用いた非侵襲的で精密な補充へと進化しています。この進化は、患者層別化のための微生物バイオマーカーによって導かれる可能性のある、より安全で拡張性の高い補助療法を約束します。将来の研究では、より標的を絞った制御手段の探索にも焦点を当てることができます。これらの中で、免疫調節薬とファージ療法は2つの有望な道筋を表しています。インドール-3-プロピオン酸などの特定の微生物代謝産物は、CD8 + T細胞の幹細胞様特性をエピジェネティックに強化することにより、免疫チェックポイント阻害の有効性を高めることが示されている[113]。さらに、バクテリオファージは腸内細菌叢を精密に編集するツールとして、有益な常在菌を維持しながら、発がん性細菌(例えば、β-グルクロニダーゼに富む分類群)を選択的に除去する可能性を秘めています[77,115]。これらの新しい戦略を既存の腸内細菌叢標的化アプローチと組み合わせることで、肥満関連乳がんの精密治療に新たな道が開かれる可能性があります。 |
| 人工知能(AI)と機械学習は、乳がんにおける腸内マイクロバイオームの役割の研究方法を変革しています。まず、k近傍法や決定木などのアルゴリズムは、微生物データと臨床データを使用してサンプルを分類できます。これは、健康な個人と患者を効果的に区別するのに役立ちます[116]。基本的な分類を超えて、ランダムフォレストなどのアルゴリズムはより深い洞察を提供できます。SHapley Additive exPlanationsなどの解釈可能性手法と組み合わせると、特定の細菌、肥満、およびがんの進行との間の複雑で非線形な関係を明らかにするのに役立ちます[117]。このアプローチは、潜在的な生物学的メカニズムを明らかにします。AIは臨床翻訳もサポートします。患者のリスクを層別化し、個別化された治療戦略を導くことができます[116]。さらに、栄養科学とメタボロミクスのAIモデルを統合することで、より包括的な視点を提供できる可能性があります[118]。これは、乳がんケアにおける精密医療を前進させる可能性があります。現在のほとんどのマイクロバイオーム研究は数値データに依存しています。しかし、色や粘稠度などの糞便サンプルの視覚的特徴は見落とされがちです。将来的には、標準化された便画像記録とコンピュータービジョンおよびディープラーニングを組み合わせることで、これらの肉眼的特徴と微生物組成を結び付けることが可能になるかもしれません。このようなマルチモーダルアプローチにより、便の外観、主要な細菌、そして代謝の健康状態との間の新たな関連性が明らかになる可能性があります。これは、肥満関連乳がんやその他の疾患に対する非侵襲的な診断ツールの開発につながる可能性があります。 |
| 腸内細菌叢に関する乳がんの臨床研究には、依然として未解決の問題がいくつか存在します。大きな課題の一つは、前臨床研究の成果の応用可能性が限られていることです。マウスとヒトの腸内生理、免疫系、マイクロバイオーム構成には根本的な違いがあり、動物モデルからヒト患者への外挿を困難にしています[119]。さらに、マイクロバイオームに基づく治療法に関する現在の規制枠組みとエビデンスは未整備です。市販されているプロバイオティクスのほとんどは、腫瘍学の用途ではなく、胃腸の健康のための栄養補助食品として規制されています。このため、免疫療法などのがん治療への反応を調節する安全性と有効性を裏付ける堅牢な臨床試験データにギャップが生じています[120]。最後に、細菌代謝物や細胞外小胞などの非生菌性微生物由来物を用いた革新的なアプローチは有望な治療手段となりますが、依然として大部分が実験段階に留まっています。生きたバイオ医薬品の安全性と拡張性の限界を克服する可能性については、さらなる検証が必要である[115]。 |
| 腸内細菌叢による乳がんの調節には依然として限界がある。腸、腸内細菌叢、乳がんの関係を探る臨床研究は、いくつかの方法論的制約によって制限されている。主な問題は、遺伝、食事、環境によって引き起こされる腸内細菌叢組成の個人間変動が大きいことである。この変動は、患者の反応がおそらく不均一であるため、画一的な介入の開発を困難にしている[121]。この問題をさらに悪化させているのは、マイクロバイオーム科学の標準化の欠如である。研究間でのサンプル収集、DNA抽出、シーケンスプロトコル、バイオインフォマティクス解析のばらつきは、再現性と結果の直接比較を妨げている。多くの臨床調査はまた、サンプルサイズが不十分であることと、主要な交絡因子の管理が不十分であることに悩まされている。食事パターン、正確な投薬歴、環境曝露などの要因は必ずしも厳密に考慮されているとは限らず、結果にバイアスが生じる可能性がある。これらの問題の根底には、特定の乳がんサブタイプにおける腸内細菌叢、その代謝産物、そして宿主の腫瘍生物学との間のメカニズム的相互作用に関する理解の不完全さがあります。この知識ギャップは、標的介入の合理的な設計を阻害しています。これらの限界を総合的に見ると、乳がん治療における微生物叢を標的とした介入に関する強固なエビデンスを確立するためには、標準化された方法論を用いた、より大規模で適切に管理された試験の必要性が浮き彫りになっています。 |
| 叙述的レビューの性質上、本研究の方法論はシステマティックレビューの基準に完全に準拠しておらず、論文選択プロセスにはある程度の主観が含まれる可能性があり、その結果、システマティックレビューと比較して再現性がわずかに低くなります。この制限は、将来の関連するシステマティックレビューやメタ分析の研究の方向性も示しています。 |
| 7. 結論 |
| 乳がんは依然として世界的な健康課題であり、罹患率は上昇傾向にあります。乳がんの病因において、腸内細菌叢、肥満、炎症は複雑に相互作用しています。肥満に関連した微生物叢の変化が乳がんの予後に重要な役割を果たすというエビデンスが増えており、この軸の調節は将来の個別化治療への期待が高まっています。本レビューでは、患者における腸内細菌叢の変化、肥満関連代謝機能障害におけるその役割、そして腸内細菌叢の異常が腫瘍の進行と免疫回避を促進するメカニズムについて概説します。プロバイオティクス、プレバイオティクス、または糞便微生物叢移植による腸内細菌叢の調節は、特に肥満患者において転帰改善に有望です。今後の研究では、サブタイプ特異的な微生物シグネチャーを定義し、厳格な試験で微生物叢を標的とした治療法を検証し、微生物代謝物を標的とした食事介入を検討する必要があります。腸内細菌叢と乳がんの相互作用に対する認識を高めることは、より効果的な予防・治療戦略の開発に貢献するでしょう。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Ann Med. 2026 Jan 7;58(1):2611203.に掲載されたThe gut microbiota-obesity axis in the pathogenesis and prognosis of breast cancer.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


