ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(発酵乳、腸内細菌の科学:研究の最前線) |
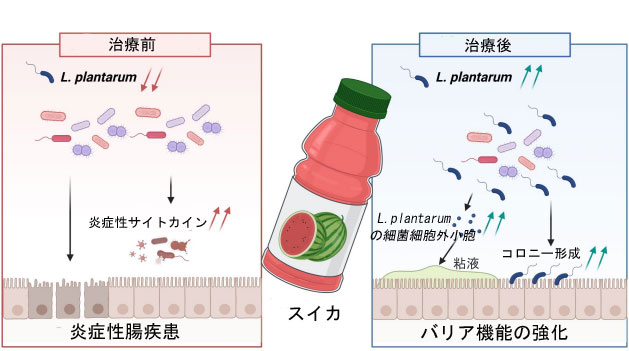
Lactiplantibacillus plantarumの定着と 細胞外小胞の放出による炎症性腸疾患の重症度軽減 |
Yuanyuan Wu et al., |
|
|
| 要約 |
炎症性腸疾患(IBD)は、腸管バリア機能の低下と有効な治療法の欠如を特徴としています。プロバイオティクスは、腸内細菌叢の調節、腸管バリア機能の強化、そして抗炎症作用を示すことから、炎症性腸疾患の治療に有望視されています。しかしながら、プロバイオティクスが炎症性腸疾患治療においてこれらの治療効果を発揮する具体的なメカニズムは、未だ十分に解明されていません。本研究では、炎症性腸疾患患者の腸内細菌叢において、Lactiplantibacillus plantarum(L. plantarum)が有意に減少していることが明らかになりました。L. plantarumは、食用プロバイオティクスの中でもよく知られたプロバイオティクス株であり、腸管バリアの強化や炎症の軽減など、腸の健康に有益な効果があることが知られています。本研究では、L. plantarumの補給が、主にL. plantarumの細菌細胞外小胞(L. plantarum-EV)を介して腸上皮細胞のアポトーシスを阻害することで、マウスの炎症性腸疾患症状を緩和できることを実証しました。この保護効果は、L. plantarum 由来の細菌細胞外小胞が腸管細胞に効率的に取り込まれることに依存しています。興味深いことに、スイカはL. plantarumのコロニー形成とL. plantarum 由来の細菌細胞外小胞の放出を促進し、腸管バリアの修復をさらに促進します。私たちの研究結果は、L. plantarum 由来の細菌細胞外小胞が、スイカなどの天然食品によって強化されるナノ粒子を用いた治療法の有望な候補であることから、プロバイオティクスをベースとした炎症性腸疾患治療における理解に貢献します。したがって、本研究は炎症性腸疾患の管理と治療における画期的な進歩となる可能性があります。 |
| 目次(クリックして記事にアクセスできます) |
| 1.はじめに |
| 2.方法 |
| 2.1.動物および炎症性腸疾患(IBD)モデル |
| 2.2.細胞培養 |
| 2.3.細胞スクラッチアッセイ |
| 2.4.ウェスタンブロット |
| 2.5.細菌DNA抽出 |
| 2.6.定量的リアルタイムPCR(qRT-PCR) |
| 2.7.アネキシンV/PI染色および細胞周期検出 |
| 2.8.酵素免疫測定法 |
| 2.9.細菌の生育条件 |
| 2.10.果物培養上清は細菌の増殖を促進した |
| 2.11.スイカ培養上清は細菌細胞外小胞の放出を促進した |
| 2.12. 細菌細胞外小胞の分離 |
| 2.13. 細菌細胞外小胞の特性評価 |
| 2.14.16S rRNA遺伝子シーケンシング |
| 2.15.RNAシーケンシングと解析 |
| 2.16.臨床検体 |
| 2.16.1.健康なドナーおよび大腸炎患者 |
| 2.16.2.ボランティア |
| 2.17.統計解析 |
| 3.結果 |
| 3.1.Lactiplantibacillus plantarumの補給は、炎症性腸疾患の症状を軽減した |
| 3.2. L. plantarum 由来の細菌細胞外小胞はマウスの炎症性腸疾患症状を緩和した |
| 3.3. L. plantarum 由来の細菌細胞外小胞は、mPTP-CytC-カスパーゼ9-カスパーゼ3軸を介して腸管上皮細胞のアポトーシスを阻害した |
| 3.4.スイカはL. plantarumのコロニー形成と細菌細胞外小胞放出を増加させた |
| 3.5.スイカは腸内細菌叢を介して炎症性腸疾患の症状を緩和した |
| 4.考察 |
| グラフィカルアブストラクト |
 |
本文 |
| 1.はじめに |
| 炎症性腸疾患は、世界中で数百万人が罹患している慢性炎症性疾患であり、遺伝的、環境的、免疫学的因子が複雑に絡み合った病態生理を有しています[1]。これらの因子は、上皮細胞機能、腸管透過性、免疫応答調節、腸内細菌叢バランスといった重要なプロセスを阻害し、最終的には腸機能障害を引き起こします[2]。既存の治療法にもかかわらず、炎症性腸疾患 患者の持続的な除菌または完全回復は、その病態生理に関する理解の不足と既存の薬剤の限界により、依然として困難です[3, 4]。プロバイオティクスは、腸内細菌叢を管理し、腸内バリアの恒常性を維持するための有望なアプローチとして浮上しています[5, 6]。Lactaseibacillus rhamnosusやLactiplantibacillus reuteriなどの菌株は、血流への有害物質の侵入を防ぐ上で重要なタイトジャンクションタンパク質を活性化することでバリア機能を改善します[7, 8]。しかし、特定のプロバイオティクスの炎症性腸疾患治療における有効性は依然として不明確であり、持続的なコロニー形成と安定した治療成果の達成には課題が残されています。さらに、炎症性腸疾患におけるプロバイオティクスの作用の根底にある主要な有効成分とメカニズムは十分に解明されていません。 |
| 近年の研究では、細菌細胞外小胞(BEV)が細菌-宿主相互作用および疾患進行における重要なメディエーターとして注目されています[9–11]。30~200 nmの大きさのこれらのナノスケール粒子は、タンパク質や遺伝物質などの生理活性分子を運搬します[12, 13]。特に、細菌細胞外小胞は、その特殊な構造特性により、ヒトの消化管内で高い安定性を示し[14]、消化酵素による分解を効果的に抑制し、宿主細胞によって容易に吸収されます[15, 16]。さらに、プロバイオティクス由来の細菌細胞外小胞は、抗炎症、抗酸化、免疫調節作用を有することが確認されており、疾患治療のためのナノ粒子医薬品の分野における有望な候補となっています[17–19]。したがって、プロバイオティクスによる腸管バリアの調節におけるこれらのナノスケール粒子の役割を解明することは、特に細菌細胞外小胞の産生とナノ粒子ベースの治療法を強化するという点で、細菌細胞外小胞ベースの炎症性腸疾患治療の画期的な進歩につながる可能性があります。 |
| 本研究では、炎症性腸疾患患者の腸内細菌叢におけるL. plantarumの存在が著しく減少していること、そしてL. plantarumの補給がマウスモデルにおける炎症性腸疾患症状を緩和できることを報告します。L. plantarumは、炎症性腸疾患の放出を介してmPTP-CytC-Caspase-9-Caspase-3経路を介して腸管上皮細胞のアポトーシスを阻害できることを実証しました。さらに、スイカは触媒として作用し、L. plantarumの増殖とL. plantarum 由来の細菌細胞外小胞の分泌を促進し、炎症性腸疾患症状の緩和に寄与することがわかりました。本研究は、腸管バリアの完全性を維持するL. plantarum 由来の細菌細胞外小胞の臨床的意義を強調し、ナノ粒子を用いた治療戦略の有望な候補として位置付けています。重要なのは、これらの小胞の有効性がスイカによって著しく向上し、炎症性腸疾患治療に対する独自の相乗的なアプローチを提供することです。 |
| 2.方法 |
| 2.1.動物および炎症性腸疾患(IBD)モデル |
| 本研究におけるすべてのマウス実験は、南方医科大学教育研究における生きた動物の使用に関する委員会(承認番号:SMUL2022002)の承認を受け、南方医科大学実験動物の飼育および使用に関するガイドラインに従って実施されました。特定病原体フリー(SPF)の健康な雄C57BL/6Jマウス(6~8週齢)は、広東智源生物医学科技有限公司から入手し、南方医科大学のSPF動物施設で飼育しました。マウスは一定の温度、湿度、12/12時間の明暗サイクルの条件下で飼育され、餌と水は自由に摂取できました。 |
| 1週間の順応後、炎症性腸疾患モデル群のマウスは7日間、3% DSS水溶液(MB5535、meilunbio)を自由に摂取できるようにした。マウスには、対照群または実験群として、毎日300µLのPBS、または大腸菌(109 CFU/mL)、大腸菌由来細菌細胞外小胞(30µg)、L. plantarum(109 CFU/mL)、L. plantarum 由来の細菌細胞外小胞(30µg)、スイカ上清などの他の介入を投与した。 |
| 塩酸バンコマイシン(10 mg/mL、200 µL、V820413、Macklin)、メトロニトリジン(10 mg/mL、200 µL、M813526、Macklin)、ネオマイシン(20 mg/mL、200 µL、XY-K1226、X-Y Biotechnology)、およびアンピシリン(20 mg/mL、200 µL、A830931、Macklin)の混合物を7日間使用して、マウスの腸内細菌叢を除去しました。 |
| 2.2.細胞培養 |
| ヒト正常結腸上皮細胞(NCM 460)を、10%ウシ胎児血清(FBS、164210-50、Procell)、10 U/mLペニシリン(PB180120、Procell)、および0.1 mg/mLストレプトマイシン(PB180120、Procell)を添加したダルベッコ改変イーグル培地(DMEM、C11995500BT、Gibco)で培養した。細胞はインキュベーター内、37℃、5% CO2で培養した。 |
| 2.3.細胞スクラッチアッセイ |
| NCM 460細胞を12ウェルプレートに2.5×105個/ウェルで播種した。細胞を一晩接着させた後、200µLピペットチップを用いてウェルあたり2箇所にスクラッチを作製した。その後、細胞をリン酸緩衝生理食塩水で2回洗浄した。次に、3% DSSおよび10µg/mL L. plantarum 由来の細菌細胞外小胞またはE. coli由来の細菌細胞外小胞を含む無血清培地1mLを各ウェルに加えた。細胞遊走は、ニコン倒立顕微鏡を用いて0時間、12時間、24時間後に評価し、スクラッチ面積はImageJソフトウェアを用いて定量化した。 |
2.4.ウェスタンブロット |
| NCM 460細胞を6ウェルプレートに3.5×105個/ウェルで播種した。一晩細胞を接着させた後、リン酸緩衝生理食塩水で2回洗浄した。続いて、3% DSSおよび異なる濃度のL. plantarum 由来の細菌細胞外小胞(5、10、15、20 µg/mL)を含む無血清培地2 mLを各ウェルに加えた。細胞はL. plantarum 由来の細菌細胞外小胞と共に0時間、12時間、24時間培養した。その後、1%プロテアーゼおよびホスファターゼ阻害剤カクテルであるフェニルメタンスルホニルフルオリド(P002、NCM Biotech)を含むRIPA溶解バッファー(WB3100、NCM Biotech)を用いてNCM 460細胞からタンパク質サンプルを採取した。総タンパク質濃度はBCAタンパク質アッセイキット(FD2001、Fdbio Science)を用いて測定した。等量のタンパク質(各群30µg)を4~20%タンパク質プレメイドゲル(ET15420Gel、ACE Biotechnology)にロードし、電気泳動に供しました。タンパク質をポリフッ化ビニリデン(PVDF)膜に転写した後、ブロットを5%ウシ血清アルブミン(BSA、FD0030、Fdbio Science)で室温で2時間ブロッキングしました。膜を一次抗体で4℃で一晩インキュベートした後、対応する二次抗体で室温で2時間インキュベートしました。すべての一次抗体はAffinity Biosciences社から、すべての二次抗体はFdbio science社から入手しました。GAPDH(ab201822、Abcam)およびβ-チューブリン(AF7011、Affinity Biosciences)は標準化に使用しました。バンドの定量化はImageJソフトウェアを用いて行いました。 |
| 2.5.細菌DNA抽出 |
| すべての糞便サンプルからのDNA抽出は、QIAamp Fast DNA Stool Mini Kit(製品番号:51604、Qiagen)を用いて、糞便サンプル専用の製造元の指示に従い、修正プロトコルを用いて実施しました。抽出したDNAの量と純度は、NanoDrop ND-1000分光光度計(Thermo Fisher Scientific)で確認し、-20℃で保存しました。 |
| 2.6.定量的リアルタイムPCR(qRT-PCR) |
| TRIzol試薬(15596026、Invitrogen)を用いて細胞内RNAを抽出し、逆転写キット(RR036A、Takara)を用いてcDNAを合成した。その後、遺伝子発現解析のためにSYBR® Green Pro Taq HS Premix(AG11701、Accurate Biology)を添加した。qRT-PCRに使用したプライマーは表S1の通りである。 |
| 2.7.アネキシンV/PI染色および細胞周期検出 |
| NCM 460細胞を6ウェルプレートに3.5×105個/ウェルで播種した。一晩接着させた後、細胞をリン酸緩衝生理食塩水で2回洗浄した。その後、3% DSS、異なる濃度のL. plantarum 由来の細菌細胞外小胞(5、10、15、20µg/mL)およびリン酸緩衝生理食塩水を含む無血清培地2mLを各ウェルに加えた。細胞をL. plantarum 由来の細菌細胞外小胞と0時間、12時間、24時間共培養した。 |
| アポトーシス細胞およびネクローシス細胞の同定には、アネキシンV-フルオレセインイソチオシアネート(FITC)/プロピジウムヨウ化物(PI)アポトーシス検出キット(40302ES50、Yeasen Biotechnology)を用いた。製造元の指示に従い、1~5×105個の生細胞を採取し、室温、暗所で15分間染色(PI 10 µLおよびアネキシンV-FITC 5 µL)した後、BD Fortessa多次元高解像度フローサイトメーターで解析した。得られたドットプロットにおいて、X軸は緑色蛍光(アネキシンV)の強度、Y軸は赤色蛍光(PI)の強度を表す。細胞集団分布解析は 4 つの象限に分割され、Annexin V-/PI-、Annexin V+/PI-、Annexin V-/PI+、Annexin V+/PI + はそれぞれ正常状態、初期アポトーシス、壊死、後期アポトーシスを表しています。 |
| 2.8.酵素免疫測定法 |
| NCM 460細胞から、1%プロテアーゼ阻害剤およびホスファターゼ阻害剤を含むRIPA溶解緩衝液を用いてタンパク質サンプルを採取した。MPTPタンパク質レベルは、ヒトMPTP ELISAキット(DG12601H、Dogesce)を用いて測定した。 |
| 2.9.細菌の生育条件 |
| E. coliは、Luria-Bertani(LB)ブロス(HB0128、Hopebio)中で37℃、160 rpmで連続振盪培養し、18時間培養した。L. plantarumは、1% D-(+)-マルトース一水和物(D813131、Macklin)および1% 酵母エキス(050090、HuanKai Biology)を添加したde Man, Rogosa and Sharpe(MRS)ブロス(HB0384-1、Hopebio)中で37℃、12時間嫌気培養した。 |
| 2.10.果物培養上清は細菌の増殖を促進した |
| MRSブロスに1‰システインおよび1% リン酸緩衝生理食塩水を添加したもの、またはピタヤ、モモ、スイカなどの果物培養上清を添加した。L. plantarumを培地に接種し、2、4、8、12、24時間培養後、細菌培養物を3,000 × gで10分間遠心分離した。上清を除去した後、等量のリン酸緩衝生理食塩水を加えて細菌を再懸濁し、OD600値を測定した。 |
| 2.11.スイカ培養上清は細菌細胞外小胞の放出を促進した |
| MRSブロスに1%システイン、1%リン酸緩衝生理食塩水、またはスイカ培養上清を添加した。L. plantarumを培地に接種し、8時間培養した。L. plantarum由来の細菌細胞外小胞は超遠心分離により単離し、BCAタンパク質アッセイキットを用いてタンパク質定量を行った。 |
| 2.12. 細菌細胞外小胞の分離 |
| 細菌細胞外小胞は細菌培養物から分離した。細菌は、まず300 × gで10分間、次に3,000 × gで20分間、最後に12,000 × gで30分間、4℃で遠心分離することにより除去した。上清液は0.22 μm孔径のフィルターでろ過し、残留細菌および細胞残渣を除去した。ろ液を135,000 × gで70分間、4℃で超遠心分離することにより細菌細胞外小胞を分離し、リン酸緩衝生理食塩水に再懸濁した。細菌細胞外小胞サンプルは、後の研究のために-80℃で保存した。細菌細胞外小胞のタンパク質定量は、BCAタンパク質アッセイキットを用いて実施した。 |
| 2.13. 細菌細胞外小胞の特性評価 |
| L. plantarum 由来の細菌細胞外小胞の形態とサイズ分布は、透過型電子顕微鏡(H-7650、日立)およびナノ粒子追跡分析(ZetaView PMX-120、Particle Metrix)を用いて観察した。L. plantarum 由来の細菌細胞外小胞の表面マーカーLTA(MA1-7402、Thermo Fisher Scientific)は、ウェスタンブロット法により特性評価を行った。 |
| 2.14.16S rRNA遺伝子シーケンシング |
| 16S rRNAシーケンシングは、Novogene(中国、北京)のNovaSeq 6000システムを用いて実施しました。ヒト糞便検体から全DNAを抽出し、-80℃で保存しました。抽出した全DNAの含有量はNanodropで定量し、1%アガロースゲル電気泳動で品質を確認しました。16Sアンプリコンシーケンシングでは、細菌16S rRNAの可変V4領域をプライマーV4F(5'-GTGTGYCAGCMGCCGCGGTAA-3')およびV4R(5'-CCGGACTACNVGGGTWTCTAAT-3')を用いて増幅し、PCR産物はGeneJET Gel Extraction Kit(K0691、Thermo Scientific)を用いて精製しました。イルミナTruSeq DNA PCRフリーライブラリ調製キット(イルミナ)を用いてシーケンシングライブラリを作製し、インデックスコードを追加しました。最後に、ライブラリをイルミナNovaSeqプラットフォームでシーケンシングし、250 bpのペアエンドリードを生成しました。QIIME2 dada2解析プロセスまたはVsearchソフトウェアの解析プロセスに沿って、配列ノイズ除去、または操作的分類単位(OTU)クラスタリングを実施しました。アンプリコン配列変異(ASV)/ OTUレベルで、各サンプルの距離行列を計算し、PERMANOVA、ANOSIM、PERMDISPなどの対応する統計検定と組み合わせて、さまざまな教師なしソートおよびクラスタリング手法によって、異なるサンプル(グループ)間の多様性の差と差の有意性を測定しました。 |
| 2.15.RNAシーケンシングと解析 |
| NCM 460細胞からRNAサンプルをAG RNAex Pro試薬(AG21102、Accurate Biotechnology社製)を用いて採取しました。RNAの総量と完全性は、Bioanalyzer 2100システム(Agilent Technologies社、カリフォルニア州、米国)のRNA Nano 6000アッセイキットを用いて評価しました。ライブラリの適格性を確認した後、各ライブラリは有効濃度と装置から取得した目標データ量に応じてプールされ、Illumina NovaSeq 6000でシーケンシングされました。150 bpのペアリング末端のリードが生成されました。ハイスループットシーケンサーで測定された画像データは、CASAVA塩基認識によってシーケンシングデータ(リード)に変換されました。リファレンスゲノムおよび遺伝子モデルアノテーションファイルは、GENCODEデータベース(https://www.gencodegenes.org)からダウンロードしました。参照ゲノムのインデックスはHISAT2 (v2.0.5) を用いて構築し、ペアエンドクリーンリードはHISAT2 (v2.0.5) を用いて参照ゲノムにアラインメントしました。FeatureCounts (v1.5.0-p3) を用いて、各遺伝子にマッピングされたリード数をカウントしました。発現レベル解析はDESeq2 Rパッケージ (1.20.0) を用いて実施しました。発現レベルが異なる遺伝子の遺伝子オントロジー (GO) エンリッチメント解析はclusterProfiler Rパッケージ (3.8.1) を用いて実施しました。 |
| 2.16.臨床検体 |
| 2.16.1.健康なドナーおよび大腸炎患者 |
| 検体採取プロトコルは、南方医科大学南方病院倫理委員会の承認を得た(承認番号:NFEC-2022-001)。健康なドナーおよび大腸炎患者は、標準ガイドライン[31]に従って南方病院から選定された。すべての便検体は-80℃で保存された。 |
| 2.16.2.ボランティア |
| ボランティアは3日間、断食フルーツを摂取し、便サンプルを採取しました。その後、7日間、新鮮なスイカを摂取し、再び便サンプルを採取しました。スイカ摂取前後の便はペアにして、-80℃で保存しました。サンプル採取は、南方医科大学南方病院倫理委員会の承認を得ました(承認番号:NFEC-2022-001)。 |
| 2.17.統計解析 |
| すべてのデータは平均値±標準偏差(SD)として示されました。複数群間の比較には一元配置分散分析(ANOVA)を用いました。2群間の比較にはStudent's t検定を用いました。データが正規性検定および対数正規性検定に合格しなかった場合は、2群間の比較にはMann Whitney検定を用い、複数群間の比較にはKruskal-Wallis検定を用いました。すべての統計解析はGraphPad Prism 9.0を用いて実施しました。P値<0.05を統計的に有意としました。*P<0.05、**P<0.01、***P<0.001、****P<0.0001。 |
| 3.結果 |
| 3.1.Lactiplantibacillus plantarumの補給は、炎症性腸疾患の症状を軽減した |
| 炎症性腸疾患に関連する潜在的に有益な微生物叢を調査するため、炎症性腸疾患患者の糞便サンプルを採取し、16S rRNAシークエンシングを実施して腸内微生物叢の構成を解析した(図1a)。研究対象となった全患者は、大腸内視鏡検査とその後の組織サンプルの病理学的解析によって炎症性腸疾患と診断された(図1b)。食生活の違いや地域差などの潜在的な交絡因子をコントロールするため、追加の公開データベース(Human Microbiome Project (HMP) Database)を用いて比較解析を行った。特に、炎症性腸疾患患者の糞便中のL. plantarumの存在量は健常者と比較して低いことが分かった(図1c)。これは、炎症性腸疾患環境下でのL. plantarumの定着率が低いことを示唆している。 |
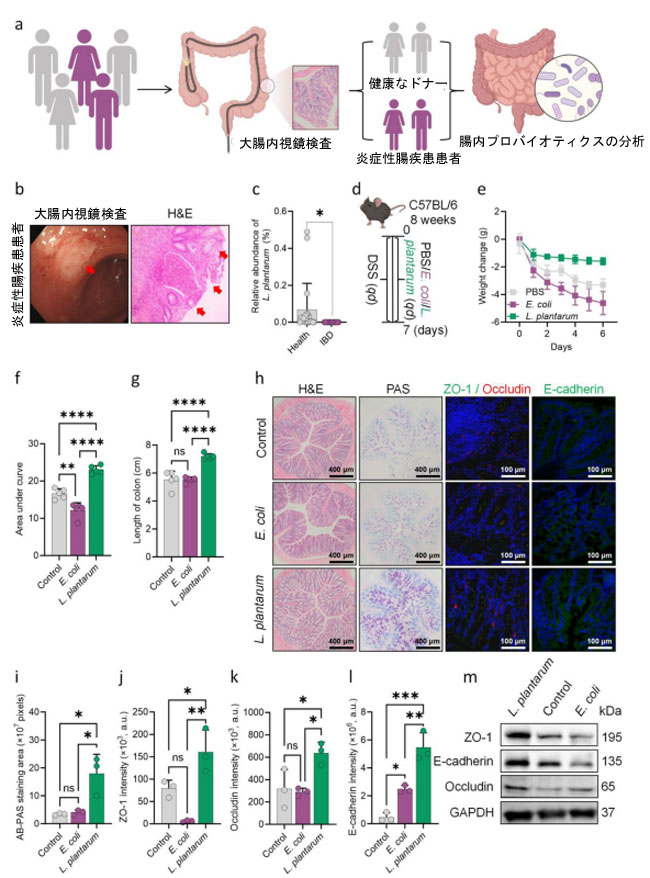 |
図1 L. plantarumによる腸管バリア機能障害の緩和。 (a) 患者からの糞便サンプルの採取。(b) 患者の組織サンプルの大腸内視鏡検査および組織学的検査。(c) 16 S rRNAシークエンシングによるヒト腸管におけるL. plantarumの相対的存在量の測定(IBD n = 20、NC n = 20)。(d) 大腸炎マウスをL. plantarumで治療するためのプロトコルを示すフローチャート。(e、f) マウスの毎日の体重変化と曲線下面積の分析(n = 5)。(g) 各実験群の結腸の長さの測定(n = 5)。(h) H&E染色した結腸切片、AB-PAS染色した結腸切片の内側粘液層、および腸管上皮タイトジャンクションタンパク質の免疫蛍光染色。 (i-l) 杯細胞から分泌される粘液量とタイトジャンクションタンパク質オクルディン、ZO-1、E-カドヘリンの発現レベルの定量分析(n = 3)。(m) 炎症性腸疾患マウスモデルにおける対照群、大腸菌投与群、およびL. plantarum投与群の大腸組織における腸管バリア関連タンパク質E-カドヘリン、オクルディン、およびZO-1のウェスタンブロット法による発現。(c)のP値はStudent's t検定を用いて算出した。(f-g)および(i-l)のP値は一元配置分散分析を用いて算出した。*P < 0.05、**P < 0.01、***P < 0.001、****P < 0.0001 |
| L. plantarum 補給の炎症性腸疾患に対する効果を評価するために、6~8 週齢のマウスに 3% DSS 水溶液を 7 日間自由に摂取させ、炎症性腸疾患マウスモデルを構築しました (図 1d)。次に、マウスを 3 つのグループに分けました。第 1 グループはリン酸緩衝生理食塩水のみを投与し (ブランク グループ)、第 2 グループは一般的な腸内細菌である大腸菌 (E. coli) を投与し (コントロール グループ)、第 3 グループは L. plantarum を投与しました (図 1d)。L. plantarum 補給は、リン酸緩衝背営利食塩水群と比較して、DSS 誘発性の体重減少 (図 1e および f) と結腸短縮 (図 1g) を効果的に緩和しましたが、E. coli 補給では同様の効果は得られませんでした。ヘマトキシリコエオシン (H&E) 染色により、L. plantarum 投与により結腸の炎症細胞浸潤と粘膜損傷が軽減されたことが示されました (図 1h)。これらの結果は、アルシアンブルー-過ヨウ素酸シッフ(AB-PAS)染色によって裏付けられ、L. plantarum は DSS によって減少した杯細胞での粘液分泌を顕著に回復させたが、大腸菌処理ではこの効果は見られなかった(図 1h および i)。さらに、組織サンプルでの粘膜バリアタンパク質発現の免疫蛍光分析により、L. plantarum は ZO-1(図 1h および j)、オクルディン(図 1h および k)、E-カドヘリン(図 1h および l)などのタイトジャンクションタンパク質の発現を安定化させたことが明らかになった。L. plantarum は、ウェスタンブロット(図 1m および図 S1a-c)および qPCR(図 S1e-g)によって決定されたように E-カドヘリンと ZO-1 のレベルを上昇させ、一方 L. plantarum は遺伝子発現に大きな影響を及ぼし、E カドヘリン、オクルディン、ZO-1 の発現が顕著に増加した。これらの結果を総合すると、L. plantarum の投与により、炎症性腸疾患のマウス モデルにおける炎症反応と粘膜損傷が大幅に軽減されることがわかります。 |
| 3.2. L. plantarum 由来の細菌細胞外小胞はマウスの炎症性腸疾患症状を緩和した |
| 近年、細菌由来の細菌細胞外小胞は、ヒトの病態生理を調節する有望なアプローチとして浮上している[20]。腸内常在細菌由来のこれらのナノ粒子は、腸管において優れた安定性と消化酵素に対する耐性を示す[21]。さらに、宿主細胞に容易に取り込まれる[22]。したがって、これらの小胞は、プロバイオティクスの有益な効果における重要なメディエーターとして重要な役割を果たす可能性がある[23]。本研究では、炎症性腸疾患におけるL. plantarum 由来の細菌細胞外小胞の役割を調査することを目的とした。L. plantarum 由来の細菌細胞外小胞は、超遠心分離によって培養液から単離され、ナノ粒子追跡分析(NTA)、ウェスタンブロット(WB)、透過型電子顕微鏡(TEM)によって特徴付けられた(図S2a-c)。回収された粒子は40nmから500nmのサイズ(図S2a)で、グラム陽性細菌のマーカー物質であるリポテイコ酸(LTA)を発現していました(図S2b)。さらに、透過型電子顕微鏡(TEM)でその球状形状が観察され(図S2c)、高純度のL. plantarum 由来の細菌細胞外小胞の分離に成功したことが示唆されました。 |
| 微生物-宿主相互作用におけるL. plantarum 由来の細菌細胞外小胞の役割(図2a)をさらに深く掘り下げるため、宿主細胞による細菌細胞外小胞の取り込みを調査しました。細菌細胞外小胞をNCM 460細胞と3時間インキュベートしました。これらの細胞による蛍光シグナルの吸収、特に核周縁部への蓄積は、細菌細胞外小胞が細胞機能に影響を与える可能性を示唆しています(図2b)。細菌細胞外小胞の効果を評価するため、細菌細胞外小胞またはE. coli由来の細菌細胞外小胞をインキュベートしたNCM 460細胞を用いてスクラッチテストを実施しました。炎症性腸疾患細胞モデルは3% DSSを用いて誘導し、リン酸緩衝生理食塩水を用いたブランクコントロール、E. coli由来の細菌細胞外小胞を用いたネガティブコントロール、およびL. plantarum 由来の細菌細胞外小胞を用いた処理群の3群に分けました。結果から、L. plantarum 由来の細菌細胞外小胞で処理したNCM 460細胞の移動能力は、共培養12~24時間後、E. coli由来の細菌細胞外小胞またはリン酸緩衝生理食塩水で処理した細胞よりも高いことが確認されました(図2cおよびd)。続いて、L. plantarum 由来の細菌細胞外小胞の効果はin vivoでも観察されました(図2e)。他のグループと比較して、L. plantarum 由来の細菌細胞外小胞は、統計的有意性には達しませんでしたが、体重減少を軽減し(図2fおよびg)、炎症性腸疾患マウスモデルの結腸短縮を改善する(図2h)傾向を示しました。H&E染色およびAB-PAS染色により、DSSによって誘発された病理学的特徴がL. plantarum 由来の細菌細胞外小胞によって回復したことが明らかになりました(図2iおよびj)。対照的に、L. plantarum 由来の細菌細胞外小胞群では、依然として中等度の炎症細胞浸潤と粘液分泌の減少が見られました(図2iおよびj)。さらに、免疫蛍光染色により、L. plantarum 由来の細菌細胞外小胞群では、ZO-1の発現は有意に変化しなかったものの(図2i、l-m)、他の2群と比較して、オクルディンおよびE-カドヘリンの発現が有意に増加していることが明らかになりました(図2i、k)。さらに、L. plantarum 由来の細菌細胞外小胞は、ウェスタンブロット(図2nおよび図S3a-c)およびqPCR(図S3d-f)によって確認されたように、E-カドヘリン、オクルディン、およびZO-1の発現を著しく上昇させており、L. plantarum 由来の細菌細胞外小胞が腸管バリア機能を促進することを示しています。全体として、データは、L. plantarum 由来の細菌細胞外小胞がL. plantarumの炎症性腸疾患緩和効果における主要な構成要素であることを示唆しました。 |
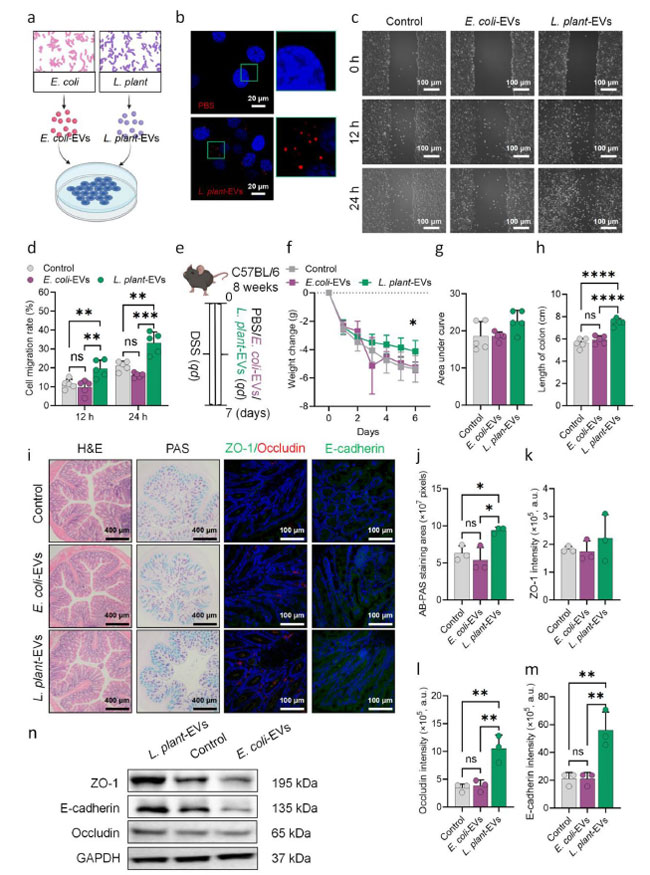 |
| 図2 L. plantarum 由来の細菌細胞外小胞(L. plant-EV)の炎症性腸疾患緩和効果。(a) L. plantarum 由来の細菌細胞外小胞による細胞処理を示す模式図。(b) 細胞取り込み実験。青色蛍光はDAPI染色を示し、赤色蛍光はCellMaskで標識されたL. plantarum 由来の細菌細胞外小胞を示す。(c、d) NCM 460細胞にスクラッチアッセイを実施し、12時間および24時間後の遊走および治癒能力を測定した(n = 5)。(e) 大腸炎マウスに対するL. plantarum 由来の細菌細胞外小胞介入のプロトコルを示すフローチャート。(f、g) マウスの毎日の体重変化および曲線下面積分析(n = 5)。(h) 各実験群の結腸の長さの測定(n = 5)。(i) H&E染色した結腸切片、AB-PAS染色した結腸切片の内側粘液層、および腸管上皮タイトジャンクションタンパク質の免疫蛍光染色。 (j-m) 杯細胞から分泌される粘液量とタイトジャンクションタンパク質オクルディン、ZO-1、E-カドヘリンの発現レベルの定量分析 (n = 3)。(n) マウス結腸におけるE-カドヘリン、オクルディン、ZO-1のウェスタンブロット分析。(f) のP値は二元配置分散分析を用いて算出した。(d)、(g-h)、(j-m) のP値は一元配置分散分析を用いて算出した。*P < 0.05、**P < 0.01、***P < 0.001、****P < 0.0001 |
| 3.3. L. plantarum 由来の細菌細胞外小胞は、mPTP-CytC-カスパーゼ9-カスパーゼ3軸を介して腸管上皮細胞のアポトーシスを阻害した |
| L. plantarum 由来の細菌細胞外小胞が炎症性腸疾患を軽減する能力を確認した後、その根底にあるメカニズムをさらに解明することを目的とした。3% DSS処理した腸管上皮細胞をL. plantarum 由来の細菌細胞外小胞と24時間インキュベートした後、抽出したRNAを用いてトランスクリプトーム解析を実施した。その結果、主要な発現差遺伝子(DEG)が明らかになり、対照群では483遺伝子、L. plantarum 由来の細菌細胞外小胞投与群では425遺伝子、両群間で発現が変化した遺伝子は合計11,694遺伝子であった(図3a)。ボルカノプロットの結果、解析した遺伝子のうち1,708遺伝子が有意に発現上昇を示し、2,081遺伝子が有意に発現低下を示した(図3b)。さらに、コントロールとL. plantarum 由来の細菌細胞外小胞処理の違いは、教師なし階層的クラスタリング解析で明らかになりました(図3c)。アポトーシスに関連する遺伝子の発現差解析から明確なパターンが明らかになり、L. plantarum 由来の細菌細胞外小胞処理がアポトーシスの改善に寄与する可能性があることが示されました(図3d)。この証拠は、L. plantarum 由来の細菌細胞外小胞処理が、おそらく転写リモデリングを介してアポトーシスを減少させる可能性を示唆しています。L. plantarum 由来の細菌細胞外小胞群の大腸では、mPTPの発現レベルが著しく低下していることが観察され、仮説を裏付けました(図3e)。L. plantarum 由来の細菌細胞外小胞がmPTP-CytC-カスパーゼ経路を介してアポトーシスを制御するかどうかを調べるために、L. plantarum 由来の細菌細胞外小胞の濃度を上昇させながら(5、10、15、20 µg/mL)、細胞における主要なアポトーシスタンパク質の発現レベルを評価しました。 L. plantarum 由来の細菌細胞外小胞の濃度が増加するにつれて、シトクロム C (CytC)、切断カスパーゼ 3、切断カスパーゼ 9 の発現は減少傾向を示し、L. plantarum 由来の細菌細胞外小胞が mPTP-CytC-カスパーゼ経路を介してアポトーシスを効果的に軽減するというさらなる証拠となった (図 3f)。アポトーシスタンパク質発現の動的変化をより深く理解するために、濃度 20 µg/mL の L. plantarum 由来の細菌細胞外小胞で処理した後、異なる時点 (0、12、24 時間) でこれらのタンパク質を分析した。経時的分析により、時間の経過とともに CytC の放出と切断カスパーゼ 3 および切断カスパーゼ 9 の発現レベルが徐々に減少することが明らかになった (図 3f)。これらの知見は、L. plantarum 由来の細菌細胞外小胞によるアポトーシス軽減における mPTP-CytC-カスパーゼ経路の機構的関与を支持するさらなる証拠となった。生化学分析を補完するために、アネキシンV-FITC/PI染色とフローサイトメトリーを用いて、異なる濃度と時間点におけるアポトーシス率を定量化した。L. plantarum 由来の細菌細胞外小胞の濃度が上昇するにつれて、用量依存的にアポトーシスが有意に減少することが観察された(図S4a、S4b)。同様に、時間依存解析では24時間後にアポトーシス率が最も低くなり、タンパク質発現解析の結果を裏付けた(図S4c、S4d)。この結果は、L. plantarum 由来の細菌細胞外小胞がmPTP-CytC-Caspase-9-Caspase-3シグナル伝達経路をダウンレギュレーションすることで、正常腸管上皮細胞のアポトーシスを阻害する可能性を示唆している。このような作用は腸管バリアの維持に寄与し、炎症性腸疾患の治療に治療効果をもたらす(図3g)。 |
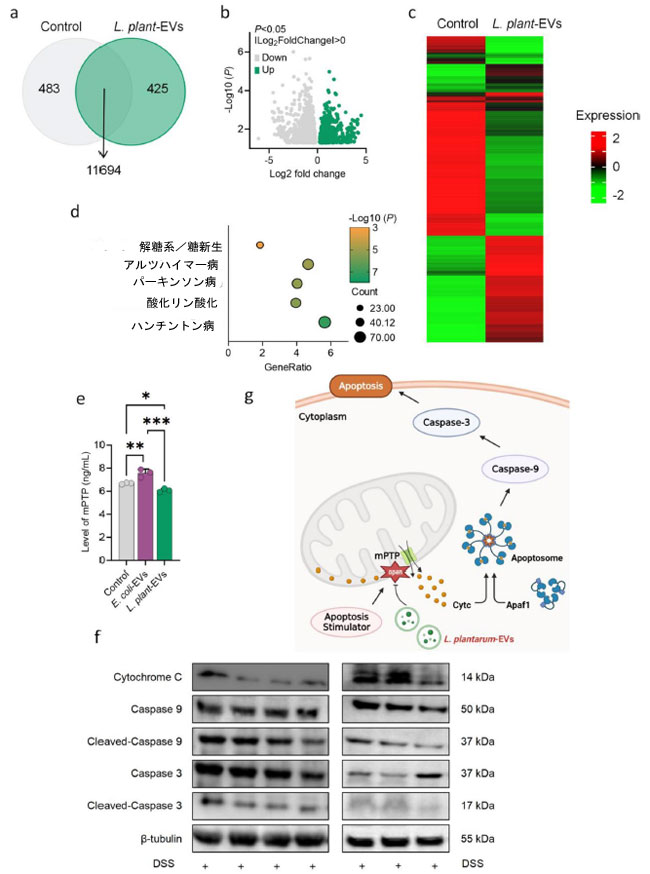 |
図3 mPTP-CytC-カスパーゼ9-カスパーゼ3軸を介したL. plantarum 由来の細菌細胞外小胞(L. plant-EV)による腸管上皮細胞のアポトーシス阻害。 (a) L. plantarum 由来の細菌細胞外小胞(L. plant-EV)を処理後DSS誘導性NCM 460細胞における遺伝子発現差(DEG)を対照細胞と比較したベン図。(b) ボルケーノプロットを用いた2群間の遺伝子発現差解析。(c, d) ハンチントン病に関連する一部の遺伝子発現差を表示するヒートマップを伴う遺伝子発現差の遺伝子オントロジー(GO)エンリッチメント解析。多変量統計モデルを用いて存在量の差を検出した(p < 0.05 [偽発見率補正]、フォールドチェンジ[FC] > 1.5、MaAsLin2)。(e) 酵素結合免疫吸着測定(ELISA)によるミトコンドリア膜透過性遷移孔(mPTP)レベルの測定。 (f) 3% DSSおよび様々な濃度のL. plantarum 由来の細菌細胞外小胞(L. plant-EV)を24時間処理したNCM 460細胞におけるアポトーシス機構の解析(左図)。3% DSSおよび20 µg/mL L. plantarum 由来の細菌細胞外小胞(L. plant-EV)を0、12、24時間処理したNCM 460細胞におけるアポトーシス機構の解析(右図)。(g) 標的パスウェイの京都遺伝子ゲノム百科事典(KEGG)解析。(e)のP値は一元配置分散分析(ANOVA)を用いて算出した。*P < 0.05、**P < 0.01、***P < 0.001、****P < 0.0001 |
| 3.4.スイカはL. plantarumのコロニー形成と細菌細胞外小胞放出を増加させた |
| これらの知見に基づき、細菌細胞外小胞のコロニー形成と放出を促進する食事介入の可能性をさらに深く掘り下げ、最終的な目標は炎症性腸疾患の効果的な管理である。果物は、腸内細菌叢を調整し、プロバイオティクスのコロニー形成を促進することが知られているプレバイオティクスの貴重な供給源として高く評価されていることから[23, 24]、L. plantarumに最も有益な果物を特定することを目指した。この目的のために、ピタヤ、桃、スイカを選び、培養液に添加した。ピタヤ、皮をむいた桃、スイカを選んだのは、これらは一般的に入手しやすく、大腸炎の管理に様々な効果をもたらす可能性があり、食物繊維の含有量の違いが腸の健康に影響を与える可能性があり、寛解期の炎症性腸疾患患者に適していると考えられるためである[24]。注目すべきことに、スイカ上清はL. plantarumの成長の定常期への移行を促進したのに対し、他の2つのグループでは同様の現象は見られなかった(図4a-c)。スイカ上清はL. plantarumの増殖を増加させたように思われた(図4d-f)。さらに、スイカ上清を含む培地中のL. plantarum 由来の細菌細胞外小胞の放出も増加した(図4g)。これらの知見は、スイカ上清が他の果物と比較して明確にL. plantarumの成長とin vitroにおけるL. plantarum 由来の細菌細胞外小胞の放出を促進する能力があることを示唆している。スイカが宿主におけるコロニー形成を促進できるかどうかをさらに調査するため、ボランティアを募集し、スイカ摂取前と摂取後の糞便サンプルを対にして採取した(図4h)。 PCoA分析では、投与前群と投与後群の微生物群集構造にわずかな違いが見られましたが(図4i)、これらの変化は、シャノン指数、シンプソン指数、およびチャオリッチネスで示されるように、多様性や豊富さの統計的に有意な変化を伴っていませんでした(図4j-l)。したがって、スイカの摂取は特定の細菌の存在量に変化をもたらした可能性はあるものの、全体的な微生物多様性には有意な変化をもたらさなかったことがわかりました。特に、スイカ摂取後のヒト腸内におけるL. plantarumの増殖が明らかになりました(図4m)。まとめると、本研究はスイカがL. plantarumの定着を促進する可能性があることを示しました。 |
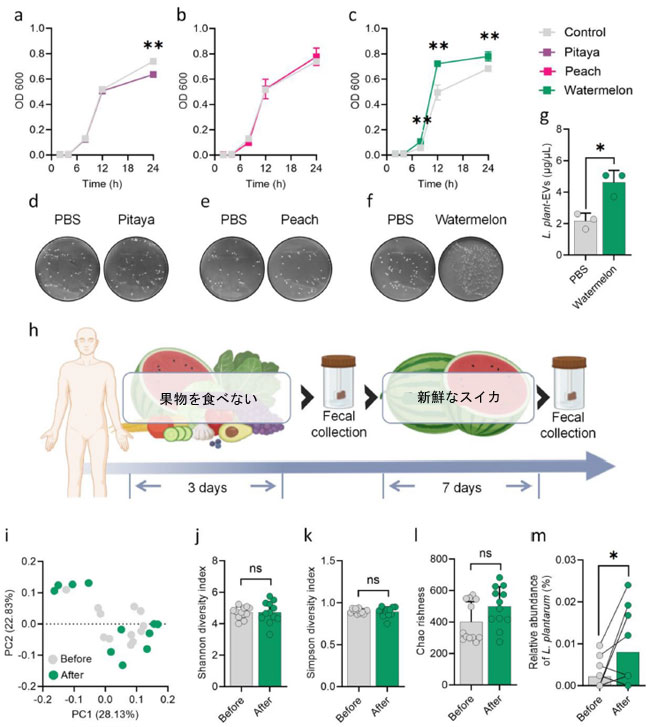 |
図4 スイカによるL. plantarumの増殖と細菌細胞外小胞放出の促進。 (a-c) PBS、ピタヤ、桃、またはスイカで処理した後のL. plantarumの細菌増殖曲線。(d-f) リン酸緩衝生理食塩水、ピタヤ、桃、またはスイカで処理した後のL. plantarumのコロニー数を示す顕微鏡写真。(g) スイカ上清を添加した培地中のL. plantarum 由来の細菌細胞外小胞の定量。(h) スイカの食事介入を受けているボランティアからの糞便サンプル採取のプロセス。(i) マイクロバイオームの多様性を示す主座標分析(PCoA)プロット。(j-l) 微生物多様性の分析(n = 12)。(m) スイカ処理前後のヒトの腸内L. plantarumの相対的存在量の比較分析(n = 6)。二元配置分散分析を使用して、(a-c)のp値を計算しました。 (g)と(m)のP値はStudent's t検定を用いて算出した。(j-l)のスイカ摂取前後のP値はWilcoxon検定を用いて算出した。*P < 0.05、**P < 0.01、***P < 0.001、****P < 0.0001 |
| 3.5.スイカは腸内細菌叢を介して炎症性腸疾患の症状を緩和した |
| その後、スイカがプロバイオティクスの定着を促進することで炎症性腸疾患の症状を緩和できるかどうかをさらに検討しました。抗生物質(Abx)によって腸内細菌叢を枯渇させたマウスに、スイカ上清を投与しました(図5a)。その結果、腸内細菌叢が損なわれていないDSSマウスでは、スイカ上清投与後に体重減少(図5bおよびc)と結腸短縮(図5d)の両方が顕著に減少したことが明らかになりました。さらに、腸内細菌叢を事前に除去せずにスイカ上清を投与したマウスでは、杯細胞数の正常化と炎症細胞浸潤の減少が見られ、最終的に粘液産生が増加しました(図5eおよびf)。しかし、抗生物質前処理したマウスでは、DSSが腸管バリアのタイトジャンクションタンパク質を破壊し、スイカ上清の補給はこの効果を回復させなかった(図5eおよびf)。重要なのは、オクルディン、ZO-1、およびE-カドヘリンの発現増加は、腸内細菌叢が損なわれていないスイカ上清を投与された群でのみ観察されたことである。これは、スイカ上清のIBD治療における有効性は、腸内細菌叢の調節に依存していることを示唆している(図5g-i)。この結論は、ウェスタンブロット(図5jおよび図S5a-c)およびqPCR(図S5e-f)によって確認された。さらに、スイカ上清とL. plantarum(図S6a)を併用すると、DSSマウスの大腸において、スイカ上清単独と比較して、大腸の長さに有意差は認められなかったにもかかわらず(図S6b)、腸粘液産生細胞数(図S6cおよびS6d)とタイトジャンクションタンパク質の発現(図S6e-k)がより効果的に促進されることが分かりました。これらの知見を総合すると、スイカの炎症性腸疾患治療における治療効果は、腸内細菌叢への影響と密接に関連していることが示唆されます。 |
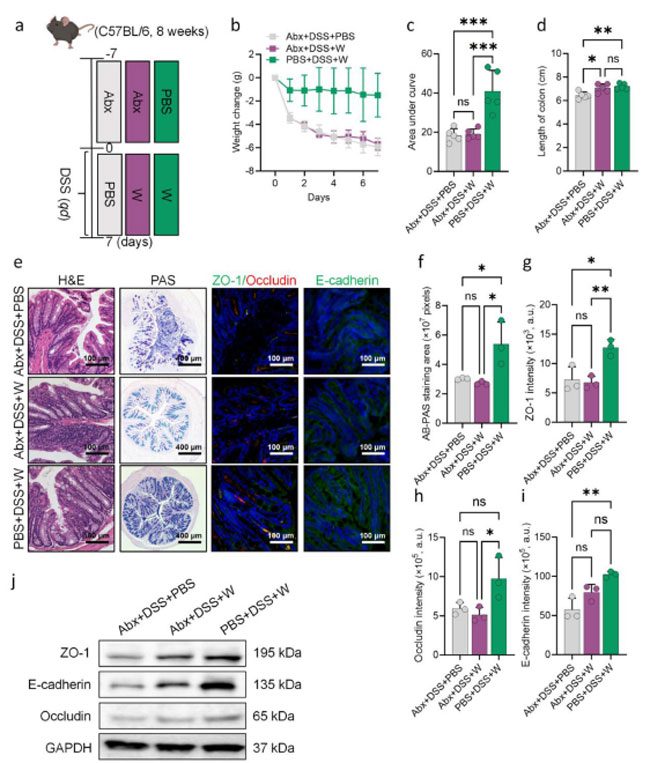 |
F.5 スイカによる腸内細菌叢の調整による炎症性腸疾患症状の緩和。 (a) 動物実験手順のフローチャート。(b、c) マウスの毎日の体重変化と曲線下面積分析を示すグラフ。腸内細菌叢の予防的抗生物質媒介クリアランス、続いて DSS 誘発大腸炎、スイカ上清による治療を行ったグループと行わなかったグループを比較しています (n = 5)。(d) 各実験グループの結腸の長さの測定値 (n = 5)。(e) H&E 染色した結腸切片、AB-PAS 染色した結腸切片の内側粘液層、および腸上皮タイトジャンクションタンパク質の免疫蛍光染色。(f-h) 杯細胞による粘液産生とタイトジャンクションタンパク質オクルディン、ZO-1、E-カドヘリンの発現レベルの定量分析 (n = 3)。 (j) マウス結腸におけるE-カドヘリン、オクルディン、ZO-1のウェスタンブロット解析。(b) のp値は二元配置分散分析を用いて算出した。(c-d) および(f-i) のp値は一元配置分散分析を用いて算出した。*P < 0.05、**P < 0.01、***P < 0.001、****P < 0.0001 |
| 4.考察 |
| 腸管バリア機能不全は炎症性腸疾患の特徴的な病態であり、腸管バリア構造の破綻を指します。腸管バリア構造は、細菌、毒素、未消化の食物粒子などの有害物質が腸管バリアを突破して血流に入るのを通常防ぎます[25, 26]。これにより炎症が誘発され、疾患が悪化します。したがって、腸管バリアの完全性を維持することは、炎症性腸疾患における重要な治療目標です。プロバイオティクスは、適切な量を投与することで健康上の利益をもたらす生きた微生物と定義され、炎症性腸疾患患者の腸管の健康を回復し、腸管バリアを保護するための治療法として大きな注目を集めています[27]。 |
| プロバイオティクスは、病原細菌の抑制、粘液分泌の促進、タイトジャンクションタンパク質の活性化、腸管免疫細胞の調節、上皮細胞のアポトーシス抑制といったメカニズムを用いて、腸粘膜を保護する多面的なアプローチとして登場しました[28]。これらのメカニズムは、炎症性腸疾患の中核となる病理学的特徴に直接作用します。したがって、これらのメカニズムを通じて腸内環境を整えることは、炎症性腸疾患の症状を緩和するだけでなく、疾患の再発や進行を予防する可能性も秘めています。プロバイオティクスは微生物バランスを回復させることで、Escherichia coliやClostridium difficileなどの腸管病原菌を含む有害微生物の増殖を抑制するのに役立ちます[29]。Lactobacillus reuteriは、細胞の成長と修復に不可欠なWnt/β-カテニンシグナル伝達経路を適度に調節することで腸粘膜バリアの完全性を保護し、炎症につながる過剰な活性化を回避することが示されています[6]。同様に、Faecalibacterium prausnitziiは、DSS誘発性大腸炎を発症したマウスの腸管バリアの密閉性を改善することが実証されています[30]。Lactobacillus rhamnosusは、オクルディンとE-カドヘリンの両方の発現を増加させ、上皮バリアをさらに強化することが示されている[31]。UC患者にLactobacillus fermentumを投与すると、NF-κBの低下した調節がもたらされ、さらにIL-6とTNF-αのレベルが低下しました[32]。 |
| これらの有望な効果にもかかわらず、プロバイオティクスの有効性を担う正確な分子メカニズムと主要成分は、未だ完全に解明されていません。新たな研究では、プロバイオティクスの活性副産物である細胞外多糖類、短鎖脂肪酸 [33]、細菌細胞外小胞[34, 35]の重要性が強調されています。例えば、Bifidobacterium longumは酪酸を産生しますが、これは結腸細胞のエネルギー源として機能し、上皮細胞の完全性を高め、抗炎症反応を促進します[36]。これらの成分は、抗炎症、抗腫瘍、抗酸化、免疫調節作用など、様々な治療特性を示します。本研究では、プロバイオティクス細菌細胞外小胞の腸管バリア機能に対する治療的役割、特にL. plantarum 由来の細菌細胞外小胞の修復効果に焦点を当てて調査しました。 |
| 腸粘膜上皮の安定性は、細胞増殖とアポトーシスの均衡に左右されます。結腸上皮細胞におけるアポトーシスの促進を特徴とするバランスの乱れ[37, 38]は、腸管バリアの完全性を著しく損なう可能性があり、ひいては炎症性腸疾患を増悪させます[39]。ミトコンドリア膜間に存在するmPTPは、細胞生存とアポトーシスにおいて極めて重要な役割を果たします。ミトコンドリアの機能不全はmPTPの開口を招き、それに続いてCytCが細胞質へ放出され、カスパーゼ9が活性化されます。これがカスパーゼ3を介したカスケードを引き起こし、最終的にアポトーシスへと至ります[40, 41]。トランスクリプトーム解析から導き出され、ウェスタンブロッティングとELISAによって検証された私たちの研究結果により、L. plantarum 由来の細菌細胞外小胞(L. plant-EV)がmPTP、CytC、カスパーゼ-9、カスパーゼ-3などのアポトーシス関連タンパク質の発現をダウンレギュレーションすることが明らかになり、過剰な上皮細胞のアポトーシスを抑制することで腸管バリアの完全性を強化する可能性が示唆されました。 |
| さらに、プロバイオティクスの安定したコロニー形成は、その機能的有効性に不可欠です。食事因子、特に特定の果物は、プロバイオティクスのコロニー形成を著しく促進し、疾患管理に影響を与える可能性があります。炎症性腸疾患患者、健常者、そして毎日スイカを摂取しているボランティアの糞便サンプルを比較分析した結果、スイカの摂取によって増強される可能性のあるL. plantarumが、炎症性腸疾患治療において重要な役割を果たす可能性が示されました。さらに、スイカの上清は、L. plantarumの増殖とL. plantarum 由来の細菌細胞外小胞放出を促進することが示されました。これらの知見は、特にスイカの摂取を介した食事介入が、L. plantarumの増殖を促進する環境を育み、それによってL. plantarum 由来の細菌細胞外小胞を増強する可能性があることを示唆しており、腸管バリア機能不全を改善するための新たなアプローチを示唆しています。 |
| 結論として、本研究ではL. plantarumの腸管バリア保護作用を調査し、腸内細菌叢を調節して腸管修復を促進するための食事介入について検討しました。スイカの摂取はL. plantarumの増殖とL. plantarum 由来の細菌細胞外小胞放出を促進し、mPTP-CytC-Caspase-9-Caspase-3経路を介してアポトーシスを抑制し、腸管バリアを効果的に保護することを実証しました。これらの知見は、炎症性腸疾患の補助療法への新たな道を開き、プロバイオティクスと食事療法を治療戦略に統合する可能性に光を当てました。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Journal of Nanobiotechnology. 2025 Mar 20;23:227.に掲載されたReducing severity of inflammatory bowel disease through colonization of Lactiplantibacillus plantarum and its extracellular vesicles release.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


