ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(植物性ヨーグルト、プランタルム菌:研究の最前線) |
Lactiplantibacillus plantarum LP95を使用した発酵豆乳の抗酸化特性 |
Francesco Letizia et al., |
|
|
| 要約 |
近年、動物性食品を植物由来の代替食品に置き換える消費者の関心が高まっています。こうした状況を踏まえ、乳酸菌発酵豆乳はその機能特性から食品業界で重要な位置を占めつつあります。本研究では、安定剤、増粘剤、酸度調整剤を使用せずに、Lactiplantibacillus plantarum LP95を用いて37℃で豆乳を発酵させました。発酵豆乳の抗酸化能とアグリコン型イソフラボンの含有量を評価しました。イソフラボン配糖体からアグリコン型イソフラボン(ゲニステイン、グリシテイン、ダイゼイン)への変換を、抗酸化活性(ABTS)、チオバルビツール酸反応性物質(TBARS)アッセイによる脂質過酸化反応、および見かけ粘度の測定と併せて分析しました。これらの研究から、Lactiplantibacillus plantarumを用いた豆乳発酵は、乳酸菌発酵において、アグリコン型イソフラボン(ゲニステイン、グリシテイン、ダイゼイン)の産生を促進することが示唆されました。スターターとしてLp. plantarum LP95を添加すると、イソフラボンのアグリコン型への変換が著しく促進されました。ダイゼイン、グリシテイン、ゲニステインの含有量は、発酵24時間後にはそれぞれ48.45 ± 1.30、5.10 ± 0.16、56.35 ± 1.02 μmol/100 g乾燥重量まで増加しました。さらに、抗酸化活性は6時間後に増加し、MDA(マロンジアルデヒド)が減少しました。見かけの粘度は発酵24時間後に増加しましたが、21日間の貯蔵からはわずかに減少しました。これらの結果に基づき、Lp. plantarum LP95は発酵豆乳製造用のスターターとして有望な候補であると考えられます。 |
| 目次(クリックして記事にアクセスできます) |
| 1. はじめに |
| 2. 材料および方法 |
| 2.1. 細菌株 |
| 2.2. 試薬 |
| 2.3. 豆乳の調製 |
| 2.4. 最適温度のスクリーニング |
| 2.5. 発酵豆乳の製造 |
| 2.6. 保水力(WHC)の測定 |
| 2.7. 流動挙動と見かけ粘度 |
| 2.8. 化学分析 |
| 2.8.1. イソフラボンの定量 |
| 2.8.2. 抗酸化活性(ABTSアッセイ) |
| 2.8.3. チオバルビツール酸反応性物質(TBARS)アッセイ |
| 2.9. 統計解析 |
| 3. 結果 |
| 3.1. 予備発酵試験 |
| 3.2. 発酵および貯蔵中の微生物学的および理化学的パラメータ |
| 3.3. 発酵豆乳の流動挙動と見かけ粘度 |
| 3.4. 発酵中のイソフラボンのバイオコンバージョン |
| 3.5. 発酵過程における抗酸化活性の変化 |
| 4. 考察 |
| 5. 結論 |
本文 |
| 1.はじめに |
| 栄養価が高く健康に良い食品への消費者の関心が高まるにつれ、発酵機能性食品の開発への関心が高まっています[1]。こうした観点から、大豆(Glycine max)およびその製品の摂取は、その栄養価だけでなく、イソフラボンなどの生理活性化合物の存在による心血管疾患、糖尿病、乳がん、慢性炎症のリスク低減など、潜在的な健康効果の両面から、研究者や消費者の注目を集めています[2,3]。大豆の水抽出物である豆乳は、東洋の重要な伝統飲料であり[4]、タンパク質とミネラルを含むコロイド系飲料と考えられています[5]。この飲料は、動物性牛乳の良い代替品となり、ビーガンや乳糖不耐症の人にとって理想的な食品です[6]。豆乳には上記のような特性があるにもかかわらず、不快な味や、ミネラルの自然な利用性を損なうフィチン酸などの抗栄養因子、および鼓腸の原因となるラフィノースやスタキオースなどの難消化性オリゴ糖の存在のために、欧米諸国での豆乳の消費はまだ限られている[7,8]。これらの制限を考慮すると、乳酸菌(LAB)を使用した発酵バイオトランスフォーメーションアプローチは、豆乳の栄養、テクスチャー、レオロジー特性を改善する効果的な戦略である[3]。イソフラボンは豆乳に天然に存在する植物化学物質であり、その腸管吸収はその化学構造に関係している。豆乳中のこれらの生理活性化合物の異なる形態の濃度は、大豆の品種、浸漬時間、大豆と水の比率、濾過、および熱処理に関係している[9,10]。大豆の主なイソフラボンはダイゼイン、ゲニステイン、グリシテインであり、これらは糖と結合した状態で植物中に存在します[11,12]。 |
| 配糖体は口腔内で加水分解され[13]、主に腸管でアグリコンに分解され、腸管で吸収される[14]。フラボノイド配糖体は生物学的に不活性であると考えられており、末梢循環への取り込みには、腸管のβ-グルコシダーゼによる糖部分の加水分解が必要となる[15]。 |
| いくつかの研究では、β-グルコシダーゼ活性を持つ乳酸菌株を用いることで、大豆食品中のグルコシド/アグリコン比を逆転させることが可能であることが示されています[16,17]。したがって、前述の酵素活性を持つこれらの細菌を豆乳発酵のスターターとして使用することで、生物学的に利用可能なイソフラボンの増加に貢献できる可能性があります[18]。 |
| さらに、発酵食品の摂取を通じて摂取された一部の乳酸菌は抗酸化作用を示し、抗酸化物質の濃度や種類によって種間で異なるため、人間の健康に重要な役割を果たす可能性がある[19,20]。 |
| 乳酸菌種の中でも、Lactiplantibacillus plantarumは、欧州食品安全機関(EFSA)から安全性の推定(QPS)の認定を受けており、米国食品医薬品局(US FDA)から一般的に安全と認められている(GRAS)[21]。さらに、この細菌種は微生物食品培養物としての歴史が文書化されている[22,23,24]。先行研究[25]に基づき、本研究では、抗菌性、β-グルコシダーゼ活性、および菌体外多糖類(EPS)産生能を有するLp. plantarum LP95株をスターターとして使用し、安定剤、増粘剤、酸度調整剤を使用せずに発酵有機豆乳を得た。 |
| したがって、私たちの研究の主な目的は、発酵豆乳の抗酸化能とイソフラボンアグリコンの豊富さを評価することでした。 |
| さらに、発酵豆乳は流動挙動と見かけの粘度によって特徴付けられました。 |
| 2. 材料および方法 |
| 2.1. 細菌株 |
| 本研究では、発酵花粉(蜂パン)から単離したLp. plantarum LP95(Genbankアクセッション番号:OM033654)を、MRS培地(de Man, Rogosa and Sharpe Broth、Oxoid Ltd.、Basingstoke, Hampshire, UK)中で37℃で培養した。12時間後、細菌細胞を遠心分離(10,000 rpm、5分、4℃)により回収し、滅菌生理食塩水(0.9% w/v NaCl)で洗浄した。上清を捨て、細胞ペレットを回収し、生理食塩水に再懸濁した後、スターターとして使用する前に細胞濃度を調整するために適切に希釈した。 |
| 2.2. 試薬 |
| 全ての試薬はSigma社(Sigma-Aldrich、Merck KGaA、Darmstadt, Germany)から購入しました。溶離液および分析用水は、Milli-Qシステム(Millipore社、Burlington, MA, USA)を用いて精製しました。 |
| 2.3. 豆乳の調製 |
| 手作り豆乳は、Wangら[26]の方法に若干の改変を加えて調製した。具体的には、成熟した黄色の有機大豆(Glycine max、BV&FdL S.r.l.、Bentivoglio, Italy)400gを滅菌蒸留水1200mLに12時間浸漬した。 |
| 次に、大豆を水切りし、乾燥させ、1400 mLの水と混合した。得られた生成物をブランチング(90 °C、10分)し、その後、ろ過し、121 °Cで15分間殺菌した後、接種段階のために冷却した。次に、全体を撹拌して均質化し、その後、微生物スターターを添加した。スターター接種後、豆乳を3つの異なる滅菌ガラス容器(200 mL)に小分けし、その後の実験および分析に使用した。 |
| 2.4. 最適温度のスクリーニング |
| 発酵段階を最適化するため、得られた豆乳にLp. plantarum LP95を106 CFU/mLの濃度で接種し、3つの温度(20℃、28℃、37℃)で予備試験を実施した。0、3、6、9、24、32、48、72時間後にpHと生菌数をモニタリングした。 |
| 2.5. 発酵豆乳の製造 |
| 最適温度の予備スクリーニングに基づき、Lp. plantarum LP95(108 CFU/mL)を豆乳に接種し、発酵段階は37℃で実施した。24時間後、凝血塊を破砕し、最終製品を4℃で保存した。サンプルは直ちに分析し、49日目まで7日ごとに分析した。 |
| 2.6. 保水力(WHC)の測定 |
| 保水能は豆乳が水分の全部または一部を保持する能力と定義され、Liら[5]の方法に従って測定した。簡単に説明すると、発酵豆乳(30g)を4℃、8000rpmで15分間遠心分離した。上清液を採取し、重量を測定し、式(1)を用いて保水力を算出した。 |
| WHC(%):保水力、W1:遠心分離後の上清の重量(g)、W2:発酵豆乳の重量(g)。 |
| 2.7. 流動挙動と見かけ粘度 |
| 発酵豆乳の流動挙動は、プレート間測定システム(直径20 mm、ギャップ距離1 mm)を備えた回転式レオメーター(Haake Mars III、Thermo Scientific、Karlsruhe, Germany)を用いて評価した。流動曲線は、せん断速度を2分間で0.001 s⁻¹から300 s⁻¹まで変化させ、37 °C(発酵段階)および4 °C(貯蔵段階)の温度におけるせん断応力と粘度を記録して作成した。温度制御は、ペルチェ素子を用いた加熱冷却システム(Phoenix II、Thermo Scientific、Karlsruhe, Germany)によって行った[27,28]。さらに、見かけ粘度は、せん断速度50 s⁻¹、4 °Cにおける流動曲線から得た[29]。対照として、接種していない豆乳を使用しました。 |
| 2.8. 化学分析 |
| その後の化学分析のために、豆乳サンプルを-40℃で凍結し、その後、凍結乾燥機Genesis 25 ES(VirTis Genesis 25ES、SP Industries Inc.、Gardiner、NY、USA)で15Paの真空下で48時間(最高保管温度+20℃)凍結乾燥させた。凍結乾燥後、サンプルは室温で保存した。凍結乾燥処理は、その後の分析工程における豆乳の安定性を保証するために必要であった。凍結乾燥豆乳の水分含量(%)は、Jungら[30]の方法に従って測定した。 |
| 2.8.1. イソフラボンの定量 |
| 発酵段階における豆乳中のイソフラボン含量は、脱気装置、温度調節カラムコンパートメント、およびダイオードアレイ検出器(DAD)を備えたDionex(Dionex、Sunnyvale, CA, USA)Ultimate 3000クォータナリーポンプを用いてHPLCで測定した。豆乳は発酵開始から0、3、6、9、24時間後に採取し、凍結乾燥した。その後、凍結乾燥豆乳500 mgをFahmiら[31]の方法に従ってメタノール抽出に供した。簡単に説明すると、25 μLのメタノール抽出物を、Security Guard Phenomenex(Phenomenex Inc.、Torrance, CA, USA)で保護された逆相カラム(Phenomenex Luna 5 µm C18 100 Å 250 × 4.6 mm)に注入しました。 溶出は、リン酸0.1%溶液(溶出液A)と無水メタノール(溶出液B)を用いて、35 °Cで流速1 mL/分で行い、%Bとして表される以下のグラジエント溶出プロファイルを設定しました:0分28%、2分37%、30分73%。 イソフラボンは、波長254 nmで検出しました。 同定および定量は、Chromeleonソフトウェアver.外部標準物質として、ダイゼイン、ダイジン、ゲニステイン、ゲニスチン、グリシテイン、グリシチンの保持時間と検量線を用いて、6.80の濃度を測定した。結果はmg/100g乾燥重量(D.W.)で表した。 |
| 2.8.2. 抗酸化活性(ABTSアッセイ) |
| 2,2'-アジノ-ビス(3-エチルベンゾチアゾリン-6-スルホン酸)ジアンモニウム塩ラジカルカチオン(ABTS•+)を用いて、Reら[32]の方法に従い、総抗酸化活性(TAA)を測定した。ABTSを水に7 mM濃度で溶解した。ABTSラジカルカチオン(ABTS•+)は、ABTSメタノール溶液と2.45 mM過硫酸カリウムを反応させることで生成した。ABTS•+溶液を冷純メタノールで希釈し、745 nmにおける光学密度(OD)が0.700になるように調整した。凍結乾燥豆乳サンプル20 mgを採取し、メタノール抽出を行った。 2時間後、メタノール抽出物100μLをABTS•+溶液900μLと混合し、バイオスペクトロメーター(Eppendorf、Hamburg, Germany)を用いて吸光度の減少を記録した。検量線にはトロロックスを標準物質として用いた。豆乳中の総抗酸化活性は、接種後0、3、6、9、24時間に測定し、トロロックス当量抗酸化能(TEAC; mg Trolox Eq./100 g D.W.)として表した。 |
| 2.8.3. チオバルビツール酸反応性物質(TBARS)アッセイ |
| マロンジアルデヒド(MDA)を指標として脂質過酸化反応を評価するために、チオバルビツール酸反応性物質アッセイを用いた。凍結乾燥豆乳40 mgにエタノール/水(80:20 v/v)溶液1 mLを加え、懸濁液を激しく振盪した。その後、サンプルを13,000 rpmで遠心分離し、上清を用いてHodgesら [33] の方法に若干の改変を加えてマロンジアルデヒド-チオバルビツール酸(MDA-TBA)複合体を生成した。吸光度は、バイオスペクトロメーター(Eppendorf、ハンブルク、ドイツ)を用いて532、440、および600 nmで測定した。検量線の標準物質として、マロンジアルデヒドビス(ジメチルアセタール)水溶液を用いた。発酵段階におけるマロンジアルデヒドの量は、Landi [34] によって報告された修正式を用いて算出した。 |
| 2.9. 統計解析 |
| 統計解析は、SPSS Statistics 21ソフトウェア(IBM Corp.、Armonk, NY, USA)を用いて、分散分析(ANOVA)およびTukeyの多重比較により実施した。また、発酵段階における見かけ粘度の有意性についてはt検定を用いた。計算は、スターター微生物接種後の豆乳1塊から得られた独立した3つのアリコート(n = 3)について実施した解析から得られたデータに基づいて行った。すべてのデータは平均値±標準偏差(±SD)として表した。 |
| 3. 結果 |
| 3.1. 予備発酵試験 |
| 発酵速度は類似したパターンを示したものの、図1および表S1、S2(補足資料)に示すように、予備試験の結果、Lp. plantarum LP95を用いた豆乳発酵には37℃が最適温度であることが明らかになった。詳細には、この温度において、生菌数は7.32 log CFU/mLから9時間発酵後に9 log CFU/mLを超える値まで徐々に増加した。さらに、図1に示すように、37℃で9時間発酵させた後、発酵豆乳のpHは5.0未満に達し、20℃(pH 5.98)および28℃(pH 5.31)での試験結果よりも低かった。 |
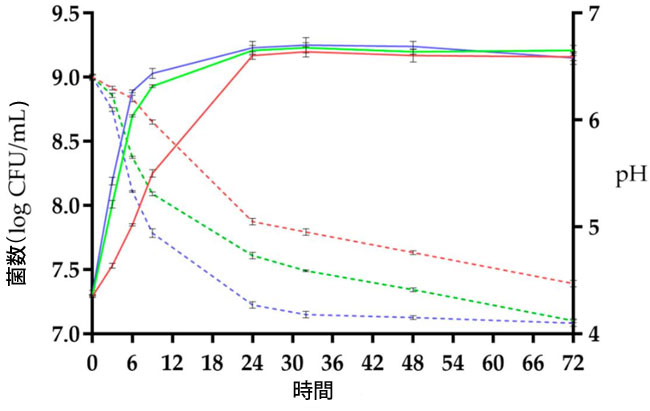 |
| 図1. 20℃(赤線)、28℃(緑線)、37℃(青線)における豆乳発酵中のLp. plantarum LP95の生菌数(log CFU/mL)(実線)とpH値(破線)。エラーバーは平均値の標準偏差を示す(n = 3)。 |
| 3.2. 発酵および貯蔵中の微生物学的および理化学的パラメータ |
| 図2は、Lp. plantarum LP95を豆乳に添加し、発酵および貯蔵段階における生菌数とpH値の変化を示したものです(表S3も参照)。Lp. plantarum LP95の生菌数から推察すると、発酵期には約9 log CFU/mLに達し、その後7日間は一定値を維持しました。7日後、生菌数は急速に減少し、28日目からは緩やかな減少に転じました。しかし、生菌数は貯蔵49日間まで7 log CFU/mL以上を維持しました。発酵豆乳のpH値に関しては、発酵中に酸性化が顕著に見られ(6.5から4.2へ)、貯蔵中はpH値は変化しませんでした。さらに、発酵豆乳の保水力を24時間後に測定したところ、43.1±0.3%という値に達しました。 |
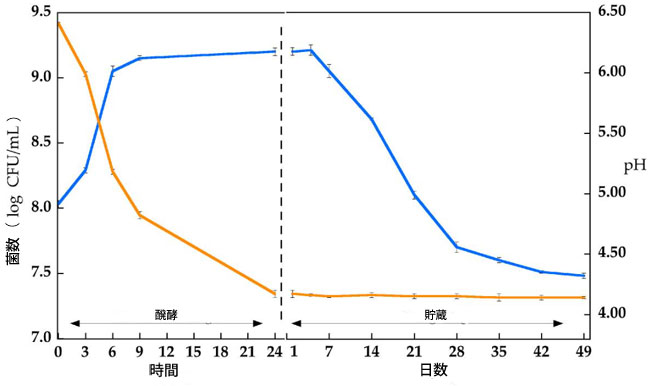 |
| 図2. Lp. plantarum LP95の生菌数(log CFU/mL)(青線)と豆乳発酵中(37℃、24時間)および発酵豆乳保存中(4℃、49日間)のpH値(オレンジ線)。エラーバーは平均値の標準偏差を示す(n = 3)。 |
| 3.3. 発酵豆乳の流動挙動と見かけ粘度 |
| 試料の流動挙動は、せん断応力(τ)とせん断速度(˙𝛾)の相関関係によって規定されることがよく知られています。粘度(η)が変形によって変化しない場合はニュートン流体挙動、粘度がせん断速度またはせん断応力の関数として変化する場合は非ニュートン流体挙動に分類できます。本研究では、発酵豆乳に関する予備的なレオロジー情報を得るため、発酵豆乳の見かけ粘度を測定しました。発酵段階(37℃)および貯蔵段階(4℃)における発酵豆乳の流動挙動を評価し、得られた曲線をそれぞれ図3A、Bに示します。詳細には、すべての試料が非ニュートン流体のせん断流動挙動を示し、せん断速度が増加すると見かけ粘度は低下しました。図 3A では、発酵が豆乳にどのような変化をもたらしたかを見ることができ、発酵 24 時間後に粘度が目に見えて増加しています。貯蔵段階 (図 3B) では、21 日後からサンプルの粘度がわずかに低下し始めました。粘稠度係数 (K) と流動挙動指数 (n) は、Hamet ら [35] によって説明されているように、流動曲線を Ostwald–de Waele モデルに適合させて取得され、その結果が表 S4 に示されています。さらに、せん断速度 50 s−1 での発酵および貯蔵段階中の発酵豆乳の見かけの粘度をそれぞれ図 4A、B に示し、数値データを表 S5 および S6 に示します。詳細には、発酵 24 時間後、見かけの粘度の値は 0 時間のサンプルと比較して異なっていました。しかし、保管 7 日間 (4 °C) で血栓が破裂した後、見かけ粘度は最高レベルに達し、21 日目には急速な低下が観察されました。 |
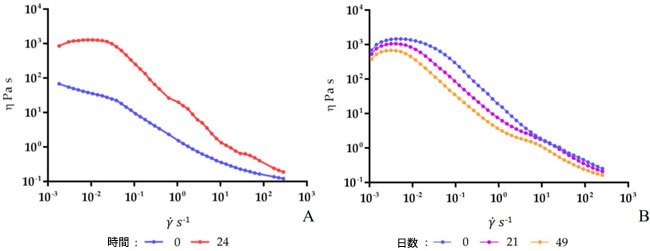 |
| 図3. Lp. plantarum LP95 をスターターとして使用し、37 °C で発酵させた豆乳の粘度曲線 (A) と、4 °C で保存した発酵豆乳の粘度曲線 (B)。粘度 (η) はせん断速度 (˙𝛾) の関数です。 |
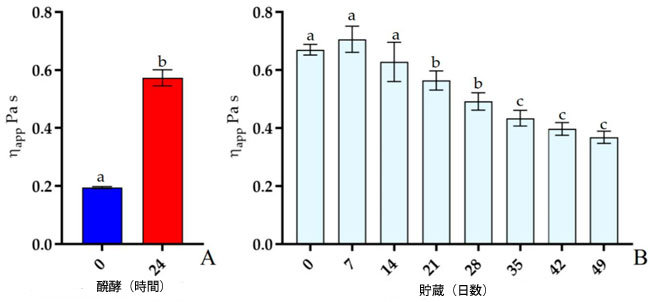 |
| 図4. Lp. plantarum LP95をスターターとして37℃で発酵させた豆乳(A)と、4℃で保存した発酵豆乳(B)の異なる時間における50 s−1における見かけ粘度。すべての値は平均±標準偏差(n = 3)として表されている。各バーの小文字の異なる部分は有意差を示す(p < 0.05)。 |
| 3.4. 発酵中のイソフラボンのバイオコンバージョン |
| (訳者注:バイオコンバージョン(生物変換)とは、微生物や酵素などの生体触媒を使って、低価値な有機物(廃棄物やバイオマスなど)を、高付加価値な製品や燃料、飼料、肥料、医薬品原料などに変換する技術のことです)Lp. plantarum LP95をスターターとして用いた豆乳発酵により、アグリコン型イソフラボンが顕著に増加した。表1に示した結果から、接種直後(0時間後)の豆乳中のグリコシル化イソフラボンには、ダイジン、グリシチン、ゲニスチン(それぞれ11.26 ± 0.27、39.34 ± 1.00、40.39 ± 1.27 μmol/100 g D.W.)が含まれており、アグリコン誘導体には、ダイゼイン、グリシテイン、ゲニステイン(それぞれ25.64 ± 0.02、1.58 ± 0.18、21.58 ± 0.39 μmol/100 g D.W.)が含まれていた。ダイゼイン、グリシテイン、ゲニステインの含有量は発酵24時間後に増加し、それぞれ48.45 ± 1.30、5.10 ± 0.16、56.35 ± 1.02 μmol/100 g D.W.の最高値に達した。凍結乾燥豆乳の水分含量(%)は0.912 ± 0.008であった。 |
 |
| 3.5. 発酵過程における抗酸化活性の変化 |
| 発酵段階において、総抗酸化活性の測定値は、接種直後(0時間)の豆乳と比較して有意に異なっていました。特に、図5Aに示した結果と表S7に示した数値データは、0、3、6、9、および24時間後の、トロロックス当量抗酸化能(TEAC)がそれぞれ123.35 ± 1.58、110.30 ± 6.03、121.42 ± 5.26、105.79 ± 2.34、および108.76 ± 3.25 mg Trolox Eq./100 g D.W.であったことを示しています。具体的には、トロロックス当量抗酸化能の減少率は3時間時点ですでに約10%でした。発酵開始時のサンプルと比較して、6 時間後にはわずか 2% となり、9 時間後と 24 時間後には約 13% となりました。 |
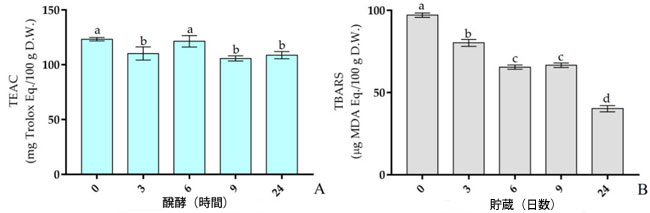 |
図5. Lp. plantarum LP95をスターターとして用いた豆乳発酵中のTEAC(mg Trolox Eq./100 g D.W.)(A)およびTBARS(µg MDA Eq./100 g D.W.)(B)。すべての値は平均値±標準偏差(n = 3)で表されている。各バーの小文字が異なる場合は有意差を示す(p < 0.05)。 TEAC:トロロックス当量抗酸化能、TBARS:チオバルビツール酸反応性物質 |
| 3.6. 発酵中のマロンジアルデヒド(MDA)の変動 |
| 発酵中のマロンジアルデヒド濃度の変化を測定した。特に、検出された値は発酵段階において有意な差を示した。図5Bおよび表S8に示すように、マロンジアルデヒド濃度は0時間後に最高値(97.11 ± 1.33 µg MDA Eq./100 g D.W.)を示したが、3時間後には有意に減少した(80.26 ± 2.12 µg MDA Eq./100 g D.W.)。一方、6時間後と9時間後(それぞれ65.53 ± 1.30、66.68 ± 1.35 µg MDA Eq./100 g D.W.)では、検出値に有意差は認められなかった。最終的に、24時間でマロンジアルデヒド値は最低レベル(40.17 ± 1.88 µg MDA Eq./100 g D.W.)に達しました。 |
| 4. 考察 |
| プロバイオティクス特性も有する発酵スターターを用いた機能性食品の配合は、食品バイオテクノロジー分野においてますます関心が高まっている分野となっている。本研究では、Lp. plantarum LP95は良好な発酵性能を示し、未発酵豆乳の生体機能特性を全体的に改善するいくつかの特性を示した。また、豆乳に天然に存在するスタキオース、ラフィノース、スクロース、グルコース、フルクトースなどの炭水化物が乳酸菌による発酵の基質として作用し、乳酸の遊離によるpH低下を引き起こすことが推測された[36,37]。使用したスターターLp. plantarum LP95は、37℃で24時間発酵させた後、緻密なカード(凝固)を生成した。カードの攪拌後、測定された保水力は、大豆ベースの製品で異なる乳酸菌株を使用して他の著者によって得られたデータと同様であった[38,39,40]。 |
| 発酵中に観察された粘度の変化も、タンパク質凝固現象に起因するものでした[41]。実際、Xu et al. [42]によって説明されているように、Lp. plantarumのプロテアーゼ活性は、豆乳のpHを下げることによって大豆タンパク質を部分的に加水分解する可能性があります。これにより、変性大豆タンパク質グループが負に帯電し、凝固が進行します。さらに、Lp. plantarum LP95からのEPS産生能力[25]は、凝固段階にプラスの影響を与える可能性があります[5]。この点を明らかにするために、菌体外多糖(EPS)を非産生LAB株または塩化カルシウムによる凝固[43,44]を参照として使用して、Lp. plantarum LP95で発酵させた豆乳について、菌体外多糖の添加の有無にかかわらず、今後比較研究が行われる予定です[45]。 |
| サンプルの見かけ粘度の研究は、発酵が最終製品の官能品質にどのような影響を与えるかを評価する上で重要です。一般的に、発酵製品の特性は、使用される微生物の種類、発酵期間、温度など、さまざまな要因の影響を受けます[46]。 |
| 本研究で分析したサンプルは非ニュートン性のずり流動化挙動を示し、ずり速度が増加すると見かけの粘度が低下しました。この挙動は他の植物発酵乳でも観察されています[35,39,47]。その後、冷蔵保存期間中の発酵製品の流動挙動を追跡しました。発酵中に観察されたのと同じ挙動は、14日目までの保存中にも見られ、その後数日で粘度値が低下しました。物理化学的変化は最終製品の食感や口当たりにも影響を与える可能性があるため、半固形製品の摂取中の口腔知覚に関連している可能性があるため、ずり速度50 s−1での見かけの粘度を取得しました[48,49]。 |
| この乳酸菌が豆乳の粘度を高める能力は、菌体外多糖の存在と関連している可能性があり、これは先行研究[35,50,51,52]と一致しています。この点に関して、発酵豆乳を含むサンプルを4℃で保存した場合、見かけの粘度はほぼ一定に保たれたことを報告できます。 |
| グリコシドイソフラボンの生物学的利用能は、まず糖部分の酵素加水分解を必要とし、これは腸管上皮細胞の微絨毛層で起こる [53]。いくつかの乳酸菌株は、イソフラボン配糖体をアグリコンに加水分解する特異的な β-グルコシダーゼ酵素活性を示す [54]。詳細には、Lp. plantarum LP95 をスターター培養物として使用した豆乳発酵により、発酵中 6 時間後にイソフラボン配糖体がアグリコン型に完全に生体内変換されたことが確認された。豆乳とともに食事に取り入れられた植物性ポリフェノールは、外因性の抗酸化システムとして機能する。実際、植物性ポリフェノールは、フリーラジカルの悪影響に対する重要な抗酸化活性を有し、酸化ストレスと細胞損傷を防ぐ [55]。発酵豆乳サンプルの総抗酸化能に関するデータは、ABTS ラジカル消去法によって測定された。発酵プロセスの最初の3時間では、抗酸化活性がわずかに低下したが、これはおそらく酸化ストレスを軽減するために細菌細胞によって抗酸化分子が枯渇したためと考えられる[20]。6時間後、発酵豆乳の抗酸化活性は上昇したが、これはおそらく細菌によるイソフラボン配糖体の脱糖化に起因すると考えられる。その後、抗酸化活性は再び低下したが、これはおそらく細菌代謝中に生成されるイソフラボノイド[56]の除去によるものと考えられる。 |
| さらに、食品加工中にモニタリングすべき重要なパラメータは、最終製品の酸化状態です。脂質の酸化は広く研究されており、フリーラジカル連鎖機構によって進行し、多くの副産物を生成します。その主要な副産物の一つがマロンジアルデヒド(MDA)であり、これは実際に生物系における酸化損傷のマーカーとなっています[57]。脂質酸化は栄養因子の喪失や食品中の毒性化合物の生成につながり、動脈硬化などの様々な疾患を引き起こすため、モニタリングは重要です[58]。チオバルビツール酸反応性(T BARS)の検出は脂質酸化の判定に頻繁に用いられます。しかし、Ghaniら[59]が報告しているように、この指標は抗酸化作用のメカニズムを示すものではありません。このような潜在的な限界があるにもかかわらず、チオバルビツール酸反応性試験には、総抗酸化活性(TAA)などの広く用いられている他のスクリーニング試験を補完する有用な特徴があります。本研究では、Lactiplantibacillus plantarumを用いた豆乳発酵中に、チオバルビツール酸反応性試験によりマロンジアルデヒドレベルが徐々に低下することが示されました。 L.plantarum LP95 で確認されたイソフラボンアグリコンの増加傾向と一致しており、この傾向は2つの事象の間に相関関係があることを示唆している可能性があります。 |
| 5. 結論 |
| 本稿では、発酵豆乳の品質向上に優れた可能性を秘めたLp. plantarum LP95株に関する研究を紹介した。本株は、豆乳の抗酸化活性を高めることが示された。 |
| 発酵中のイソフラボンアグリコン含有量の増加は、イソフラボン配糖体に対するβ-グルコシダーゼ活性の結果です。このプロセスにより、抗酸化能が向上した大豆飲料が得られ、消費者の健康と栄養状態の改善に貢献します。 |
| さらに、化学添加物を使用せずに製造され、4 °C で保存された豆乳は、最大 14 日間の良好な保存期間を有することも報告されています。 |
| この証拠に基づくと、Lp. plantarum LP95 は、イソフラボンアグリコンが豊富で健康促進特性が強化された発酵豆乳を得るためのスターター培養物として有望な候補であると思われます。 |
| この応用を検証するために、今後、この細菌で発酵させた豆乳の保存期間や官能的品質、栄養的品質に関する調査が行われる予定です。 |
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
この文献は、Antioxidants (Basel). 2023 Jul 18;12(7):1442.に掲載されたAntioxidative Properties of Fermented Soymilk Using Lactiplantibacillus plantarum LP95.を日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


