ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(ヴィーリ:研究の最前線) | |
健康と疾病予防における発酵食品としてのヴィーリ:A研究のレビュー |
|
Cheng Luo and Shanggui Deng |
|
|
要約 |
|
ヴィーリは北欧諸国発のユニークな発酵乳製品で、特にフィンランドで人気があります。ヴィーリには、乳酸菌、真菌、酵母など、生存能力の高い豊富なプロバイオティクスの共生クラスターが含まれており、心地よいシャープな味と良好なジアセチルの香りが糸を引くような食感と結びついており、半固形構造のためスプーンで簡単に摂取できます。ヴィーリに含まれる粘液形成性のラクトコッカス・ラクティス亜種クレモリスは、リン酸含有ヘテロ多糖類を生成します。これは、ヴィーリと他の発酵乳製品とを区別する主な特徴の1つです。ヴィーリとその菌外多糖(EPS)の共生特性は、腸内プロバイオティクス相互作用の促進から、抗酸化、抗炎症、免疫調節、抗腫瘍活性まで、さまざまな利点をもたらします。さらに、発酵によって得られるトリペプチド、イソロイシン-プロリン-プロリン(IPP)とバリン-プロリン-プロリン(VPP)は、アンジオテンシン変換酵素の働きを阻害し、血圧を低下させ、心血管疾患の発生率を低下させます。すべての研究において、複数の微生物を発酵させたヴィーリは、プロバイオティクスとしてだけでなく、北欧の人々、そしておそらく他の地域の人々にも有益な多くの要素をもたらすことが示されています。 |
|
|
|
| 目次(クリックして記事にアクセスできます) | |
| 1.はじめに | |
| 2.ヴィーリの調製 | |
| 3.プロバイオティクスの源泉としてのヴィーリ | |
| 4.ヴィーリの菌体外多糖の組成と基本構造 | |
| 5.菌体外多糖の特性評価と機能 | |
| 6.ヴィーリの熱影響 | |
| 7.ヴィーリの抗酸化作用 | |
| 8.アンジオテンシンI変換酵素(ACE)阻害活性 | |
| 9.免疫調節効果 | |
| 10.ヴィーリの 菌体外多糖により促進された腫瘍免疫療法 | |
| 11.抗腫瘍免疫療法 | |
| 12.結論 | |
本文 |
|
| 1.はじめに | |
|
ヴィーリは、北欧諸国の独特な発酵乳製品で、強い粘りがあります。スウェーデンが起源と考えられていますが、現在ではフィンランドでも発見され、フィンランドの宝物として広く認識されています。 この家庭用発酵乳は通常朝食時に消費され、フィンランドの子供や長老の間でも人気のあるスナック食品です。 製品は単独で、またはシリアル、ミューズリー、フルーツと共に消費されます。ヴィーリを食べる伝統的な方法は、それをシナモンと砂糖と混ぜることです(Leporanta、2003)。 その独特の粘着性は、スライム形成性 ラクトコッカス・ラクティス亜種クレモリスによって産生されるリン酸含有菌外多糖に起因します。 ヴィーリの菌外多糖は、抗酸化作用、抗炎症作用、抗発癌作用、老化防止作用および免疫調節作用を含むいくつかの健康上の利点を示すと主張されている(Kitazawa et al、1991、1992、1993)。ヴィーリは歴史的に大きな木製のバケツで、そして家庭で調理器具を使って農場で作られました。ヴィーリの工業生産は1950年代にフィンランドで始まりました。今日、この製品はフィンランドで重要な発酵乳製品を構成しています。 市場の乳製品の幅がより広いために実際の平均消費量は減少しているにもかかわらず、年間消費量は一人当たり4.5 kgを超えています(Leporanta、2003)。(Alatossava et al、2013)ヴィーリという用語はスウェーデン語の「fil」に由来すると考えられています(Leporanta、2003)。しかし、何世紀にもわたって、ヴィーリを作る伝統とスキルは世代から世代へと受け継がれてきました。ヴィーリは主にフィンランド、スウェーデン、デンマーク、そしてそれほどではないがノルウェーで消費されています。ここ数年、マクロファージRAW 264.7細胞を調べて、食作用、NOの放出、iNOS、IL-6およびIL-1βの遺伝子発現、ならびにヴィーリ菌外多糖類(VEPS)の存在下での形態変化を観察した。 がん細胞における腫瘍抗原MAGEA10および炎症性COX-2遺伝子発現に対するヴィーリ菌外多糖類の影響も調べ、ヒト免疫におけるヴィーリ菌外多糖類の潜在的な可能性のある役割を調査した。 日常の健康と疾病予防におけるヴィーリの複雑な複数のメカニズムを理解するために、私たちはこれまでの研究をさらに検証し、免疫療法の可能性を探る様々なアプローチを分析します。 |
|
 |
|
| 図1.市販のヴィーリ、A:全乳から作られたヴィーリ、B:半固形ヴィーリの構造と粘度 | |
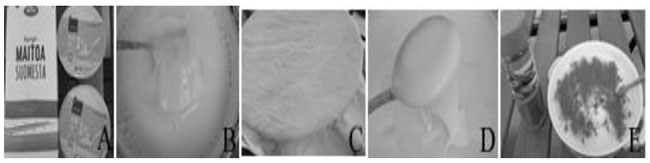 |
|
図2. 家庭でのヴィーリ製造。 A:ヴィーリのスターターと牛乳。 B:低温殺菌牛乳(V/V)にヴィーリを約10~20%接種。 C:室温で16~24時間発酵。容器は2~3層の布で覆い、20~30℃で放置する。 D:出来上がったヴィーリには、ねばねばした多糖類が含まれているはずで、全乳を発酵させたヴィーリの場合は、表面がベルベット状になっているはずである。 E:ヴィーリを砂糖とシナモンで食べる方法の一つ(Leporanta, 2003)。 |
|
2.ヴィーリの調製 |
|
ヴィーリの商業的工業生産(図1)では、牛乳は分離され、1.0〜3.5%の脂肪含有量に標準化されています。 伝統的に、ヴィーリは均質化されていない牛乳から作られています。それがクリームのより厚い層がその表面に形成される理由です。標準化後、牛乳を低温殺菌し、20℃に冷却します。L.ラクティス亜種クレモリス、 L.ラクティス亜種ラクティス、およびG.カンジダム に接種し混合する。次に混合物をカップに入れ、熟成のためにインキュベーターに入れ、そこで20℃で20時間発酵させる。発酵の後、ヴィーリは輸送および販売棚の至るところで冷却されます(6°C)。 ヴィーリは28°Cの最適温度で糸状/糸状のテクスチャーを持っています。 ヴィーリの有効期間は約3週間です。乳糖を減らして風味の異なる品種、脂肪分の異なる製品など、さまざまな種類のヴィーリが市場に出回っています。 ヴィーリは、表面にカビが生えていないホモジナイズミルクと牛乳以外のミルクからも商業的に作られていますが、伝統的なヴィーリは依然としてフィンランドの地域で最も人気があります(Leporanta、2003)。しかし、ヴィーリの消費量は、複数の食物文化によって変わりやすく多用途です。商業用ヴィーリには生きた微生物が含まれているため、誰でも自宅、農場、または業界規模で、汚染することなく簡単に繁殖することができます。 彼らは生きている微生物を持っていないか、彼らは特許によって保護されているため、この手順は、他のほとんどすべてのヨーグルトでは不可能です。 |
|
3.プロバイオティクスの源泉としてのヴィーリ |
|
プロバイオティクスは、摂取したときに健康上の利益をもたらすと考えられている微生物です。 この概念の導入は一般にノーベル賞受賞者のメチニコフによってなされており、1907年に腸内微生物の食物への依存が腸内微生物叢を改変し、有害な微生物を有用な微生物に取り替える手段をとることを可能にする。 さらに、プロバイオティクスは多数のビタミン、または効果的なペプチドを分泌します。 しかしながら、各個人のプロバイオティクスのプロファイルは、実際にはかなり早い時期に確立された(Bäckhedet al. 2015)。 通常、病原菌中のプロバイオティクスは、特に消化器系のために、プラスの健康効果をもたらす細菌、真菌、酵母です。 ヴィーリは、相乗的に作用する共生細菌、酵母、およびカビの高い集団を提示します。 ヴィーリはラクトコッカス・ラクチス 亜種 クレモリス、 ラクトコッカス・ラクチス 亜種 ジアセチラクチス、およびロイコノストック・メセンテロイデス 亜種. クレモリスを含むいくつかの乳酸菌(LAB)を含みます。 それらの中で、粘液形成性ラクトコッカス・ラクチス 亜種 クレモリスは、特徴的なリン酸含有ヘテロ多糖類またはEPSを産生する。これらの乳酸菌株はまた、乳酸発酵、ならびにクエン酸塩ベースの芳香形成にも関与している。 さらに、伝統的なヴィーリ培養物には、クルイベロマイセス マルシアナスやピキア・フェルメンタンスなどの酵母株も含まれています。 牛乳は主にカゼインタンパク質、またはペプチドで構成されているため、醸造発酵における酵母の役割は最小限ですが、発酵の終わりには、またはラクトースまたはグルコースが増加するにつれて、少量のエタノールが酵母によって生産されます。 期限切れのヴィーリの場合、それは嗅覚システムによって臭いがすることができます。しかしながら、共生としての酵母菌の病原菌への影響は明らかではない。酵母菌の発酵によるCO2が、ストリッピングH2Sの役割以外に相乗効果の成長因子として、特にヨーグルト製造の場合は作用するかもしれない(Butzke and Park. 2011)。 さらに、病原菌中の酵母は製品の独特の風味を提供し、より多くの菌体外多糖を産生するように乳酸菌を誘導する可能性があるとも考えられている(Wang et al.2008)。しかし、酵母はアルコールを含まないようにするために今日のヴィーリ業界ではしばしば除外されています(Kalle Leporantaとの個人的なコミュニケーション、2016年)。 ヴィーリには少なくとも1種類の真菌:ジオトリカム・カンジダムが含まれています。 白色糸状酵母様カビ。これは、醸造発酵の終わりにベルベット様表面を形成する。 ジオトリカム・カンジダムは多くの植物の病原体ですが、それはヴィーリとチーズの発酵プロセスに存在するプロバイオティクス微生物としての役割でよく知られています。それは5〜38℃の範囲の温度で、約25℃で最適に増殖し、そして3〜11の大きなpH間隔で、5.0〜5.5で最適のpH値で増殖することができる。5~38℃の温度範囲で生育可能で、最適生育温度は25℃付近です。pHは3~11と広く、最適pH値は5.0~5.5です。長い誘導期を除けば、ジオトリカム・カンジダムの世代時間は30℃の液体培養で66分と、真核生物の中で最も短い部類に入り、最終的な菌数は106 tfu/g未満です(Boutrou and Gueguen, 2005; Hudevoca et al., 2009)。ジオトリカム・カンジダムはヴィーリの上にビロードのようなクリーミーな表面を作り出し、それは様々なチーズの熟成過程にも関与しています。 典型的には、ヴィーリの製造中に、発酵はパッケージ内で行われ、18〜20℃で約18〜20時間続く(Roginski、2002)。 |
|
4.ヴィーリの菌体外多糖の組成と基本構造 | |
ヴィーリ製造のために使用される細菌株は、乳酸発酵によってヴィーリに、粘重性とゼラチン状の稠度および心地よい穏やかな味を与えるEPSを生成する(Fonden et al. 2006)。ラクトコッカス・ラクティス亜種クレモリスは ヴィーリににヴィーリアンと呼ばれるリン酸含有ヘテロ多糖を生産します。 ラクトコッカス・ラクティス亜種クレモリス によって分泌された菌体外多糖の組成は、3〜47%のタンパク質および29〜85%の炭水化物からなる(Macura and Twonsley、1984; Nakajima et al. 1990)。ヴィーリの 菌体外多糖は約2000 kDaの分子量を持ち、D-グルコース、D-ガラクトース、L-ラムノース、およびホスフェートから構成され、繰り返し単位は「→4-β-Glcp-(1→4) - 」です。 Β-D-Galp(1→4)-β –D-D-Glcp-(1→n)、およびα-L-Rhapおよびα-D-Galp-1-1-pの群がGlapの両側に結合している(Nakajima et al. 1990; 1992;Higashimura et al. 2000; Sletmoen et al. 2003)。菌体外多糖の組成および糖成分は亜株および培地依存性である。 ラクトコッカス・ラクティス亜種クレモリスSBT 0495, ARH53, ARH74, ARH 84, ARH 87, および B30によって分泌された菌体外多糖は、ホスホジエステル構造要素を有するガラクトース、グルコース、およびラムノースの繰り返し単位からなる(Nakajima et al. 1990;Yang et al. 1999)。対照的に、ラクトコッカス・ラクティス亜種クレモリス H414は、分岐五糖反復単位を有するガラクトースからなるホモポリマーである(Gruter et al. 1992)。 マーシャル等は、ラクトコッカス・ラクティス亜種クレモリス LC33は、2つの異なるEPSを生成することができた。 それらの1つはブドウ糖、ガラクトース、ラムノース、グルコサミン、およびリン酸を含みます。 もう一方は、分岐末端ガラクトース部分を有するガラクトース、グルコース、およびグルコサミンから構成されていたと報告しました1995)。さらに、エプス遺伝子クラスターの転写レベルは糖源に依存しなかったものの、ラクトコッカス・ラクチスは糖基質としてフルクトースよりもグルコースでより多くの EPS を生成しました (Looijesteijn ら、1999)。 | |
5.菌体外多糖の特性評価と機能 | |
ラクトコッカス・ラクティス亜種クレモリス による菌体外多糖形成に関与する酵素には、炭水化物代謝に関与するもの、糖ヌクレオチド合成と相互変換につながる酵素、グリコシルキャリア脂質に結合した繰り返し単位を形成するグリコシルトランスフェラーゼ、ポリマーを形成するトランスロカーゼとポリメラーゼなどがあります。菌体外多糖の生合成に関与する酵素をコードする遺伝子は、ラクトコッカス・ラクティス亜種クレモリスの菌体外多糖プラスミドに配置されている。遺伝子産物EpsD、EpsE、EpsF、およびEpsGareglycosylトランスフェラーゼは、菌体外多糖骨格の合成に必要である(Van Kranenburg et al. 1997、1999)。プラスミド上の菌体外多糖遺伝子の存在は、より高い温度およびスターター培養の頻繁なバッチ接種があるときの菌体外多糖発現不安定性の原因であることが示唆されている(VedamuthおよびNeville. 1986;Cerning et al. 1992)。 粘菌形成能は、細菌が17℃で増殖するときは安定であるが、30℃を超える温度で増殖すると失われることが示されている(Forsénet al. 1973)。 |
|
6.ヴィーリの熱影響 | |
その高い栄養価に加えて、ヴィーリは人間の健康にプラスの利益を示します。 ヴィーリは、異なる数のプロバイオティクス細菌(108 / mL)、降圧効果、ならびにヴィーリの存在に関連した抗炎症性、抗酸化性および抗発がん性の活動を含んでいます。 したがって、ヴィーリは伝統的な天然の機能性食品と見なすことができます。 ヴィーリの菌体外多糖は腸粘膜との相互作用を助けることが示されている(Ruas-Madiedo et al. 2006)が、ヴィーリ内の他の微生物と共生し、同じライフチェーン内の複数の代謝産物を消費するため安全です。 正確なメカニズムは不明ですが、技術的使用および乳製品の消費に関連してジオトリカム・カンジダムの「病原体」が原因で感染が発生する危険性は、1842年から2006年の間に報告された100件に満たないため、事実上ゼロでした(Pottier et al. 2007)。 |
|
7.ヴィーリの抗酸化作用 | |
多くの食物化合物は、それらの抗酸化作用と抗炎症作用のために健康上の利点を持つことが知られています。 抗酸化食に加えて、細胞内Nrf2 / ARE抗酸化経路も確立されています。すなわち、Nrf2 / AREを介した細胞内抗活性酸素種の活性化と低酸素、炎症、ならびに細胞遊走の促進および細胞内微小環境への侵入との関連性があり、細胞外抗酸化剤の相互作用は酸化をバランスさせることによって細胞の健康を維持する 状態(Luo et al、2011)。ヴィーリとその分離されたバクテリアは抗酸化作用を含むいくつかの健康上の利益を持っていると報告されています(Wang et al. 2014)。 人体内または食品系内の内因性代謝過程および外因性化学物質は、状況によっては、生体分子を酸化することができる高反応性酸素種を生成することができ、組織損傷および細胞死をもたらす。 これは炎症、糖尿病、遺伝毒性、がん、そして加齢の促進につながる可能性があります(Biswas et al、2010)。最近の研究では、ウルソール酸(UA)の抗酸化能力が0〜100μg/ mlの濃度で用量依存的に増加することを示したが、ヴィーリの 菌体外多糖(VEPS)の抗酸化力はより穏やかであった。 両化合物0〜50μg/ ml。 MTTアッセイによる200μg/ mlの濃度のUAおよびヴィーリの菌体外多糖によるHepG2細胞の有意な抗増殖が観察されたが、細胞は12.5μg/ mlで老化を開始し、それはアポトーシスの誘導または壊死よりもむしろ複数の分子調節機構を示した。これらすべての試験は、ハーブウルソール酸と食品媒介ヴィーリの菌体外多糖の適合性を示しています。これは、ヴィーリの 菌体外多糖はウルソール酸と相乗的な抗酸化物質であるため、健康製品または機能性食品として一緒に加工できることを意味します。 ヴィーリの菌体外多糖に加えて、ヴィーリの細菌は、フリーラジカル捕捉効果およびFe 2+ - キレート化能力を有するα、α-ジフェニル-β-ピシルヒドラジルを含むことが実証されている(Chiang et al. 2011)。 ヴィーリとその製品の抗酸化作用は、人体が酸化ダメージを軽減するのを助けるかもしれません。乳タンパク質は多くの異なる生物学的に活性な化合物の前駆体であるので、フリーラジカル消去活性を有するいくつかのペプチドが発酵乳製品中に同定されている。 乳タンパク質をペプチドと遊離アミノ酸に分解するのを助けるヴィーリのタンパク質分解能力は、1990年代初頭に特徴付けられた(Tan and Konings. 1990; Alting et al. 1995)。 ヴィーリで作られた低脂肪チーズで見られる抗酸化活性の変化は、おそらく乳酸菌プラス抗酸化ペプチドの生存力のある集団にも関係しています。 |
|
8.アンジオテンシンI変換酵素(ACE)阻害活性 | |
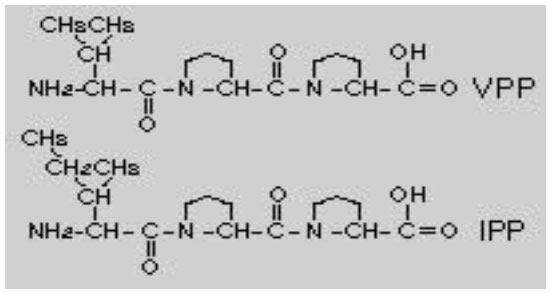
アンジオテンシン(EC 3.4.15.1)は高血圧と鬱血性心不全に関連することが知られています。この酵素はアンジオテンシンⅠをアンジオテンシンIIに変換し、前者は不活性ペプチドであり、後者は昇圧剤である。この酵素は、拡張性ペプチドであるブラジキニンの分解も引き起こします。したがって、酵素は高血圧を含む特定の心血管疾患の治療のための明らかな薬物標的です。乳酸菌は発酵中に酵素の阻害剤を産生することが知られている。ラクトコッカス・ラクティス亜種クレモリス株は、アンジオテンシン活性に対して強い阻害効果を有することが実証されている(Chiang et al. 2011)。スターターのタンパク質分解活性およびタンパク質分解速度は、これらの乳製品の阻害活性において重要な役割を果たすように思われる。ラクトコッカス・ラクチスのタンパク質分解系が研究されており、それは細胞壁結合プロテイナーゼおよびいくつかの細胞内ペプチダーゼからなる(Tan & Konings et al. 1990; Alting et al. 1995)。発酵乳製品としての高いタンパク質分解活性、ヴィーリは、他の発酵乳製品と比較してより優れたアンジオテンシン阻害効果を示す。研究は主にヴィーリからのIPP+VPP、in vitroでアンジオテンシンを阻害することができる2つのラクトトリペプチドに焦点を合わせてきた。(軽度)高血圧症のフィンランド人と日本人の両方の被験者で、図3のIPPとVPPはアンジオテンシンに対する抑制を示し、拡張期血圧(DBP)と収縮期血圧(SBP)を7〜14 mmHg低下させ、統計的に有意 (Hata et al、1996; Pins and Keena. 2006)。さらに、多くの研究は、生物活性ペプチドの種類と濃度が乳製品の機能特性に大きな影響を与えることができると報告しています(Ong and Shah. 2008a、b)。 |
|
 |
|
| 図 3. ヴィーリおよび他の多くの発酵乳製品由来のトリペプチド (Turpeinen et al., 2009)。 | |
9.免疫調節効果 | |
ヴィーリおよびその乳酸菌は、抗アレルギー作用および抗大腸炎作用を含め、in vitroおよびin vivoで免疫調節作用を有することが証明されています(Huang et al。、2010)。ヴィーリおよびヴィーリ細菌ラクトコッカス・ラクティス亜種クレモリスTL1は、in vitroでヘルパー細胞I型(Th1)サイトカイン腫瘍壊死因子-α、炎症誘発性サイトカインインターロイキン(IL)-6、およびT調節細胞(Treg)サイトカインIL-10の産生を誘導することが示されている。 ヴィーリが有益であり、Th1 / Th2バランスを改善するかもしれないことを示唆しています。ヴィーリに含まれる ラクトコッカス・ラクティス亜種クレモリス TL1の経口摂取は、オボアルブミン感作マウスの血清中の総免疫グロブリンIgEおよびオボアルブミン(OVA)特異的IgEレベルを抑制することが示されている。IgE産生の抑制は、アレルギーを治療する際の重要な目標です。さらに、腸の生理機能の調節に関するヴィーリ細菌ラクトコッカス・ラクティス亜種クレモリス TL1のin vivo効果が実証されている。 この株は、出血スコアの有意な減弱および結腸短縮の減少によって例示されるように、デキストラン硫酸ナトリウム(DSS)誘発性大腸炎を改善することができる。組織学的分析はまた、ラクトコッカス・ラクティス亜種クレモリス TL1 処理したグループに含まれる動物の間の結腸における再生および上皮の回復を示した。
|
|
 |
|
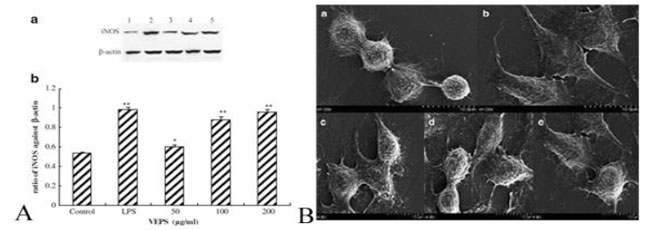
| 図4. ヴィーリ菌体外多糖のマクロファージRAW 264.7細胞への影響(Wu et al., 2013) | |
| これらの知見は、ヴィーリから分離されたラクトコッカス・ラクティス亜種クレモリス TL1株は上皮細胞に関して潜在的な直接的な抗炎症活性を有し、そしてこの効果はDSS-大腸炎マウスの粘膜領域における好中球の蓄積の阻害をもたらし得る。 | |
| Toll様受容体(TLR)ファミリーが、抗炎症過程に関与する細菌性病原体関連分子パターンを認識することを通して宿主防御において重要な役割を果たすことは広く知られている。そのため、炎症が最小限に抑えられるため、大腸炎による不快感を最小限に抑えることができます。プロバイオティクス乳酸菌の免疫調節作用がブタの研究で調べられています。腸内のTLRによって媒介されるプロバイオティック乳酸菌による腸の免疫調節を示し、これはヒトの大腸菌のリポ多糖(LPS)のリガンドの分子機構を介するTLRシグナル伝達伝達経路に類似している(T0hno et al. 2007, 2008)。最近そのようなTLRファミリータンパク質はRP105 / MD1複合体として定義された。それは、ラクトバチルス プランタルム N14由来の菌体外多糖の免疫調節効果に関与している(Murofushi et al. 2015)。 RAW 264.7マクロファージにおけるVEPSの効果を研究することによって、食作用は走査型電子顕微鏡(SEM)によって観察され、NO、IL-6、およびIL-1βの力価はELISA、IL-6およびIL-1の遺伝子発現によって増加した。 1βはRT-PCRによって増強され、誘導型一酸化窒素シンターゼ(iNOS)の遺伝子およびタンパク質発現もまたRT-PCRおよびウエスタンブロッティングによって増加し、これはヒト免疫におけるVEPSの可能性のある役割を示唆する(図4)。 サイトカインの誘導は、Tヘルパー細胞を介して体液性免疫を促進する可能性を示唆しています(Wu et al. 2013)。 A:ウエスタンブロッティングによる、異なる濃度のVEPSを有するマクロファージRAW264.7細胞におけるiNOSのタンパク質発現。 B:SEMによるVEPSおよびLPSの刺激下でのRAW264.7の細胞形態。 a)コントロール、b)1μg/ mLのLPS、c – e)50、100、および200μg/ mLのVEPS。 元の倍率は4,000倍であり、SEMの元のスケールは各画像において10μmを表す(Wu et al、2013)。 | |
10.ヴィーリの 菌体外多糖により促進された腫瘍免疫療法 | |
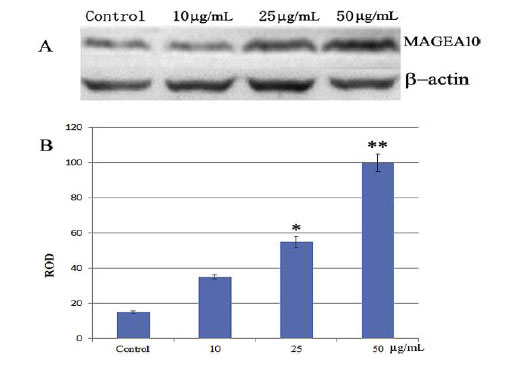
免疫療法は、固有のマッチングHLAタイピングエピトープ、または非特異的抗原エピトープを介して免疫反応を誘導、増強、または抑制することによる疾患の一種の治療法です。 免疫応答を惹起または増幅するように設計された免疫療法は活性化免疫療法として分類され、免疫応答を低下させるかまたは抑制する免疫療法は抑制免疫療法として分類される。 MAGE-A抗原は、腫瘍中に発現されるが精巣および胎盤を除く正常組織中には発現されないがん/精巣抗原(CTA)のクラスターに属する。 MAGE-A抗原のうち、MAGEA10はそのエピトープが細胞傷害性Tリンパ球応答を広範囲に引き出すため、がん免疫療法の魅力的な標的となります。 しかしながら、遺伝子発現の抑制的細胞環境および特定のHLA対立遺伝子提示の必要性は、しばしば免疫療法の失敗につながっている。 MAGE遺伝子の遺伝子発現およびメチル化を研究することによって、MAGEA10は癌患者ではほとんど発現されなかったが、その発現は病原性多糖類によって増強され得ることが最近示された。これはエピトープ提示の増加の可能性を示す(図5)。 |
|
 |
|
| 図5. ウェスタンブロッティングによる絨毛菌体外多糖の影響下におけるA549細胞におけるMAGEA10タンパク質発現の増強(Wang et al., 2015)。 | |
 |
|
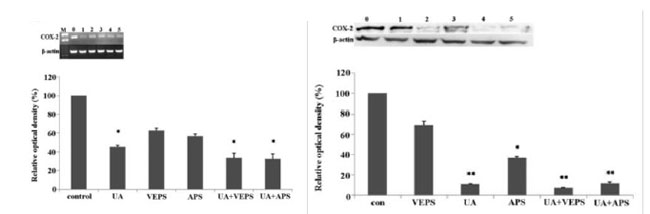
図6. HepG2細胞における(COX)-2発現に対する各種化合物の阻害効果。 HepG2細胞を、UA:ウルソール酸(5 μg/ml)、絨毛EPS:菌体外多糖(50 μg/ml)、黄耆多糖類(APS)(50 μg/ml)、または併用処理で48時間処理した。 (左):COX-2遺伝子のRT-PCR解析。レーン0:対照;レーン1:UA(5 μg/ml)、レーン2:VEPS(50 μg/ml)、レーン3:APS(50 μg/ml)、レーン4:UA+VEPS;レーン5:UA+APSを48時間処理。 (右):同一サンプルを用いたタンパク質レベルの定量解析。*P<0.05、**P<0.01、対照群との比較(Liu et al., 2014)。 |
|
 |
|
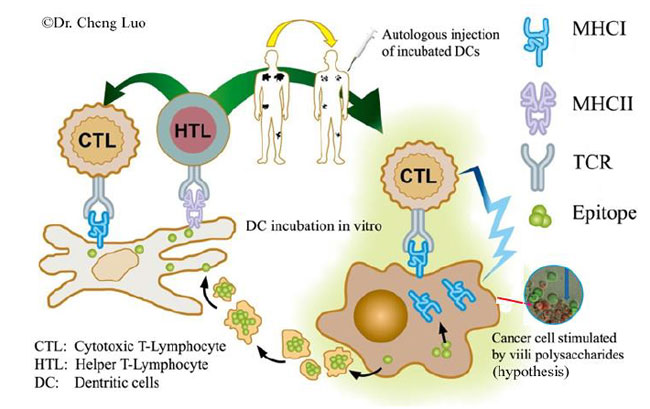
| 図7. CTL活性化因子(イピリムマブなど)とがん抗原提示プロモーター(ヴィーリ多糖類など)を用いた自己/非自己免疫療法。 | |
11.抗腫瘍免疫療法 | |
いくつかの研究はヴィーリの抗腫瘍作用を報告しています。北沢ら (1992)ヴィーリとそのスターターバクテリアの1つであるラクトコッカス・ラクティス亜種クレモリス KVS20は、ルイス肺癌の転移を抑制し、そして in vivoで固形および液状のサルコーマ-180の増殖を減少させたと報告しました。 ヴィーリの抗腫瘍効果は、ラクトコッカス・ラクティス亜種クレモリス KVS20によって刺激されたマクロファージの細胞傷害活性の増加に起因する可能性がある。Liuら (2012)はヴィーリの 菌体外多糖による処理後のHepG2がん細胞の老化を観察した。これはヴィーリの菌体外多糖が抗腫瘍活性を有する可能性があるという考えを支持する(図6)。 さらにヴィーリ菌体外多糖は、COX-2遺伝子およびタンパク質発現の阻害を介してがん細胞アポトーシスを誘導した(Liu et al. 2014)。しかしながら、コイックス多糖類のような他の多糖類と比較して、ヴィーリ菌体外多糖の抗酸化力はそれほど有能ではなく、抗酸化依存性アポトーシスの誘導はそれほど敏感ではなかった(Liu et al. 2014; Wang et al. 2014)。2011年3月25日に、米国食品医薬品局(USFDA)は、見逃しがたいまたは転移性の黒色腫の治療のためのイピリムマブ注射剤(Bristol-Myers Squibb Companyによって製造されたYervoy)を承認した。 イピリムマブは、免疫系を下方制御するタンパク質受容体であるCTLA-4を標的とすることによって免疫系を活性化し、それによって細胞傷害性Tリンパ球(CTL)を活性化し、がん細胞と戦う機会を増やすモノクローナル抗体である。 最近の研究で、ヴィーリ多糖類は癌抗原MAGEA10の遺伝子およびタンパク質発現を誘導することができ、がん抗原の過剰発現はがん細胞を破壊するCTL機会を増加させるため、免疫療法のより高い機会を与えることが示された(Wang et al, 2015)。がん抗原の発現および提示を増加させることは、がん細胞に対するCTL媒介細胞毒性の機会を増加させることが可能である(図7)。1型のMHC(HLA-A))によって提示されるがん抗原(エピトープ)は、CTRのTCRによって認識され得、そして最終的に癌細胞破壊を導き得る。右挿入円の画像は、MAGEA3パルス癌細胞(赤)が対応する特異的CTLによって攻撃され、非パルスがん細胞(緑)は無傷のままであったことを特徴とした(Wang et al. 2014)。 |
|
| 12.結論 | |
発酵させたヴィーリなどのさまざまな発酵食品の機能的健康の役割は広く認識されています。食品生まれの多糖類ヴィーリ菌体外多糖は、特にインターロイキンとCOX-2の発現を抑制することで抗炎症作用と抗がん作用を持ちます。これは内部酸化を増加させ、内部抗酸化反応要素の変化と共にアポトーシスを引き起こし、細胞増殖の減少につながります。 これらの特定のメカニズムはさらに研究する必要があります。 |
|
参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
|
|
この論文は、Journal of Agricultural Science and Food Technology Vol. 2 (7), pp. 105-113, August, 2016 に掲載されたViili as Fermented Food in Health and Disease Prevention: A Review Studyを日本語に訳しました。タイトルをクリックして、原論文を英文で読むことが出来ます。 |


