ケフィアライフをお勧めする中垣技術士事務所

HOME>自社研究>スカンジナビアの発酵乳ヴィーリからの細胞外多糖は、 マウスの腸内の酪酸とMuribaculumのメンバーを増加させます
| 論文発表(ヴィーリ)ぶ |
スカンジナビアの発酵乳ヴィーリからの細胞外多糖は、 |
Takuya Yamane, Satoshi Handa,Momoko Imai, Naoki Harada, Tatsuji Sakamoto, Testuo Ishida, Takenori Nakagaki, Yoshihisa Nakanoa Food Chemistry :Molecular Sciences |
概要 |
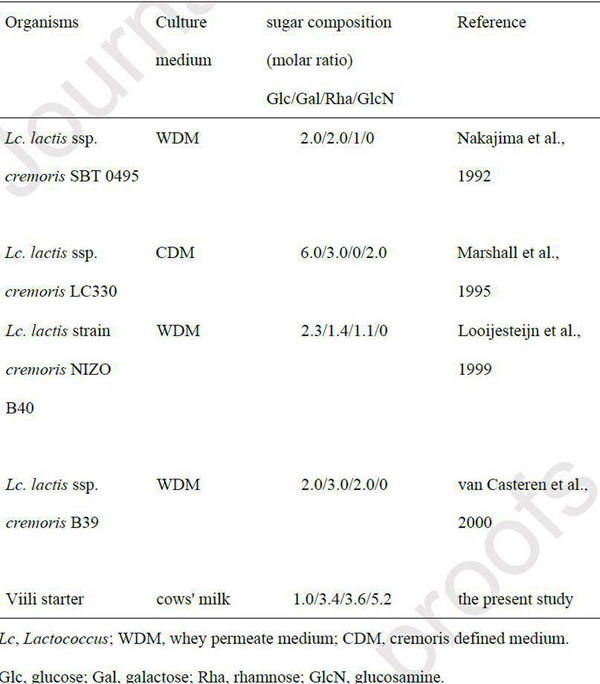
ヴィーリのスターターカルチャーには、Lactococcus lactis に属する乳酸菌が含まれています。 これらのバクテリアは大きな多糖類(EPS)を牛乳に分泌し、その結果、ヴィーリの糸引き食感になります。 マウスの実験では大量のEPS(5〜140 mg /日)が腸内細菌叢の調節を通じて人工的に誘発された病気の重症度を軽減することが示されています。 本研究では、EPSの補足量が正常なマウスの腸内細菌叢に影響を与えるかどうかを調査しました。 グルコサミン含有量の高いEPS(VEPS)は、自家製のヴィーリから分離されました。 通常の食餌を与えられたC57BL / 6J雄マウスは、8μg/ mLのVEPSを含む水道水を自由に飲むことにより、49±1μgのVEPS /日を28日間摂取しました。Muribaculum の相対的な存在量は、VEPSの補給によって大幅に増加しました。 糞便中の酪酸の相対的な存在量は対照マウスで減少し、VEPSはこの減少を防ぎました。 これらの発見は、腸内細菌叢が少量のVEPSによって調節できることを示しました。 |
1. はじめに |
|
ヴィーリは、スカンジナビアで生まれた伝統的な発酵乳製品です(Luo&Deng、2016; Bakry&Campelo、2018)。 ヴィーリを作るには、ミルクにスターターを接種し、約20ºCで16〜24時間培養します。 ヴィーリスターターには、粘液形成中温性乳酸菌としてLactococcus lactis ssp. cremorisおよび/または Lactococcus lactis ssp. lactis が含まれています(Kahla et al.,2008)。 このスライムはヴィーリにロープ状のテクスチャーを与え、エキソポリサッカライド(EPS)と呼ばれるバクテリアによって細胞外に排泄される多糖類がスライムを作ります。Lacococcus lactisでは、これらのEPSのヴィーリでの生合成(VEPS)は、プラスミドのeps遺伝子クラスターにコードされている酵素によって実行されます(Neve,Geis & Teuber,1988; Zhou,Cui & Qu,2019)。 |
| 乳酸菌によって産生されるEPSのさまざまな構造が決定されています(Laws,Gu & Marshall,2001; Zannini,Waters,Coffey &Arendt、2016)。 これらの構造のほとんどは、Lactobacillus と Streptococcusによって生成されたEPS用に決定されています。 EPSの中には、1種類の単糖(ホモ多糖)のみを含むものと、2種類以上の単糖(ヘテロ多糖)で構成されるものがあります。 EPSは、数百のオリゴ糖単位からなる大きなポリマー(分子量104〜107 Da)であり、繰り返し単位は、α-またはβ-グリコシド結合によって結合された3〜7個の単糖で構成されています。 繰り返し単位は、主鎖(背骨)と、背骨に化学的に結合している1つまたは複数の分岐を持っています。 ヘテロ多糖の化学構造の決定は簡単な作業ではないため、VEPSの構造はごくわずかしか知られていません。 |
最近、乳酸菌によって産生されるEPSの生物活性が集中的に調査され、EPSの健康上の利点が明らかになりました(Saadat,Khosroushahi およびGargari,2019年)。 たとえば、細胞を使用したin vitro実験では、EPS(細胞培養培地で50〜200μg / mL)は、免疫調節(Kitazawa,Yamaguchi,&Itoh,1992)、抗腫瘍活性(Ishiguro et al., 2017)、抗酸化活性(Ling.,Junhua et al.,2012)、およびα-アミラーゼ阻害活性(Ayyash et al.,2020)を示しており、 インビボ実験では、EPSは免疫調節(Vinderola, Perdigón, Duarte,Farnworth および Matar,2006)および腸のバリア機能の調節(Zhou et al.,2018)を示しました。 これらのマウス実験では、大量のEPS(約100 mg EPS / kg体重/日)が強制経口投与によってマウスに投与されました。 ヨーグルト、ケフィア、ヴィーリなどの発酵乳製品は、安全で人間の健康に有益であると考えられています。 それらの有益な効果は、一部は生きている乳酸菌(プロバイオティクス)によるものであり、一部は細菌によって生成される代謝物によるものです(Kareb.O & Aїder.M,(2019)。 EPSは代謝物の1つであり、ヘテロ多糖含有量は50〜200 mg / Lです(Badel, Bernardi およびMichaud, 2011年)。 報告されたマウス実験でのEPSの摂取量は、成人の場合6g /日に相当します。 機能性食品の観点から人間の健康に対するEPSの有益な効果を見つけ、そのメカニズムを調査するには、実際の用量のEPSを使用したinvivo実験が避けられません。 |
| 腸内細菌叢と宿主の食事の組成は密接に関連しています。 Morrison et al は、雌と雄の両方のマウスで、食物繊維の減少が腸内細菌叢の組成を大幅に変化させ、バクテロイデス門内の分類群の喪失とクロストルディアおよびプロテオバクテリアの拡大をもたらすことを示しました(Morrison, Jašarević, Howard, & Bale, 2020)。 食物繊維は盲腸と結腸の微生物によって発酵され、酢酸塩、プロピオン酸塩、酪酸塩を生成します(Koh, De Vadder,
Kovatcheva-Datchary, &Bäckhed, 2016; Morrison&Preston, 2016; McNabney &Henagan, 2017)。 これらの短鎖脂肪酸(SCFA)は結腸細胞に吸収され、これらの細胞のエネルギー源として使用され、循環に輸送されたSCFAはシグナル伝達分子として機能します(Dalile, Oudenhove, Vervliet&Verbeke, 2019)。 最近、マウス肥満モデル(Lim et al., 2017)および肝障害モデル(Xu et al., 2019)の腸内細菌叢に対するEPSの影響が報告されています。 前者のモデルでは、バクテロイデス科とアッケルマンシア属の相対的な存在量は、EPSグループのマウスで有意に増加しました。 後者のモデルでは、EPSを14日間前投与すると、リポ多糖とD-ガラクトサミンの腹腔内注射後の腸内細菌叢の腸内毒素症が予防されました。 これらの2つの実験では、5〜140 mgのEPS(成人の場合は12〜336 g /日に相当)が強制経口投与によって各マウスに与えられたことに注意する必要があります。 |
| 本研究の目的は、EPSを自由に補給した水道水を飲むことが、通常の食餌を与えられた通常のマウスの腸内細菌叢とSCFA産生に影響を与えるかどうかを調べることです。 まず、ヴィーリからEPS(VEPS)を分離しました。 VEPSの単糖組成と走査型電子顕微鏡(SEM)画像は、現在のVEPSがLactococcus lactisについて報告されたものとは異なる構造を持っていることを示しました。 第二に、VEPSの最大用量は、VEPSグループのマウスの水分摂取量を、サプリメントなしで水道水を与えられたコントロールグループのマウスの水分摂取量と比較することによって決定されました。 最後に、8μg/ mLのVEPSを含む水道水をC57BL6マウスに28日間投与しました。 VEPSの1日平均摂取量は49±1μg/日でした。 低用量のVEPSは、糞便中のMuribaculumの相対的な存在量を大幅に増加させました。 28日後、VEPS群の糞便中の酪酸の相対量は対照群よりも高かった。 |
2. 材料と方法 |
2.1 材料 |
ヴィーリスターターは、有限会社中垣技術士事務所(堺、日本)から入手しました。 スターターには、Lactococcus lactis ssp lactis、Lactococcus lactis ssp cremoris、Lactococcus lactis ssp lactis biovar diacetylactis、およびLeuconostoc meseuteroides ssp cremorisが含まれています。 牛乳は地元のスーパーマーケットから購入しました。 2-ニトロフェニルヒドラジン塩酸塩(2-NPH・HCl)、N-(3- ジメチルアミノプロピル)-N'-エチルカルボジイミド塩酸塩(EDC・HCl)、短鎖脂肪酸、および単糖は、東京化学工業(東京、日本)から購入しました。 他のすべての化学薬品(分析グレード)は和光純薬(大阪、日本)から購入しました。 |
2.2 ヴィーリからのEPSの分離 |
| ヴィーリは次のように準備されました。ヴィーリスターター(1 g)を1Lの牛乳に加えました。 タンブリングで混合した後、ミルクが固まるまで混合物を22.5℃で24時間放置しました。 タンパク質を沈殿させるために、トリクロロ酢酸(TCA)をヴィーリに添加しました(最終TCA濃度6.7%)。 マグネチックスターラーを使用して混合物を4ºCで1時間激しく攪拌した後、混合物を12,000×gで20分間4ºCで遠心分離しました。 上澄みを集め、2倍量のエタノールと混合しました。 混合物を4ºCで12時間インキュベートした後、混合物を12,000×gで20分間4ºCで遠心分離しました。 沈殿物を収集し、蒸留水に再懸濁しました。 懸濁液は、分子量が10 kDaにカットオフされたセルロース膜を使用して、1Lの蒸留水に対して4ºCで1日間透析されました。 透析中に蒸留水を2回交換しました。 透析されたサンプル(VEPS)は、凍結乾燥機(DRW040DA、ADVANTEC、東京、日本)を使用して凍結乾燥されました。 |
2.3 動物実験 |
| 6週齢のC57BL / 6J雄マウスは、Japan SLCから購入し、マウスケージに個別に収容しました。 順応のために、マウスに通常の食餌(CE-2、CLEA Japan、東京、日本)と水道水を2週間与えました。食事(100g)には4.3gの食物繊維が含まれていました。 順応の2週間後、マウスは2つのグループに割り当てられました(グループあたり6匹のマウス)。試験群(EPS群)のマウスは、8μg/ mLのVEPSを含む水道水を自由に飲むことができました。 対照群のマウスは水道水を飲むことができた。 両方のグループのマウスは通常の食餌を与えられた。 処置の1日目および28日目に、個々のマウスから糞便を収集した。 糞便は使用するまで-70ºCに保たれました。 すべての動物実験は、国立衛生研究所の実験動物の管理と使用に関するガイドに従って実施され、すべてのプロトコルは、大阪府大学の動物研究委員会(許可番号19-161)によって承認されました。 |
2.4 VEPSの走査型電子顕微鏡(SEM) |
| 凍結乾燥したVEPSの少量(マイクロスパチュラ1カップ)を、5mLの0.1Mリン酸緩衝液(pH 7.4、緩衝液A)中の4%パラホルムアルデヒドで4°Cで8時間処理しました。 インキュベーション後、VEPSを遠心分離により沈殿させた。 沈殿物を5mLの緩衝液Aで洗浄した。 洗浄したVEPSを遠心分離により回収し、5 mLバッファーA中の1%タンニン酸で25°Cで30分間処理しました。 遠心分離によりVEPSを沈殿させ、沈殿物を5 mLのバッファーAで洗浄した後、5mLの蒸留水で25℃で30分間洗浄しました。 洗浄したVEPSをエタノールシリーズで脱水しました:50%、70%、90%、95%、最後にtert-ブタノール(アルコール溶液は30分ごとに交換)。 脱水したVEPSを凍結乾燥し、両面金属テープのスタブに固定し、20 mAのイオンスパッタ(E-1010、日立、東京、日本)を使用して金の薄層で覆った。 固定されたサンプルは、走査型電子顕微鏡(SU1510、日立、東京、日本)を使用して、15.0kVの加速電圧で観察された。 |
| 2.5 単糖組成の分析 |
| VEPS(2 mg)は、0.1mLの2mol / L硫酸中で120ºCで2時間加水分解されました。 溶媒を蒸発させ、加水分解物を0.26mLの0.1mol / L NaOH(溶媒A)に溶解した後、溶液のアリコート(80μL)をDionex CarboPac PA1 ICカラム(4×250 mm)にアプライしました(4×250 mm)(Thermo Fisher Scientific, Waltham, MA)。 カラムは、次のグラジエントを使用して1 mL / minの流速で展開されました:0〜5分、0%B; 5〜35分、0〜90%B(直線的に増加)。 溶媒Bは、0.5 mol / Lの酢酸ナトリウムを含む溶媒Aでした。 流出物は、PAD検出器(Dionex ICS-5000、Thermo Fisher Scientific)を使用したパルスアンペロメトリー検出によって監視されました。 本物の単糖溶液(0〜100μM)を使用して検量線を取得しました。 |
| 2.6 VEPSのSDS-ポリアクリルアミドゲル電気泳動(SDS-PAGE) |
| SDS-PAGEは、製造業者の指示に従って、プレキャストゲル(任意のkD precast gel, Bio-Rad)を使用して実施された。 CBB-G250溶液(Bio-Rad、CA、USA)を使用して、タンパク質をクマシーブリリアントブルーG-250で染色しました。 多糖類を視覚化するために、過ヨウ素酸シッフ(PAS)染色(Zacharius、Zell、Morrison、およびWoodlock、1969)が実行されました。 簡単に説明すると、電気泳動の直後に、ゲルを12.5%TCAで30分間固定し、蒸留水で軽くすすいだ後、1%過ヨウ素酸(3%酢酸中)に50分間浸しました。 過ヨウ素酸処理後、ゲルを蒸留水で一晩洗浄した(水を3回交換した)。 洗浄したゲルを暗所でフクシン-亜硫酸塩溶液(Sigma-Aldrich、MO、USA)に50分間浸漬し、次に0.5%メタ重亜硫酸塩で10分間洗浄しました。 この洗浄は3回行った。 次に、ゲルを蒸留水で一晩洗浄し、5%酢酸に保存した。 |
| 2.7 16SrRNAシーケンシングによる腸内細菌叢の組成の分析 |
| 1日目と28日目に、対照群とVEPS群のマウスから個別に糞便を採取した。
糞便からのDNAの抽出、16S rRNAのV3–V4領域の増幅(センスプライマー、 5'- TCGTCGGCAGCGTCAGATGTGTATAAGAGACAGCCTACGGGNGGCWGCAG3 '; アンチセンスプライマー、 5'- GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAGGACTACHVGGGTATCTA ATCC-3 ')、シーケンスアダプターによるインデックス作成、およびMiSeq(Illumina, San Diego, CA)を使用したシーケンスは、前述のように実行されました(Harada,Hanada et al.,2020)。 後処理シーケンスデータは、QIIME2パイプラインを使用して分析されました(Bolyen.,Rideout et al.,2019)。 Deblur(Hyde,Gonzalez & Knight.2017)を使用してノイズ除去した後、フィルタリングされたシーケンスデータはSilva(v132)に対して分類されました。 プリンシパル座標分析(PCoA)と階層的クラスター分析は、Rソフトウェアを使用して実行されました。 細菌の16SrRNAシーケンスデータセットは、アクセッション番号DRA012528でDDBJシーケンスリードアーカイブに寄託されています。 |
| 2.8 短鎖脂肪酸の分析 |
| ポリトロンホモジナイザーを使用して、糞便(約3.0 g)を10容量(v / w)の蒸留水でホモジナイズし、ホモジネートを3000×gで10分間遠心分離しました。 上清のアリコート(1 mL)をさらに13000×gで10分間遠心分離しました。 上清(500μL)を新しい1.5 mLチューブに移し、500μLのアセトニトリルと混合しました。 混合物を氷上で10分間インキュベートした後、13000×gで10分間遠心分離しました。 上清のアリコート(40μL)を135μLの50%アセトニトリル水溶液および25μLの2.0 mmol / Lヘプタン酸(50%アセトニトリル水溶液)と混合しました。 このサンプル(200μL)のSCFAの2-NPH誘導体化は、Peters etal。が使用した方法に従って実施しました。 (Peters et al。、2004)。 サンプルを20μLの40mmol / L 2-NPH・HCl(50%水性エタノール中)および40μLの125 mmol / L EDC・HCl(1.5%ピリジンを含む50%水性エタノール中)と混合しました。 混合物を60℃で15分間インキュベートしました。 混合物を氷上で冷却することにより反応を停止させた。 過剰のエタノールとアセトニトリルを除去するために、冷却した混合物を遠心エバポレーターを使用して30分間蒸発させた。 得られたサンプル中の塩および過剰な試薬は、MonoSpinC18(GL Science、東京、日本)を使用した固相抽出によって次のように除去されました。 スピンカラムを300μLのメタノールで洗浄した後、300μLの0.1%TFA水溶液(溶媒C)で平衡化しました。 サンプルを300μLの溶媒Cで希釈し、希釈したサンプルをスピンカラムにアプライしました。 カラムを300μLの溶媒Cで2回洗浄した。 次に、2-NPH誘導体化脂肪酸を、90%アセトニトリル水溶液(溶媒D)中の50μLの0.1%TFAでモノリスから溶出しました:溶媒C = 50:50(v / v)。 |
| 溶出したサンプルを溶媒Cで5倍に希釈し、希釈したサンプルの20μLアリコートをInertSustain C18カラム(2.1mm×100mm、GL Science)にアプライしました。 カラムは、次のタイムプログラムに従って、150μL/分の流速で開発されました。0〜5分、10%B; 5〜10分、10〜20%B; 10〜50分、20〜90%B; 50〜59分、90%B; 59〜60分、90〜10%B。 400nmでの吸光度をモニターしました。 クロマトグラムは、クロマトグラフィーソフトウェアClarity(DataApex、プラハ、チェコ)を使用して分析しました。 脂肪酸の検量線は、各脂肪酸とヘプタン酸のピーク面積比を濃度に対してプロットすることによって作成されました。 HPLC分析は、プロミネンスHPLCシステム(島津、京都、日本)を使用して実施された。 |
| 2.9 統計分析 |
| データは、各サンプルの少なくとも3回の繰り返しの平均±S.Eとして表されます。 統計分析は、Statcel4ソフトウェア(OMS、東京、日本)を使用して実行されました。 2つのグループ間の差異は、分散分析(一元配置分散分析)と、それに続くp <0.05での対応のないスチューデントのt検定を使用して評価されました。 複数のサンプルを比較するために、Tukey-Kramer検定が使用されました。 |
| 3.結果と考察 |
| 3.1 VEPSの分離と特性評価 |
| VEPS(33.5 mg)は、1Lの牛乳から社内で生産されたヴィーリから分離されました。 Ruas-Madiedoらは、市販の発酵乳ヴィーリから約70 mgのEPSを分離しました(Ruas-Madiedo, Gueimonde, Reyes-Gavilán および Salminen. 2006年)。 精製されたVEPSのSDS-PAGEは、クマシーブルーで染色されたバンドを示さず(図1Aの左側のパネル)、VEPSが検出可能なレベルのタンパク質を含まなかったことを示しています。 比較的広いPAS染色バンド(図1Aの右パネル)が分離ゲルの上端近くで検出されました。 10μgのVEPSを適用すると(図1Aの3番目のレーン)、PAS染色された薄いバンドが広帯域のすぐ下に現れ、VEPSに分子サイズの異なる多糖類が少なくとも2つ含まれていることを示しています。 |
| SEM画像VEPSは、長い繊維とフレークの絡み合った混合物の構造を示しました(図1B)。 この構造は、フレーク状の構造が優勢であるLactococcus lactis F-mou(Nehal et al., 2019)、 粗い表面のフレークが優勢であるLactobacillus plantarum KX041からのEPS(Xu, Cui et al., 2019)、およびスティック状とフレーク状の構造が層状になっているLactococcus garvieae C47からのEPS(Ayyash et al., 2020)のEPSの構造とは異なります VEPSの繊維質の性質は、ヴィーリの糸を引く性質に関連している可能性があります。 |
| 図1Cに示すように、VEPSには、ラムノース、グルコース、ガラクトース、およびグルコサミンが、ラムノース/グルコース/ガラクトース/グルコサミンのモル比= 3.6 / 1.0 / 3.4 /5.2で含まれていました。 |
| 図1.VEPSの特性評価 |
A.VEPSのSDS-PAGE。左のゲルはCBBで染色されました。右のゲルはPAS染色されました。 レーンM、事前に染色された分子量マーカー。 B.VEPSのSEM画像。スケールバー、100μm。 C.VEPSの単糖組成。VEPSの酸加水分解物をDionexCarboPac PA1 ICカラムにかけ、パルスアンペロメトリーで検出しました。 Fuc、フコース(内部標準として使用); Rha、ラムノース; GlcN、グルコサミン; Gal、ガラクトース; Glc、ブドウ糖。 |
| 表1に、Lactococcus lactis種が産生するEPSの単糖組成を比較しました。L. Iactis subsp. cremoris SBT 0495によって生成されたEPSには、ラムノース、グルコース、ガラクトース、およびリンがモル比1.3:1.8:2.1:1.0で含まれています。 (中島・廣田・鳥羽・伊藤・足立、1992)。 この研究で分離されたVEPSには、他のEPSと比較してはるかに大量のグルコサミンが含まれています。 VEPSにおけるグルコサミンのアセチル化レベルはまだ決定されていません。 VEPSの構造を解明することは、その生物活性を理解する上で重要です。 |
| 表1 ラクトコッカス・ラクティスに属する乳酸菌が産生するEPSの糖組成 |
 |
| 3.2 EPSがマウスの体重と摂餌量に及ぼす影響 |
| 水道水中のVEPSの濃度は、VEPSグループのマウスの水分摂取量を測定することによって決定されました。 対照群のマウスは、9.0±0.3mLの水道水/日を飲んだ。 VEPS濃度が8.0μg/ mLまで増加すると、1日の水分摂取量は6.1±0.2mLに減少しました。 これらの結果に基づいて、水道水中の最大許容VEPS濃度を8.0μg/ mLと決定しました。
図2Aは実験計画を示しています。 約50μgのVEPSの1日摂取量は体重増加に影響しませんでした(図2B)。 実験を通して、VEPSグループのマウスは対照マウスと同じ量(3.1〜3.7g /日)の餌を食べました(図2C)。 通常の食餌には4.3%(w / w)の食物繊維が含まれていたため、マウスは1日あたり130〜160mgの食物繊維を摂取しました。 したがって、VEPSの摂取量(50μg/日)は食物繊維の摂取量よりもはるかに少ないです。 |
| Lim et al.,は、ケフィア粒から分離された5%(w / w)エキソポリサッカライド(EPS)を含む高脂肪食をC57BL / 6Jマウスに与え、EPS処理マウスの体重増加の減少を観察しました(Lim et al., 2017) 。 彼らの実験では、EPSの1日摂取量は140 mgであり、現在の研究と比較して約3000倍高い用量でした。 体重増加に関する異なる結果は、C57BL / 6Jマウスに対するEPSの影響を調査するために使用される食餌とEPSの用量の重要性を示しています。 |
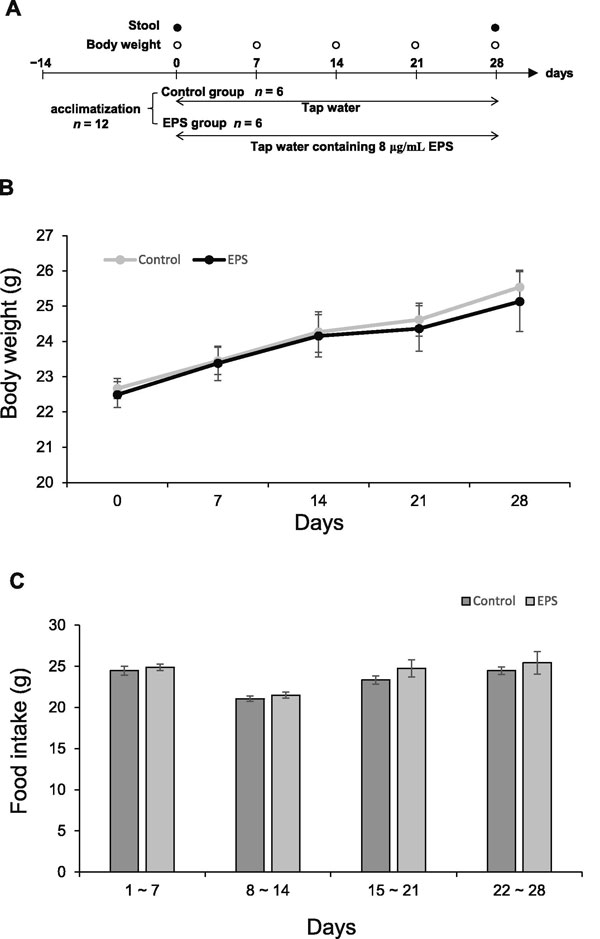 |
| 図2. 体重と食物摂取量 |
| A.動物実験のスケジュール。 B.体重。 すべてのマウスの週体重を測定した。 C.食物摂取。各マウスに事前に加重した食餌を与え、7日後の残りを加重して毎週の摂餌量を決定した。 データは平均±SEとして表されます。 |
| 3.3 マウスの糞便微生物叢に対するVEPSの影響 |
| 図3Aは、各糞便サンプルの属レベルでの細菌組成を示しています。 優勢な属は、ラクノスピラ科に属するもの、ムリバクルム属、および理由は不明ですが他のサンプルと比較して異常な微生物組成を示した0日目に7番のマウスから収集されたものを除くすべての糞便サンプル(全細菌の35〜80%)でバクテロイデス目に属するものでした。 主要な座標分析は、日とグループに基づく糞便サンプルの有意なクラスター化を示さなかった(図3F)。 系統樹分析では、サンプルのクラスター化は見られませんでした(図3G)。 これらの結果は、少量のVEPSが腸内細菌叢の組成に大きな変化を引き起こさなかったことを示しています。 |
| 興味深いことに、Muribaculumの相対的な存在量は、すべてのVEPS処理マウスで増加しました(図3A)。 VEPSグループマウスのMuribaculumの平均相対存在量は6.3%から16.2%に増加しました(図3D)。 他の優勢な細菌群では有意な変化は観察されませんでした(図3B、3C、および3E)。 |
| 以前はファミリーS24-7と呼ばれていたムリバキュラ科は、マウスの腸内で優勢な細菌群です(Seedorf et al., 2014; Lagkouvardos et al., 2016,2019)。 Muribaculumは、この科に属する最初に記載された属です。 最近、2つの種、M intestinale DSM28989TとMgordoncarteri sp nov(DSM 108194T)が、従来の方法で飼育されたC57BL / 6Jマウスの顔から分離されました(Miyake et al.,2020)。 これらの細菌細胞はグラム染色陰性で、厳密に嫌気性であり、オキシダーゼおよびカタラーゼ活性を欠いており、多糖類の分解を伴うさまざまな酵素をコードする遺伝子を持って います。 デキストラン硫酸ナトリウムによって誘発された大腸炎マウスモデルでは、ムリバキュラ科の相対的な存在量は炎症性サイトカインと負の相関があり、密着結合タンパク質とムチン2の発現レベルと正の相関がありました(Yan et al.,2019)。 したがって、ムリバキュラムに属する細菌種は、マウスの腸の正常な状態を維持するために重要であるように思われます。 |
| 腸内細菌叢に対する大量のEPSの経口強制飼養の影響が調査されました。 たとえば、Xu et al.,は、Lactobacillus buchneri TCP016によって生成された約8mgのEPSを雌のBALB / cマウスに14日間毎日強制経口投与しました(Xu, Aruhan et al.,2019)。 このEPS治療は、腸内細菌叢を大幅に調節しませんでしたが、リポ多糖/ D-ガラクトサミン(急性肝障害モデル)の腹腔内注射によって引き起こされる腸内細菌叢の変化を大幅に軽減しました。 老化したマウスモデルでは、Lactobacillus plantarum YW11によって生成された約1mg EPSを経口胃管栄養法で毎日投与すると、D-ガラクトース溶液を皮下注射したマウスの腸内細菌叢の多様性の低下が防止されました(Zhang et al., 2017)。 これらの報告は、EPSがこれらの疾患に見られる腸内毒素症の改善に有用であることを示唆しています。 ただし、成人の場合、1〜8 mg EPS /日は3〜24 g EPS /日に相当するため、大量のEPSは栄養補助食品への適用において非常に問題があります。 |
| 図3. 属レベルAでの糞便微生物叢の組成 |
VEPSの摂取前(0日目)と摂取後(28日目)の運用分類単位(OTU)の相対的な存在量。 |
| 3.4 マウスの糞便SCFAに対するVEPSの影響 |
糞便中のSCFAと乳酸を測定しました。予期せぬことに、対照群のマウスでは、酪酸の相対的な存在量が15.0±1.7%から9.5±1.3%に大幅に減少しましたが、VEPS群では、酪酸の相対的な存在量は変化しませんでした(図4C)。他のSCFAと乳酸は、28日後に有意な変化を示さなかった(図3A、3B、3D–G)。
酢酸、プロピオン酸、および酪酸は、腸内で消化されない繊維を代謝する細菌によって生成され、これらの糞便SCFAは、若いマウス(2〜3か月)と比較して高齢マウス(18〜20か月)で減少します(Lee et al 、2020)。 |
| 図4.糞便中のSCFAと乳酸の組成 |
| 酢酸(A)、プロピオン酸(B)、酪酸(C)、乳酸(D)、吉草酸(E)、イソ吉草酸(F)、およびイソ酪酸(G)の平均相対存在量は、 0日目と28日目の対照群マウス(対照)とVEPS群マウス(VEPS)。 データは平均±SEとして表されます。 アスタリスクは、統計的に有意な差を示します(p <0.05)。 |
| 4.結論 |
| 新しい単糖組成(VEPS)を持つ細胞外多糖がヴィーリから分離されました。 飲用に適した最高用量のVEPS(50μg/日)を、通常の食餌を与えられた若いオスのマウスに水道水を介して投与しました。 VEPSは、微生物叢の腸内のムリバキュラム属の相対的な存在量を特に増加させました。 摂食中の糞便中酪酸の減少が見られ、VEPSによって防止されました。 これは、正常な若いマウスの腸内細菌叢に対する低用量VEPSの影響に関する最初の報告です。 |
| 参考文献(本文中の文献No.は原論文の文献No.と一致していますので、下記の論文名をクリックして、原論文に記載されている文献を参考にしてください) |
| この研究はFood Chemistry: Molecular Sciences Available online 22 September 2021, 100042 に掲載されたExopolysaccharides from a Scandinavian fermented milk viili increase butyric acid and Muribaculum members in the mouse gutを、日本語に訳したものです。タイトルをクリックして原論文の全文を英文で読むことが出来ます。 |


