ケフィアライフをお勧めする中垣技術士事務所

| 文献調査(ケフィア:研究の最前線) |
ケフィアのペプチドプロファイリングは、スターターカルチャーまたはケフィアグレインによるカゼインから放出された236個のユニークなペプチドを明らかにします |
Jennifer Ebner et al., |
|
要約 ケフィアは、その健康促進効果を前提としているため、人間の栄養には長い伝統があります。 ケフィアの生理学的効果に対する生理活性ペプチドの潜在的な寄与を調査するために、ナノ超高性能液体クロマトグラフィーに結合したナノESI-LTQ-Orbitrap MSによってペプチドプロファイルの包括的な分析が行われました。 したがって、257のペプチドが同定され、主にβ-カゼインから放出され、続いてαS1-、κ-、およびαS2-カゼインが同定されました。 ほとんどの(236)ペプチドは、ケフィアでは一意に検出されましたが、生乳では検出されませんでした。これは、発酵ステップがタンパク質分解活性を未発酵乳に比べて1.7〜2.4倍増加させるだけでなく、ペプチド画分の組成も変化させることを示しています。 ミクロフローラの影響は、伝統的なケフィア粒または市販のスターターカルチャーから生産されたケフィアを分析することによって決定されました。 スターターカルチャーのケフィアは、230のペプチドシーケンスを特徴とし、127のペプチドを含むケフィアグレインのケフィアグレインよりも1.4倍高いタンパク質分解活性を示しました。 両方の品種で97のペプチドが一致することは、微生物叢の個々の組成に影響されない典型的なケフィアペプチドプロファイルの存在を示しています。 新しく同定されたペプチドの16は、アンジオテンシン変換酵素(ACE)阻害、抗菌、免疫調節、オピオイド、ミネラル結合、抗酸化剤、および抗血栓効果を含む生物活性として以前に説明されていました。
生物学的意義 本研究は、257のシーケンスを含むケフィアの包括的なペプチドプロファイルについて説明します。 ペプチドリストを使用して、ケフィアのACE阻害、抗酸化、抗血栓、ミネラル結合、抗菌、免疫調節、オピオイド活性を持つ16の生理活性ペプチドを特定しました。 さらに、ケフィアペプチドの大部分は原材料のミルクに内在的に存在していなかったが、微生物叢のプロテアーゼによってミルクカゼインから放出されたことが示された。 したがって、製品に固有です。 その結果、タンパク質分解活性とペプチドプロファイルの構成は、適用された微生物叢(グレインまたはスターターカルチャー)によって制御できます。 一方、ペプチドプロファイルのかなりの部分は、ケフィア一般に典型的であり、生産パラメーターから独立していることが確認されました。 要約すると、生成されたケフィアペプチドプロファイルは、その起源を明らかにし、ケフィア中の生理活性ペプチドを特定するのに役立ちました。これにより、この食品の健康上の利点の理解が進む可能性があります。 結果はさらに、ケフィアペプチドリストのサブセットをマーカーとして使用して、食品の信頼性を制御し、たとえば異なる種類のケフィアを区別できることを示しています。 |
はじめに |
|
酸味と酸味のあるさわやかな、わずかに炭酸とアルコールの発酵乳飲料であるケフィアは、人間の栄養に非常に長い伝統があります。 コーカサス山脈に起源を持ち、数千年もの間、健康への影響が想定されていたために消費されてきました[1]。 免疫効果[2,3]や抗酸化効果[4,5]のように、過去数年間、いくつかの健康促進効果は確かにin vivoで科学的に確認できます。 これらの多くは、微生物自体が最も重要な影響を与えるプロバイオティック機能だけでなく、菌体外代謝の外因性多糖類ケフィランやその他の副産物にも処方されています[6]。 しかし、発酵中に形成されるケフィアにおける生理活性ペプチドの役割についてはあまり知られていない。 乳タンパク質由来のペプチドは、機能性食品成分の豊富な供給源です。 とりわけ、オピオイド、免疫調節、抗酸化、および抗菌活性が報告されています[7]。 特に低血圧およびミネラル結合乳ペプチドは十分に研究されており、すでに機能性食品の生理活性成分として使用されています[8]。 内因性乳ペプチドの非標的プロファイリングにより、組成は予想よりもはるかに複雑であることが明らかになりました[9]。 Baumらは、確立された生理学的機能を持つ22個のペプチドを含む、生乳中の248個のカゼイン由来ペプチドを特定しました[10]。 別の質量分析アプローチを使用して、ダラスらは生乳中に159ペプチドの存在を明らかにしました[11]。 彼らの研究のほとんどのペプチドはカゼインに由来していたが、非典型的または少量の乳タンパク質からのペプチドも検出された。 発酵乳製品の製造中は、生乳に比べて生理活性ペプチドの数が増加し、使用した微生物のタンパク質分解作用によりペプチド画分の組成が変化すると考えられます[12]。 いくつかの研究では、伝統的な発酵乳製品の生理活性ペプチドを調査し、たとえば、マンチェゴチーズの主要なアンジオテンシン変換酵素(ACE)阻害ペプチドや、さまざまなチーズの種類の抗菌ペプチドを特定しました[13、14]。 さらに、Quiros et al。 山羊ケフィアに2つのACE阻害ペプチドがあることが明らかになりました[15]。 他のいくつかの発酵乳製品と比較して、ケフィアはより高いタンパク質分解率を示し[16]、したがって、生理活性ペプチドの優れた供給源となり得る 。 乳発酵のための異なるスターターカルチャーはペプチドの放出に影響を与えるため、発酵条件の選択により生理活性ペプチドの組成を制御することが期待できます。 ケフィアは伝統的にケフィア粒を使用して製造されています[6]。 穀物の微生物組成は非常に不均一であり、多くの要因、特に一次穀物の起源に依存します[17]。 主に、乳酸菌、ラクトコッカス、ロイコノストック、酢酸菌からの菌株だけでなく、さまざまな酵母も存在し、すべて多糖マトリックスに埋め込まれていますが、全体的な微生物学的組成はまだ完全に解明されていません[1]。 異なる種の牛乳を発酵に使用できます。 ケフィア穀粒を直接接種するか、生産を容易にするために穀粒から調製した母培養物を接種します。 ただし、工業生産では、大部分が明確に定義されたスターターカルチャーが適用されます。 本研究の目的は、牛乳からのケフィアのペプチドプロファイルの包括的な分析でした。 結果のペプチドデータベースは、ケフィアの生理活性ペプチドを識別するために使用できます。 ペプチド組成は、発酵に使用する微生物叢によって調整できるため、2つの代表的なケフィア品種を比較しました。ケフィア粒で調製した伝統的な製品と、工業的に使用されるスターターカルチャーで調製したケフィア製品です。
|
材料および方法 |
2.1 ケフィアの生産 |
| この研究で使用したケフィア粒は、トルコのアクデニズ大学の食品工学部から入手したものです。 ケフィア粒は、滅菌乳(4%)への接種とその後の25°Cでのインキュベーションによって活性化されました。 24時間後、ケフィア粒をふるいにかけ、新鮮な滅菌乳に入れました。 このステップは、3日間続けて繰り返されました。市販のケフィアスターターカルチャーは、Danisco Biolacta(Olztyn、ポーランド)から購入し、Lactococcus lactis ssp。、Leuconostoc ssp。、Streptococcus thermophilus、Lactobacillus ssp。、ケフィアイースト、およびケフィアグレインマイクロフローラから構成されていました。 ケフィアの製造に使用される牛の生乳は、0.1%の脂肪にスキムされました。 標準化された牛乳サンプルをプレート交換加熱システムで90°Cで5分間加熱し、その後25°Cの培養温度まで冷却し、上記のケフィア粒または市販のスターターカルチャーを接種しました。 接種後、pHが4.8に下がるまで牛乳サンプルを25°Cでインキュベートしました。特に断りのない限り、実験は2回行った。 |
| 2.2 微生物学的分析 |
| 微生物学的分析は、ケフィアの各サンプルについて2つずつ実行しました。微生物学的分析用の希釈液を調製するために、リンガー溶液(1/4強度)が使用されました。 Plate Count Agar(PCA; Merck、Darmstadt、Germany)で評価された生存微生物の総数。 PCAプレートを30℃で2日間好気的にインキュベートしました[18]。 乳酸菌のカウントは、MRS培地(pH 6.5±0.2; Merck、Darmstadt、Germany)で、嫌気性条件下(5%CO2)で30°Cのインキュベーション温度で3日間行いました。 ラクトコッカス菌の計数は、M17培地(Merck、ダルムシュタット、ドイツ)で、嫌気性条件下(5%CO2)のインキュベーション温度30°Cで3日間行われました[19]。 酵母菌数は、酵母に対して選択的である酵母エキスグルコースクロラムフェニコール(YGC)寒天培地で、好気性条件下で3〜5日間、25°Cで培養しました[20]。 Leuconostocの選択培地であるMayeux、Sandline and Elliker(MSE)寒天を使用して、22°Cのインキュベーション温度で5日間および好気性条件でLeuconostocを列挙しました[21]。 酢酸菌数は、Acetobacter peroxydansmedium(APM)を用い、25°Cで3〜5日間好気的に培養しました[20]。 |
| 2.3 タンパク質分解活性の決定 |
| ケフィアの種類ごとに2つの独立したバッチでの微生物のタンパク質分解活性を、アミノ基の増加した含量を定量化するためにo-フタルジアルデヒド(OPA)法によって放出されたアミノ酸とペプチドの総量を測定することにより、二重に評価しました[22]。 この目的のために、0.95 gの四ホウ酸ナトリウム、0.5 gのドデシル硫酸ナトリウム、および0.1 mLの2-メルカプトエタノールを水で希釈して、最終容量を50 mLにしました(溶液A)。 次に、40 mgのOPAを1 mLのメタノールに溶解しました(溶液B)。 溶液AとBを混合しました(溶液C)。 ケフィアサンプルを30°Cで1分間ボルテックスし(1 mL)、2.28 mLの0.68 Nトリクロロ酢酸に加えました。 混合物を室温で10分間保持し、16,200 gおよび4℃で10分間遠心分離した。 遠心分離後、50μLのアリコートを上澄みから取り出し、1.5 mL石英キュベット内の溶液C 1 mLに直接加えました。 溶液を短時間混合し、340 nmでの吸光度を測定しました。 生乳と未発酵加熱脱脂乳の4つのサンプルをそれぞれ同様に分析して、発酵前のタンパク質分解活性を監視しました。 |
| 2.4 ペプチド抽出 |
| まず、サンプルを1100 g、4°Cで30分間遠心して、凝固したカゼインを除去しました。 上清を、直径0.22μmの無菌膜フィルター(PVDF、カール・ロス、カールスルーエ、ドイツ)を使用して濾過した。 ケフィアの種類ごとに1つの代表的なサンプルの水溶性ケフィア画分を、C18-SPE(200 mg C18-E、3 mL、Phenomenex、アシャッフェンブルク、ドイツ)によるペプチド抽出に使用しました。 この目的のために、1 mLのサンプルを2 mLのACN(LC–MSグレード、VWR International、ダルムシュタット、ドイツ)で事前調整されたSPEカートリッジに 精製水中の0.1%TFA(HPLCグレード、Sigma-Aldrich、タウフキルヒェン、ドイツ)2 mLロードしました。。 ペプチドの溶出は、2 mLの0.1%TFAで洗浄した後、2 mLのACNと0.1%TFAの混合物(60:40)で達成されました。これを両方のサンプルで3回繰り返しました。 MALDI-TOF-MSの場合、ペプチド抽出物を直接適用しました。 ハイフネーションされたnano-ESI-MS / MSを使用したnano-ultra-HPLC(UPLC)による分析では、最初に抽出物を-80°Cで凍結し、SpeedVacシステム(SPD 121P、Thermo Fisher Scientific、ブレーメン、ドイツ)を使用して乾燥しました。 。 抽出物を0.5%ギ酸(FA)を含む60%ACNに溶解し、0.1%FAを含む3%ACNで25 nmol / mLの濃度に希釈しました(平均分子量1500 Daの想定)。 注入前に、ホエータンパク質を除去するために10 kDaカットオフの遠心フィルターユニット(Merck、ダルムシュタット、ドイツ)を使用して限外濾過を行い、続いてサンプルを1:5希釈しました。 |
| 2.5 MALDI-TOF-MS |
| MALDImatrixは、5 mMのリン酸二水素アンモニウムを含むACNと0.1%TFAの60:40混合物1 mL中の5 mgのα-シアノ-4-ヒドロキシケイ皮酸(HCCA、Sigma-Aldrich、タウフキルヒェン、ドイツ)で構成されていました。 サンプルをマトリックスと均等に混合した後、それぞれ0.7μLのアリコートを粉砕したスチールターゲットプレート(Bruker Daltonik、ブレーメン、ドイツ)にスポットし、風乾しました。 MALDI-TOF-MSは、窒素レーザーを備えたBruker Autoflex質量分析計で、ポジティブリフレクターモードで、遅延抽出(140 ns)の後に実行されました。 加速電圧は20 kVに設定した。 すべてのサンプルについて、600から5000 Daの質量範囲の異なるスポット位置から300の単一スペクトルが自動的に生成され、合計されました。 外部較正は、Brukerペプチド較正標準IIを使用して実行されました。 生成されたスペクトルに対して、BrukerのflexAnalysisソフトウェアによってベースラインの減算とスムージングを実行し、S / N比が6以上の信号にピークピッキングを適用しました。 |
| 2.6 nano-UPLC-nano-ESI-MS / MSによる分析 |
| ペプチド分離は、nanoAcquity UPLC(Waters、エシュボルン、ドイツ)で、LTQ Orbitrap XL ETD質量分析計とnano-ESIソース(Thermo Fisher Scientific、ブレーメン、ドイツ)を組み合わせて行いました。 実験は両方のケフィア品種について三重に行われた。 各ペプチドサンプルの10μLの一部を、10μL/分の流速でトラップカラム(nanoAcquity対称C18、180μm×20 mm、粒子径5μm)にロードし、nanoAcquity UPLC BEH 130カラムを使用して分離しました(C18、75μm×100 mm、粒子径1.7μm)。 流速を400 nL / minに設定し、次のようにグラジエント溶出により分離を達成しました:0〜1.0分3%B、1.0〜1.1分3〜9%B、1.1〜4.0分9〜9.9%B、4.0〜 14.0分9.9–17.1%B、14.0–14.5 17.1–18%B、14.5–14.6分18–20.7%B、14.6–17.7分20.7–22.5%B、17.7–20.7分22.5–25.6%B、20.7–25 、7分25.6–30.6%B、25.7–28.5分30.6–37.8%B、28.5–31.5分37.8–81%B、0.1%FA水溶液として溶出液A、0.1%FAを含むACNとして溶出液B。 トランスファーキャピラリーの温度は200°Cでした。 オンライン結合されたシリカコーティングナノESIエミッター(新目的、ベルリン、ドイツ)を使用して、チューブレンズ電圧を120 Vに、イオンスプレー電圧を1.5 kVに設定しました。 プレカーサーイオンサーベイスキャンは、m / z 400–2000の質量範囲で、オービトラップ分解能60,000でポジティブモードで実行されました。 プロダクトイオンスキャンの場合、各MSスキャンの6番目に豊富なイオンにCIDが適用され、最小荷電状態は+2(分離幅2.0 Da、活性化Q 0.25、正規化された衝突エネルギー35%、活性化時間30 ms)。 プロダクトイオンスキャンの結果は、SwissProtデータベース(Release 2013_01)に対するMASCOT検索にかけられ、ペプチドが同定されました。 検索パラメーターは次のとおりでした:分類学の哺乳類、酵素なし、切断の欠落なし、修正された修飾なし、変数修飾としての酸化(メチオニン)とリン酸化(セリン、スレオニン)、前駆体イオンの10 ppm質量許容値、およびプロダクトイオンの0.8 Da、最小電荷+2。 結果の評価は、Proteome Discovererソフトウェア(Thermo Fisher Scientific、Dreieich、ドイツ)によって実行されました。 信頼性の高いペプチド同定のために、次のアプローチを適用しました。スコアが> 10のすべてのペプチドを事前選択しました。次に、これらの候補のペプチド割り当てのランクが「1」であり、割り当てられたペプチドがウシ由来のものであるかどうかを確認しました。 これらの2つの条件が満たされた場合、プロダクトイオンスペクトルは、計算されたフラグメントイオンの質量と比較することにより、手動で検証されました。 |
| 2.7 選択したHPLCフラクションの直接注入ESI-MS / MS実験 |
| RP-HPLCは、Zorbax Eclipse XDB C8カラム(4.6×150 mm、粒子径5μm、細孔径80Å、Agilent、Boeblingen、ドイツ)を備えたJASCO HPLC(JASCO Deutschland、Groß-Umstadt、ドイツ)、とMD-1510多波長検出器で実行しました。 この目的のために、水溶性ケフィア画分を、10 kDaのカットオフを備えた遠心フィルターユニット(メルク、ダルムシュタット、ドイツ)による追加の限外濾過工程の後に使用した。 このペプチド含有溶液の50μLの一部を注入し、流速を0.5 mL / minに設定しました。 分離は、溶離液A(0.1%TFAを含む5%ACN)での最初の5分間の後、0〜45%溶離液B(0.1%TFAを含む95%ACN)の直線勾配を使用して60分間行いました。 目的のペプチドを含む1つの画分を、さらに分析するために51.8から59.4分の間に収集しました。 この画分を等量の2つの部分に分け、–80°Cで凍結し、SpeedVacで乾燥させました。 画分の一部をMALDI-TOF-MSで分析して、この画分に目的のペプチドが存在することを確認しました。 この目的のために、乾燥したサンプルを10μLのMALDIマトリックスに溶解し、上記のように分析した。 含まれているペプチドのシーケンス情報を取得するために、乾燥したサンプルを0.5%FAを含む60%ACN 30μLに溶解した後、このフラクションの他の部分を使用して、LTQ Orbitrap XL ETD質量分析計に直接注入しました。 50%ACN、25%メタノール、1%FAを含むESIバッファーで1:50に希釈します。 前述のように、気相分画データ依存取得(DDA)メソッドを使用してデータを記録しました。 MSスペクトルは、m / z 400で100,000のターゲット質量分解能でFT-MSスキャンモードで取得されました。 5つのm / zセグメント(m / z 400–551、549–601、599–801、799–1001、および999–2000)内で連続DDA実験(上位5つ)が実行されました また、指定されたオフセット(それぞれm / z 0、0.1、0.2、0.3、および0.4)は、リニアイオントラップでの前駆イオンの分離に使用されました[23]。 分離幅は、最初の2つのセグメントではm / z 1に設定され、他の3つのセグメントではm / z 1.5に設定されました。 CID正規化衝突エネルギーは、すべてのセグメントで30%に設定されました。 各セグメントの長さは3分で、動的除外は45秒間続きました。これにより、合計実行時間は15分になりました。 その他のMSパラメータは上記のとおりです。 各サンプルについて、分画とそれに続く測定を3回繰り返して行いました。 ペプチドの同定は、上記の検索パラメーターを使用して、SwissProtデータベースのMASCOT検索によって実行されました。 割り当てられたペプチド配列は、一致の確認のために手動で検証されました。 |
| 2.8 ステージチップ抽出とMALDI-TOF-MSによる比較ペプチドプロファイル分析 |
| ケフィアのペプチドプロファイルの再現性を調査するには、同一条件下で製造されたサンプル、ケフィアの種類ごとに4つのサンプルが14か月の間に独立して製造され、分析にかけられました。 ペプチドは、いくつかのマイナーな変更を加えてバウメット[25]によって修正されたRappsilber et al [24]による段階チップマイクロ抽出を使用して抽出されました。 C18エンポアディスク(3 M、ドイツ、ノイス)の3つの層を生検パンチ(直径1 mm、KAI Medical、ゾーリンゲン、ドイツ)で打ち抜いた そして、ステージチップアセンブリ用に1〜20μLのepTIP(Eppendorf、ハンブルク、ドイツ)に移しました。 調整ステップとして、50μLのACNと0.1 TFAを連続的にロードし、1840 g、25°Cで1分間遠心分離して遠心分離しました。 続いて、50μLの水溶性ケフィア画分と5分の遠心分離時間でサンプルをロードするための手順を繰り返し、さらに次の洗浄ステップのために50μLの0.1%TFAと3分の遠心分離を繰り返しました。 溶出は、ACNと0.1%TFAの60:40混合液10μLと3分の遠心分離で達成されました。 上記のように実施されたペプチド抽出およびその後のMALDI-TOF測定は、各サンプルについて3回行われた。 |
| 3. 結果 |
| 3.1 微生物学的分析およびタンパク質分解活性 |
| 本研究は、質量分析法によってケフィアのペプチドプロファイルを評価することを目的とした。 次に、ペプチドプロファイルを使用して、生物活性成分を明らかにし、適用された微生物のタンパク質分解活性に関する情報を取得します。 スターターカルチャーはペプチドの形成に大きな影響を与える可能性があるため、2種類のケフィアの品種を作って分析しました。 1つの製品では、熱処理したスキムミルクを市販のケフィアスターター培養液で発酵させ、ケフィア粒を他のタイプのサンプルに使用しました。 他のすべての生産パラメータは両方の品種で同じでした。 微生物学的組成の特徴は、ケフィアミクロフローラの主要成分、すなわち、生存可能な中温性好気性細菌、乳酸桿菌、乳酸球菌、ロイコノストック、酢酸菌、酵母[1]を監視し、各グループに選択培地を使用してコロニー形成単位(CFU)を数えることでした。 )。 図1は、微生物学的分析の結果を示しています。 中温好気性細菌の総数は、市販のスターターカルチャーで生産されたケフィアの方がわずかに多かったが、乳酸桿菌、乳酸球菌、ロイコノストック、および酢酸菌では有意差は観察されなかった。 酵母の含有量は、ケフィア穀粒で発酵させた牛乳について、有意に高い数のCFUを示しました。 観察された微生物組成は、Ender [26]およびKesenkaşらの以前の研究とよく一致しています。 [27]。 市販のスターターカルチャーの製造中に細胞をストレスにさらすフリーズドライは、細胞生存率の損失をもたらします[28]。 したがって、凍結乾燥した乳酸菌とケフィア穀粒からの酵母を含むスターターカルチャーで生産されたケフィアは、特に酵母の含有量に関して、ケフィア穀粒で直接生産されたケフィア[6]よりも微生物の数と種類が少ないです。 その結果、ケフィアの酵母菌数が減少すると、ケフィアパッケージの膨潤量が制限される可能性があります。これは、乳業で重要な問題です[30]。 |
| 図1 –中温好気性細菌、乳酸桿菌、乳酸球菌、ロイコノストック、酢酸菌、および市販のスターターカルチャーによって生産された酵母のそれぞれのコロニー形成単位(CFU)またはケフィア粒。 2つの独立したプロダクションのCFUの平均値±SDが、それぞれ2つずつ測定されて示されています。 * p <0.05; n.s. 有意ではない(対応のないスチューデントt検定)。 |
| サンプルのタンパク質分解活性は、OPA法で評価しました。 結果は、穀物によって生産されたサンプルと比較して、商業スターターカルチャーによって生産されたケフィアの1.4倍有意に高いタンパク質分解活性を明らかにしました(表1)。 加熱処理後の生乳と未発酵脱脂乳についても、タンパク質分解活性を監視しました。 両方の未発酵乳サンプルの値は著しく低く、両方のタイプのケフィアの発酵中にかなりのペプチドが放出されたことを示しています。 生乳の熱処理によりタンパク質分解活性が大幅に増加しましたが、ペプチドの放出に対する発酵の影響はかなり高かったです。 |
 |
| 表1 – o-フタルジアルデヒド法で測定され、340 nmでの吸収単位として表されるタンパク質分解活性。生乳と未発酵の加熱脱脂乳の4つのサンプルの平均値とSD、およびそれぞれ市販のケフィアスターターカルチャーまたはケフィアグレインで発酵した乳の2つのサンプルの平均値とSDが表示されます。各サンプルを2回ずつ分析しました。 |
| 3.2 ケフィアのペプチドプロファイル分析 |
| 次に、600から5000 Daの範囲のz / zで直接MALDI-TOF測定を行って、より詳細なペプチド分析を行いました。 図2は、両方のケフィア品種の典型的なMALDI-TOF-MSスペクトルを示しています。 ほとんどの信号は800から2200 Daの範囲で検出されました(図2、挿入されたウィンドウ)。つまり、約7〜20アミノ酸のペプチド長に対応します。 市販のスターターカルチャーで生産されたサンプルでは49のペプチドが検出されましたが、ケフィア粒サンプルでは34の信号が観察されました。 両方のケフィアタイプは、2つの最も豊富なペプチドatm / z 1718.0とm / z 1881.1を含むシグナルの半分以上を共有しましたが、主要な類似性を示唆していますが、スターターカルチャーのタイプに応じたペプチド放出の違いも示唆しています。 MALDI-TOF-MSは直接、つまりペプチド分画を行わずに実行されたため、イオン抑制により、イオン化プロセス中にペプチドの負の識別が発生する可能性があります。 それにもかかわらず、MALDITOF-MSによって記録されたペプチドプロファイルは、主要なペプチドの優れた概要を提供します。 より多くのケフィアペプチドを検出し、それらの同一性を明らかにするために、ナノUPLC分離後のESI-LTQ-Orbitrap-MSと、SwissProtデータベースのaMASCOTデータベース検索を組み合わせて、フラグメントスペクトルの解釈を行いました。 主なウシタンパク質の結果として生じるすべての割り当てられたペプチド配列は、明確な同定を達成するために手動でチェックされました。 したがって、253の異なるペプチドシーケンスが確認され、すべてカゼインフラグメントを表しています。 ほとんどのペプチドは、β-カゼイン(107)に由来し、次にαS1-カゼイン(56)、κ-カゼイン(53)、およびαS2-カゼイン(37)が続き、62のペプチドがモノまたはジリン酸化されています。 シーケンスカバレッジは、β-カゼインで98%、κ-カゼインで83%、αS1-カゼインで72%、αS2-カゼインで約60%でした。 ただし、プロダクトイオンスペクトルの品質が不十分なため、MALDI-TOFmassスペクトルの2つの最も強い信号(ペプチドatm / z 1718.0および1881.1)のシーケンス割り当ては失敗しました。 したがって、ケフィアペプチドは、HPLCによって分画された。 これら2つの主要なペプチドを含む画分は、ESI-LTQ-Orbitrap MSによる追加の直接注入測定にかけられました。 シグナルのペプチド配列は、QEPVLGPVRGPFPIIVおよびYQEPVLGPVRGPFPIIVとして確認できます。どちらも、それぞれβ-カゼインf194–209およびf193–209のC末端領域からのフラグメントです。 この実験により、さらに2つのペプチド、すなわち、同じ領域に由来するf192–209とf191–209が同定されました。 直接注入実験からのこれら4つのペプチドを含め、表2に示すように、ペプチドシーケンス、前駆体タンパク質、位置、および起源を含む257のペプチドが同定されました。 図3は、親タンパク質の検出された切断部位をまとめたもので、放出されたペプチドがタンパク質配列間で均一に分布していないことを示しています。 代わりに、他の部分よりも多くのペプチドが放出されるすべてのタンパク質に異なる部分があります。 β-カゼインでは、K28–K29、K29–I30、Q175–K176、およびQ182–R183は、ケフィア菌叢による分解が特に起こりやすいようです。 αS1-カゼインでは、L40–S41およびQ130–Q131がタンパク質分解に対して高い感受性を示します。 κ-カゼインでは、N53–Q54、A65–A66、およびE151–V152が好ましい切断部位ですが、E12–S13、K21–Q22、およびE133–N134は特にαS2-カゼインで影響を受けます。 大多数のラクトコッカスプロテイナーゼが標的とする切断部位(図3の黒い三角形)と比較すると、ケフィアペプチドで観察されたすべての切断部位の約17%が、これらの酵素の活性によって説明できることがわかります。 ケフィアのカゼイン分解に関与する他の微生物のプロテイナーゼは、おそらく残りの切断部位での活性に関与していると思われます。 |
| 図2 – m / z 600〜5000の質量範囲の市販のケフィアスターターカルチャーで発酵させた牛乳(A)とケフィアグレインで発酵させた牛乳(B)のMALDI-TOF質量スペクトル。 各スペクトルの最も強い信号は、スペクトルの正規化に使用されました。 挿入されたウィンドウは、800〜2200 Daの範囲の信号を拡大します。 2つの最も強い信号m / z 1718.0およびm / z 1881.1は、両方のスペクトルでマークされます。 |
| 図3 –親タンパク質αS1-、αS2-、β-、およびκ-カゼインのアミノ酸配列(1文字のコード)。 矢印は、同定された放出ペプチドを表します。 マークされたセリン残基は、可能なリン酸化部位である[33、35]。 黒い三角形は、大部分の乳酸球菌プロテイナーゼに共通する切断部位を示しています[36]。 |
| 3.3 ケフィアペプチドプロファイルに対するスターターカルチャーの影響 |
| 図4に、4つの親タンパク質のそれぞれについて、分析された両方のケフィアタイプ間のペプチドマッチを合計して個別に示します。 両方のサンプルに多数のペプチドが存在し(257のうち97)、ケフィアに典型的なペプチドの存在が示されました。 市販のスターターカルチャーによって生成されたケフィアの記録されたペプチドプロファイルは、230の異なるペプチドで構成されていましたが、ケフィア粒のケフィアでは124のペプチド配列が同定されました。 一般的なパターンは4つのカゼインすべてに似ていますが、 つまり、ほとんどのペプチドは、市販のスターターカルチャーケフィア(133/257)のペプチドームでのみ同定されました。 一方、ケフィアの両方のタイプ(97/257)で多数が共有されており、ケフィア粒サンプルに固有のペプチドシーケンスはわずかでした(27/257)。 |
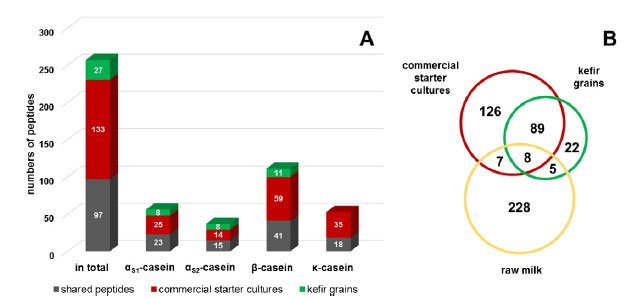 |
| 図4 –異なるサンプルタイプ間の識別されたペプチドの分布 数値は、市販のケフィアスターターカルチャーで発酵させた牛乳、またはケフィアグレインで発酵させた牛乳と、すべての親タンパク質で識別されたペプチドの合計量を示しています。 すなわち、αS1-、αS2、β-およびκ-カゼイン(A)、およびベン図(B)の生乳のペプチドプロファイルとの比較[10]。 |
| 図5 –市販のケフィアスターターカルチャー(A)またはケフィアグレイン(B)で発酵させた牛乳の親タンパク質αS1-、αS2-、β-、およびκ-カゼインのシーケンスで識別されたペプチドの起源。 色は、アミノ酸を含むペプチドの数を表しています。 |
| 図5のヒートマップは、両方のケフィア品種の対応する親タンパク質のアミノ酸配列におけるペプチドの起源を示しています。 赤色はそれぞれの領域でのタンパク質分解の優先的な部位を示し、濃い緑色はタンパク質のこの部分に由来する同定されたペプチドがないことを意味します。 どちらのタイプのケフィアでも、β-カゼインアミノ酸28–56の領域から放出されるペプチドの数が最も多いことがわかります。 その他の一般的なホットスポットは、κ-カゼインに関して(図5の赤と黄色の部分)アミノ酸164〜175とβ-カゼインのC末端領域、αS1カゼインのシーケンスでは129〜142、αS2カゼインのシーケンスでは13〜21および123〜147、42〜53です。 両方のサンプル間の最大の違いは、位置106〜119のβ-カゼイン、αS1カゼインシーケンスのアミノ酸41〜55、κ-カゼインの21〜33および114〜140で見つかりました。 市販のスターターカルチャーで生産されたケフィアでは、これらの領域から比較的多数のペプチドが放出されましたが、ケフィア粒で発酵させた牛乳ではペプチドがまったく検出されなかったか、数個しか検出されませんでした。 どちらのケフィア品種でも、次の領域から放出されるペプチドは見つかりませんでした:αS1-カゼインのアミノ酸64〜69、95〜104、124〜128、および145〜179、N末端およびアミノ酸34〜 αS2-カゼインで63、96–113、161–174、185–189、β-カゼインとN末端でアミノ酸69–72、κ-カゼインでアミノ酸80–95(濃い緑色の部分)図5)。 要約すると、両方のケフィア品種のペプチドプロファイルはほぼ同じですが、市販のスターターカルチャーによる発酵後、ケフィアでより多くのペプチドを同定できます。 |
|
| 表2 –ケフィアのペプチドプロファイル。 シーケンスは1文字のコードで示され、ペプチドの質量はDaで示されています。市販のスターターカルチャーで発酵させた牛乳中の同定されたペプチドとケフィア粒が提示され、生乳のペプチドプロファイルとの一致も表示されます[10、11]。 |
| 3.4 ケフィアと生牛乳のペプチドプロファイルの比較 |
| 表1は、未発酵乳の発酵後のタンパク質分解活性が1.7〜2.4倍高いことを示しています。 しかし、最近の研究では、牛の生乳の最初のペプチドプロファイルでさえ非常に複雑であることが示されています[10、11]。 したがって、ペプチド画分の組成が発酵によってどの程度変化するかについても調査した。 Baumらは、αS1-カゼインから生乳の内因性ペプチドを129個、β-カゼインから63個のペプチド、αS2-カゼインから得た54個のペプチド、それぞれκ-カゼインとβ-ラクトグロブリンから1個のペプチドを同定した[10]。 Dallas et alの結果は、ほとんどのペプチドがαS1-カゼイン(約40%)に由来し、続いてβ-カゼインとαS2-カゼイン、および少量の乳タンパク質からのいくつかのペプチドが続く、さまざまな生乳サンプルに対して同様の分布を示しました[11]。 しかし、ケフィアサンプルで識別されたペプチドのうち21のみが以前に生乳の成分として識別されたのに対し、236はケフィアに固有でした(表2、図4)。 図4は、発酵中のペプチドプロファイル全体のほぼ完全なシフトを示しています。 さらに、同定されたペプチドの質量範囲の変化が観察されました:ミルクペプチドの質量は約800から4400 Daの間ですが、ケフィアで同定されたペプチドの質量は約2700 Daに等しいかそれ以下です。 市販のスターターカルチャーからケフィアで同定されたペプチドの数は、牛乳のペプチドームでのペプチドの数と同様です。 ケフィア粒からのケフィアの場合、それはさらに低いです。 したがって、タンパク質分解活性が高いため、発酵後のペプチドの濃度が高くなることを示唆していますが、複雑さの増加は見られませんでした。 |
| 3.5。 ケフィアペプチドプロファイルのバッチ間変動 |
| 発酵中のペプチド形成の再現性を調査するために、両方の種類のケフィア、つまり市販のスターターカルチャーまたはケフィア粒からの4つの独立して製造されたサンプルのペプチドプロファイルを、MALDI-TOF-MSで比較分析しました。 質量分析の前に、この方法はシンプルで高速であり、MALDI-TOF-MSに最適であることが証明されているため、ペプチドはステージのヒントによって抽出され、再現可能な結果と多くのサンプルの並行処理が可能です[31]。 検出された質量のリストを比較して、共通の特徴や異なるバッチ間の違いを特定しました。 市販のスターターカルチャーの場合、サンプルあたりの重複するペプチドの割合、つまり2つ以上のサンプルで検出されたペプチドは、83±15%でした。 したがって、17±15%のごく一部のみがサンプル固有のものでした。 ケフィア粒のサンプルは同様の画像を示しました:平均して、サンプルあたり83±7%の信号が2つ以上のサンプルで検出されましたが、17±7%はサンプル固有で可変的でした。 これらの発見は、ケフィアのペプチドプロファイルの再現性が高く、両方のケフィア品種のバッチ間変動が比較的低いことを示しています。 |
| 4 議論 |
| 4.1 ケフィアペプチドプロファイルの分析 |
| 本研究では、ケフィアのペプチドプロファイルの包括的な分析を行いました。 これまでに、ケフィアの生産中に放出されたペプチドを分析した研究は数件しかありませんが、ケフィアではタンパク質分解活性を持つ微生物叢の存在が以前に確認されています[32]。 Kahalaらによる初期の研究では、さまざまな発酵乳製品のHPLC-UV分析によって、タンパク質分解率と生成されたペプチドプロファイルを比較しました。 彼らの調査により、ケフィアのタンパク質分解率が高く、7つのペプチドの同定が可能になりました。これらはすべてβ-カゼインフラグメントです[16]。 さらに、ファーンワースの研究では、ケフィアに含まれるほとんどのペプチドの分子量が5000 Da以下であることが示されています([6]で引用されている未発表のデータ)。 Quirósらは、ヤギのケフィアのACE阻害特性に焦点を当て、RP-HPLC–MS / MSによって16のペプチドを同定しました[15]。 私たちの知る限りでは、ケフィアの包括的なペプチドーム分析はまだ行われていません。 したがって、本研究は、ケフィアの製造中に放出されたペプチド全体を非対象アプローチで分析する最初の研究です。 結果はタンパク質分解プロセスの理解を改善し、生理活性成分の発見の基礎として役立ちます。 |
| 同定された257のペプチドのうち、約43%がβ-カゼイン、22%がαS1-カゼイン、21%がκ-カゼイン、14%がαS2-カゼインに由来します。 他の乳タンパク質と比較して、カゼインは全乳プロテオームの約80%と明確な有病率を示し、34%αS1-カゼイン、25%β-カゼイン、9%κ-カゼイン、8%αS2-カゼインに分けられます。 残りはβ-カゼイン分解産物です。 乳タンパク質全体の20%を占めるホエイタンパク質の主成分は、それぞれ9%および4%の含有率のβ-ラクトグロブリンとα-ラクトアルブミンです[33]。 微生物学的タンパク質分解がすべてのタンパク質で同じ程度にランダムに発生する場合、ケフィアペプチドの起源は牛乳のタンパク質組成を反映しますが、これは明らかにそうではありません。 したがって、特にβ-カゼインは、ケフィア菌叢による微生物学的分解を受けやすいはずです。 驚くべき事実は、サンプルに主要な乳清タンパク質からのペプチドが見つからなかったことです。これは、球状構造のためにプロテアーゼに対する耐性が優れていることで説明できます。 対照的に、カゼインは、その高いプロリン含有量によって部分的に引き起こされる柔軟性のために、おそらく微生物にとってより利用しやすい[34]。 |
| すべてのカゼインはリンタンパク質です。 αS1-カゼインの主要な変異体には、8〜9個のリン酸化部位があります。 αS2-カゼイン配列には11個のリン酸基がありますが、αS2-カゼインファミリーの一部のメンバーはホスホセリン残基の数が異なります。 β-カゼインは通常5つのセリン結合リン酸を含み、 一方、κ-カゼインは主に一リン酸化されている[33]。 現在の研究では、62のリン酸化ペプチドが確認されました。52リン酸化されたリン酸化ペプチドと10のペプチドは2つのリン酸基を持っています。 すべてのリン酸化部位は、現在の知識およびUniProtデータベース(http://www.uniprot.org)に記載されているリン酸化部位と一致していました[33、35]。 ケフィアの生産中に以前にリン酸化されたペプチドからリン酸基が失われるのは、ほんの数例でしか観察されなかった。 |
| 私たちの結果は、発酵が未発酵乳と比較してペプチドの1.7〜2.4倍の追加放出を引き起こしたことを明確に示しています。 さらに、ペプチド形成への熱処理の小さいが有意な寄与が検出された。 したがって、発酵プロセスは、生理活性ペプチドの存在から生じるミルクの健康促進効果を改善すると結論付けることができます。 |
| 加熱と発酵の両方のプロセスにより、ペプチドプロファイルが主にαS1-カゼインペプチドからより多くのβ-およびκ-カゼインフラグメントにシフトしました。 新しいペプチドの生成と他のペプチドの分解が組み合わさったことが原因と考えられます。 生乳[10,11]とケフィアのペプチドプロファイルを比較すると、一般的な成分はわずかしかありませんが、同定されたペプチドの236はケフィアに固有のものでした。 その結果、発酵プロセス中に生理活性ペプチドの濃度が増加するだけでなく、生理活性プロファイルも牛乳と比較してケフィアで完全に異なる場合があります。 21のペプチドを除いて、全体のペプチドプロファイルは発酵中に変化しました。 したがって、ペプチド形成のプロセスは実質的に異なる必要があります。 牛乳ペプチドは主にプラスミン、カテプシンB、D、Gなどの内因性プロテイナーゼの作用によって生成されますが、微生物学的分解は発酵製品で重要な役割を果たします。 ラクトコッカスでは、プロテイナーゼの2つの一般的な特異性クラスが報告されています。 PIの主要な基質はβ-およびκ-カゼインですが、PIIIはさらにαS1-カゼインの活性を示します[36]。 これは、乳酸菌による発酵中のβ-およびκ-カゼイン断片の特に高い放出を説明します。 |
| 放出されたペプチドの切断部位を詳しく見ると、形成メカニズムを洞察できます。 一部の切断部位が他よりも頻繁に出現するという事実は、いくつかの微生物学的プロテイナーゼの特異性に関連している可能性があります。 切断部位E–S、LS–Q、S、E–V、E–D、E–N、Q–Q、Q–R、E–K、N–S、E–E、Q– K(頻度の降順で表示)は10回以上観察され、酸性残基グルタミン酸またはそのアミドグルタミンのC末端切断に対する活性酵素の優先度を示しています。 一連の相同ペプチドの出現によるエキソペプチダーゼの作用の兆候もあります。 β-カゼインのf29–36、f29–37、f29–39、f29–40、f29–41、f29–42、およびf29–43。 図3に示すように、一部の切断部位は以前の報告に準拠しており、大部分のラクトコッカスプロテイナーゼ(黒い三角形)に典型的です[36]。 ただし、これらのプロテアーゼ効果はケフィアの切断パターンを不完全にしか説明しません。 ラクトコッカスは、単に複雑なケフィア菌叢の一部です。 それらのプロテイナーゼの特異性は等しく十分に調査されていないが、ケフィアの他の微生物もタンパク質分解挙動を明らかに示している。 Yüksekdagらは、選択したケフィア粒乳酸桿菌のタンパク質分解特性を分析し、いくつかの株が強力な活性を持っていることを示した[32]。 |
| 4.2 スターターカルチャーの影響 |
| ケフィアは発酵に使用する微生物によって大きく異なるため、2つの異なる製品タイプを分析して比較しました。 1つのケフィアは、トルコの伝統的なケフィア粒を使用して生産され、別のタイプのケフィアは、市販のスターターカルチャーミックスを使用して製造されたため、最も一般的な2つの製品に対応しています。 両方の発酵産物の微生物学的組成は、違いを解明するために調査されました。 CFU / gの総数は、総好気性中温菌の数のわずかな違いと酵母含有量の大きな不一致に匹敵し、ケフィア穀粒製品の酵母CFUは多かった。 しかしながら、両方の製品のタンパク質分解活性はかなり変動し、市販のスターターによって生産されたケフィアでは約1.4倍高かった。 この違いは、穀物ケフィアで検出された中温性好気性微生物の数がわずかに少ないだけでは説明できません。 おそらく、細菌の種と亜種の組成は両方の製品間で異なり、異なるタンパク質分解挙動を引き起こします。 ケフィア粒と比較して、市販のスターター混合物で強力なタンパク質分解特性を持つ細菌株のシェアが大きいと、これらの結果を説明できます。 市販のスターターカルチャーでの発酵では、放出されるアミノ酸とペプチドの量が多くなるだけでなく、ケフィア粒の品種と比較してペプチドプロファイルの組成が異なります。 MALDI-TOFペプチドスクリーニングとnano-UPLC-ESI-MS / MSによって生成された拡張ペプチドプロファイルの両方により、市販のスターター混合物からのケフィアに多くのペプチドが明らかになりました。 |
| それにもかかわらず、ペプチドの大部分は両方の製品タイプで検出でき、マッチはスターターカルチャーケフィアで検出されたペプチドの42%、グレインケフィアで78%を占めました。 したがって、製造に使用される個々の微生物叢から比較的独立している典型的なケフィアペプチドプロファイルが存在すると結論付けることができます。 ケフィアペプチドプロファイルの共通部分のコンポーネントは、一般的にケフィア製品のマーカーとして使用できますが、プロファイルの可変部分のコンポーネントは、ケフィアの品種と製造パラメーターを区別するためのマーカーとして機能すると仮定できます。 |
| ペプチドプロファイルのバッチバリエーションを調査するために、ケフィアタイプごとに4つのケフィアサンプルを14か月間で個別に作成し、ステージチップマイクロ抽出とその後のMALDI-TOFスクリーニングで比較しました。 MALDI-TOFスクリーニングはサンプルの完全なペプチドプロファイルをカバーしていませんが、一般的にかなりの数のサンプルのペプチド組成のばらつきを明らかにするための迅速な方法です。 市販のスターターカルチャーからの4つのケフィアサンプルと4つのケフィア穀物サンプルは、複数のサンプル(83%)で検出されたペプチドの割合が高く、高いレベルの再現性を示しています。 |
| 4.3 ケフィアペプチドの生物活性の可能性 |
| 生成されたケフィアペプチドリストで既知の生理活性配列を特定するために、詳細な文献調査が行われました。 生理活性乳タンパク質由来ペプチドの主要な部分はACE阻害剤であり、アンジオテンシンIから血管収縮性アンジオテンシンIIへの変換と血管拡張剤ブラジキニンからその不活性断片への分解を阻害することにより血圧に影響します[12]。 ケフィアペプチド間の12の配列は、すでにACE阻害剤として同定されています(図6)[37–42]。 |
| さらに、VLNENLLR(αS1-casein15–22)およびYQEPVLGPVRGPFPIIV(β-casein193–209)の配列を持つ2つの抗菌ペプチド、カゼイシンB [43]およびカゼシジン17 [44]が同定されました。 カゼイシンBは、0.22 mMの最小発育阻止濃度(MIC)値で大腸菌(E.)コリDPC6053に対して活性を示し、カゼシジン17は同じ菌株に対して、MICが0.4 mg / mLおよび0.5 mg / mLの大腸菌DH5aに対して活性でした。それぞれ。 ケフィアペプチドの中から、免疫調節活性を持つ2つのペプチドが同定されました[45]。 さらに、ACEの阻害は免疫刺激性ブラジキニンの不活性化も妨げるので、ACE阻害と免疫調節の関係が議論されてきました[7]。 したがって、本研究で検出されたACE阻害ペプチドも潜在的な免疫調節剤である可能性があります。 |
| 一部の乳由来ペプチドは、オピオイド受容体に結合することができます。 アゴニストおよび拮抗メカニズムは、例えば、下痢止め効果またはアミノ酸輸送の調節をもたらすと記載されている[12]。 1つのペプチドVYPFPGPIPN(β-casein59–68)が、ケフィアペプチドプロファイルでオピオイド活性と同定されました[46]。 生物学的に活性なミルクペプチドのもう1つの重要な部分は、カゼインホスホペプチドです。これはミネラルに結合するため、歯の再石灰化に、そして場合によってはカルシウム吸収にも有益な効果があります[8,47]。 ケフィアペプチドの1つであるKIEKFQSEEQQQT(β-カゼイン29–41、S7のホスホセリン)では、カルシウム結合が確認されました[48]、 しかし、62の同定されたリン酸化ペプチドからの他のシーケンスもミネラル結合特性を持っている可能性があります。 最後に、抗酸化活性が確立された3つのケフィアペプチドと1つの抗血栓ペプチドも同定されました[42、49、50]。 |
| 同定された生物活性ペプチドの2つは特に重要です。 カゼシジン17は、抗菌作用、ACE阻害作用、免疫調節作用、抗酸化作用、および抗血栓作用を発揮する多機能性ペプチドです[37、42、44、45、50]。 興味深いことに、このペプチドは、MALDI-TOFマススクリーンで2番目に高い強度のシグナルであり(図2、ペプチドマス1881.1 Da)、非常に豊富であることを示しています。 その興味深い生物学的機能と豊富さを考慮すると、ペプチドはケフィアの健康促進効果に特に関連があると期待されています。 ペプチドVYPFPGPIPN(β-casein59–68、V-β-casomorphin-9とも呼ばれる)は、ACE阻害、抗酸化、オピオイド活性を示す別の多機能ペプチドです[42,46]。 生物学的活性を発揮すると以前に報告されたこれらのペプチドに加えて、他の多くの同定された配列は、以前に記載された生理活性ペプチドと高い相同性を示し、したがって、類似の生体機能を有する可能性があります。 さらに、ほとんどのケフィアペプチドの生物活性はまだ調査されていないと考えられる。 したがって、新しく生成されたケフィアペプチドデータベースを使用して、この製品のさらなる生理活性成分を特定できます。 |
| 要約すると、本研究は257の配列を含むケフィアペプチドデータベースを確立しました。 これらのペプチドのうち236個はケフィアに特有であり、以前は乳汁中に検出されていませんでした。 したがって、発酵プロセスはペプチド画分の生物活性プロファイルを大幅に変更すると結論付けることができます。 市販のスターターカルチャーまたは従来のケフィア粒のいずれかによって調製されたケフィアサンプルで一般的な97のペプチドの存在は、典型的なケフィアペプチドプロファイルを示します。 これは、製造に使用される特定の微生物叢から比較的独立しています。 ペプチドプロファイルの可変部分の成分は、異なる生産パラメーターの指標として使用できます。 スターターカルチャーによって調製された製品は、より高いタンパク質分解活性を示し、健康促進効果に有益な影響を与える可能性があります。 |
| 図6 –ケフィアに含まれる既知の生理活性ペプチドと、人体のそれらの可能な標的部位。 ペプチド配列は1文字のコードで表示されます。 |
|
|
この文献はJounal of Proteomics 117(2015)41-57に掲載されたPeptide profiling of bovine kefir reveals 236 unique peptides released from caseins during its production by starter culture or kefir grainsを日本語に訳したものです。タイトルをクリックして原文を読むことが出来ます。 |


